基于胞外多糖和菌丝生物量的香菇发酵培养基优化
, ,文,2,*, ,2,,2,,2,
(1.陕西理工大学生物科学与工程学院,陕西汉中 723000; 2.陕西省食药用菌工程技术研究中心,陕西汉中 723000)
基于胞外多糖和菌丝生物量的香菇发酵培养基优化
王颖1,陈琰1,陈文强1,2,*,彭浩1,2,邓百万1,2,解修超1,2,何强1
(1.陕西理工大学生物科学与工程学院,陕西汉中 723000; 2.陕西省食药用菌工程技术研究中心,陕西汉中 723000)
为研究液体发酵培养基对香菇胞外多糖和菌丝生物量的影响,以秦巴山区香菇808菌株为试材,采用Plackett-Burman设计实验、最陡爬坡实验和响应曲面法对其液体发酵培养基的碳源、氮源和其它营养物质进行优化。结果表明,香菇胞外多糖发酵培养基的最佳组合是(g/500 mL):蔗糖7.18,玉米粉15.00,麦麸14.05,酵母膏0.35,KH2PO40.50,MgSO4·7H2O 0.50,pH自然,胞外多糖实测值为0.967 g/500 mL;香菇菌丝生物量发酵培养基的最佳组合是(g/500 mL):蔗糖7.18,玉米粉15.00,麦麸14.05,酵母膏0.35,KH2PO40.75,MgSO4·7H2O 0.50,pH自然,菌丝生物量实测值为28.146 g/500 mL。优化后的香菇胞外多糖产量和菌丝生物量较优化前分别提高12.44%和11.00%。此研究结果可为香菇液体发酵的中试生产提供理论依据。
胞外多糖,生物量,香菇,发酵培养基,响应曲面法
香菇(Lentinusedodes),又名冬菇、香蕈、北菇、花菇等,是担子菌纲伞形科真菌,世界名贵食药用菌之一,因其含有高蛋白、低脂肪、多种氨基酸和多种维生素而受到消费者的广泛认可[1-2]。香菇多糖作为香菇的重要活性成分之一,具有调节免疫、降血脂、抗肿瘤、抗病毒、抗衰老、抗感染等作用[3-5],在临床医学方面,也被广泛应用于免疫增强剂、恶性肿瘤的辅助治疗及增强化疗疗效并降低毒副反应等[6-7]。
众多研究表明,食用菌液体发酵技术比传统生产方法具有显著的优势。在其发酵过程中,反应器内的营养菌丝能在最适的温度、酸碱度、氧气浓度和碳氮比等条件下生长,呼吸作用所产生的代谢产物能及时排放,因此新陈代谢旺盛、菌丝分裂迅速,从而缩短生长周期、提高菌丝产量,同时还能保持菌丝营养成分和药用效果[8-9];另外,液体菌种接入固体培养料,又具有流动快、萌发快、易分散、发菌点多、出菇整齐等特点[10-12]。香菇808是秦巴山区主栽的高产特优食用菌菌种之一,菇型圆整、肉厚、柄短,子实体茶褐色,出菇温度10~28 ℃,菌龄90~120 d,属袋栽中熟菌株。目前,有关香菇液体发酵培养基的研究报道较多[13-14],但得到的胞外多糖产量和菌丝生物量普遍较低,且以秦巴山区香菇808菌株胞外多糖产量和菌丝生物量为主要指标,采用Box-Behnken响应曲面法联合优化液体发酵培养基尚无研究报道。本研究以秦巴山区香菇808菌株胞外多糖产量和菌丝生物量为主要指标,采用Box-Behnken响应曲面法联合优化液体发酵培养基,旨在为香菇液体发酵的中试生产提供理论依据。
1 材料与方法
1.1材料与仪器
LRH-250-GS型数显式恒温培养箱 广东省医疗器械厂;SW-CJ-1F型超净工作台 苏州安泰空气技术有限公司;ZHWY-210 2C型数显式恒温摇床 上海志成有限公司;SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司;TB-214型电子分析天平 北京赛得利斯仪器系统有限公司。
1.2 实验方法
1.2.1 液体种子的制备 将香菇808菌株原种转至CPDA斜面,28 ℃培养至菌丝满管,备用。配制基础发酵培养基,500 mL三角瓶装量为250 mL,将0.5 cm2斜面菌种2块接于基础发酵培养基,每次实验做3个重复,静置24 h,26 ℃、180 r/min振荡培养10 d。
1.2.2 香菇菌丝生物量的测定 将待测菌株发酵液置于布氏漏斗中,抽滤至不滴水,电子分析天平称重(鲜重),取平均值[15]。
1.2.3 香菇胞外多糖的测定 将抽滤后的发酵液浓缩至原体积的1/5,取浓缩液10 mL,加无水乙醇40 mL,调节pH至7.0,4 ℃冰箱放置16 h,4000 r/min离心15 min,沉淀依次用丙酮、乙醚洗涤3次,60 ℃烘干至恒重,电子分析天平称重,取平均值。
1.2.4 Plackett-Burman实验设计 选用n=12的Plackett-Burman实验设计,以蔗糖(X1)、玉米粉(X2)、麦麸(X3)、酵母膏(X4)、KH2PO4(X5)、MgSO4·7H2O(X6)(6个实际量和5个空项)为自变量,菌株胞外多糖产量(Y1)和菌丝生物量(Y2)为响应值,可用最少实验次数尽可能精确地筛选出对Y1和Y2影响显著的因素[16]。每个因素分别取高(+1)低(-1)两个水平,高水平为低水平的1.5倍,水平编码见表1。

表1 Plackett-Burman实验设计因素及水平表Table 1 The factors and levels table of Plackett-Burman experiment design
1.2.5 最陡爬坡实验 根据Plackett-Burman实验结果,以实验值变化的梯度方向为爬坡方向,以各因素效应值的大小确定步长,使正效应的值逐步增加,负效应的值逐步减小。其它不显著因素中,正效应的取高水平,负效应的取低水平,寻找最佳响应区域。
1.2.6 Box-Behnken实验设计 依据Plackett-Burman实验和最陡爬坡实验确定的因素与水平,采用Box-Benhnken实验设计对香菇液体发酵培养基进行3因素3水平的响应曲面优化。3个水平以(-1,0,+1)编码(见表2),对数据进行二次回归拟合,得到包括一次项、平方项和交互项的二次方程,分析各因素的主效应和交互效应[17],最后在一定水平范围内求取最佳值。

表2 Box-Benhnken实验设计Table 2 Box-Benhnken experimental design
1.2.7 数据分析 采用Minitab 17软件和Excel 2003对Plackett-Burman实验结果进行分析,采用Design-Expert 8.0.6软件对Box-Behnken实验结果进行分析。
2 结果与分析
2.1 Plackett-Burman实验
通过Minitab 17软件和Excel 2003考察蔗糖(X1)、玉米粉(X2)等11个因素对菌株胞外多糖产量(Y1)和菌丝生物量(Y2)的影响,结果见表3、表4。

表3 Plackett-Burman实验设计与结果Table 3 Plackett-Burman design and results
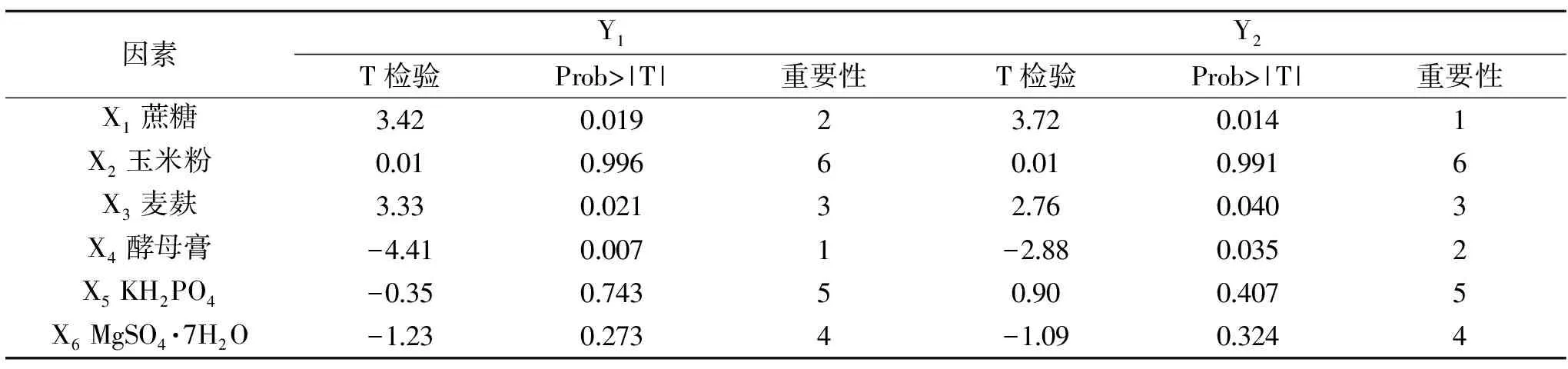
表4 Plackett-Burman试验分析结果Table 4 Result of regression analysis of Plackett-Burman design
由表3、表4可见,在香菇808菌株液体发酵过程中,蔗糖(X1)、麦麸(X3)和酵母膏(X4)三个因素对菌株胞外多糖产量(Y1)和菌丝生物量(Y2)影响显著。其中,当X1、X3的量增加时,Y1和Y2均明显增加,所以X1、X3为正效应因素;当X4的量增加时,Y1和Y2反而降低,所以X4为负效应因素。因此,可将X1、X3、X4作为主要因素进行响应曲面实验。
2.2最陡爬坡实验
根据Plackett-Burman实验结果,将蔗糖(X1)和麦麸(X3)的量逐步增加,酵母膏(X4)的量逐步减小,其它不显著因素中,正效应的取高水平,负效应的取低水平,寻找最佳响应区域。结果见表5。
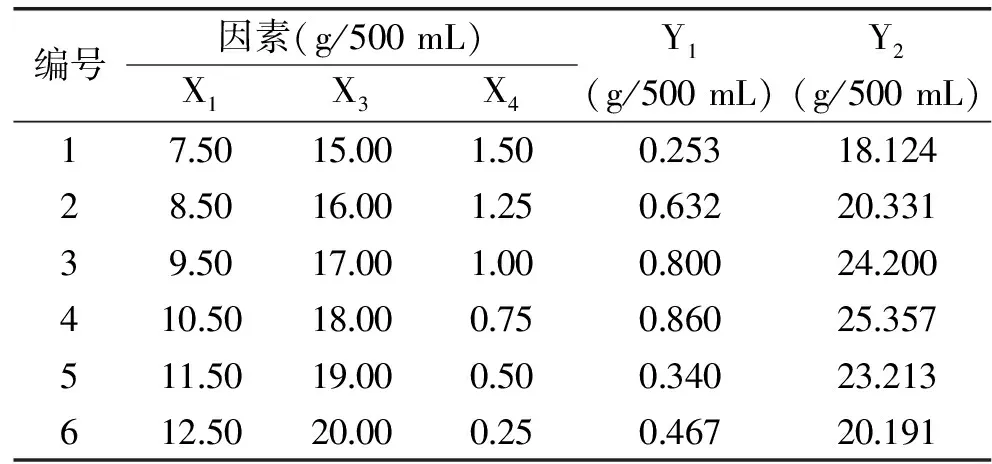
表5 最陡爬坡实验设计及结果Table 5 Experimental design and results of steepest ascent path
由表5可见,当蔗糖10.50 g/500 mL、麦麸18.00 g/500 mL、酵母膏0.75 g/500 mL时,测得发酵液中菌丝胞外多糖产量最大值为0.860 g/500 mL,菌丝生物量最大值为25.357 g/500 mL,所以,后续响应曲面实验以第4实验组各因素水平为中心值进一步设计优化。
2.3 Box-Benhnken实验
根据表2因素水平,采用Box-Benhnken实验设计对香菇808菌丝液体发酵培养基进行3因素3水平响应曲面优化,结果见表6。

表6 Box-Behnken中心组合因素水平编码表Table 6 Independent variables and coded levels in Box-Behnken experimental design

表7 Y1方差分析表Table 7 ANOVA table of Y1
注:*、**分别为0.05及0.01水平上的显著性差异;表8同。
2.4回归模型和方差分析
采用Design-Expert 8.0.6统计软件对表6数据进行二次多项回归拟合,寻求最优响应因子水平,整理得到关于胞外多糖产量回归方程如式(1),回归方程方差分析见表7;得到关于菌丝生物量回归方程如式(2),回归方程方差分析见表8。

表8 Y2方差分析表Table 8 ANOVA table of Y2
Y1=-0.147+0.105X1+0.090X3+1.278X4+(1.323-003)X1X3+0.059X1X4-0.040X3X4-(9.826E-003)X12-(3.772E-003)X32-1.607X42
式(1)
Y2=-13.518+1.876X1+4.230X3+50.631X4-0.063X1X3+2.702X1X4-1.989X3X4-0.133X12-0.130X32-60.997X42
选用抗性品种;轮作倒茬,合理施肥浇水;施用充分腐熟优质有机肥,避免使用未腐熟粪肥,以免把虫源带入田间;优化农田生态条件,铲除地头、渠沟边杂草,降低蚜虫越冬基数。
式(2)
由表7结果可见,模型相关系数R2=0.9767,说明该方程模型与实验数据有97.67%的符合度;模型p值小于0.0001,差异极显著,说明该模型有意义;失拟项p值为0.9136>0.05,说明失拟项差异不显著,没有出现失拟现象,实验操作可信。各因素中X1、X4、X12、X32、X42项差异极显著,X1X4、X3X4项差异显著,X3、X1X3项差异不显著。从p值可看出这三个因素对香菇菌株胞外多糖产量的影响顺序:X1>X4>X3,即蔗糖>酵母膏>麦麸。
由表8结果可见,模型相关系数R2=0.9706,说明该方程模型与实验数据有97.06%的符合度;模型p值为0.0001<0.01,差异极显著,说明该模型有意义;失拟项p值为0.4631>0.05,说明失拟项差异不显著,没有出现失拟现象,实验操作可信。各因素中X1、X4、X32、X42项差异极显著,X1X4、X3X4、X12项差异显著,X3、X1X3项差异不显著。从p值可看出这三个因素对菌丝生物量的影响顺序:X1>X4>X3,即蔗糖>酵母膏>麦麸。
2.5响应曲面分析
分析回归方程,绘制菌株胞外多糖产量(Y1)和菌丝生物量(Y2)随各因素变化的响应曲面图,每个响应曲面分别代表两个独立因素间的相互作用,第三个因素保持在编码0水平。曲面越陡峭,影响越显著[18],拟合的响应曲面能直观反映各因素之间的交互作用。
2.5.1 菌株胞外多糖产量(Y1)的响应曲面分析 绘制响应曲面图见图1、图2,考察响应曲面图的形状,确定蔗糖(X1)、麦麸(X3)、酵母膏(X4)三个因素及其交互作用对香菇808号菌株胞外多糖产量(Y1)的影响。

图1 Y1=f(X1,X4)响应曲面图Fig.1 Response surface of Y1=f(X1,X4)
由图1结果可见,在低蔗糖含量条件下,随着酵母膏含量增加,胞外多糖产量先缓慢上升,当酵母膏含量达0.33 g/500 mL后迅速下降;在高蔗糖含量条件下,随着酵母膏含量增加,菌丝胞外多糖产量先缓慢上升,当酵母膏含量达0.45~0.57 g/500 mL时,胞外多糖产量缓慢下降,酵母膏含量超过0.57 g/500 mL后迅速下降;在低酵母膏含量和高酵母膏含量条件下,随着蔗糖含量的增加,胞外多糖产量均呈先迅速上升至平缓,当蔗糖含量达7.88 g/500 mL后呈缓慢下降的趋势。

图2 Y1=f(X3,X4)响应曲面图Fig.2 Response surface of Y1=f(X3,X4)
由图2结果可见,在低麦麸含量条件下,随着酵母膏含量增加,胞外多糖产量先迅速上升至平缓,当酵母膏含量超过0.45 g/500 mL后迅速下降;在麦麸高含量条件下,随着酵母膏含量增加,胞外多糖产量略有上升后迅速下降;在酵母膏低含量条件下,随着麦麸含量增加,胞外多糖产量先迅速上升至平缓,当麦麸含量超过10.80 g/500 mL后缓慢下降;在高酵母膏含量条件下,随着麦麸含量的增加,胞外多糖产量先迅速上升,当麦麸含量达到8.10 g/500 mL后迅速下降。
2.5.2 菌丝生物量(Y2)的响应曲面分析 绘制响应曲面图见图3、图4,考察响应曲面图的形状,确定蔗糖(X1)、麦麸(X3)、酵母膏(X4)三个因素及其交互作用对香菇808号菌丝生物量(Y2)的影响。

图3 Y2=f(X1,X4)响应曲面图Fig.3 Response surface of Y1=f(X1,X4)
由图3结果可见,在低蔗糖含量条件下,随着酵母膏含量的增加,菌丝生物量先略有上升,当酵母膏含量超过0.33 g/500 mL后迅速下降;在高蔗糖含量条件下,随着酵母膏含量的增加,菌丝生物量先缓慢上升,当酵母膏含量达到0.45 g/500 mL后缓慢下降;在低酵母膏含量条件下,随着蔗糖含量的增加,菌丝生物量略有上升后略有下降;在高酵母膏含量条件下,随着蔗糖含量的增加,菌丝生物量先迅速上升,当蔗糖含量达到7.88 g/500 mL后继续缓慢上升。

图4 Y2=f(X3,X4)响应曲面图Fig.4 Response surface of Y1=f(X3,X4)
由图4结果可见,在低麦麸含量条件下,随着酵母膏含量增加,菌丝生物量先迅速上升至平缓,当酵母膏含量达到0.45 g/500 mL后迅速下降;在高麦麸含量条件下,随着酵母膏含量增加,菌丝生物量略有上升,当酵母膏含量达到0.33 g/500 mL后迅速下降;在低酵母膏含量条件下,随着麦麸含量增加,菌丝生物量迅速上升,当麦麸含量达到13.50 g/500 mL后缓慢下降;在高酵母膏含量条件下,随着麦麸含量的增加,菌丝生物量迅速上升至平缓,当麦麸含量达到10.80 g/500 mL后迅速下降。
2.6验证实验
在实际生产过程中,为降低成本,尽可能使用廉价原料,所以在Design-Expert 8.0.6软件的“Criteria”选项中,选取X1和X4的“Goal”值均为“in range”,X3的“Goal”值为“maximize”,Y1、Y2的“Goal”值为“maximize”,确定影响菌株胞外多糖产量和菌丝生物量主要因素的最优值为(g/500 mL):蔗糖7.18,麦麸14.05,酵母膏0.35,此时菌株胞外多糖产量预测值为0.953 g/500 mL,菌丝生物量预测值为27.829 g/500 mL。为检验该提取工艺的可靠性,分别采用上述最优发酵条件进行验证性实验,三次重复取平均值后得到菌丝胞外多糖产量实测值为0.967 g/500 mL,与预测值相对误差为+1.47%,相比初始培养条件下胞外多糖产量0.860 g/500 mL提高了12.44%;菌丝生物量实测值为28.146 g/500 mL,与预测值相对误差为+1.14%,相比初始培养条件下菌丝生物量25.357 g/500 mL提高了11.00%。
3 讨论与结论
以秦巴山区香菇808菌株胞外多糖产量和菌丝生物量为主要指标,通过响应曲面法联合优化液体发酵培养基,其胞外多糖发酵培养基最佳组合为(g/500 mL):蔗糖7.18,玉米粉15.00,麦麸14.05,酵母膏0.35,KH2PO40.50,MgSO4·7H2O 0.50,pH自然,菌丝胞外多糖产量实测值为0.967 g/500 mL;菌丝生物量发酵培养基最佳组合为(g/500 mL):蔗糖7.18,玉米粉15.00,麦麸14.05,酵母膏0.35,KH2PO40.75,MgSO4·7H2O 0.50,pH自然,菌丝生物量实测值为28.146 g/500 mL。优化后香菇菌丝胞外多糖产量和菌丝生物量较初始培养条件下的产量分别提高了12.44%和11.00%。
近年来,采用响应曲面法优化香菇发酵培养基测定菌丝生物量、并从发酵液中提取胞外多糖的研究报道较少。赵俊杰[19]采用单因素实验和正交实验确定香菇B08菌株发酵培养基最佳组合,多糖产量为1.58 g/L,本研究得到香菇胞外多糖产量比赵俊杰的研究报道提高了22.41%。另外,陈文强[15]等在单因素实验的基础上采用响应曲面法优化香菇南山1#液体种生产工艺,菌丝生物量达51.004 g/L;梁宝东[20]等采用正交实验确定香菇武856菌株发酵培养基最佳配比,菌丝生物量达55.00 g/L,本研究得到的香菇菌丝生物量比前二者的研究报道分别提高10.37%和2.35%。
本研究以香菇808菌株胞外多糖产量和菌丝生物量为主要指标,采用响应曲面法优化得到发酵培养基最佳组合,可为香菇液体深层发酵的中试生产提供理论依据。
[1]Feeney MJ,Miller AA,Roupas P. Mushrooms-biologically
distinct and nutritionally unique-Exploring a “Third Food Kingdom”[J]. Nutr Today,2014,49(6):301-307.
[2]Feeney MJ,Dwyar J,Hasler-lewis CM,et al. Mushrooms and health summit proceedings[J]. J Nutr,2014,144(7):1128s-1136s.
[3]Liu W,Gu J,Qi J,et al. Lentinan exerts synergistic apoptotic effects with paclitaxel in A549 cells via activating ROS-TXNIP-NLRP3 inflammasome[J]. Journal of Cellular and Molecular Medicine,2015,19(8):1949-1955.
[4]Yeh MY,Ko WC,Lin LY. Hypolipidemic and antioxidant activity of enoki Mushrooms(Flammulinavelutipes)[J]. Biomed Res Int,2014,214:352-365.
[5]邹林武,赵谋明,游丽君. 香菇多糖提取工艺的优化及其抗氧化活性研究[J].食品工业科技,2013,34(19):177-182.
[6]Carniero AA,Ferreira IC,Duenas M,et al. Chemical composition and antioxidant activity of dried powder formulations of Agaricus blazei and Lentinus edodes[J]. Food Chem,2013,138:2168-2173.
[7]王国佳,曹红. 香菇多糖的研究进展[J]. 解放军药学学报,2011,27(5):451-455.
[8]陈文强,邓百万. 两种食用菌液体发酵培养基筛选的初步研究[J]. 氨基酸和生物资源,2000,22(3):29-32.
[9]李云,曾东方. 食用菌液体深层发酵的研究热点[J]. 食品工业科技,2006,27(7):199-201,205.
[10]马琼,畅雷,吴雄,等. 香菇深层发酵培养条件的优化[J]. 中国酿造,2009(6):74-76.
[11]金红,杨孝丽,任灿,等. 食用菌深层发酵物中生物活性物质含量的比较[J]. 食品研究与开发,2015,36(3):93-96.
[12]刘世玲,卢兴潮,江坤,等. 香菇液体菌种深层发酵工艺探索[J]. 中国食用菌,2016,35(1):21-24.
[13]魏雅冬,王广慧,郭海滨,等. 香菇液体发酵培养基的优化研究[J]. 北方园艺,2015(12):136-138.
[14]徐思炜,张胜君,周雯. 香菇液体菌种培养条件优化[J]. 江苏农业科学,2014,42(12):290-292.
[15]陈文强,乔艳明. 响应面法在香菇液体种生产工艺优化中的应用[J]. 食品工业科技,2015,36(18):290-294,319.
[16]许晖,孙兰萍. 羊肚菌培养条件响应面法优化[J]. 食品与生物技术学报,2007,26(5):92-98.
[17]乔艳明,陈文强,邓百万,等. Box-Behnken响应面设计法优化微波辅助提取猪苓多糖工艺[J]. 食品与生物技术学报,2015,34(9):986-994.
[18]Doulgs C. Montgomery. 傅珏生,张健,王振羽,等,译.实验设计与分析[M]. 北京:人民邮电出版社,2009:317-326.
[19]赵俊杰. 香菇液体发酵及多糖提取工艺研究[D]. 郑州:郑州大学,2014.
[20]梁宝东,魏海香,林范学,等. 香菇菌丝体液体发酵的研究[J]. 中国酿造,2011(10):77-80.
OptimizationoffermentationmediumforextracellularpolysaccharidesandbiomassbyLentinusedodes
WANGYing1,CHENYan1,CHENWen-qiang1,2,*,PENGHao1,2,DENGBai-wan1,2,XIEXiu-chao1,2,HEQiang1
(1.School of Biological Science and Engineering,Shaanxi University of Technology,Hanzhong 723000,China; 2.Shaanxi Engineering Research Center of Edible and Medicated Fungi,Hanzhong 723000,China)
Optimization of fermentation medium for extracellular polysaccharides(EPS)and biomass byLentinusedodeswas studied by the method with Plackett-Burman design,the steepest ascent experiment and Box-Behnken design. TheLetinousedodes808 was used as the test material,for study the effect of liquid fermentation medium on the extracellular polysaccharide and mycelial biomass ofLentinulaedodes. The results showed that the best medium combination for EPS were(g/500 mL)sucrose 7.18,corn meal 15.00,wheat bran 14.05,yeast extract 0.35,KH2PO40.50,MgSO4·7H2O 0.50,natural pH. In this condition,EPS yield was 0.967 g/500 mL. The best medium combination for biomass yield were(g/500 mL)sucrose 7.18,corn meal 15.00,wheat bran 14.05,yeast extract 0.35,KH2PO40.75,MgSO4·7H2O 0.50,natural pH. In this condition,biomass yield was 28.146 g/500 mL. All of the EPS yield and the biomass yield in the fermentation medium increased 12.44% and 11.00% as compared with that in the initial medium. This results could provide a theoretical basis for fermentation pilot production ofLentinusedodes.
extracellular polysaccharides(EPS);biomass;Lentinusedodes;fermentation medium;response surface methodology
2016-10-18
王颖(1994-),女,硕士研究生,主要从事微生物资源利用开发方面的研究,E-mail:306104241@qq.com。
*通讯作者:陈文强(1956-),男,大学本科,教授,主要从事微生物资源保育及开发利用方面的研究,E-mail:wenqiangc@126.com。
陕西省“13115”科技创新工程计划项目(2008ZDGC-04)。
TS201.3
:A
:1002-0306(2017)12-0176-06
10.13386/j.issn1002-0306.2017.12.032

