白酒腌制对糟鹅肌原纤维蛋白结构和滋味物质形成的影响
,,2,*,,,,
(1.宁波大学浙江省动物蛋白食品精深加工技术重点实验室,浙江宁波 315211; 2.南京师范大学食品科学与营养系,江苏南京 210097)
白酒腌制对糟鹅肌原纤维蛋白结构和滋味物质形成的影响
陈丽艳1,潘道东1,2,*,雒宏琳1,周昌瑜1,曹锦轩1,孙杨赢1
(1.宁波大学浙江省动物蛋白食品精深加工技术重点实验室,浙江宁波 315211; 2.南京师范大学食品科学与营养系,江苏南京 210097)
以浙东白鹅为原料,建立了糟鹅加工中白酒添加量(0%、1%、3%、6%、9%)对糟鹅品质影响的模型,利用透射电镜、拉曼光谱及氨基酸分析仪等技术探究了糟鹅肌肉微观结构、质构特性和滋味物质的变化。结果表明,腌制时白酒添加量从0%~9%时肌节长度呈现先增大后减小趋势(p<0.05),肌原纤维直径无明显变化;蛋白质二级结构分析显示,随着白酒添加量的增加,α-螺旋逐渐转变为β-折叠和无规则卷曲(p<0.05);游离氨基酸总量及呈味氨基酸含量也显著增加(p<0.05)。色差分析显示,亮度(L*)、红度(a*)和黄度(b*)都呈先增加后减小趋势,L*和a*在白酒添加量为3%达到最大;硬度先减小后增加,在3%白酒腌制时硬度最小。以上研究表明白酒腌制影响了糟鹅蛋白微观结构、质构特性和促进了滋味物质的形成。
糟鹅,白酒,肌原纤维超微结构,二级结构,质构,游离氨基酸
糟醉肉制品是我国东南沿海的传统特色风味食品,通常采用酒糟或者白酒进行腌制而得。糟渍食品的历史悠久,自宋代盛行以来,糟鱼、糟肉、糟鸭、糟鹅等制品陆续出现[1]。其中糟鹅是我国传统糟醉肉制品,以其独特而浓郁的糟香味以及鹅肉富含高蛋白而深受消费者喜爱。浙东白鹅是一种高蛋白、低脂肪和胆固醇的肉类,其蛋白质的含量高达22.3%,并含有人体生长发育所必需的各种氨基酸,且其组成接近人体所需氨基酸的比例,具有很好的消化吸收率。除此之外还含有多种人体所需的不饱和脂肪酸和丰富的钙、磷、铁等[2],这些特点表明,浙东白鹅是加工糟肉制品的理想原料。
白酒在去腥、调味、增香、防腐等方面有重要的作用,并作为烹饪辅佐料而被广泛用于肉制品的烹饪中[3]。糟鹅是采用酒糟或者白酒等对鹅肉进行腌制而得的肉制品。腌制过程对肉制品的品质特性、蛋白质功能特性和结构的影响已经被研究。谭汝成等[4]在研究糟量对糟鱼品质的影响时发现,随着酒糟用量的提高,酒糟鱼中的还原糖含量逐渐升高,氯化钠、粗蛋白和氨基态氮含量逐渐下降,当鱼和糟的比例为1∶2时,酒糟鱼的感官品质最好。徐大伦[5]等对糟醉带鱼的糟醉工艺进行优化发现,鱼块中酒精含量逐渐提高,总酸含量和TVB-N值下降,品质得分先上升后下降。此外,白酒的糟制,不但去掉了鹅肉固有的一些不良气味,而且有单纯加香或简单加料酒难以产生的柔和香气。然而前人对糟醉肉制品的研究大多集中于对工艺改进和优势菌群的选择上,在品质特性和微观结构变化还缺乏深入的研究,同时,由于糟制的研究基础薄弱、原辅料复杂多变、生产工艺多样化,糟鹅制品的产业化发展受到极大限制[6]。因此探究糟制对糟鹅品质的影响非常有必要。
本文以浙东大白鹅为研究对象,利用拉曼光谱技术、氨基酸分析以及其他分析技术,探究不同白酒量的腌制对肌肉组织微观结构和品质特性的影响,旨在改进传统加工工艺,提高糟鹅食用品质,丰富糟制品理论研究宝库和提高实用价值。
1 材料与方法
1.1材料与仪器
浙东白鹅(日龄90 d、体重为(5±0.5) kg) 购自浙江象山大白鹅有限公司;白酒(酒精度:56% vol) 北京红星股份有限公司;Thermo冰冻切片包埋剂(OCT) 美国赛默飞;苏木素、伊红染液 北京索莱宝科技有限公司;Epson 812树脂 海德创业(北京)生物科技有限公司;APES粘附剂 北京鼎国昌盛生物技术有限责任公司;其它试剂 均为分析纯。
CR-400色差仪 日本柯尼达美能达有限公司;TA-XT2i质构分析仪 StableMicro System公司;L-8900型氨基酸自动测定分析仪、H-7650 透射电镜 日本日立公司;SKD-2000全自动凯氏定氮仪 上海沛欧分析仪器有限公司;Leica CM1900型冷冻切片机 德国Leica公司;BM 53 OLYMPUS光学显微镜 日本OLYMPUS公司;inVia-Reflex拉曼光谱仪 法国Renishaw公司;Leica UC7常温超薄切片机 德国Leica公司。
1.2实验方法
1.2.1 样品处理 浙东白鹅,放血脱毛去内脏,清洗干净后将鹅胸脯肉整块取下。将取下的胸脯肉利用手术剪和双面刀片顺着肌原纤维的方向将鹅胸肉制样为4 cm×3 cm×2 cm的肉块,按照肉块大小一致、肌原纤维整齐、无可见脂肪和结缔组织的标准挑选出30个肉块。将挑选出的鹅胸肉随机分成5组,每组6块,进行腌制,腌制条件为,肉∶腌制液(w∶v)=1∶3,4 ℃,24 h。其中腌制液为,食盐质量分数一定(6%),白酒添加量(0%、1%、3%、6%、9%;V/V)不同。腌制完成后,从每块糟鹅的胸肉样品中沿肌纤维方向切出长形型肉块,用锡箔纸包好,在液氮中速冻保存,用于微观结构实验。剩余鹅胸肉样品保存,用于其他指标分析。
1.2.2 肌节长度测定 沿肌纤维方向切取0.1 cm×0.1 cm×0.2 cm的肉块,浸泡于2.5%的戊二醛(0.01 mol/L PBS,pH7.4)预固定2 d,PBS冲洗(3次,20 min),锇酸后固定2 h,PBS冲洗,梯度浓度丙酮冲洗,乙醇梯度浓度脱水,环氧树脂浸透包埋,聚合,超薄切片,酸双氧铀-柠檬酸铅双重染色,最后透射电镜拍照观察[7]。肌节长度用Digimizer软件进行测定,每张照片随机选择15个测量点测量肌节长度,每个取样点重复测量3次,所得数据的平均值记录为该取样点的肌节长度。
1.2.3 肌肉组织微观结构观察 将经液氮预冷冻、锡箔纸包裹的肉样(3 mm×3 mm×5 mm)取出,用包埋剂固定,沿肌纤维垂直方向冷冻切片,切片厚度为10 μm。用APES包被过的载玻片固定切片,置于4 ℃环境中,及时进行染色。
染色步骤:晾片→苏木素染液浸染5 min→70%、80%乙醇脱水→伊红染液染色30 s→乙醇逐级脱水→二甲苯通透→中性树胶封片→观察、拍照。使用Image-pro plus软件测量肌纤维细胞直径。测量时,每张照片随机选择15个测量点,重复测量3次,取平均值。
1.2.4 肌原纤维蛋白拉曼光谱分析 拉曼光谱的测定参照Berhe[8]和曹锦轩[9]的方法,去掉可见脂肪与结缔组织,将样品置于载玻片上。测定条件:20倍聚焦镜头聚焦,785 nm氩离子激光器,功率为50 mW,曝光时间10 s,分辨率为 1 cm-1。用Labspec软件绘制图谱,以苯丙氨酸的单基取代苯基环在(1003±0.5) cm-1伸缩振动强度作为内标进行归一化[10]。用Peakfit 4.12软件对拉曼光谱进去傅立叶去卷积处理,计算蛋白的二级结构含量[11-12]。
1.2.5 氨基酸测定 称取0.1 g肉糜样品,加入6 mol/L的盐酸进行水解,经过离子交换色谱法分离并以茚三酮柱后衍生,上机测定分析,其中氨基酸混合标准液的浓度为100 nmol/L。结果计算参照国标GB/T 5009.124-2003进行。
1.2.6 质构特性分析 参照Li Z等[13]方法并进行适当修改。将样品切成1.5 cm×1.5 cm×1.5 cm的肉块,质构参数设定如下:测试探头(P/5),测前速度2.0 mm/s,测试速度l.0 mm/s,测后速度2.0 mm/s,穿刺距离10 mm,感应力5 g,停留时间5 s。利用自带软件得到样品的相关质构参数:硬度、弹性、黏性以及咀嚼性。
1.2.7 色泽的测定 取腌制结束后的样品,置于空气中静置30 min后,用色差仪测定其亮度(L*)、红度(a*)、黄度(b*),参数设置:光源为D65,测定直径是8 mm,每个样品点重复5次测量,取平均值,使用前对仪器进行校准[14]。
1.2.8 数据处理与统计分析 每个实验重复3~5次,数据以平均值±标准差表示。所得实验数据采用SAS 8.0中one-way ANOVA的Duncan’s Multiple Range Test模型进行统计学分析,差异显著性水平p<0.05。
2 结果与分析
2.1白酒对糟鹅胸肉肌节长度的影响
图1表明,白酒量对肌节长度具有显著的影响,随着腌制液中白酒量的增加,肌节长度先增加后逐渐缩短(p<0.05),1%的白酒添加量时,肌节长度达到最大值。肌节长度是衡量肌肉组织收缩程度的重要指标,肌节长度变化对嫩度的影响也已经被广泛研究。Wheeler等[15]在研究猪肉的蛋白水解作用、肌节长度、胶原蛋白含量及嫩度时发现,肌节长度与肌肉嫩度呈正相关。Nagaraj等[16]人研究了冷冻和贮藏时间对羊肉肌节长度的影响,发现肌节长度因肌肉部位的不同变化不同。李超[17]研究了加热对肌节长度的影响,发现三段式加热鸭肉肌节长度显著增大,同时鸭肉的嫩度有明显的改善。在本研究中,低浓度的白酒腌制增加了糟鹅的肌节的长度,然而高浓度的白酒腌制则缩短了糟鹅的肌节。这表明不同浓度的白酒腌制可能改变了鹅胸肉的微观结构。

图1 白酒添加量对糟鹅胸肉肌节长度的影响Fig.1 The effect of marination on the sarcomere length of vinasse goose注:图中不同字母表示差异显著(p<0. 05),图2同。
2.2白酒对糟鹅胸肉组织学的影响
不同白酒添加量对糟鹅胸肉组织学的影响如图2、图3所示。从图2可以看出,经不同白酒含量的腌制液腌制后其微观结构发生了明显变化。随着白酒量的增大,肌原纤维之间的间隙逐渐增大。当白酒添加量为1%时,肌原纤维之间的间隙显著大于对照组。由图3可知,醉腌后鹅胸肉的肌纤维直径逐渐减小但未显著降低。出现这种情况的原因可能是肌束膜破裂,肌纤维束松散增加了肌原纤维之间的空隙,而并没有减小肌纤维直径。

图2 白酒添加量对糟鹅胸肉肌纤维的影响(400×)Fig.2 The effect of distilled spirit on the myofibers of vinasse goose(400×)

图3 白酒添加量对肌纤维直径的影响Fig.3 The effect of distilled spirit on the myofiber diameter of vinasse goose
2.3拉曼光谱分析白酒对糟鹅胸肉蛋白结构的影响

图4 糟鹅胸肉拉曼光谱(800~1800 cm-1)Fig.4 Raman spectra in the 800~1800 cm-1 region of the different distilled spirit content注:a,b,c,d,e分别表示白酒添加量为0%、1%、3%、6%、9%。
图4是不同白酒添加量的糟鹅胸肉的拉曼光谱图(800~1800 cm-1)。通过分析拉曼光谱谱图的特征峰、峰强以及峰面积,来表征蛋白质二、三级结构以及水分的变化。根据Susi[11]的方法,对1600~1700 cm-1范围内的拉曼光谱进行傅里叶去卷积处理后再进行曲线拟合,得到二级结构的特征峰及其面积所占总面积的百分比,估算出蛋白质二级结构的含量。蛋白二级结构定量分析结果见图5,结果表明,随着白酒添加量的增加,α-螺旋含量呈下降趋势,其含量由46.44%下降为33.34%(p<0.05)。β-折叠的含量由对照组的19.17%增加为9%白酒添加量的26.87%(p<0.05)。在整个腌制过程中,白酒的添加量对β-转角的含量无明显影响。这说明添加白酒腌制后,α-螺旋结构逐渐展开,形成了极性更强的β-折叠结构。与对照组(19.15%)相比,9%含量的白酒腌制组无规则卷曲含量(26.62%)显著增加(p<0.05)。Sun等[10]利用拉曼光谱技术分析了广式香肠加工过程中指出,肌原纤维蛋白的α-螺旋逐渐转变为β-折叠。Herrero等[18]对冷藏或冷冻条件下鳕鱼的肌肉蛋白二级结构研究也发现,α-螺旋逐渐逐渐降低且减少的α-螺旋转变为β-折叠。以上与本文中蛋白的结构变化类似,Beattie等[19]应用拉曼光谱技术评价牛肉品质时指出,α-螺旋的含量与β-折叠的含量的比率是影响牛肉嫩度的重要因素。本文对白酒腌制糟鹅时发现,白酒腌制促使了肌原纤维蛋白二级结构中的α-螺旋逐渐转变为β-折叠和无规则卷曲。

表1 白酒添加量对鹅胸肉拉曼光谱归一化强度变化Table 1 Normalized intensity of some Raman spectra bands of goose as a function of distilled spirit

图5 白酒添加量对鹅胸肉蛋白二级结构含量的影响Fig.5 The effect of distilled spirit on the relative content of secondary structure of protein of vinasse goose
注:同行字母不同表示具有差异显著性,p<0.05,表2同。I760可用来表征芳香族氨基酸中色氨酸(Trp)残基的微环境的变化。由表1可知,I760整体呈现先增后减的趋势,当白酒添加量为3%时,其值为0.94达到了最高,同1%组没有明显差异,与其他各组之间差异显著(p<0.05),之后其值又开始下降,表明色氨酸残基逐渐从包埋的疏水环境中暴露出来[20]。酪氨酸(Tyr)双峰的比值(I850/I830cm-1)可用于表征Tyr是处于包埋还是暴露的状态。由表1可知,添加白酒进行腌制后,I850/I830cm-1的比值都是大于1的,说明Tyr处于暴露状态[21],但各组间差异不显著,这表明白酒腌制不影响酪氨酸残疾的暴露。1450 cm-1的拉曼光谱谱带可分别用来表征CH3和CH2的弯曲振动。由表1可知,I1450呈上升的趋势,低白酒量腌制组(1%~3%)与高白酒添加量组(6%~9%)间I1450存在一定的差异,这表明高浓度的白酒腌制增加了CH3和CH2的弯曲震动。
2.4白酒添加量对糟鹅胸肉氨基酸含量的影响
糟醉肉制品具有其特有的甜味、鲜味等特殊滋味,而这些风味的来源取决于低分子的非挥发性成分,如游离氨基酸、核苷酸等[22]。糟醉制品在腌制和糟醉过程中由于微生物的作用以及蛋白酶的水解,氨基酸的种类和含量会发生一定的变化。如表2所示,白酒添加量对糟鹅氨基酸的含量有很大的影响。随着白酒添加量的增大,总氨基酸含量逐渐增大(p<0.05)。然而必需氨基酸却有下降的趋势,但实验中各组的必需氨基酸/总氨基酸均在40%左右[23],能够达到的理想蛋白源的要求。随着白酒添加量的增大,鲜味氨基酸(天门冬氨酸、谷氨酸、亮氨酸、异亮氨酸以及赖氨酸)中两种起主要作用的天冬氨酸、谷氨酸的含量分别从29.12、118.02 mg/100 g逐渐增加到72.23、227.2 mg/100 g;呈味氨基酸(天门冬氨酸、谷氨酸、甘氨酸、丙氨酸、脯氨酸)的含量随白酒添加量的增大也呈不断上升的趋势(p<0.05);甜味氨基酸(丝氨酸、苏氨酸、甘氨酸、苯丙氨酸、甲硫氨酸、赖氨酸、脯胺酸)占总游离氨基酸的比例先有上升后下降,从对照组43.50%上升到白酒添加量为1%时的47.12%,然后在9%时下降为42.59%。张进杰[24]等人的研究表明,糟醉过程中带鱼块的游离氨基酸含量随着糟醉进程逐渐升高,尤其是5种呈味氨基酸的含量。蔡瑞康等[25]对糟制大黄鱼氨基酸进行分析发现,各糟制阶段样品的氨基酸总量及鲜味氨基酸含量均高于鲜鱼中的鲜味氨基酸总量。以上研究结果均与本文类似,这可能是在糟制过程由于内源蛋白酶水解和微生物的代谢作用使得糟制品中游离氨基酸种类和含量均逐渐增加,但各游离氨基酸含量的增减幅度各不相同,这可能是由于加工方式或加工原料不同,其中本研究中鲜味氨基酸含量的增加,可能使得糟制过程中鲜味得到了提升。
2.5白酒添加量对糟鹅质构特性的影响
经不同白酒添加量腌制后的糟鹅质构特性结果如表3所示,与对照组相比,添加1%和3%白酒后糟鹅肉的硬度下降(p<0.05),然而随着白酒添加量的继续增加,其硬度又逐渐上升;糟鹅的咀嚼性和硬度有相似的变化趋势;糟鹅肉的弹性则仅在9%的白酒添加量时显著降低;粘聚性与对照组相比,总体呈现下降的趋势(p<0.05)。白酒对糟鹅肉质构特性的影响较大,可能是由于白酒中的主要成分乙醇,乙醇作为一种极性有机溶剂,可以与带电荷的蛋白质作用,从而对蛋白质的有序结构有一定的作用,对其硬度等产生一定的影响;另一方面可能是由于乙醇分子中的羟基与蛋白质分子作用,氢键作用增强,因此,当白酒浓度较高时,这种氢键作用更强,使其硬度增大[17]。
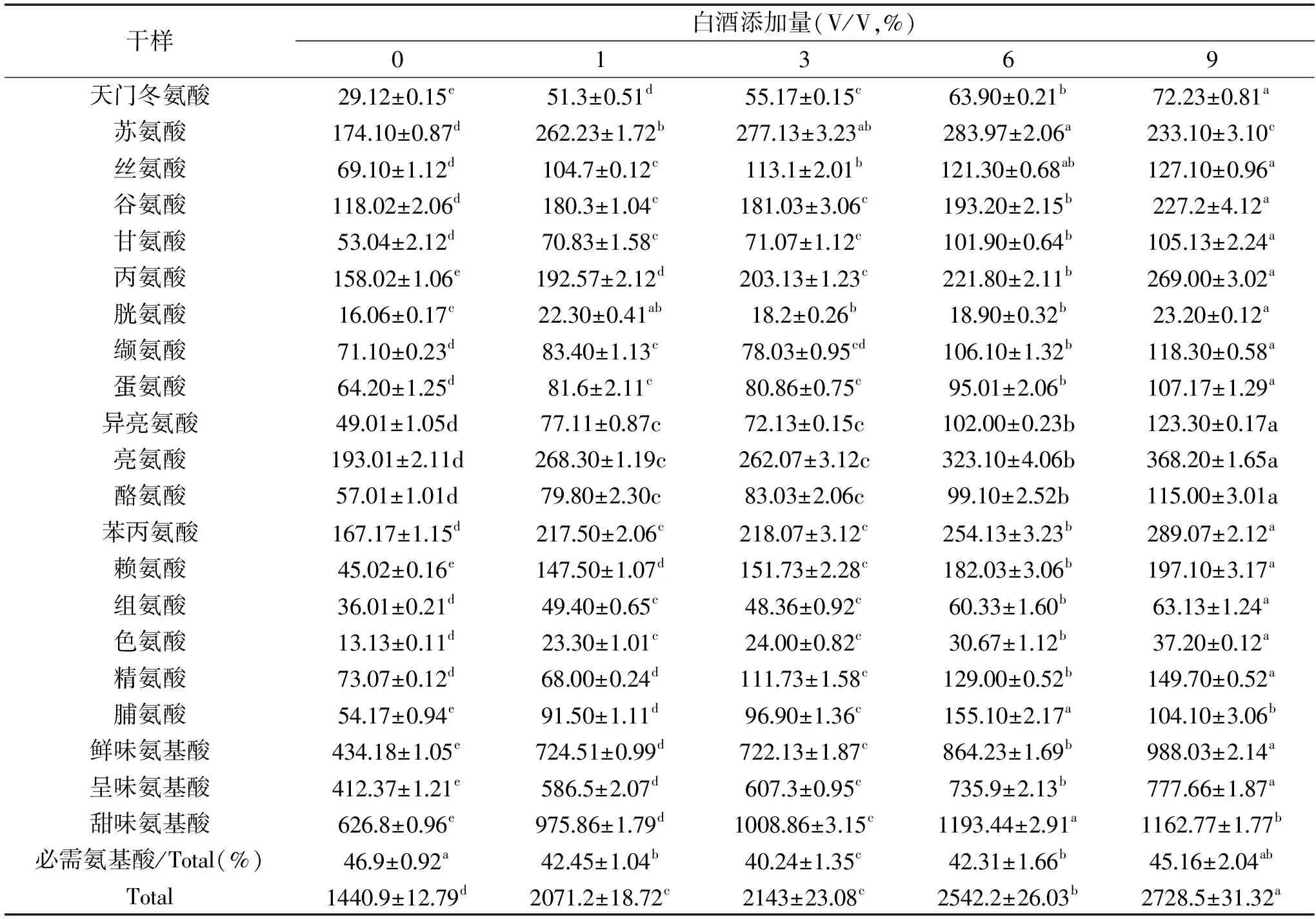
表2 白酒添加量对糟鹅的氨基酸的影响(mg/100 g,n=3)Table 2 The effect of distilled spirit on the content of amino acids of vinasse goose(mg/100 g,n=3)
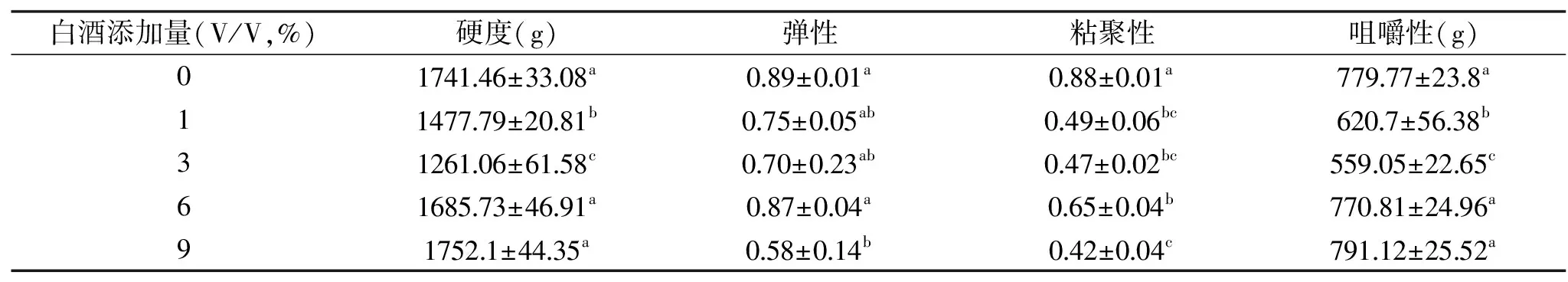
表3 白酒添加量对糟鹅的质构特性的影响Table 3 The effect of distilled spirit on the textural properties of vinasse goose
注:同列字母不同表示具有差异显著性,p<0.05,表4同。2.6白酒添加量对糟鹅胸肉色泽的影响
亮度(L*)是肉色的重要品质之一,研究表明肉的水分含量越多,对光的反射能力越强,但是在腌制过程中,肌红蛋白氧化生成高铁肌红蛋白,会使得L*值下降[26]。白酒添加量对糟鹅胸肉色泽的影响见表4。
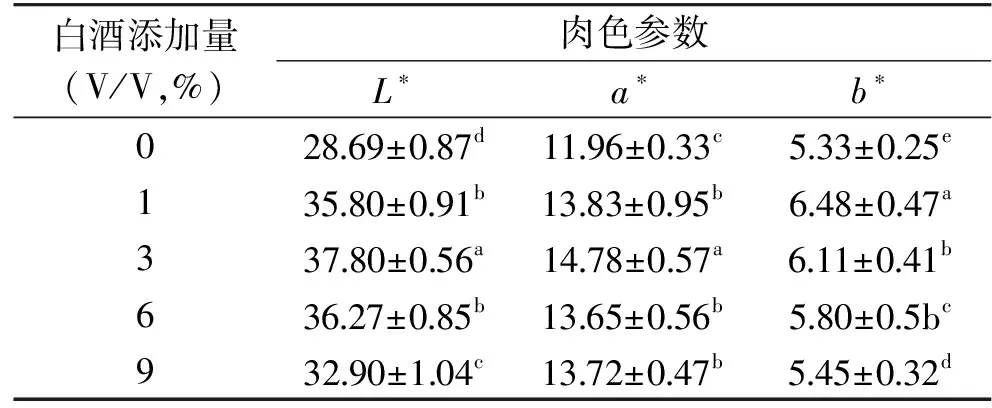
表4 不同白酒添加量下糟鹅色泽比较Table 4 The color changes of vinasse goose during the marination of distilled spirit
由表4可知,随着白酒添加量的增加,糟鹅肉L*和a*值都呈现先增大后减小的趋势,并且在3%时达到最大值。红度(a*)与肌红蛋白含量、红肌纤维数量有很大的关系,a*越大,表明肉的发色效果越好[27],添加白酒后肉的a*值都显著高于对照组(p<0.05)。随着白酒添加量的增加,b*值先上升后下降,以白酒添加量为1%时b*最大,对照组与白酒腌制处理组差异显著(p<0.05)。谢晓红[28]等人通过不同水平含量的白酒糟喂养新西兰兔,发现随着白酒糟添加量的增加,L*值上升,a*值先上升后下降,但是差异不显著,b*值变化不大。以上研究结果表明白酒对肉品的色泽能够产生一定的影响,不过产生的变化不同,可能与物种差异有关。
3 结论
本文研究了白酒添加量对糟鹅腌制过程中肌肉组织微观形态、蛋白二级结构、肌肉质构和滋味物质的变化。白酒腌制显著影响了肌肉组织的微观结构、改变了肌原纤维蛋白质二级结构以及促进了游离氨基酸的形成。糟鹅腌制过程中,随着白酒含量增加,糟鹅胸肉肌节长度先增加后减小,肌原纤维蛋白二级结构的α-螺旋含量下降,逐渐转变为β-折叠和无规则卷曲。游离氨基酸总量从对照组的1440.9 mg/100 g显著增加至9%白酒腌制的2728.5 mg/100 g。白酒腌制也保护了糟鹅的肉色和改变了质构,与对照组相比,3%的白酒腌制时,糟鹅胸肉有更高的L*、a*值,同时硬度达到最小值。该研究结果可为糟鹅加工腌制过程奠定理论基础,为改善糟鹅品质提供新途径,但白酒作用下的蛋白结构与功能特性变化之间的关系还有待进一步研究。
[1]Prajapati J B,Nair B M. 1 The History of Fermented Foods[J]. Handbook of Fermented Functional Foods,2008-1.
[2]Raveling D G. The annual cycle of body composition of Canada Geese with special reference to control of reproduction[J]. The Auk,1979,96(2):234-252.
[3]Istrati D,Ionescu A,Vizireanu C,et al. The tenderization of bovine Biceps femoris muscle using marinades on the basis of wine[J]. Romanian Biotechnological Letters,2012,17(6):7787-7795.
[4]谭汝成,熊善柏,张晖. 酒糟鱼糟制方法的研究[J]. 食品工业科技,2007,28(7):119-121.
[5]徐大伦,薛长湖,杨文鸽,等. 响应面分析法优化糟醉带鱼的糟醉工艺[J]. 食品工业科技,2013,34(4):310-313.
[6]李思维. 两种酒糟鱼风味相关蛋白酶的纯化与性质分析[D]. 南昌"江西农业大学,2015.
[7]Chen L,Feng X C,Zhang Y Y,et al. Effects of ultrasonic processing on caspase-3,calpain expression and myofibrillar structure of chicken during post-mortem ageing[J]. Food Chemistry,2015,177(12):280-287.
[8]Berhe D T,Engelsen S B,Hviid M S,et al. Raman spectroscopic study of effect of the cooking temperature and time on meat proteins[J]. Food Research International,2014,66(66):123-131.
[9]曹锦轩,张玉林,韩敏义,等. 腊肉加工过程中肌原纤维蛋白结构的变化[J]. 中国农业科学,2013,46(18):3871-3877.
[10]Sun W,Zhao Q,Zhao M,et al. Structural evaluation of myofibrillar proteins during processing of Cantonese sausage by Raman spectroscopy[J]. Journal of Agricultural and Food Chemistry,2011,59(20):11070-11077.
[11]Susi H,Byler D M. Fourier Deconvolution of the Amide I Raman Band of Proteins as Related to Conformation[J]. Applied Spectroscopy,1988,42(5):819-826.
[12]Bouraoui M,Nakai S,Li-Chan E. In situ investigation of protein structure in Pacific whiting surimi and gels using Raman spectroscopy[J]. Food Research International,1997,30(1):65-72.
[13]Li Z,Jia C,Wang X,et al. Nondestructive determination of beef textural properties by near infrared spectroscopy[J]. Transactions of the Chinese Society of Agricultural Engineering,2016,32(16):286-292.
[14]Overholt M F,Arkfeld E K,Mohrhauser D A,et al.
Comparison of variability in pork carcass composition and quality between barrows and gilts[J]. Journal of Animal Science,2016,94(10):4415-4426.
[15]Wheeler T L,Shackelford S D,Koohmaraie M. Variation in proteolysis,sarcomere length,collagen content,and tenderness among major pork muscles[J]. Journal of Animal Science,2000,78(4):958-965.
[16]Nagaraj N S,Santhanam K. Effect of frozen temperature and storage time on calpains,cathepsins(B,B+L,H and D)and their endogenous inhibitors in goat muscles[J]. Journal of Food Biochemistry,2006,30(2):155-173.
[17]李超. 加热处理对鸭肉嫩度的影响及其机制研究[D]. 南京:南京农业大学,2012.
[18]Herrero AM,Carmona P,Careche M. Raman spectroscopic study of structural changes in hake(MerlucciusmerlucciusL.)muscle proteins during frozen storage[J]. Journal of Agricultural and Food Chemistry,2004,52(8):2147-2153.
[19]Beattie R J,Bell S J,Farmer L J,et al. Preliminary investigation of the application of Raman spectroscopy to the prediction of the sensory quality of beef silverside[J]. Meat Science,2004,66(4):903-913.
[20]Shao J H,Zou Y F,Xu X L,et al. Evaluation of structural changes in raw and heated meat batters prepared with different lipids using Raman spectroscopy[J]. Food Research International,2011,44(9):2955-2961.
[21]Li-Chan E,Nakai S,Hirotsuka M. Raman spectroscopy as a probe of protein structure in food systems[M]//Protein structure-function relationships in foods. Springer US,1994:163-197.
[22]Liu P,Li H M,Tang Y J. Comparison of free amino acids and 5′-nucleotides between Tuber fermentation mycelia and natural fruiting bodies[J]. Food Chemistry,2012,132(3):1413-1419.
[23]安加俊. 宁南山区高中档牛肉杂交生产模式[D]. 杨凌:西北农林科技大学,2008.
[24]张进杰,徐大伦,杨文鸽,等. 糟醉带鱼制作过程中营养、呈味物的变化[J]. 中国食品学报,2014(9):224-232.
[25]蔡瑞康,吴佳佳,马旭婷,等. 糟鱼腌制过程中的营养成分分析与评价[J]. 食品与发酵工业,2016,42(2):172-177.
[26]Wulf D M,Wise J W. Measuring muscle color on beef carcasses using the L*a*b*color space[J]. Journal of Animal Science,1999,77(9):2418-2427.
[27]羿庆燕,华晶忠,李官浩,等. 不同质量等级延边黄牛肉成熟期间新鲜度的变化[J]. 肉类研究,2013(3):13-16.
[28]谢晓红,郭志强,杨奉珠,等. 白酒糟对肉兔生产性能和肉质的影响[J]. 中国畜牧杂志,2012(17):51-54.
Effectofdistilledspiritmarinationonmyofibrillarstructureandtastedcompoundsofvinassegoose
CHENLi-yan1,PANDao-dong1,2,*,LUOHong-lin1,ZHOUChang-yu1,CAOJin-xuan1,SUNYang-ying1
(1.Key Laboratory of Animal Protein Food Deep Processing Technology of Zhejiang Province,Ningbo University,Ningbo 315211,China; 2.Food Science & Nutrition Department of Nanjing Normal University,Nanjing 210097,China)
This paper established the interaction system between vinasse goose and distilled spirit,aiming at illustrating how the concentrations of distilled spirit change the microstructure,texture and tasted compounds by transmission electron microscope,Raman spectroscopy and amino acid analyzer.The results indicated that sarcomere length firstly increased and then decreased(p<0.05)when concentration of the distilled spirit increased from 0% to 9%(v/v). Myofiber diameter of vinasse goose had no significant change during processing,the content of secondary structure of myofibrillar proteins implied that the content ofα-helix significantly decreased,and gradually transformed intoβ-sheet and random coil(p<0.05). The content of total free amino acids and delicious amino acids significantly increased during the processing(p<0.05). At 3% of distilled spirit,L*anda*values reached the maximum while hardness reached the minimum value. This investigation showed that the marination of distilled spirit could influence the structure of myofibrillar proteins,improve texture characteristics and contribute to the accumulation of free amino acid.
vinasse goose;distilled spirit;myofibril ultrastructure;secondary structure;texture;free amino acids
2017-01-13
陈丽艳(1991- ),女,硕士研究生,研究方向: 水禽产品加工及综合利用,E-mail:chenliyan0407@163.com。
*通讯作者:潘道东(1964-),男,博士,教授,研究方向:水禽产品加工及综合利用,E-mail:daodongpan@163.com。
国家水禽产业体系(CARS-43-17);国家科技部星火计划项目(2014GA701052);浙江省重大科技专项重大农业项目(2014C02020)。
TS251.1
:A
:1002-0306(2017)12-0081-06
10.13386/j.issn1002-0306.2017.12.015

