咔唑席夫碱衍生物的制备与表征
周义丰, 张宗辉, 刘佳然, 赵剑英
(淮阴师范学院 化学化工学院, 江苏 淮安 223300)
咔唑席夫碱衍生物的制备与表征
周义丰, 张宗辉, 刘佳然, 赵剑英
(淮阴师范学院 化学化工学院, 江苏 淮安 223300)

咔唑希夫碱衍生物; 合成; 表征
0 引言
现代工业生产的快速发展引发了严重的能源危机和环境污染问题,亟待开发利用清洁新能源以解决人类生存危机.太阳能作为一种清洁可再生能源,没有地域限制,储量巨大,是现今世界上可以开发的最大能源.20世纪90年代,瑞士洛桑高等工业学校Gratzel M.教授领导的研究小组将纳米多孔的概念引入染料敏化宽禁带TiO2半导体研究中,获得光电转换效率7.1%的染料敏化太阳能电池(DSSCs)[1].成功开启了合成高效太阳能敏化染料的先河.
咔唑及其衍生物是一类重要的富电子含氮芳杂环化合物.咔唑环上易引入各种功能化的官能团[2-3],使其具有多种功能,如:光电性能[4]、抗菌能力[5]、荧光探针[6]等材料,已被广泛应用于染料、医药、农药、香料、高分子等领域[7-8].咔唑及其衍生物的良好光电性能主要来自于分子中氮原子核外电子的排布以及成键特性,氮原子的存在提高了咔唑分子及其衍生物局部或整体的电子云密度[9].本文利用咔唑为母体合成了(E)-4-(N-乙基咔唑-3-甲亚胺基)-安替比林希夫碱(R1)和2-氨基-3-(E)-(N-对苯甲基咔唑基-甲亚胺基)-马来腈席夫碱(R2)两种希夫碱,并对其结构和性质进行了表征.
1 实验部分
1.1 试剂及仪器
4-氨基安替比林,乙醇,冰醋酸,二氨基马来腈,乙腈,国药集团化学试剂有限公司生产,分析纯,使用前未进行纯化处理.N-乙基咔唑-3-甲醛,4-N-对甲基苯咔唑3-甲醛,实验室自制.
傅立叶变换红外光谱仪FT-IR(AVATAR360,美国尼高力);核磁共振波谱仪NMR(AVANCE,400MHz,瑞士布鲁克);紫外-可见光谱仪UV-Vis(UV-1750,日本Kyoto);Perkin-ElmerLS-55型荧光光谱仪(美国,PE);单晶X射线衍射仪(Bruker,SMART,APEX).
1.2 咔唑衍生物的合成
1.2.1 R1的合成
在250 mL三颈烧瓶中加入4-氨基安替比林0.7 g、N-乙基咔唑-3-甲醛0.669 g、乙醇25 mL.在81℃油浴中回流溶解,待溶解完全后,滴加1 mL冰醋酸,继续回流4 h.反应结束,冷却至室温,低温静置12 h,过滤,得到淡黄色产物R1.1HNMR(400MHz,DMSO):δ(ppm)9.78(s,1H,CH=N),8.57(s,1H,Ar),7.37~8.29(d,11H,Ar),3.15(s,3H,CH3),1.32(s,3H,CH3).ESI-MS[m/z]:409.2[M]+.反应方程式如图1.
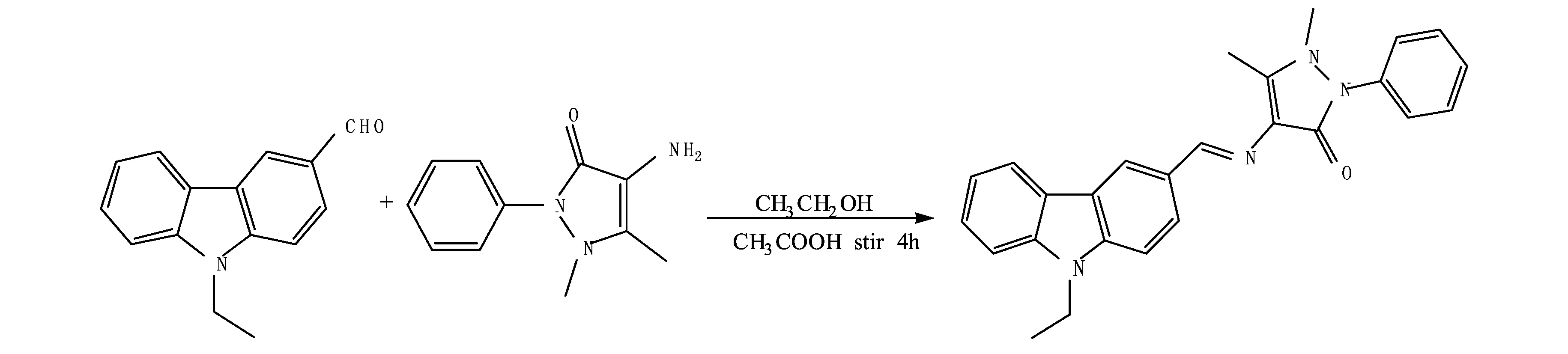
图1 R1合成示意图
1.2.2 R2的合成
将二氨基马来腈0.324 g溶于20 mL无水乙醇中,向其中加入4-N-对甲基苯咔唑3-甲醛0.878 g,在搅拌的条件下将混合溶液加热到80℃,3 h后有黄色沉淀生成.等反应结束后将混合物抽滤,用无水乙醇重结晶得到R2.1HNMR(400MHz,CDCl3):δ(ppm)8.61(s,1H,Ar),8.59(s,1H,Ar),8.19(d,1H,CH),7.89(d,1H,Ar),7.45(d,4H,Ar),7.38(d,2H,Ar),7.34(d,2H,Ar),5.14(s,2H,NH2),2.51(s,3H,CH3).ESI-MS[m/z]:376.2[M]+.反应方程式如图2.

图2 R2合成示意图
1.3 晶体结构测定
1.3.1 晶体的培养
将R1、R2分别溶解于乙腈溶剂中,配制成近饱和溶液,置于空气中挥发,约1周后分别有浅黄色晶体从溶液析出.
1.3.2 晶体结构测定

2 结果与讨论
2.1 晶体结构
2.1.1 R1晶体结构
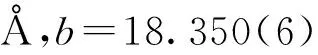

表1 R1和R2的晶体学数据
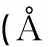
表2 化合物R1的部分键长(nm)、键角)和二面角)
2.1.2 R2晶体结构


(a) R1分子结构椭球 (b) R1分子晶胞堆积图

氢键类型键长和键角Dist.DH…AADist.D…AAAngleD-H…A/°N3H3A…N22.45002.751(4)101.300C10H10A…N42.8519(27)3.7490(45)162.29(24)N3H8B…N22.39002.705(4)101.900N3H8C…N4*2.14002.961(4)159.500
注:*2-x, 1-y, 2-z.
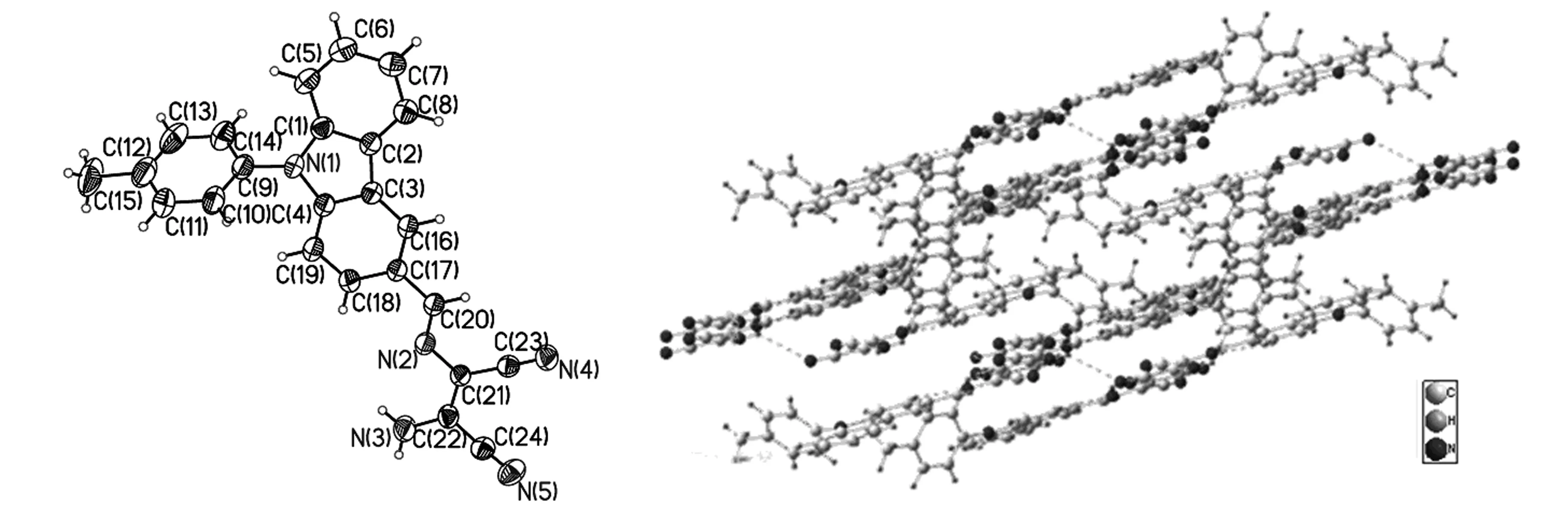
(a) R2分子结构椭球图 (b) R2分子的晶胞堆积图
2.2 红外光谱特征
室温下采用KBr压片测定了R1、R2的红外光谱分别见图5a和图5b.图5a中,3 188~3 012cm-1范围内明显有两对振动吸收,属于是典型的甲基C-H键伸缩振,分别可归属于N-乙基上甲基和吡唑啉环上甲基振动.1 739 cm-1的吸收峰可归属于吡唑啉环中羰基的伸缩振动.1 634 cm-1处强吸收峰,是亚胺键C=N伸缩振动.1 522 cm-1归属于苯环的呼吸振动.在1 415 cm-1和1 390 cm-1处有较强双峰吸收,为甲基的对称弯曲振动吸收,由于振动耦合使之分裂成两条强度相近的谱带.
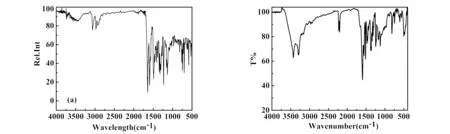
(a) R1 (b) R2
图5b为KBr压片测定的R2红外谱图.3 432 cm-1和3 294 cm-1两外有强的红外吸收,根据分子结构可判断这是氨基N-H的伸缩振动所致的吸收.在3 208 cm-1和3 196 cm-1处有2个强度较弱的吸收峰,归属于芳基上C-H伸缩振动.2 976 cm-1处弱吸收归属于甲基振动.氰基伸缩振动吸收分别位于2 227和2 206 cm-1,这是受分子中不同化学环境的影响使致.1 594 cm-1处的强吸收归属于芳基的吸收振动.
2.3 紫外光谱特征
图6是浓度约为1.0×10-4mol·L-1的化合物R1在甲醇溶剂中的紫外-可见吸收光谱图.由图可见,R1分别在波长209,245,287和351 nm处有强吸收峰.351 nm处吸收归属于R1分子内π-π*跃迁吸收.287 cm吸收峰为N-乙基咔唑母体π-π*跃迁吸收.209 cm和245 cm处的吸收可归属于苯环及取代苯环的π-π*跃迁吸收.

图6 R1在溶剂甲醇中的紫外光谱图 图7 R2在溶剂DMF中的紫外光图
图7是R2(浓度为2.0×10-5mol·L-1)在DMF溶剂中的电子吸收光谱.图中显示,R2最大吸收峰在396 nm左右.实验室发现母体3-甲酰基-N-对苯甲基咔唑的最大吸附峰在324 nm,这表明在母体上引入马来腈后扩大了共轭范围,导致电子吸收光谱红移.R2分子分别在290 nm处有1个吸收峰,这是苯环的特征吸收峰.
HOMO和LUMO轨道是用于确定分子电传输特性[11]的关键参数.R1和R2使用含时密度泛函理论的PBE1PBE、B3LYP和M062X混合泛函在6-311G(d,p)基础上计算的前线轨道能量列于表4.表中可见,不同方法计算的轨道能量略有区别,M062X方法计算值最小.根据B3LYP/6-311++G(d,p)的方法,R1最高占据分子轨道(HOMO)的能量水平为约-5.335 eV,最低未占分子轨道(LUMO)约为-1.482 eV,HOMO-LUMO轨道能极差约为3.853 eV.L2的HOMO轨道能量水平为-5.868 eV,LUMO轨道能量为-2.593 eV,两者差值为3.275 eV.
良好的DSSC染料必须具备2个条件:较宽的能隙、LUMO轨道能级高于TiO2导带能量及HOMO轨道能量必须低于氧化还原电对电势.纳米晶(TiO2)38的HOMO轨道及LUMO轨道能量分别为-7.23和-4.1 eV,I-/I3-电对氧化还原势为4.8 eV.从表4可知,化合物R1和R2的理论计算值均能满足条件,表明R1和R2在DSSC中有着潜在的应用价值.

表4 用B3LYP/6-311++G(D,P)方法计算出的R1、R2的前线轨道能量
2.4 荧光特征
图8是R1(浓度为1.0×10-5mol·L-1)甲醇溶液以350 cm为激发波长、在1%的衰减片作用下得到的荧光发射图谱.图中可见,R1荧光最大发射波长为458.7 cm,属蓝色荧光,发射光强度大.与电子光谱相比发生了107 cm斯托克红移.表明R1分子在回到基态前激发态寿命的能量消耗较大,有利于大斯托克红移的光电材料的设计.
同时还检测了R2的荧光发射能力,发现R2荧光强度较弱.

图8 R1在溶剂甲醇中的荧光光谱图
3 结论
本文利用咔唑为原料合成了化合物R1和R2.利用核磁共振氢谱(1HNMR)、质谱(MS)、红外光谱(FT-IR)、紫外光谱(UV-Vis)和荧光光谱(PL)对R1和R2化合物结构和性质进行了表征.发现R1和R2晶系分别属于P2(1)/n空间群和P-1(2)空间群.最大吸收波长分别为:λmax=396.1 cm、λmax=351.1 cm,R1具有较强的荧光,最大发射波长(甲醇溶液)位于458.7 cm.
利用密度泛函理论B3LYP等方法方法对R1和R2的轨道能量进行了计算,结果发现R1、R2轨道能量及能差满足太阳能敏化染料的需求,表明这两种化合物在DSSC中有着潜在的应用价值.
[1] Gratzel M. A low-cost, high-effciency solar cell based on dye-sensitized colloidal TiO2films[J]. Nature, 1991, 353: 737-739.
[2] 王歌扬, 徐茂梁, 周瑞, 等. 咔唑功能化的长链端烯β二酮的制备[J]. 化学试剂, 2009, 31(8): 587-590.
[3] Katsis D, Mastrangelo J C, Chen S H, et al. Fluorescence of Pyrenyl and Carbazolyl Derivatives in Liquid Solution and Solid Film[J]. Journal of Physical Chemistry A, 1998, 102: 9213-9218.
[4] 耿凤华, 王永祥, 刘保霞, 等. 咔唑及其衍生物在光电材料中的应用研究[J]. 应用化工, 2011, 40(8): 1444-1450.
[5] 李中华, 李佳凤, 汪焱钢, 等. 咔唑席夫碱的合成及抗菌活性[J]. 应用化学, 2007, 24(9): 1074-1076.
[6] 汤立军, 赵国有, 王楠楠, 等. 一种基于咔唑的荧光探针对铜(II)离子的荧光增强识别[J]. 化学研究与应用, 2013, 25(7): 946-951.
[7] 赵德丰,周丹红,杨锦宗,等. 咔唑化学的进展及其在颜料工业中的应用[J]. 染料与染色, 1987(4): 32-38.
[8] 冯岩, 陈秋容, 李万舜, 等. 3-乙酰基-6-苯甲酰基-N-乙基咔唑的合成[J]. 化学研究与应用, 2007, 19(10): 1162-1165.
[9] 高首勤. 咔唑类ICT化合物的合成及光谱研究[D]. 太原:山西大学, 2014.
[10] 王玉凤. 亚胺键桥连苯环化合物的合成、表征及其光响应性能研究[D]. 南京:南京理工大学, 2012.
[11] Li M J, Lin M, Xie R, et al. Synthesis and electrochemiluminescence studies of tricarbonylrhenium(I) complexes with a cationic 2,2’-bipyridyl ligand[J]. Electrochimica Acta, 2011, 56(25): 9344-9349.
[责任编辑:蒋海龙]
Preparation and Characterization of Carbazole Schiff base Derivatives
ZHOU Yi-feng, ZHANG Zong-hui, LIU Jia-ran, ZHAO Jian-ying
(School of Chemistry and Chemical Engineering, Huaiyin Normal University, Huaian Jiangsu 223300, China)

carbazole schiff base derivatives; synthetize; characterization
2017-01-29
江苏省高校大学生创新训练计划项目(201410323026Y)
赵剑英(1965-),女,江苏常熟人,教授,博士,主要从事配位化学等研究. E-mail: Zhaojy008@21cn.com
O626.2
A
1671-6876(2017)02-0135-07

