密孔菌固态发酵农业废弃物产漆酶活性的研究
李秀男, 牛子琪, 胡卫成,2,3, 王新风,2,4
(1.淮阴师范学院 生命科学学院, 江苏 淮安 223300; 2.淮安市食品组分与功能食品重点实验室, 江苏 淮安 223300; 3.江苏省区域农业与环境保护协同创新中心, 江苏 淮安 223300;4.江苏省生物质能与酶技术重点实验室, 江苏 淮安 223300)
密孔菌固态发酵农业废弃物产漆酶活性的研究
李秀男1, 牛子琪1, 胡卫成1,2,3, 王新风1,2,4
(1.淮阴师范学院 生命科学学院, 江苏 淮安 223300; 2.淮安市食品组分与功能食品重点实验室, 江苏 淮安 223300; 3.江苏省区域农业与环境保护协同创新中心, 江苏 淮安 223300;4.江苏省生物质能与酶技术重点实验室, 江苏 淮安 223300)
分别以玉米秸秆、小麦秸秆和杨树木屑为原料,研究了一株密孔菌在发酵不同农业废弃物时漆酶的活性.结果表明,农业废弃物对密孔菌产漆酶具有良好的诱导效果,且以玉米秸秆的效果最佳,漆酶酶活可达40.92 U·mg-1.Cu2+的存在或浓度变化显著影响密孔菌产酶,当添加0.02% Cu2+时,菌株在小麦秸秆和木屑培养基上产酶活分别达到41.24 U·mg-1和57.13 U·mg-1;当Cu2+浓度为0.04%时,菌株在玉米秸秆培养基上分泌漆酶酶活达到峰值94.92 U·mg-1.pH值对密孔菌产漆酶有明显影响,在中酸性环境中菌株产漆酶酶活较高.菌株在小麦秸秆和玉米秸秆培养基上发酵产酶的最适温度较高,分别为35℃和40℃,且在整个发酵周期能维持较高较稳定的酶活水平.因此,密孔菌有很好产漆酶和降解农作物秸秆的能力,可用于农作物秸秆处理.
密孔菌; 固态发酵; 农业废弃物; 漆酶
0 引言
漆酶是一类含铜多酚氧化酶,广泛存在于高等植物和真菌体内[1].目前已知真菌类的担子菌、子囊菌和半知菌大多都具有产漆酶能力,其中具有降解木质素能力的白腐菌是主要的漆酶产生菌[2].在过去的几十年中,人们发现漆酶具有广泛的底物特异性,可以氧化酚类、芳胺类、羧酸类、甾体激素与生物色素、金属有机化合物和一些非酚类物质,且副产物只有水,被誉为“绿色酶”.漆酶不仅在生物制浆、生物漂白以及有毒化合物的降解等方面有重要的应用前景,而且在合成工业、生物检测、染料降解等方面也具有潜在的应用前景[3-5].它们的应用从纺织到纸浆和造纸工业[6-7],从食品[8]到有机合成[9]和制药工业[10],从生物降解到环境保护和生态修复[11-13]等多个领域越来越广泛,随着人们对漆酶作用机理的深入了解,以及对白腐真菌这一降解木质素明星微生物的研究,利用白腐真菌来处理农业废弃物的研究也就走进了研究者的视线.
目前,我国已成为世界上农业废弃物产出量最大的国家,其中农作物秸秆年产量达7亿吨(干质量),畜禽粪便排放量30多亿吨,锯末、刨花等林业废弃物16 000吨[14].在我国各地政府部门的大力倡导下,作为主要农业废弃物的秸秆大多以直接还田的方式行处理,如江苏省淮安市秸秆年产量达420万吨,其中夏季所产的秸秆还田量可达95%.秸秆还田的过程也是微生物降解的过程,农业废弃物是一种富含木质素资源(如稻草中含木质素10%~15%,纤维素35%~40%和半纤维素25%~30%),也是一种天然的漆酶诱导剂[15].本文将讨论一株密孔菌(Pycnoporuscoccineus)在发酵不同农业废弃物时漆酶的活性变化情况,旨在为加强农业废弃物的综合利用和对农业面源污染的综合治理寻找理论依据.
1 材料方法
1.1 菌种
绯红密孔菌(Pycnoporuscoccineus),采自江苏省溧阳市天目湖南山竹海翠谷庄园板栗林,本实验室保存.
1.2 试剂和仪器
2,2-连氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS),美国Sigma 公司产品;考马斯亮蓝G250和牛血清蛋白,Amresco分装;冰乙酸,无水乙酸钠为市售分析纯.
T6新世纪紫外可见分光光度计(北京普析).
1.3 培养基
母种活化培养基: PDA固体培养基.
液体种子培养基: 土豆200 g,葡萄糖20 g,酵母膏5 g,自来水1000 mL.
固体发酵培养基: 杨树木屑、玉米秸秆、小麦秸秆分别轻度粉碎,按每种基质的总质量加入2%蔗糖、1% Ca(OH)2、1% KH2PO4、0.5% MgSO4、0.5%酵母膏、2%石膏、10 mg·L-1VB,以最终培养基含水量为65%为标准加入适量自来水,反复搓揉均匀,用塑料薄膜盖2 h.
铜离子浓度试验培养基: 在固体发酵培养基基础上加入CuSO4·5H2O,调整培养基中铜离子浓度分别为(0.01%、0.02%、0.03%、0.04%),以未加CuSO4·5H2O的培养基为空白对照考察铜离子浓度对绯红密孔菌产漆酶的影响.
pH试验培养基: 根据试验培养基计算所需自来水体积,将除石膏外的各试剂溶于定量自来水中,用柠檬酸和Na2CO3分别调节pH为3.0,5.0,7.0,9.0,11.0,加入石膏,均匀拌入固体基质中.考察发酵料初始pH对绯红密孔菌产漆酶的影响.
温度试验培养基: 在固体发酵培养基基础上加入适量的CuSO4·5H2O,分别置于不同温度下(20℃,25℃,30℃,35℃,40℃)培养,考察培养温度对绯红密孔菌产漆酶的影响.
1.4 方法
1.4.1 发酵培养
将活化后的母种,接种于液体发酵培养基,25℃,120 r·min-1恒温振荡,避光培养5 d后,得到液体菌种.配制固体培养基,按每罐10 g基质(小麦秸秆、玉米秸秆或木屑)分装于玻璃罐头瓶中,每罐发酵料终体积约占1/3.将液体菌种接种于不同配方的固体培养基上,适宜温度下恒温避光培养.
1.4.2 粗酶液获取
在无菌条件下, 随机选择生长状态一致的菌丝体培养料1 g, 置于加入15 mL醋酸缓冲液(0.2 mol·L-1,pH 4.5)的100 mL三角瓶中,25℃,120 rpm的摇床中浸提2 h,4 000 r·min-1离心10 min后取上清液,即为粗酶液.
1.4.3 可溶性蛋白测定
采用考马斯亮蓝G250法[16].蛋白浓度在20 ~80μg·mL-1之间,蛋白含量与吸光度值呈很好的线性关系,两者间的回归方程为:y=0.0062x+0.0081,相关系数r=0.9981.
1.4.4 酶活测定方法
漆酶活力的测定采用ABTS法[1],以2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)为底物,量取2 mL ABTS,将3.2 mL pH 4.5的醋酸缓冲液和0.8 mL稀释好的粗酶液混合,使反应总体积为6 mL.测定反应前3 min内420 nm 处每30 s吸光值的变化,酶活定义为粗酶液中每mg蛋白每分钟引起吸光度增加0.1所需要的酶量,单位为U·mg-1.酶活计算公式:
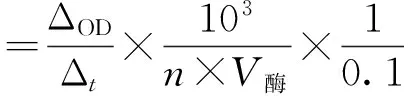
其中,V酶为添加酶液体积(mL);n为蛋白含量(μg·mL-1).
2 结果
2.1 农业废弃物对密孔菌漆酶活性的影响
如表1所示,密孔菌在玉米秸秆培养基上产酶酶活最高,在培养的第11 d,漆酶酶活达到峰值40.92 U·mg-1.而菌株在小麦秸秆和木屑培养基上产酶酶活最大值相差不多,分别为12.33 U·mg-1和11.18 U·mg-1.这可能是由于废弃物的种类或所取废弃物的部位不同,而导致各发酵培养基中纤维素、半纤维素、木质素含量不同造成的结果[17].

表1 农业废弃物对密孔菌产酶活性的影响 (U·mg-1)
2.2 Cu2+对密孔菌漆酶活性的影响
漆酶作为一种含铜的多酚氧化酶,属于蓝色多铜氧化酶[18].它的活性位点主要由4个3种不同类型的铜离子组成,因此铜离子是漆酶分泌的一个重要影响因素[19].本实验通过改变产酶培养基中Cu2+浓度,研究其对漆酶产量的影响.结果如表2~表4所示.
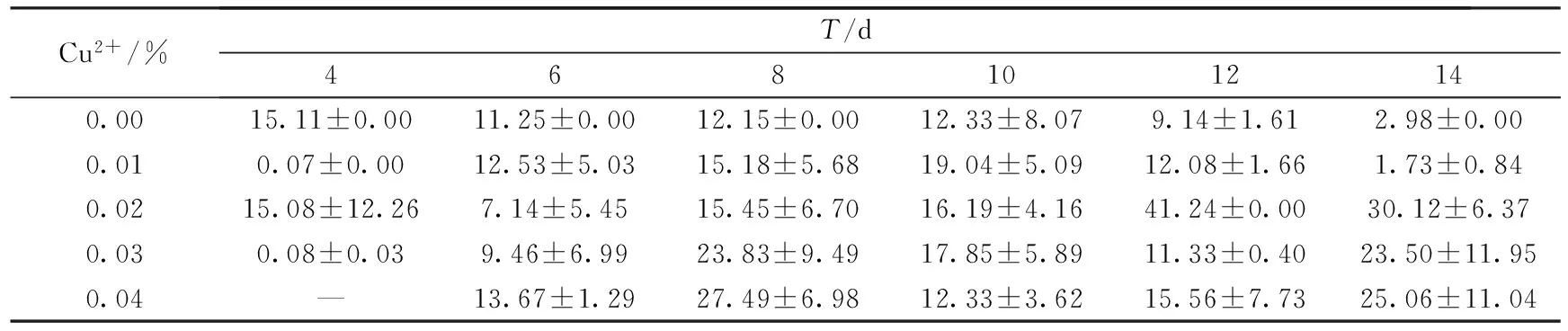
表2 小麦秸秆培养基上Cu2+对密孔菌产酶活性的影响 (U·mg-1)
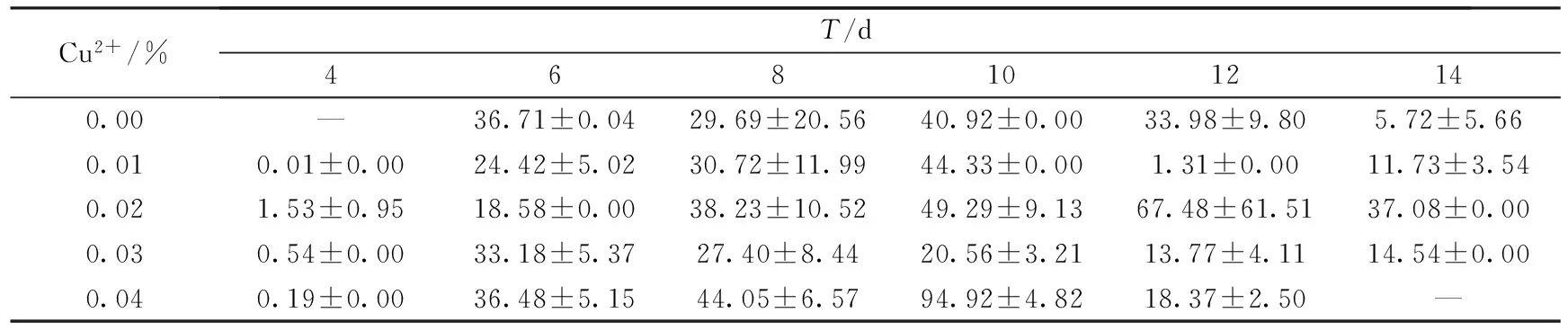
表3 玉米秸秆培养基上Cu2+对密孔菌产酶活性的影响 (U·mg-1)
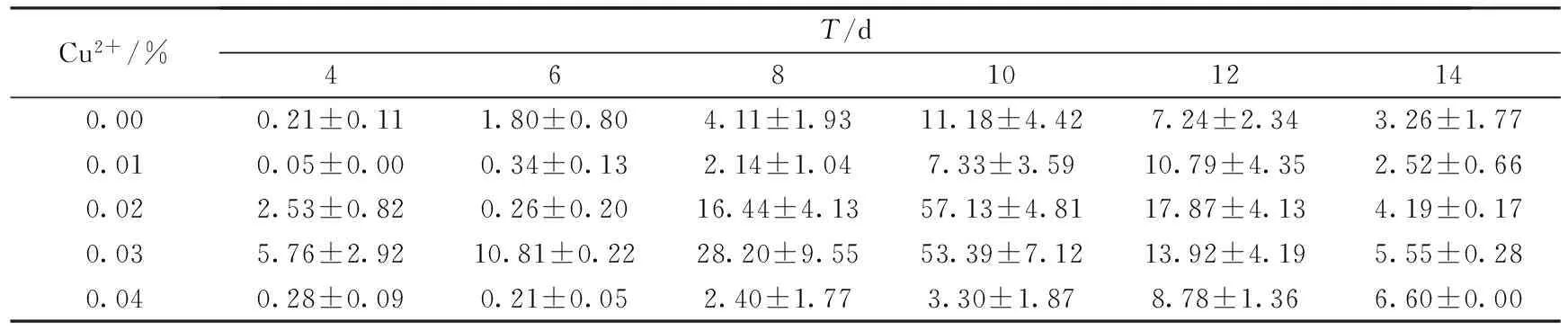
表4 木屑培养基上Cu2+对密孔菌产酶活性的影响 (U·mg-1)
结果表明,在以不同农业废弃物为主料的培养基上,Cu2+对密孔菌产酶活性的影响也不相同.对于小麦秸秆,当Cu2+浓度为0.02%时,菌株产漆酶酶活最高,为41.24 U·mg-1.对于玉米秸秆,当Cu2+浓度为0.04%时,菌株分泌漆酶酶活达到峰值94.92 U·mg-1.在培养初期,添加Cu2+的培养基产酶酶活低于空白培养基,而随着培养天数的增加,Cu2+对菌株分泌漆酶的促进作用逐渐表现出来;而木屑培养基中,Cu2+浓度为0.02%时,菌株产漆酶酶活最高,达到57.13 U·mg-1.并且在整个培养过程中,添加0.02%和0.03%浓度Cu2+的培养基产漆酶酶活均高于空白培养基,Cu2+对菌株产漆酶的促进作用十分显著.过高或过低浓度的铜离子都不利于漆酶的分泌.
2.3 发酵料初始pH对密孔菌漆酶活性的影响
研究表明,漆酶合成与活力表达受环境pH影响显著[20-21].本实验调整3种发酵料不同初始pH值,考察其对密孔菌产酶活性的影响.实验结果如表5~表7所示.
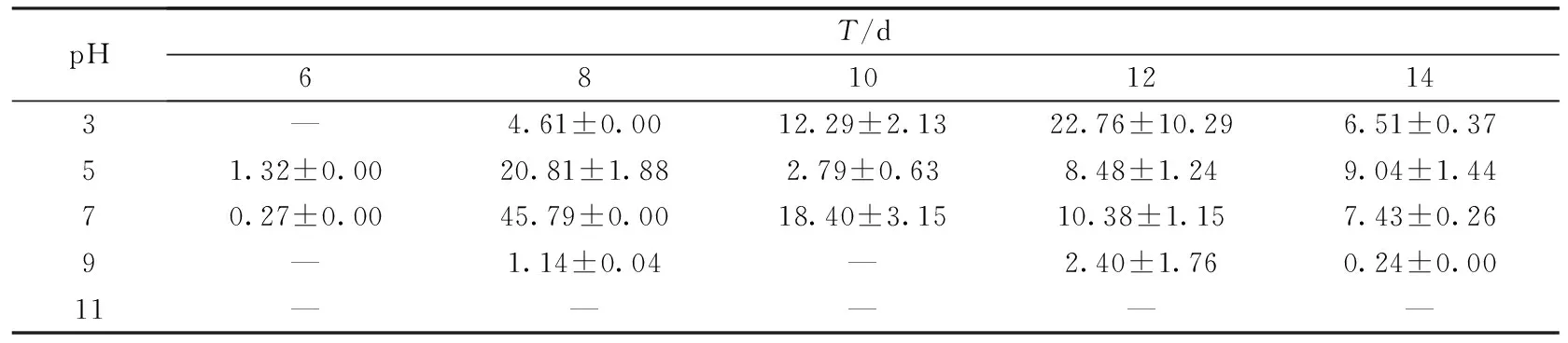
表5 小麦秸秆培养基上发酵料初始pH对密孔菌产酶活性的影响 (U·mg-1)
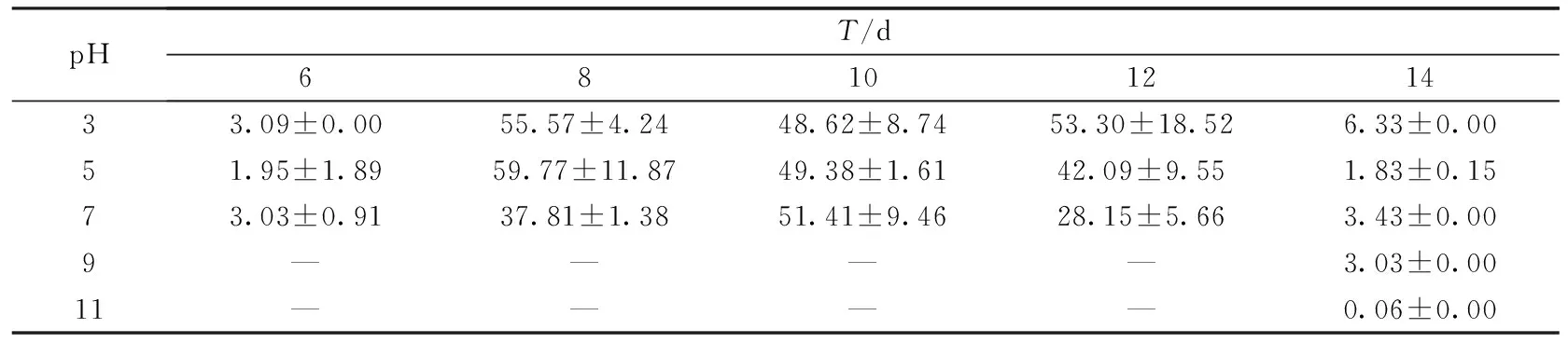
表6 玉米秸秆培养基上发酵料初始pH对密孔菌产酶活性的影响 (U·mg-1)
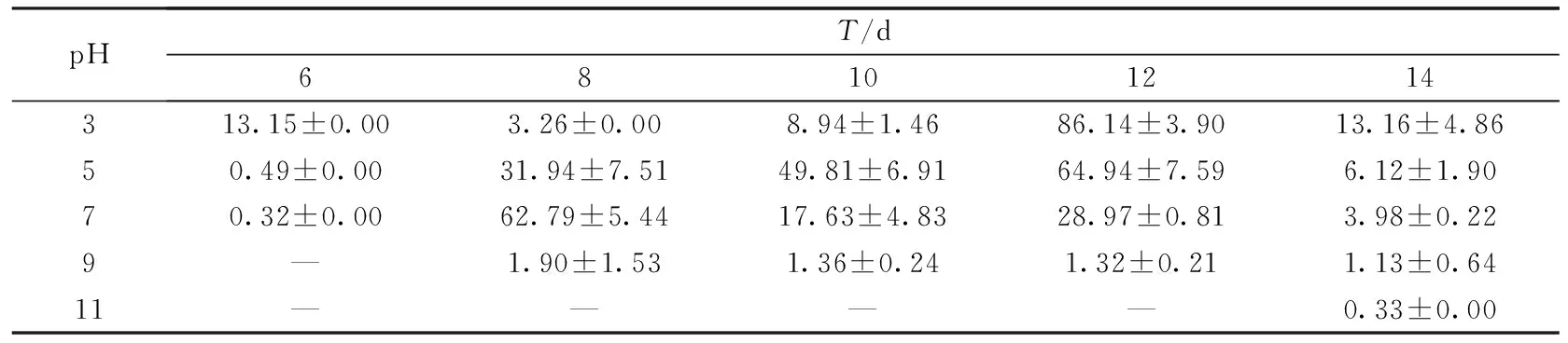
表7 木屑培养基上发酵料初始pH对密孔菌产酶活性的影响 (U·mg-1)
结果显示,菌株在中酸性条件下分泌漆酶酶活较高,而在碱性环境中产酶酶活极低甚至检测不出.此外,菌株在不同培养基上产酶所需最适pH也存在差异.对于小麦秸秆和玉米秸秆培养基,菌株在偏中性环境中产酶酶活较高,分别在初始pH为7和5时达到酶活峰值45.79 U·mg-1和59.77 U·mg-1;而在木屑培养基中,菌株更适宜在偏酸性环境中生长,在初始pH值为3时酶活最高,为86.14 U·mg-1,且出现的时间晚于小麦秸秆和玉米秸秆.有研究表明,真菌在中偏酸性环境下酶活较高,这与本实验研究结果基本一致[22].尹艳丽等[23]认为偏酸性条件,一方面会促进白腐菌生长,另一方面,由于漆酶的最适作用pH为酸性,因而能使白腐菌分泌的漆酶保持较高活性.
2.4 培养温度对密孔菌漆酶活性的影响
微生物的生命活动都是由一系列的生化反应组成的,这些反应受温度影响极其明显,所以温度是影响微生物生长繁殖的重要因素之一[24].本实验设置不同的培养温度,考察其对密孔菌产酶活性的影响.实验结果如表8~表10所示.
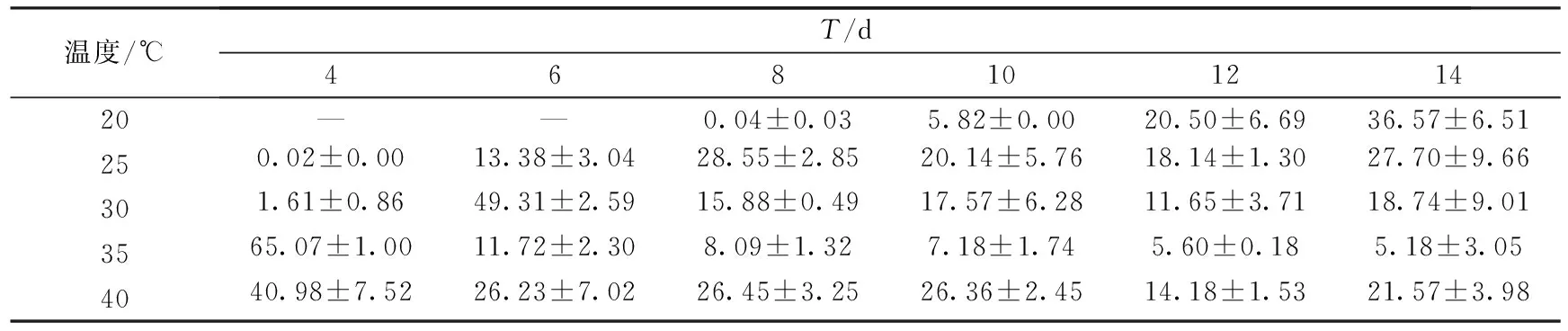
表8 小麦秸秆培养基上培养温度对密孔菌产酶活性的影响 (U·mg-1)
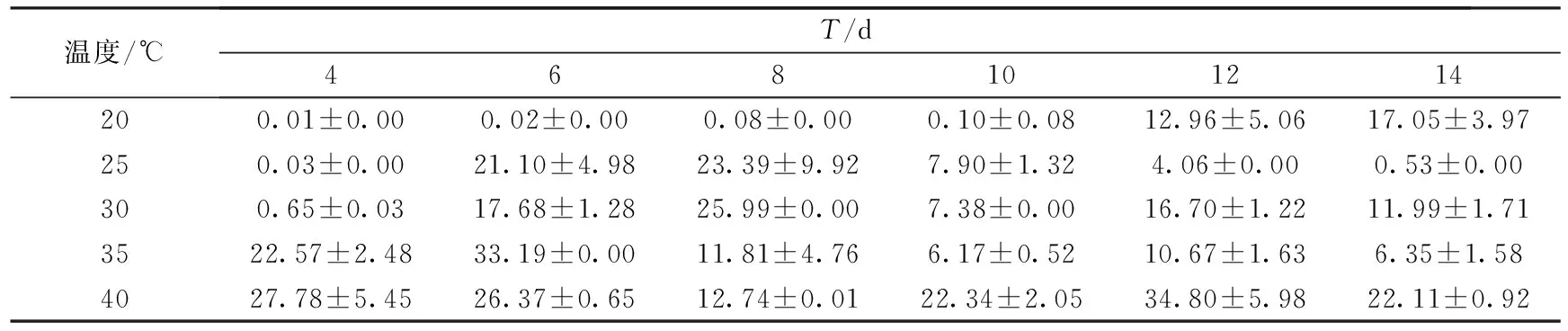
表9 玉米秸秆培养基上培养温度对密孔菌产酶活性的影响 (U·mg-1)
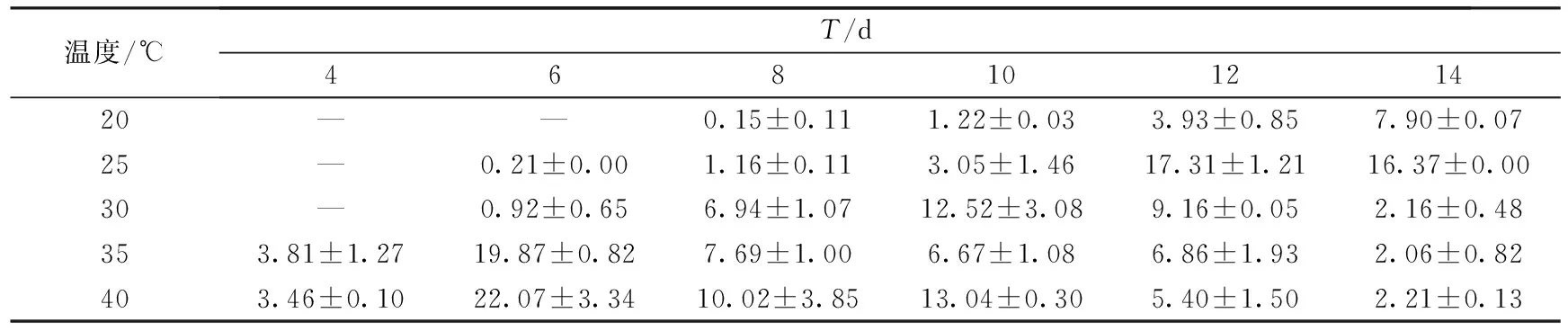
表10 木屑培养基上培养温度对密孔菌产酶活性的影响 (U·mg-1)
结果显示,培养温度对密孔菌产酶酶活具有较大的影响.菌株在以不同农业废弃物为主料的培养基上所需的最适温度也不同.在小麦秸秆培养基上,当培养温度为35℃时,在培养的第4 d,酶活达到最大值65.07 U·mg-1.但随着培养天数的增加,酶活下降非常迅速.而当培养温度为40℃时,在整个培养周期内,酶活均能稳定维持在20 U·mg-1上下.在玉米秸秆培养基上,当培养温度为40℃时,在培养的第12 d,菌株产酶酶活达到峰值34.80 U·mg-1,整个培养周期内,菌株都能维持较高的酶活.实验中我们还发现,40℃高温条件下,菌丝体生长状况欠佳,因此我们认为密孔菌产的漆酶在较高的温度下活性会增强.在木屑培养基上,当培养温度为25℃时,菌丝生长至12~14 d,酶活达到16~17 U·mg-1,且在此温度下,菌丝生长茂密.在高于25℃温度条件下,反应体系中的酶活最大值均出现提早,并且最大酶活较低.这可能因为木屑培养料透气性和保水性都较差,较高温度会导致湿度下降,不利于其发酵.相比于小麦秸秆和玉米秸秆培养基,木屑酶活最大值出现的时间较晚,这可能与木屑培养基营养成分与前两者不同,菌株在其上生长较慢有关.并且在40℃培养条件下,菌株在木屑培养基上产酶酶活低于小麦和玉米秸秆培养基,这可能与木屑保水性较差有关.
3 讨论
农作物秸秆等废弃物对密孔菌产漆酶具有良好的诱导效果,主要是因为半纤维素和木质素结构是白腐真菌的主要降解部位[25-26],密孔菌在以玉米秸秆为主料的培养基上产漆酶酶活高于以小麦秸秆和杨树木屑为主料的培养基,可达40.92 U·mg-1.这是因为玉米秸秆、小麦秸秆以及杨树木屑三者的组成成分、含量以及物理结构不同,玉米、小麦秸秆和杨树木屑中木质素的含量分别为14.93%,20.51%和35%[27-28].随着发酵周期的延长,漆酶活性逐渐下降,主要是因为菌丝生长活力下降和秸秆中的木质素只能部分被降解的缘故[29].
Cu2+的存在或浓度变化显著影响密孔菌产漆酶的酶活.多数漆酶是含铜的蛋白,而漆酶基因转录合成时需要铜离子的调节,因此在限铜或缺铜时,漆酶蛋白表达受限,所以活力较低[30].发酵料中的Cu2+浓度对密孔菌的漆酶活性的影响,随着秸秆种类的不同而存在差异,具体的调节机理则需进一步的研究.
pH值对密孔菌产漆酶有明显影响,在中酸性环境中菌株产漆酶酶活较高.一般认为培养基中的氢离子和氢氧根离子对微生物的影响是间接的,首先作用于胞外可解离的弱酸或弱碱,形成易透过细胞膜的游离态进入胞内,再作用于参与代谢的各种酶类,从而影响菌体的生长和酶的合成[31].
菌株在小麦秸秆和玉米秸秆培养基上发酵产酶的最适温度较高,分别为35℃和40℃,且在整个发酵周期能维持较高较稳定的酶活水平.运用本实验菌株进行这两类农业废弃物降解时,在保持较高湿度的同时,应适当增加堆料厚度,提高料内温度.
对于不同的农业废弃物,菌株产酶的最适铜离子浓度、最适pH和最适培养温度也是不同的,因此我们要因材制宜.密孔菌能利用农业废弃物发酵产漆酶,可以作为外源菌剂缩短秸秆还田周期,在农业废弃物资源利用方面具有广阔的应用前景.此外,产生的漆酶具有降解DDT等多种污染物的能力,还可以起到环境保护和生态修复的作用.
[1] Feng X Y,Chen H Y,Xue D S. Enhancement of Laccase Activity by Marine-derived Deuteromycete Pestalotiopsis sp. J63 with Agricultural Residues and Inducers[J]. Chinese Journal Chemical Engineering,2013,21(10): 1182-1189.
[2] 王佳玲,余惠生,付时雨,等.白腐菌漆酶的研究进展[J].微生物学通报, 1998,25(4):233-236.
[3] Ian D. Reid, Michael G. Paice. Biological bleaching of kraft pulps by white-rot fungi and their enzymes[J]. FEMS Microbiology Reviews. 1994, 13(2-3):369-375.
[4] Angel T. Martinez, Susana Camarero, Francisco Guillen, et al.Progress in biopulping of non-woody materials: Chemical, enzymatic and ultrastructural aspects of wheat straw delignification with ligninolytic fungi from the genus Pleurotus[J]. FEMS Microbiology Reviews, 1994,13(2-3):265-273.
[5] 许颖,兰进.真菌漆酶研究进展[J]. 食用菌学报,2005,12(1):57-64.
[6] 侯红漫,周集体,陈丽.白腐菌漆酶特性及异生芳香化合物的降解[J].林产化学与工业,2003,23(1):89-94.
[7] 吴香波,谢益民,冯晓静.白腐菌漆酶催化聚合造纸废水中木素的研究[J].环境科学与技术, 2010, 33(1):23-26.
[8] 左莹,马惠玲,罗耀红,等.栓菌属漆酶催化儿茶素和绿原酸生物转化的动力学研究[J].食品研究与开发, 2008,29(5):39-43.
[9] 赖超凤,李 爽,彭丽丽,等.漆酶及其在有机合成中应用的研究进展[J].化工进展,2010,29(7):1300-1308.
[10] Melissa R D, Carolina O N, Raul G M, et al. Biotransformation kinetics of pharmaceutical and industrial micropollutants in groundwaters by a laccase cocktail from Pycnoporus sanguineus CS43 fungi[J]. International Biodeterioration & Biodegradation,2016,108:34-41.
[11] Federica Spina, Chiara Cordero, Tiziana Schiliro, et al. Removal of micropollutants by fungal laccases in model solution and municipal wastewater: evaluation of estrogenic activity and ecotoxicity[J]. Journal of Cleaner Production,2015,100:185-194.
[12] 李丹,张波,李玉.高产漆酶菌株的筛选及其对秸秆降解初探[J].吉林农业科学,2013,38(6):90-94.
[13] Zhao Y C,Yi X Y,Li M H,et al. Biodegradation Kinetics of DDT in Soil under Different Environmental Conditions by Laccase Extract from White Rot Fungi[J].Chinese Journal of Chemical Engineering, 2010,18(3) 486-492.
[14] 科学技术部,农业部.农业废弃物(秸秆、粪便)综合利用技术成果汇编[R/OL].(2015-10-09)[2016-11-15].http://www.most.gov.cn/tztg/201510/t20151020_122045.htm
[15] Moldes D,Lorenzo M,Sanroman M A, Different proportions of laccase isoenzymes produced by submerged cultures of Trametes versicolor grown on lignocellulosic wastes[J].Biotechnology Letters,2004,26(4):327-330.
[16] 李合生.现代植物生理生化实验原理和技术[M].北京:高等教育出版社, 2000:184-185.
[17] 赵蒙蒙,姜曼,周祚万.几种农作物秸秆的成分分析[J].材料导报,2011,25(16):122-125.
[18] Nina H,Laura-Leena K,Kris tina K,et al.Crystal structure of a laccase from Melanocarpus albonyces with an intact trinuclear copper site[J].Nature Structural Biology,2002,9(8):601-605.
[19] Galhaup C,Haltrich D.Enhanced formation of laccase activity by the white-rot fungus Trametes pubescens in the presence of copper[J]. Applied Microbiology and Biotechnology, 2001, 56(1-2): 225-232.
[20] 史伯安,雷福厚,但悠梦,等.酸度对漆树酶活性的影响[J].中国生漆, 1996(1):8-11.
[21] 黄慧艳,张晓昱.漆酶测定过程中缓冲体系的影响研究[J].工业微生物, 2005,35(4):29-32.
[22] Thurston C F. The structure and function of fungal laccases[J]. Microbiology, 1994, 140(1): 19-26.
[23] 尹艳丽,张晓昱,王宏勋,等.不同摇瓶条件对侧耳菌生长及漆酶分泌的影响[J].生物技术,2004,14(5):72-76.
[24] 王广慧,戴明,魏雅冬.真菌液态发酵产漆酶的培养条件优化研究进展[J].造纸科学与技术,2011,30(6):92-97.
[25] Sharma R K,Arora D S. Changes in biochemical constituents of paddy straw during degradation by white rot fungi and its impact on in vitro digestibility[J]. Appli Microbiol, 2010, 109(2): 679-686.
[26] Martinez A T,Speranza M,Francisco J R, et al. Biodegradation of lignocellulosics: microbial, chemical, and enzymatic aspects of the fungal attack of lignin.Int Microbiol Off J Span Soc Microbiol[J]. International Microbiology, 2005, 8(3): 195-204.
[27] 范树国,周丽娟,邱璐.硫酸法测定4种常见农作物秸秆的木质素含量[J].江苏农业科学,2010(5):395-398.
[28] 鞠洪波,郎子健.食用菌对山杨木质素及纤维素的降解[J].东北林业大学学报, 2007,35(12):41-42.
[29] 陈合,张强.菌酶共降解玉米秸秆的工艺研究[J].农业工程学报,2008,24(3):270-273.
[30] Collins P J,Dobson A. Regulation of laccase gene transcription in Trametes versicolor[J].Applied and Environmental Microbiology,1997,63(9):3444-3450.
[31] 司静,崔宝凯,戴玉成.栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J].微生物学通报,2011,38(3):405-416.
[责任编辑:蒋海龙]
Research on Laccase Production by Pycnoporus in Solid-Stage Fermentation using Agricultural Residues
LI Xiu-nan1, NIU Zi-qi1, HU Wei-cheng1,2,3, WANG Xin-feng1,2,4
(1.College of Life Sciences, Huaiyin Normal University, Huaian Jiangsu 223300, China) (2.Huaian Key Laboratory of Food Components and Functional Foods, Huaian Jiangsu 223300, China) (3.Jiangsu Collaborative Innovation Center of Regional Modern Agriculture & Environmental protection, Huaian Jiangsu 223300, China) (4.Jiangsu Key Laboratory for Biomass-based Energy and Enzyme Technology, Huaian Jiangsu 223300, China)
The aim of this study is to investigate laccase production by Pycnoporus in solid-stage fermentation using different agricultural residues, such as corn stalk, wheat straw and poplar sawdust. The results reveled that agricultural residues can induce Pycnoporus to produce laccase and corn stalk showed the highest effect with production of 40.92 Umg-1. Moreover, the concentration of Cu2+has a significant effect on laccase production and the production could reach 41.24Umg protein-1 and 57.13Umg-1using wheat straw and poplar sawdust as medium with 0.02% Cu2+; the production of laccase could reach 94.92 U·mg-1using corn stalk as medium with 0.04% Cu2+. Lassase production was affected by pH obviously and the activity of laccase was higher in neutral and acid environment. The optimum temperature for Pycnoporus to produce laccase in wheat straw medium and corn stalk medium was 35°C and 40°C, respectively. Moreover, laccase activity could maintain a high and stable level during the whole fermentation period. The results from this study indicate that Pycnoporus has a high efficacy in producing laccase and degrading crop straw, which can be used in the treatment of crop straw.
pycnoporus; solid state fermentation; agricultural wastes; laccase
2017-03-28
江苏省大学生创新创业训练计划项目(201510323013Z); 江苏高校品牌专业建设工程资助项目(PPZY2015A018); 江苏省农业自主创新基金项目(CX(13)3026)
王新风(1964-),男,江苏涟水人,教授,主要从事微生物及食用菌等研究. E-mail: wangxf@hytc.edu.cn
S147.4
A
1671-6876(2017)02-0147-07

