球形脂联素对糖尿病心肌病大鼠心脏保护作用的研究
武鸿儒,李 兴,高晓芳,韩雪鸿,刘 晶
球形脂联素对糖尿病心肌病大鼠心脏保护作用的研究
武鸿儒,李 兴,高晓芳,韩雪鸿,刘 晶
目的 观察球形脂联素(gAd)对糖尿病心肌病(DCM)的影响,并探讨其可能作用机制。方法 30只雄性Sprague-Dawley(SD)大鼠选取10只作为正常对照组(A组),余20只建造糖尿病心肌病模型,造模成功后大鼠随机分为阳性对照组(B组)、球形脂联素治疗组(C组)。C组大鼠每日给予球形脂联素治疗。治疗8周后,采用苏木素伊红(HE)染色法观察大鼠心肌组织大体形态,免疫组化法检测大鼠心肌组织中Ⅰ型胶原蛋白、转化生长因子-β1(TGF-β1)、Smad3、Smad7含量,原位末端标记法(TUNEL)检测心肌细胞凋亡。结果 HE染色示:B组大鼠心肌细胞排列紊乱;C组大鼠心肌细胞排列较B组整齐。免疫组化结果示:Ⅰ型胶原蛋白、TGF-β1、Smad3蛋白表达较A组、C组增多(P<0.05);Smad7蛋白表达较A组、C组减少(P<0.05)。TUNEL结果:B组凋亡细胞数较A组、C组增加(P<0.05)。结论 gAd可能通过降低心肌间质纤维化和减少心肌细胞凋亡两方面保护心肌组织。
糖尿病心肌病;球形脂联素;转化生长因子-β1;纤维化;凋亡
糖尿病心肌病(DCM)是糖尿病的主要心血管并发症之一,可增加糖尿病病人的死亡率。脂联素(APN)是体内一种调节能量代谢的胰岛素敏感性激素,已发现在糖尿病、心血管病病人体内脂联素含量减少,现已提出低循环水平脂联素为心血管疾病的一个独立预测因子[1]。近期研究发现脂联素对心脏具有保护作用,本研究旨在观察球形脂连素(gAd)对糖尿病心肌病心肌组织转化生长因子-β1(TGF-β1)/Smads通路及细胞凋亡的影响,探讨其对糖尿病大鼠心肌的保护作用。
1 材料与方法
1.1 实验药物及试剂 链脲佐菌素(STZ)购自美国sigma公司,gAd购自美国Peprotech公司,兔抗大鼠抗体购自武汉博士德生物工程有限公司,TUNEL细胞凋亡检测试剂盒购自江苏凯基生物技术股份有限公司。
1.2 实验动物 清洁级雄性SD大鼠30只,体重180 g~200 g,由山西医科大学实验动物中心提供。高糖高脂饲料由北京科澳协力有限公司提供,普通饲料由山西医科大学实验动物中心提供。
1.3 模型建立及分组 采用随机数字表法分为正常对照组(A组,n=10)与造模组(n=20),分别给予普通饲料和高糖高脂料喂养。8周后,造模组给予空腹一次性腹腔内推注1%STZ 30 mg/kg;A组经腹腔内推注等量柠檬酸-柠檬酸钠钠缓冲液。72 h后,尾静脉测2次随机血糖≥16.7 mmol/L,且出现多饮、多食、多尿、精神萎靡等现象为造模成功[2],期间死亡3只。继续喂养12周[3]后,造模组随机分为阳性对照组(B组,n=8)、gAd治疗组(C组,n=9)。C组给予10 μg/kg gAd每日腹腔注射,A组与B组每日腹腔注射同等剂量生理盐水。8周后,取大鼠进行后续实验。
1.4 实验步骤 gAd干预8周后,空腹称重,胸腹备皮后,腹腔注射10%水合氯醛麻醉大鼠,暴露腹腔,腹主动脉取血后一部分立即检测糖化血红蛋白(HbA1c),一部分离心后取上清-70 ℃冰箱保存。剖开胸腔,取出心脏,冲洗后称重,左心室同一部位取组织,放入保存液中,4 ℃过夜后制作石蜡切片。
1.5 生化指标检测 全自动生化分析仪检测空腹血糖(FBG)和HbA1c。
1.6 心肌组织形态观察 蜡块切片,行HE染色,光镜下观察心肌组织形态学变化。
1.7 免疫组织化学分析 心肌组织Smad3、Smad7、TGF-β1、Ⅰ型胶原蛋白免疫组织化学分析:蜡块切片,二甲苯脱蜡,梯度酒精脱水,3%H2O2阻断灭活内源性过氧化物酶,抗原修复,滴羊血清封闭液孵育30 min甩干,后滴加1∶50稀释的兔抗大鼠Ⅰ型胶原蛋白、TGF-β1、Smad3、Smad7抗体4 ℃冰箱过夜,再滴加二抗孵育30 min,洗片后,加辣根过氧化物酶标记链霉卵白素工作液20 min,再洗片,加二氨基联苯胺(DAB)显色,苏木素复染10 s,脱水、透明、封片。Scanscope数字病理扫描系统进行图像分析,以出现棕黄色颗粒为阳性,测量灰度值。
1.8 TUNEL染色观察凋亡 采用TUNEL细胞凋亡检测试剂盒对心肌组织切片进行荧光染色,在荧光显微镜下细胞核显示红色的细胞为凋亡细胞。TUNEL凋亡指数计算(AI):AI=TUNEL标记阳性细胞数/细胞总数×100%。选择细胞分布较均匀的高倍视野计数。

2 结 果
2.1 3组大鼠一般情况比较 8周后,与A组相比,B组大鼠FBG和HbA1c升高,体重下降,心重指数(HW/BW)明显增加,gAd干预后C组较B组大鼠FBG降低、体重增加,HW/BW减小。详见表1。

表1 3组大鼠一般情况比较(±s)
2.2 心肌组织形态学分析 光镜下可见A组大鼠心肌细胞形态正常,胞核排列整齐;B组大鼠细胞大小不一,形态紊乱,核呈多形性,细胞间质增多,心肌细胞有断裂现象;C组大鼠心肌细胞有病态改变,但较B组减轻。详见图1。

A组 B组 C组
图1 心肌组织形态学分析(HE染色,×200)
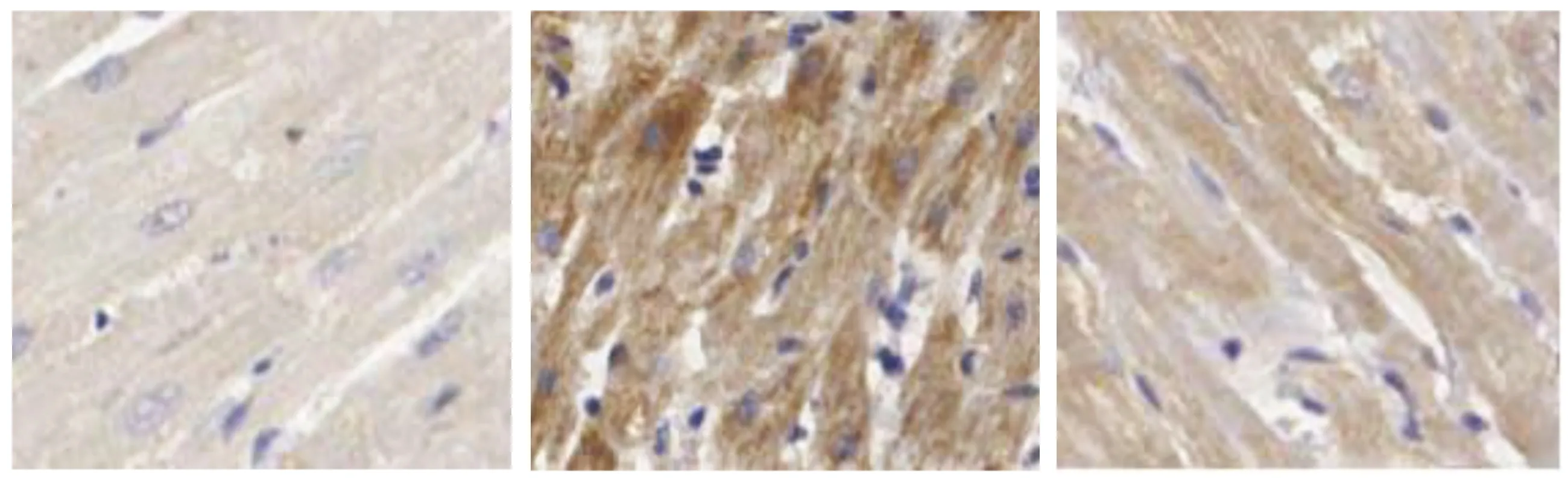
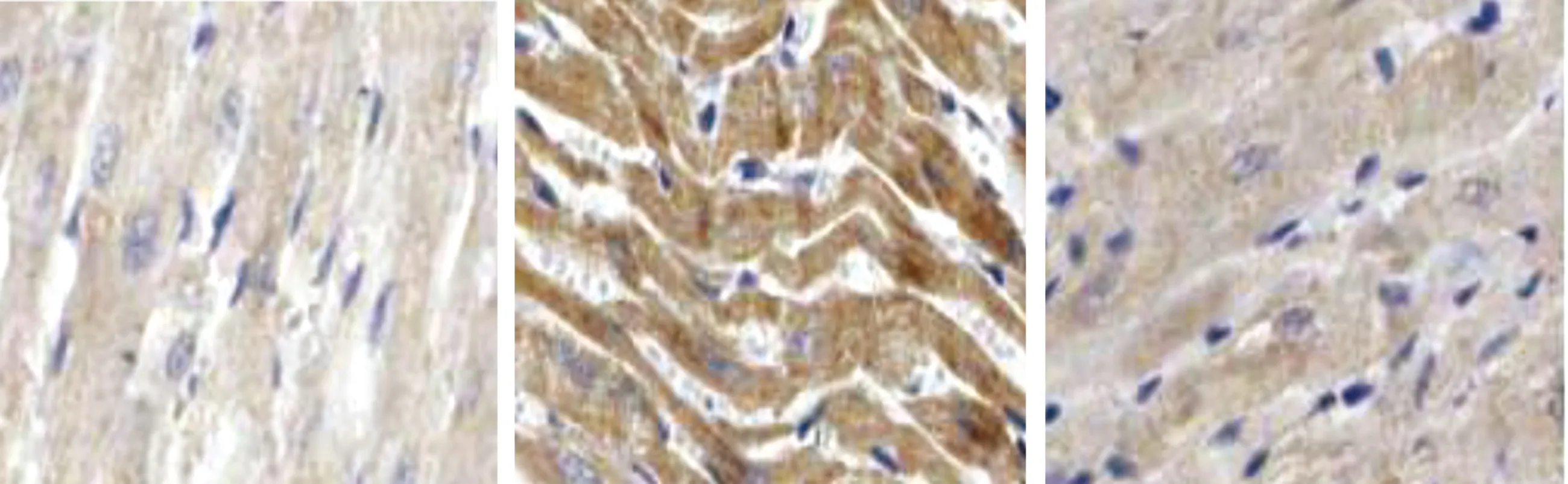
2.3 3组大鼠心肌组织Smad3、Smad7、TGF-β1、Ⅰ型胶原蛋白免疫组化分析比较 B组大鼠Ⅰ型胶原蛋白、TGF-β1、Smad3蛋白表达较A组增多,Smad7蛋白表达较A组减少;gAd干预后C组Ⅰ型胶原蛋白、TGF-β1、Smad3蛋白表达较B组减少,Smad7蛋白表达较B组增多。详见表2、图2~图5。

表2 3组大鼠心肌组织Smad3、Smad7、TGF-β1、Ⅰ型胶原蛋白免疫组化分析比较(±s)

A组 B组 C组
A组 B组 C组
A组 B组 C组

A组 B组 C组
2.4 3组大鼠心肌细胞凋亡表达 B组大鼠心肌细胞凋亡数较A组增加,C组大鼠心肌细胞凋亡数较B组减少,A组AI为16.49±0.83,B组AI为43.88±3.27,C组AI为23.43±1.77。A组与B组、C组比较,差异有统计学意义(P<0.05);B组与C组比较,差异有统计学意义(P<0.05)。详见图6。

A组:细胞凋亡较少
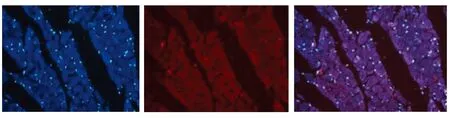
B组:大量细胞凋亡

C组:细胞凋亡数量较B组减少
3 讨 论
DCM是指发生于糖尿病病人除冠心病、原发性心肌病、心脏瓣膜病及高血压性心脏病外,以心肌细胞肥大、心肌微血管病变、心肌代谢紊乱、心肌间质增生及纤维化为主要病理变化,以早期心脏舒张、收缩功能障碍,晚期心力衰竭为其临床症状的一种疾病[4]。糖尿病心肌病的发病机制尚不完全明确,有研究认为左室肥厚、心肌间质纤维化、心肌细胞糖脂代谢紊乱、小血管病变、心脏自主神经调节异常、胰岛素抵抗、钙稳态失衡、线粒体损伤、氧化应激、细胞异常凋亡等是重要的促进因子,参与其发生和发展[5]。
TGF-β1是最有力和普遍存在的促纤维化细胞因子,Smad3和Smad7是其下游两个重要介质[6]。近年来有研究发现,作为TGF-β1的下游信号分子,Smads蛋白在多种心脏病理生理状态下均可出现活化和表达增加[7]。TGF-β1活化后,TGF-β1受体I(TβRI)磷酸化Smad2和Smad3,促进纤维化的发生和发展;而Smad7可结合TβRI并抑制Smad2/3磷酸化阻断TGF-β1/Smad信号传导阻止TGF-β1/Smad2/3信号[8]。Goyall等[9]发现慢性餐后高血糖症,高胰岛素血症和胰岛素抵抗等代谢异常可诱导TGF-β1的过表达,TGF-β1通过与Ⅱ型受体结合上调组织中胶原蛋白的表达,在心肌主要是Ⅰ型胶原蛋白,这个过程参与糖尿病心肌病的发生发展。有研究认为高血糖促进心肌中Ⅰ型和Ⅲ型胶原的形成,导致间质纤维化,进而导致左室舒张功能障碍[10]。心肌中Ⅰ型胶原以粗纤维形式存在,决定心肌的抗张力能力[11]。本实验发现B组大鼠心肌中Ⅰ型胶原蛋白含量多于A组大鼠,也证实上述说法。本实验B组大鼠心重指数增大,TGF-β1、Ⅰ型胶原蛋白、Smad3表达增加,Smad7表达减少,提示TGF-β1/Smads信号通路活化可促进糖尿病心肌病的发生发展。
脂联素(adiponectin,APN)又称Acrp30,是一种主要由脂肪细胞合成和分泌的脂肪细胞因子。有研究发现心肌细胞、肝细胞、肌肉细胞、骨骼肌成纤维细胞、成骨细胞等均可分泌脂联素[12]。目前发现其具有改善胰岛素抵抗、抗炎、抗纤维化、抗凋亡、抗动脉粥样硬化等生物学效应[13]。在人类血浆中存在两种APN活性形式分别为球形结构域(gAd)和全长型结构域(fAd)。gAd可由fAd经弹性蛋白酶裂解而产生,gAd是APN实现生物学效应的主要区域[14-15]。本实验中,外源性gAd干预后C组大鼠心重指数下降,Ⅰ型胶原蛋白、TGF-β1、Smad3表达较B组减少,Smad7表达增加,提示gAd可通过上调Smad7表达,减少Smad3表达来调节TGF-β1/Smads信号通路,减轻心肌纤维化来改善糖尿病心肌病。此结果与前期离体实验结果一致[16]。
TUNEL细胞凋亡染色结果可见B组大鼠心肌细胞凋亡增加,外源性gAd干预后凋亡细胞减少,提示gAd可通过抗心肌细胞凋亡对糖尿病心肌病变起到保护作用。可能的作用机制为:①细胞色素C从线粒体释放到细胞质激活半胱氨酸天冬氨酸蛋白酶(caspase)-9,从而激活caspase-3效应物导致细胞凋亡,抗凋亡因子B淋巴细胞瘤(Bcl)-2可干扰细胞色素C释放和抑制凋亡进展。作为对凋亡刺激的回应,促凋亡因子Bcl同源相关蛋白(Bax)通过过表达与构象变化对抗Bcl-2的激活,刺激细胞色素C释放和其他凋亡蛋白进入细胞质,最终引发凋亡。gAd可诱导腺苷单磷酸活化蛋白激酶(AMPK)表达,激活其磷酸化,上调Bcl-2,下调Bax,进而起到抗凋亡作用[17]。②gAd可通过激活神经酰胺酶,降低胞内神经酰胺含量,抑制蛋白激酶C(PKC)和蛋白磷酸酶2(PP2A)活化,从而激活蛋白激酶B(Akt/PKB)通路,进而减少心肌细胞凋亡;gAd还可能通过激活神经酰胺酶促进抗凋亡代谢产物磷酸鞘氨醇(S1P)合成而抑制心肌细胞凋亡[18]。③gAd通过Akt依赖信号通路抑制非正常压力反应引起的细胞凋亡,且gAd可通过抑制肿瘤坏死因子(TNF)α在心肌细胞中的表达减少凋亡[19]。
综上所述,gAd可能通过抗心肌间质纤维化和抗心肌细胞凋亡两方面减轻糖尿病心肌病变,对糖尿病心肌病具有一定的保护作用。
[1] Gayani N,Thiruchelvan K,Wang LL,et al.The cardio-protective signaling and mechanisms of adiponectin[J].Am J Cardiovasc Dis,2012,2(4):253-266.
[2] 穆松牛,高云,万福生,等.链尿佐菌素加高糖高脂饮食复制大鼠2型糖尿病模型[J].中国比较医学杂志,2008,18(2):19-22.
[3] Jackson CV,Mcgrath GM,Tahiliani AG,et al.A functional and ultrastructural analysis of experimental diabetic rat myocardium.Manifestation of a cardiomyopathy[J].Diabetes,1985,34(9),876-883.
[4] Pappachan JM,Varughese GI,Sriraman R,et al.Diabetic cardiomyopathy:pathophysiology,diagnostic evaluation and management[J].World J Diabetes,2013,4(5):177-189.
[5] Falcao PI,Leite-Moreira AF.Diabetic cardiomyopathy:understanding the molecular and cellular basis to progress in diagnosis and treatment[J].Heart Fail Rev,2012,17(3):325-344.
[6] Ross S,Hill CS.How the Smads regulate transcription[J].International Journal of Biochemistry & Cell Biology,2008,40(3):383-408.
[7] Yamauchi T,Iwabu M,Okada-Iwabu M,et al.Adiponectin receptors:a review of their structure,function and how they work[J].Best Pract Res Clin Endocrinol Metab,2014,28(1):15-23.
[8] Rao SS,Zhang XY,Shi MJ,et al.Suberoylanilide hydroxamic acid attenuates paraquat-induced pulmonary fibrosis by preventing Smad7 from deacetylation in rats[J].J Thorac Dis,2016,8(9):2485-2494.
[9] Goyall BR,Mehta AA.Diabetic cardiomyopathy:pathophysiological mechanisms and cardiac dysfuntion[J].Human and Experimental Toxicology,2013,32(6):571-590.
[10] Greenstein A,Khavandi A,Asghar O,et al.Diabetic cardiomyopathy[J].Clinical Sciences,2009,116(10),741-760.
[11] Guo CY,Wang Y,Liang H ,et al. ADAMTS-1 contributes to the antifibrotic effect of Captopril by accelerating the degradation of type I collagen in chronic viral myocarditis[J].European Journal of Pharmacology,2010, 629(13):104-110.
[12] Delaigle AM,Jonas JC,Bauche IB,et al.Induction of adiponectin in skeletal muscle by inflammatory cytokines:in vivo and in vitro studies[J].Endocrinology,2004,145(12):5589-5597.
[13] Brakenhielm E,Veitonmaki N,Cao R,et al.Adiponectin induced antiangio genesis and antitumor activity involve caspase mediated endothelial cell apoptosis[J].Proc Natl Acad Sci USA,2004,101(8):2476-2481.
[14] Fisman EZ,Tenenbaum A.Adiponectin:a manifold therapeutic target for metabolic syndrome,diabetes,and coronary disease?[J].Cardiovasc Diabetol,2014,23(13):103.
[15] Fruebis J,Tsao TS,Javorschi S,et al.Proteolytic cleavage product of 30-KDa adipocyte complement-related protein increases fatty acid oxidation in muscle and causes weight loss in mice[J].Proc Natl Acad Sci USA,2001,98(4):2005-2010.
[16] 张晶,李兴,魏立静,等.脂联素对高糖环境下心肌细胞中TGFβ1/Smads通路的影响[J].中西医结合心脑血管病杂志,2013,11(4):458-460.
[17] Masanori K,Go H,Hirokazu O,et al.Adiponectin protects against doxorubicin-induced cardiomyopathy by anti-apoptotic effects through AMPK up-regulation[J].Cardiovascular Research,2011,89(2):309-319.
[18] Holland WL,Miller RA,Wang ZV,et al.Receptor-mediated activation of ceramidase activity initiates the pleiotropic actions of adiponectin[J].Nat Med,2011,17(1):55-63.
[19] Skurk C,Wittchen F,Suckau L,et al.Description of a local cardiac adiponectin system and its deregulation in dilated cardiomyopathy[J].Eur Heart J,2008,29(9):1168-1180.
(本文编辑薛妮)
The Cardioprotection of Globular Adiponectin on Diabetic Cardiomyopathy in Rats
Wu Hongru,Li Xing,Gao Xiaofang,Han Xuehong,Liu Jing
The Second Hospital,Shanxi Medical University,Taiyuan 030001,Shanxi,China
Liu Jing
Objective To observe the effect of globular adiponectin (gAd) on diabetic cardiomyopathy (DCM) and to explore its possible mechanism.Methods Thirty male Sprague-Dawley (SD) rats were divided into normal control group (group A),and 20 rats were treated with diabetic cardiomyopathy model,the rats were randomly divided into positive control group (group B) and spherical adiponectin group (group C).Rats in group C were given globular adiponectin daily.After 8 weeks of treatment,the morphology of myocardium was observed by hematoxylin-eosin (HE) staining.The expression of type Ⅰ collagen,transforming growth factor-β1 (TGF-β1),Smad 3 and Smad 7 in myocardium of rats were detected by immunohistochemistry.The apoptosis of myocardium was detected by TUNEL.Results HE staining showed that the arrangement of myocardial cells in group B was disturbed,and the arrangement of cardiomyocytes in group C was more neat than group B.The expressions of type Ⅰ collagen,TGF-β1 and Smad 3 protein in group B was higher than that in group A and group C (P<0.05).The expression of Smad 7 protein in group B was lower than that of group A and group C (P<0.05).TUNEL results showed that the number of apoptotic cells in group B was higher than that of group A and group C (P<0.05).Conclusion Globular adiponectin may protect cardiomyocytes by alleviating myocardial interstitial fibrosis and cardiomyocyte apoptosis.
diabetic cardiomyopathy;globular adiponectin;transforming growth factor-β1;fibrosis;apoptosis
山西省卫生计生委科研项目(No.2014040);山西省国际科技合作项目(No.2015081031)
山西医科大学第二医院(太原 030001)
刘晶,E-mail:40574592@qq.com
信息:武鸿儒,李兴,高晓芳,等.冬虫夏草对脑缺血防治作用的研究进展[J].中西医结合心脑血管病杂志,2017,15(11):1319-1327.
R587.1 R255.4
A
10.3969/j.issn.1672-1349.2017.11.009
1672-1349(2017)11-1319-06
2016-12-25)

