红颜草莓脱毒优化及病毒检测的研究
陈 英,肖春林,罗燕娜,张西英,刘江娜
(新疆生产建设兵团第六师农业科学研究所,新疆 五家渠 831300)
红颜草莓脱毒优化及病毒检测的研究
陈 英,肖春林,罗燕娜,张西英,刘江娜
(新疆生产建设兵团第六师农业科学研究所,新疆 五家渠 831300)
以红颜草莓品种为材料,采用无菌瓶苗,经高温处理、冰点低温处理结合茎尖剥离脱毒,并用血清学中的双抗体一步夹心酶联免疫法检测4种病毒的方法,对细胞分生组织诱导分化成苗的成活率高低和脱毒效果进行比较。结果表明,采用-1 ℃低温处理结合茎尖剥离长度由0.3 mm增加到0.5 mm,诱导分化苗的成活率由23.0%大幅度提高到39.6%~60.0%,再通过双抗体夹心酶联免疫法检测病毒,4种病毒全部脱除。
草莓;温度;茎尖脱毒;病毒检测;优化
草莓(Fragaria×ananassaDuch.)是篱蔽科(Rosaceae)草莓属(Fragaria)宿根性多年生常绿草本植物,因果实颜色鲜艳、肉质细嫩、柔软多汁、甜酸适口和风味独特而深受消费者喜爱[1]。近年来,新疆设施草莓进入了快速发展期。草莓一般以无性繁殖方式为主,易感染病毒,且多为潜隐性病毒,易造成复合侵染,严重影响植株长势,使果实品质和产量下降,严重时减产可高达75%[2]。草莓病毒病会随着其营养繁殖代代相传,目前尚无特效的药剂或方法;因此,运用生物技术对草毒进行脱毒[3-4]和病毒检测并培育和推广使用脱毒苗是解决问题的关键。据报道,脱毒草莓苗的过氧化氢酶(CAT)、过氧化物酶(POD)活性均高于常规苗,有利于改善植株正常代谢活动、恢复种性、提高产量和品质、增强抗逆性[5];同时,也可有效减少农药的使用量,为生产绿色无公害优质草莓果品提供了良好保障,有助于草莓产业的健康持续发展。
用热处理结合茎尖培养法进行无病毒苗的培育,是目前世界上获得草莓无毒苗最普通且最有效的方法,但采用恒温或变温的热空气处理带病母株结合茎尖剥离,耗时长、成活率低、脱毒率不高且效率低。常用的草莓病毒检测方法有指示植物小叶嫁接法、酶联免疫吸附法(ELISA)和分子生物学方法等,其中指示植物小叶嫁接法耗时长,且需要一定的隔离空间;分子生物学方法所需仪器设备昂贵、检测费用高,对技术人员的业务水平要求较高[6]。Thompson等[7]提取草莓总RNA的研磨溶液中含有剧毒物质,不被广泛采用;而血清学检测方法具有简便快速、灵敏度高、批次量大,检测试剂盒已实现商品化供应等优点。
本试验采用新疆主要推广的草莓品种之一红颜,采集匍匐茎为外植体建立无菌繁殖体系,并对无菌系瓶苗采用低温与高温对比处理后结合茎尖剥离脱毒,用血清学检测病毒,研究其脱毒及检测的优化方法,以建立优化的脱毒技术和检测方法,便于基层工作者在草莓大规模生产中确定草莓感染病毒种类和为害程度。
1 材料与方法
1.1 试验材料
1.1.1 植物材料
供试材料为新疆生产建设兵团第六师国家科技园区设施基地引进栽培的草莓品种红颜,所用试材均带毒。
1.1.2 病毒检测种类及方法
利用双抗体夹心酶联免疫法(DAS-ELISA)检测草莓皱缩病毒(SCV)、草莓斑驳病毒(SMoV)、草莓轻型黄边病毒(SMYEV)和草莓镶脉病毒(SVBV)4种病毒,检测试剂盒购自北京绿源大德生物科技有限公司。
1.2 试验内容与方法
1.2.1 无菌繁殖体系建立
从田间选取生长健壮、匍匐茎充实、无病虫斑、具典型性状的优良红颜草莓植株为母株,剪取刚抽出的匍匐茎顶端约2~3 cm,用1%洗洁精水溶液浸泡5 min并用玻璃棒轻微搅动后,再用自来水冲洗30~40 min,无菌水冲洗1~2次,移入超净工作台,倒入75%乙醇分别浸泡30 s,无菌水冲洗2~3次,转入0.1%升汞溶液轻微搅动4 min,最后用无菌水冲洗4~5次,迅速用滤纸吸干水分,切取长度为1.0~1.5 cm接种到MS培养基中。培养条件为温度(22±2)℃,光照12~14 h,光照强度1 000 lx。
1.2.2 高温处理与茎尖剥离相结合对草莓成活率及脱毒效果的影响
本试验参照盆栽苗移入培养箱的方法进行适当改进:将无菌系瓶苗放入3个人工智能气候箱中,温度逐步升至35、38和40 ℃处理28 d,以23.5 ℃处理为对照,然后剥取瓶苗茎尖0.2~0.3、0.3~0.5、0.5~0.8 mm的生长点作为3个处理,接种至诱导培养基,每瓶接入1个茎尖,诱导30~40 d后统计苗成活率。继代培养2次后采集样品并编号进行病毒检测。
1.2.3 低温处理与茎尖剥离相结合对草莓成活率及脱毒效果的影响
将无菌瓶苗分别置于-1、0、2、4、8、10 ℃处理28 d,以23.5 ℃处理为对照,剥取瓶苗茎尖0.2~0.3、0.3~0.5、0.5~0.8 mm的生长点作为3个处理,接种至诱导培养基,每瓶接入1个茎尖,诱导30~40 d后统计苗成活率。继代培养2次后采集样品编号进行病毒检测。
1.2.4 病毒检测
每个样品称取0.5 g,在经液氮预冷的研钵中快速研磨成粉末,取50 mg转入1.5 mL离心管中,于1 000g离心20 min,取上清液,冻存于-20 ℃。在冰浴条件下配制洗涤缓冲液,洗板5次,按照说明书依次加入标本、标准品、HRP标记的检测抗体,温育并彻底洗涤,用底物TMB显色,用酶标仪在450 nm下测定吸光度。根据检测结果进行判断,阳性对照孔D值平均值≥1.00,阴性对照孔D值平均值≤0.15,说明试验结果有效。临界值=阴性对照孔平均值+0.15。检测数据≤临界值为脱除病毒。
1.2.5 统计分析
试验数据用DPS8.0软件进行统计分析。
2 结果与分析
2.1 热处理与茎尖剥离结合对成活率及脱毒效果的影响
随着温度的提高,草莓无菌瓶苗的成活率逐渐降低(图1),表现为叶片逐渐萎蔫褪绿,随着温度升高,成活率逐渐下降,在同一温度条件下,茎尖长度与成活率呈正相关。40 ℃恒温处理7 d后,瓶苗下部叶片全部反卷,萎蔫失绿,出现不同程度的枯死;40 ℃处理21 d后有全株枯死现象,成活率低于5%。
经过高温处理后,当草莓茎尖长度为0.2~0.3 mm时,直观上无显色反应,ELISA检测值中4种病毒的光密度值均小于临界值,说明脱毒效果最好;SVBV经过35、38、40 ℃处理后,茎尖长度为0.5~0.8 mm的样品显色为浅黄色,SVBV光密度值均大于0.223 5,该病毒没有脱除,其余3种病毒脱除。对照茎尖长度为0.2~0.3 mm时无显色,4个病毒光密度值均小于临界值,病毒脱除;而对照中茎尖长度为0.3~0.5 mm、0.5~0.8 mm时显色为浅黄色到黄色,测得的SCV、SMYEV、SVBV 3个病毒的光密度值均大于临界值,病毒未脱除。这与魏永祥等[5]报道的镶脉病毒SVBV耐热性较强,常规热处理方法很难脱除的结论一致。本试验中SCV、SMYEV、SVBV脱毒效果与茎尖剥离大小有关,对照只在0.3 mm以下病毒可脱除,而高温处理与茎尖剥离结合的茎尖长度0.5 mm病毒可脱除,可见高温处理与茎尖培养相结合比单纯的高温处理或茎尖培养脱毒率高得多(图2)。
2. 2 低温处理与茎尖剥离结合对成活率及脱毒效果的影响
从显色反应可以看出,-1和0 ℃处理后,无色,病毒脱除率为100%。当温度逐渐升高至2 ℃以上时,茎尖长度为0.2~0.3 mm的脱毒效果较高,但成活率仅为25.30%;茎尖长度大于0.5 mm以上的成活率较高,达65.32%~85.00%,但是病毒检测显色为浅黄色,光密度数值大于临界值,没能达到脱除病毒的要求。在实际操作过程中,剥取0.2~0.3 mm的茎尖难度较大,茎尖太小易失水而失活,且生长周期较长,不符合实际生产的要求,因此,选择长度为0.3~0.5 mm的茎尖在-1 ℃进行脱毒为最佳方式,既可以保证较高的脱毒率,又能保证茎尖的高成活率和生长速度(图3)。
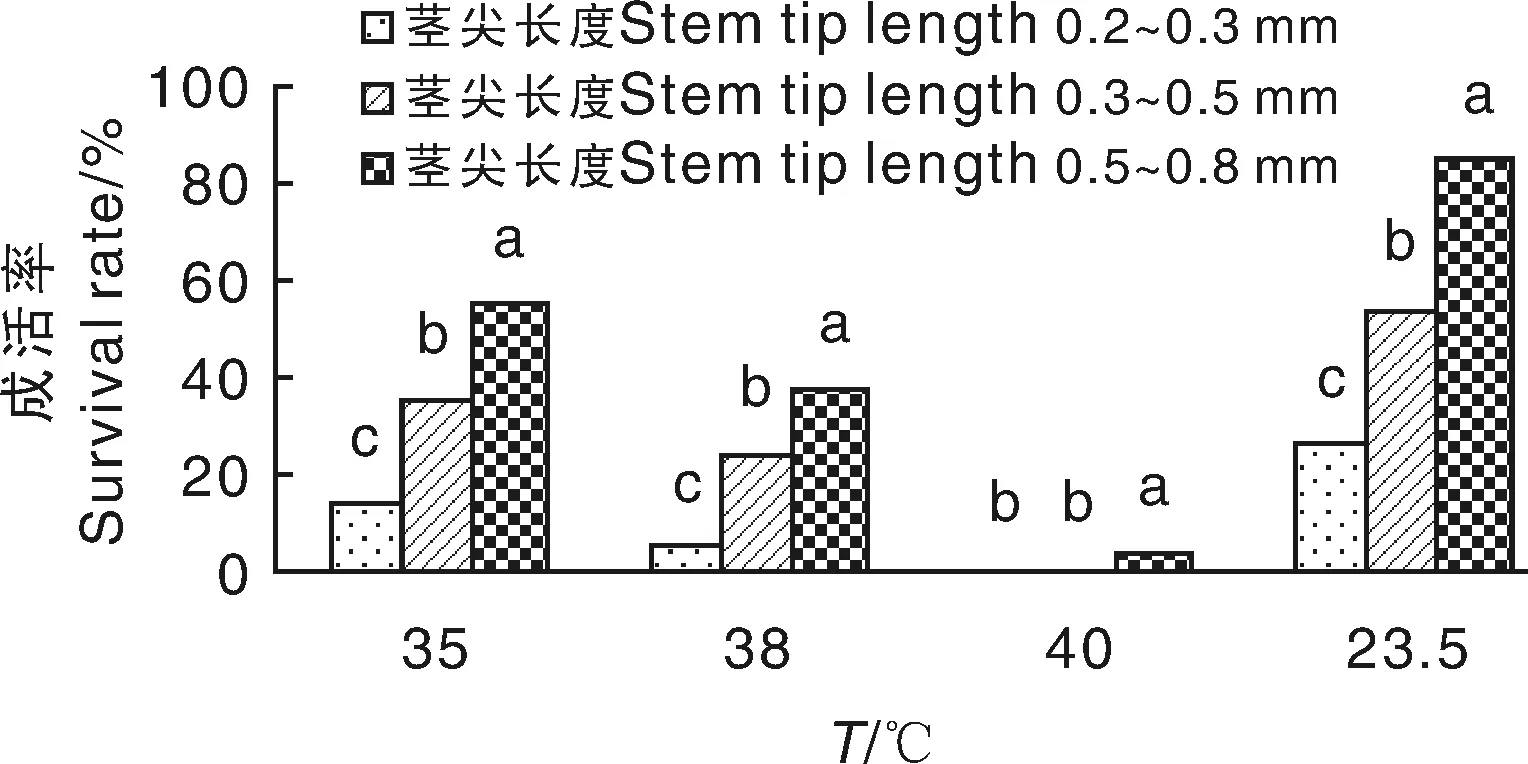
图1 高温处理结合茎尖剥离对成活率的影响Fig.1 The influence of high temperature treatment combined with stem tip stripping on the survival rate
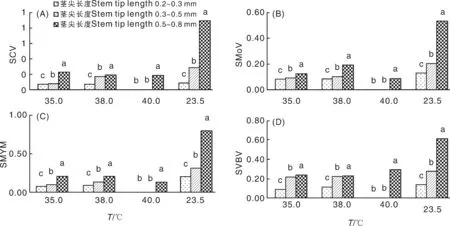
图2 高温处理结合茎尖剥离对病毒脱除率的影响Fig.2 The influence of high temperature treatment combined with stem tip stripping on the rate of virus-free
从图4可以看出,SCV病毒在茎尖长度为0.2~0.3 mm 时光密度检测值小于临界值,病毒脱除;茎尖长度为0.3~0.5 mm时,2 ℃及以下脱除,其余温度处理没有脱除;而茎尖长度为0.5~0.8 mm时,只有0 ℃及以下脱除,其余温度没有脱除。SMoV病毒在茎尖长度为0.2~0.3 mm时所有检测值小于临界值,病毒脱除;茎尖长度为0.3~0.5 mm时,10 ℃以下脱除,其余温度没有脱除;而茎尖长度为0.5~0.8 mm时,只有0 ℃及以下脱除,其余温度没有脱除。SMYEV病毒在茎尖长度为0.2~0.3 mm时所有检测值小于临界值,病毒脱除;茎尖长度为0.3~0.5 mm时,4 ℃以下脱除,其余温度没有脱除;而茎尖长度为0.5~0.8 mm时,只有0 ℃及以下脱除,其余温度没有脱除。SVBV病毒在茎尖长度为0.2~0.3 mm所有检测值小于临界值,病毒脱除;茎尖长度为0.3~0.5 mm和0.5~0.8 mm时,0 ℃以下脱除,其余温度没有脱除。
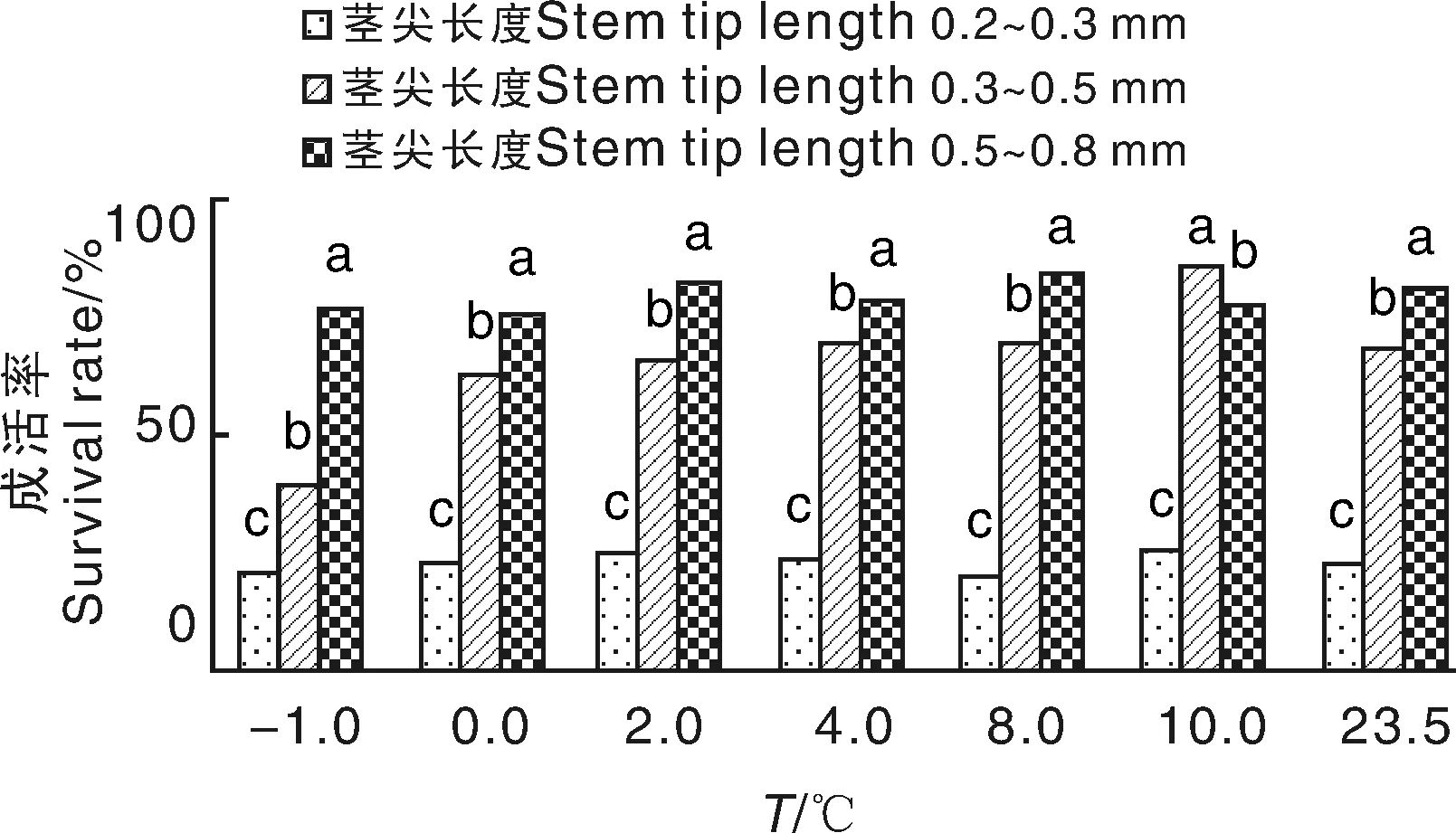
图3 低温处理结合茎尖剥离对成活率的影响Fig.3 The influence of low temperature treatment combined with stem tip stripping on the survival rate
3 讨论
近年来,采用RT-PCR对草莓病毒进行检测的分子技术具有灵敏、快速、特异性强等优点,但仪器设备昂贵、检测费用高、操作要求高,不适用于基层检测工作。双抗体一步夹心酶联免疫吸附法(DAS-ELISA)是最为灵敏的血清学技术之一,具有批量较大、准确度高、灵敏度高、特异性强、操作简单,运用性强,直观,节省人力和物资等优点,通过目测或酶标仪可判定结果,能快速而准确地检测出草莓中含有的病毒类型。
植物的根尖和茎尖等顶端分生组织不含病毒的部分是极小的,不超过0.1~0.5 mm[8]。热处理草莓植株,所用时间长,植株易死亡,且脱毒率较低;而用田间匍匐茎直接消毒,茎尖剥离诱导,污染率可高达60%,导致成活率偏低。本试验采集科技园区的匍匐茎,消毒处理培养成无菌瓶苗,再进行茎尖剥离脱毒和培养,使污染率有效降低至5%以下。同时,本试验结果表明,采用直接茎尖培养法对草莓的脱毒效果并不理想;而采用逐步升温法至38 ℃处理试管苗30 d,茎尖长度在0.8 mm以下的草莓试管苗100%脱除了草莓轻型黄边病毒、斑驳病毒和皱缩病毒;40 ℃热处理试管苗,茎尖长度在0.5~0.8 mm的成活率很低,仅为4.3%,但是4种病毒均可脱除。由此可见,不同病毒种类的耐热性不同,对于种苗携带的不同病毒而采取的不同温度梯度、时间长短设计、热处理方式结合茎尖剥离等处理的合理搭配对存活率和脱毒率的影响还有待于进一步深入研究。
Helliot等[9]用超低温成功地去除了黄瓜花叶病毒(CMV)和香蕉条斑病毒(BSV)。本试验采用低温处理,对照的茎尖大小为0.3 mm以下时脱毒效果较好,但成活率仅有22.67%。而采用低温-1和0 ℃处理30 d,茎尖大小为0.5 mm时能脱除4种病毒,成活率提高40%~60%。由此,对于耐0 ℃低温的植物,可以采用低温处理与茎尖剥离相结合的方式进行脱毒,既能提高脱毒率又能提高茎尖成活率,且能保证茎尖生长的速度,整个操作过程简单易行,满足大规模实际生产的需要。除了温度处理结合茎尖剥离脱毒,还可采用的二次茎尖脱毒方法,不仅可以提高草莓茎尖的脱毒效果,降低污染率,同时又能提高茎尖的分化率,加快繁育速度[10]。低温处理结合茎尖剥离与二次茎尖脱毒,哪一种更优,还有待于后续的进一步研究。
致谢:感谢中国林业科学研究院王小艺博士和浙江农业科学院王卫平研究员对本文的精心指导!
[1] 赵伶.温室草莓高产栽培几项技术问题的探讨[J].中国农村小康科技, 2001(5):30-31. ZHAO L. Greenhouse strawberries high-yield cultivation technique question discussion[J].ChineseCountrysideWell-offTechnology, 2001(5):30-31. (in Chinese)
[2] 肖君泽,黄溢宏.草莓病毒病及其脱毒与检测技术研究进展[J].江西农业学报,2010, 22(8):88-90. XIAO J Z, HUANG Y H. Research progress in detoxication and testing of strawberry virus disease[J].ActaAgriculturaeJiangxi, 2010, 22(8):88-90. (in Chinese with English abstract)
[3] 孙崇波,蒋桂华,施季森,等.不同外植体对草莓病毒脱除效果及病毒的多重RT-PCR检测[J].核农学报, 2008, 22(4):447-450. SUN C B, JIANG G H, SHI J S, et al. Effect of explants on strawberry virus elimination of strawberry and viruses detection by multiplex RT-PCR[J].JournalofNuclearAgriculturalSciences, 2008,22(4):447-450. (in Chinese)
[4] MARTIN R R, TZANETAKIS I E. Characterization and recent advances in detection of strawberry viruses[J].PlantDisease, 2006,90: 384-396.
[5] 魏永祥. 草莓无病毒栽培技术[M].北京:金盾出版社,2007.
[6] 刘健,刘向蕾,胡繁荣,等.草莓热处理结合茎尖培养脱毒效果研究[J].浙江农业科学,2009 (6):1088-1090. LIU J, LIU X L, HU F R, et al. Study on strawberry heat treatment combined with stem tip seedling cultivation effect[J].JournalofZhejiangAgriculturalSciences, 2009 (6):1088-1090.(in Chinese)
[7] THOMPSON J R,JELKMANN W.The detection and variation of strawberry mottle virus[J].PlantDisease,2003,87(4):385-390.
[8] 刘军,王升.草莓脱病毒技术的研究与应用[J]. 北方果树, 2008(3):1-2. LIU J, WANG S. Research and application of virus-free techniques in strawberry [J].NorthernFruits, 2008(3):1-2.(in Chinese)
[9] HELLIOT B, PANIS B, POUMAY Y, et al. Cryopreservation for the elimination of cucumber mosaic and banana streak viruses from banana (Musaspp.) [J].PlantCellReports, 2002, 20(12):1117-1122.
[10] 邓群仙,熊庆娥.品种和培养基对草莓茎尖培养的影响[J].四川农业大学学报, 2000, 18(3):252-255. DENG Q X, XIONG Q E. Effects of variety and medium on callus and shoot growth in strawberry shoot tip cultures[J].JournalofSichuanAgriculturalUniversity,2000,18(3):252-255.(in Chinese with English abstract)
(责任编辑 张 韵)
Detoxification protocal optimization and virus detection in strawberry variety Hongyan
CHEN Ying, XIAO Chunlin, LUO Yanna, ZHANG Xiying, LIU Jiangna
(ResearchInstituteofAgriculturalSciences,the6thAgriculturalProductionDivisionofXinjiangProductionandConstructionCorps,Wujiaqu831300,China)
With strawberry variety Hongyan as the material, the sterile container seedlings were treated with high temperature treatment, low temperature freezing treatment combined with stem tip off detoxification. The double antibody step of serology and the clip art enzyme-linked immunoassay detection method were carried out to detect four kinds of virus. The survival rate and the detoxification efficiency of seedlings induced by meristem cells were compared. The results showed that the survival rate increased from 23.0% to 39.6%-60.0% under-1 ℃ cryogenic treatment with the stem tip stripping length increased from 0.3 mm to 0.5 mm, and all four virus were removed by the double antibody sandwich enzyme-linked immunoassay detection.
strawberry; temperature; virus-free meristem; virus detection; optimization
10.3969/j.issn.1004-1524.2017.06.15
2017-02-09
国家十二五科技支撑计划项目(2012BAD41B00)
陈英(1967—),女,湖北黄陂人,高级农艺师,主要从事特色作物脱毒快繁、育苗栽培技术的研究与应用。E-mail: 1131382130@qq.com
S668.4
A
1004-1524(2017)06-0966-05

