神经妥乐平联合羟考酮控释片治疗癌性神经病理性疼痛的临床效果评价
续 蕾 罗 萍 李靖文
神经妥乐平联合羟考酮控释片治疗癌性神经病理性疼痛的临床效果评价
续 蕾 罗 萍 李靖文
目的 探讨癌性神经病理性疼痛患者使用神经妥乐平+羟考酮控释片治疗后的临床效果。方法 选取VAS评分>4分的癌性神经病理性疼痛患者86例,并按数字表法随机分为对照组与试验组两组,每组均43例。对照组予以安慰剂+羟考酮控释片的治疗方案,试验组则实施神经妥平乐+羟考酮控释片的治疗措施。分析对比两组患者治疗前后VAS评分、SAS评分、治疗后疼痛缓解情况、治疗7 d及14 d后爆发痛发作情况及羟考酮控释片服用情况。结果 经过治疗后,试验组患者VAS评分为(0.96±1.08)分、SAS评分为(36.69±8.45)分,均明显低于对照组的(3.01±1.29)分、(48.56±10.27)分,差异有统计学意义(P<0.05);试验组患者整体疼痛缓解情况明显优于对照组,疼痛缓解率(95.35%)明显高于对照组的(53.49%),组间对比有统计学上有意义(P<0.05);治疗14 d时,试验组爆发痛发作次数为(1.72±0.95)次/d、羟考酮控释片日均服用量为(80.76±20.79)mg/d,均明显优于对照组[(2.21±1.24)次/d、(101.99±23.56)mg/d],有统计学意义(P<0.05)。结论 神经妥乐平联合羟考酮控释片联合治疗,可缓解肿瘤患者的癌性神经病理性疼痛,临床治疗效果较优。
临床效果;神经妥乐平;癌性神经病理性疼痛;羟考酮控释片
(ThePracticalJournalofCancer,2017,32:1034~1037)
对癌晚期患者而言,其出现癌性疼痛的原因大致可分为3种,即癌症治疗过程中产生的疼痛、肿瘤疾病自身引起的疼痛、肿瘤间接引发的疼痛[1]。癌性神经病理性疼痛(NCP)作为最复杂、常见的癌性疼痛分型之一,其发病原因主要是肿瘤自身或在治疗过程中侵犯、损伤或压迫了周围神经组织,引发炎性反应,继而出现神经病理性疼痛[2]。目前临床上多给予羟考酮控释片等阿片类药物以缓解病患的疼痛程度,虽有一定改善效果,但长期单一用药会使病患产生耐药性[3]。为了探寻新的治疗方案,在本次研究中,特对经我院收治的NCP患者给予不同治疗方案,回顾性分析其相关资料,现将结果报告如下。
1 资料与方法
1.1 临床资料
选取自2015年3月起至2016年4月经我院肿瘤科收治且VAS评分>4分的癌性神经病理性疼痛患者86例,并按数字表法随机分为对照组与试验组两组,每组均43例。其中,试验组中男性28例,女性15例;年龄在55~77岁,平均年龄为(65.19±1.17)岁;病程为1~7年,平均病程为(4.01±0.34)年。对照组中男性31例,女性12例;年龄为59~77岁,平均年龄为(67.04±1.74)岁;病程2~6年,平均病程(4.05±1.11)年。两组患者在病程、性别、年龄等基本资料方面均具有可比性,无明显差异(P>0.05)。
入选标准:①本次研究经医院伦理委员会批准,所有患者经临床诊断后确诊为癌性神经病理性疼痛患者,疼痛视觉模拟划线法(VAS)评分>4分。②所有患者均自愿参与调查研究且已签署知情同意书,依从性较优。③治疗前1个月未服用其他阿片类止痛药、未行放化疗、据估计病患生存时间超过3个月。
排除标准:①有其他严重血液性、代谢性病变、心肺、肝肾功能异常者。②身体极度衰弱、意识模糊、言语沟通障碍、神经、精神疾患。③吞咽困难、恶心、呕吐、家属已放弃治疗者。
1.2 方法
试验组予以神经妥乐平+羟考酮控释片的治疗方案:取神经妥乐平(牛痘疫苗接种家兔炎症皮肤提取物注射液)(润和生物医药科技有限公司,国药准字S20090092,规格:3.6N单位/3 ml/支*10支/盒)6 ml溶于0.9%生理盐水100 ml中,每天一次静脉滴注;羟考酮控释片(中国北京华素制药股份有限公司,国药准字H20090214,规格:5 mg)首次服用剂量为10 mg,严格遵照医嘱每12 h温水送服一次,根据患者用药后有无其他不良反应及疼痛缓解程度,适当增加50%剂量或减少25%剂量。两种药物均连续使用14 d。对照组则采用安慰剂+羟考酮控制片的治疗方案:遵医嘱给予0.9%生理盐水100 ml,每天一次静脉点滴,同时告知患者每12 h口服一次羟考酮控释片,具体服用方法同试验组,持续治疗14 d。
1.3 观察指标
观察分析两组治疗前后VAS评分、SAS评分、治疗后疼痛缓解情况、治疗7 d及14 d后爆发痛发作情况及羟考酮控释片服用情况。VAS(疼痛视觉模拟划线法)评分标准[4]:可分为四级,即7~10分为疼痛剧烈,4~6分为中度疼痛,1~3分为疼痛较轻,0分为无痛。SAS(焦虑自评量表)评分标准[5]:含20个小项目,每个项目按出现频率分成4级评分,由家属协同患者在治疗后进行评分,轻度焦虑为50~59分、中度焦虑为60~69分、重度焦虑为70分以上(含70分)。疼痛缓解情况评定标准[6]:根据世界卫生组织疼痛缓解程度进行分析评分,即0级为无疼痛;1级为轻度疼痛,有疼痛感,可耐受,不影响休息与工作;2级为中度疼痛,疼痛已影响人们的正常生活,患者常难以入睡;3级为重度疼痛,疼痛剧烈难忍,药物治疗后仍不能缓解。疼痛缓解率(%)=(无痛+轻度疼痛)例数/总例数×100%。
1.4 统计学处理
2 结果
2.1 两组患者治疗前后VAS及SAS评分情况
治疗前,两组VAS及SAS评分比较,无统计学意义(P>0.05);经过治疗后,试验组VAS评分及SAS评分均明显低于对照组的,差异有统计学意义(P<0.05),见表1。

表1 两组患者治疗前后VAS及SAS评分情况分)
2.2 两组患者治疗后疼痛缓解情况
试验组患者经过治疗后的整体疼痛缓解情况明显优于对照组的,疼痛缓解率明显高于对照组的,差异有统计学意义(P<0.05),见表2。
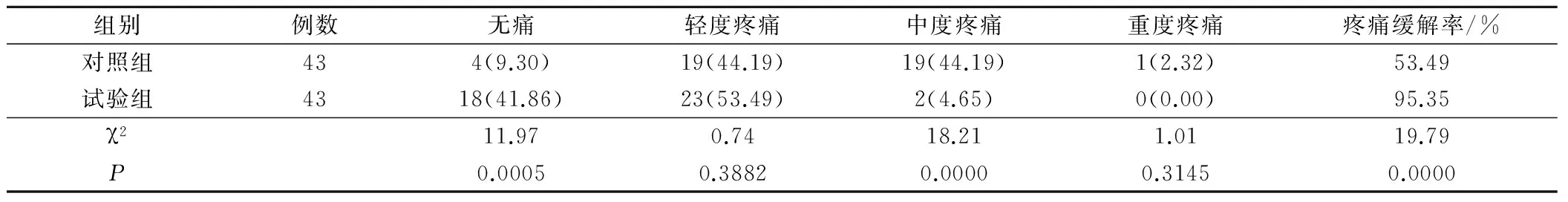
表2 两组患者治疗后疼痛缓解情况(例,%)
2.3 两组治疗7 d及14 d后爆发痛发作及羟考酮控释片服用情况比较
治疗7 d时,两组爆发痛发作次数及日均羟考酮控释片服用量相比,无统计学意义(P>0.05);治疗14 d时,试验组爆发痛发作次数、羟考酮控释片日均服用量均明显低于对照组的,有统计学意义(P<0.05),见表3。
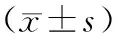
表3 两组治疗7 d及14 d后爆发痛发作及羟考酮控释片服用情况
3 讨论
多数肿瘤患者在疾病治疗过程中常伴有强烈的植物神经异常及全方位疼痛,临床上称之为癌性疼痛,其中癌性神经病理性疼痛(NCP)是最常见的疼痛类型之一,常难以治愈[7]。NCP的发生发展严重影响了患者的情绪及信心,使其丧失治疗的信念,心理承受巨大压力,可直接表现在躯体症状上,加重了病情变化,同时也增加了治疗的困难度[8]。目前,临床上对NCP的治疗原则多以药物治疗为主,其中缓解疼痛程度为其主要给药目的。
在本次治疗中,对经我院收治的NCP患者给予神经妥乐平+羟考酮控释片的治疗方案。神经妥乐平是一种N-甲基-D天冬氨酸受体的拮抗剂,同时也是将牛痘疫苗接种至家兔皮肤后从其炎症皮肤组织中分离提取的非蛋白性生理活性物质,可有效控制延髓中神经递质的释放量,调节5-HT功能,维持中枢神经系统内的去甲肾上腺素功能,减少缓激肽的游离,抑制外周激肽释放酶的活性,同时神经妥乐平还可激活下行性抑制疼痛系统,减少疼痛对神经的刺激[9-10]。神经妥乐平的生物活性效价是通过机体内对激肽释放酶样物质产生的阻碍作用试验与慢性应激负荷动物所做的镇痛效果试验进行规定的,其药理作用主要是将机体内处于痛觉阈值低下的痛觉过敏状态调整恢复至正常水平,与急性突发疼痛类病变相比,该药对慢性延续性疼痛伴随的麻木感及冷感改善效果较佳,具有明显的镇痛效果,因而用以治疗癌性神经病理性疼痛[11-12]。神经妥乐平可有效调节植物神经功能,改善病患的知觉、冷感异常,具有明显的抗变态反应性抑制作用及镇静效果[13]。羟考酮控释片属于新型半合成类纯阿片类受体激动剂,约38%的即释部分在1 h内可快速起效作用于机体内,另62%的缓释部分可用以维持体内的血药浓度,其镇痛强度明显高于吗啡,常用作第二、三阶梯的中、重度止痛治疗[14-15]。羟考酮控释片发挥药效强度与是否进食无关,其吸收程度、最高血药浓度和使用剂量呈正比,可持续发挥镇痛效果又不影响即释片固有的迅速镇痛效果,可与各种辅助用药及非阿片类药物联用又不需要考虑药物之间的互相作用,应用价值较高,使用率广泛[16]。神经妥乐平与羟考酮控释片联合应用后,毒副作用小,具有较佳的神经修复功能,对前列腺素的生化合成没有抑制作用,对机体免疫、呼吸、循环系统无明显损害作用,可有效改善微循环,修补损伤的植物神经系统,调节神经传导速度,营养神经组织,继而达到持续镇痛效果[17-18]。在本次研究中,如表1、2、3可知,试验组VAS评分、SAS评分、治疗后疼痛缓解情况、爆发痛发作情况及羟考酮控释片日均服用量等均明显优于对照组,统计学上有意义(P<0.05),说明两种药物联合使用后,患者NCP发作情况得到了有效改善,镇痛效果在较大程度上达到了患者的期望值,同时联合用药可减少羟考酮的日均用量,预防或减轻了大剂量用药可能引发的副作用,较单一用药相比,安全性更高。
综上所述,神经妥乐平+羟考酮控释片联合用药可有效减少肿瘤患者羟考酮控释片的日均量,改善了爆发痛的发作次数,减轻了NCP发作的疼痛程度,作用效果较优。
[1] 卢 帆,宋 莉,刘 慧.癌性神经病理性疼痛的评估和诊疗现状〔J〕.中国疼痛医学杂志,2015,21(9):692-696.
[2] Smith EM,Bridges CM,Kanzawa G,et al.Cancer treatment-related neuropathic pain syndromes-epidemiology and treatment:an update〔J〕.Curr Pain Headache Rep,2014,18(11):459.
[3] 段 力,阎 飞,涂志全,等.盐酸羟考酮缓释片联合复方苦参注射液治疗癌性神经病理性疼痛〔J〕.天津药学,2016,28(1):34-35,37.
[4] 刘波涛,樊碧发.老年患者癌性疼痛的规范化药物治疗〔J〕.中华老年学杂志,2014,33(8):828-830.
[5] 谢之微,杨婉花,张震华,等.盐酸羟考酮控释片治疗晚期癌症疼痛的临床疗效及安全性〔J〕.中国肿瘤临床与康复,2015,22(11):1379-1382.
[6] 龚黎燕,孔祥鸣,裘友好,等.盐酸羟考酮缓释片联合吗啡片滴定中重度癌痛的临床观察〔J〕.中国疼痛医学杂志,2014,20(7):481-485.
[7] Masuguchi K,Watanabe H,Kawashiri T,et al.Neurotropin(R) relieves oxaliplatin-induced neuropathy via Gi protein-coupled receptors in the monoaminergic descending pain inhibitory system〔J〕.Life Sci,2014,98(1):49-54.
[8] 杨 平,王 昆.盐酸羟考酮缓释片用于癌痛治疗的滴定〔J〕.中国肿瘤临床,2015,42(12):600-602.
[9] 李文文,韩 磊,张志国,等.不同剂量羟考酮对重度癌痛患者疼痛抑制的作用研究〔J〕.中国医师杂志,2016,18(1):22-25.
[10] Bennett MI,Laird B,van Litsenburg C,et al.Pregabalin for the management of neuropathic pain in adults with cancer:a systematic review of the literature〔J〕.Pain Med,2013,14(11):1681-1688.
[11] 刘宁红,吴海玲.盐酸羟考酮缓释片联合加巴喷丁治疗老年重度癌痛的临床观察〔J〕.中国药物与临床,2015,15(9):1301-1303.
[12] Fanelli G,Fanelli A.Developments in managing severe ch- ronic pain:role of oxycodone-naloxone extended release〔J〕.Drug Des Devel Ther,2015,9(6):3811-6381.
[13] 成宪江,刘维帅,王 昆.神经妥乐平联合羟考酮控释片治疗癌性神经病理性疼痛的疗效观察〔J〕.中国肿瘤临床,2015,42(11):546-549.
[14] Gilron I,Jensen TS,Dickenson AH.Combination pharmacotherapy for management of chronic pain:from bench to bedside〔J〕.Lancet Neurol,2013,12(11):1084-1095.
[15] 周 行,李霁川,刘显玉,等.癌性神经病理性疼痛的治疗〔J〕.中国医刊,2015,50(9):4,10.
[16] Nakamura A,Hasegawa M,Minami K,et al.Differential activation of the mopioid receptor by oxycodone and morphine in pain-related brain regions in a bone cancer pain model〔J〕.Br J Pharmacol,2013,168(2):375-388.
[17] 丁远远,姚 鹏.加巴喷丁联合神经妥乐平治疗痛性糖尿病周围神经病变的临床观察〔J〕.中国现代医学杂志,2015,25(23):86-90.
[18] 夏欣欣,韩黎丽,邓文英,等.盐酸羟考酮缓释片治疗中重度癌痛临床观察〔J〕.中华实用诊断与治疗杂志,2014,16(1):91-92.
(编辑:吴小红)
Clinical Effect of Neurotropin Combined with Controlled-release Oxycodone Tablets for Neuropathic Cancer Pain
XULei,LUOPing,LIJingwen.
XiangyangCenterHospital,Xiangyang,441021
Objective To study the clinical effect of neurotropin combined with controlled-release oxycodone tablets for neuropathic cancer pain.Methods 86 cases of neuropathic cancer pain patients with VAS score > 4 were randomly divided into 2 groups,the control group and the treatment group,43 cases in each group.To control group received placebo and controlled-release oxycodone tablets,the treatment group received neurotropin combined with controlled-release oxycodone tablets.VAS score,SAS scores,pain relief after treatment,7 d and 14 d after the outbreak of pain treatment and controlled-release oxycodone tablets of the 2 groups before and after treatment were compared.Results After treatment,the VAS score of the experimental group was(0.96±1.08) points,SAS score was(36.69±8.45),which were significantly lower than those of the control group (3.01±1.29),(48.56±10.27),there had statistically significant difference(P<0.05);The overall situation of pain relief in the experimental group was obviously better than the control group,the pain relief rate (95.35%) was significantly higher than that of the control group (53.49%),there had statistically significant difference (P<0.05);Outbreak of pain in the experimental group at day 14 was (1.72±0.95) times/d,controlled-release oxycodone tablets daily dose was (80.76±20.79) mg/d,which was obviously better than that of the control group (2.21±1.24)times/d,(101.99±23.56) mg/d,there had statistically significant difference (P<0.05).Conclusion Neurotropin combined with controlled-release oxycodone tablets can relieve neuropathic cancer pain,it has a better clinical therapeutic effect.
Clinical effect;Neurotropin;Neuropathic cancer pain;Controlled-release oxycodone tablets
441021 湖北省襄阳中心医院
10.3969/j.issn.1001-5930.2017.06.049
R73-36
A
1001-5930(2017)06-1034-04
2016-07-11
2017-03-08)

