DP和IP方案二线治疗氟尿嘧啶类药物化疗失败的进展期胃癌疗效比较
任 萍 胡春艳
DP和IP方案二线治疗氟尿嘧啶类药物化疗失败的进展期胃癌疗效比较
任 萍 胡春艳
目的 探讨氟尿嘧啶类药物化疗失败后多西他赛联合顺铂(DP)和伊立替康联合顺铂(IP)方案二线治疗进展期胃癌的疗效。方法 回顾性分析接受氟尿嘧啶类药物基础化疗失败的进展期胃癌患者120例,按照二线治疗方案的不同,分为DP组与IP组。DP组65例,行多西他赛联合顺铂化疗,IP组55例,行伊立替康联合顺铂化疗。比较两组患者临床疗效、生活质量、不良反应、以及生存情况。结果 DP组临床有效率与控制率分别为27.69%、56.92%,与IP组的21.82%、52.73%比较,无统计学差异(P>0.05)。两组治疗后体质量与卡氏评分均较同组治疗前明显上升(P<0.05),但两组比较,无统计学差异(P>0.05)。两组白细胞减少、血小板减少、血红蛋白减少、恶心、呕吐、乏力、肝功能损害、神经毒性发生率比较,无统计学差异(P>0.05);DP组腹泻、胆碱能综合征发生率分别为9.23%、0,明显低于IP组的65.45%、10.91%(P<0.05),脱发、口腔黏膜炎发生率分别为100.00%、49.23%,明显高于IP组的38.18%、25.45%(P<0.05)。截至2016年10月31日,DP组生存5例,IP组生存4例。DP组中位肿瘤无进展生存期为4.1个月,IP组为4.5个月;DP组中位生存期为6.1个月,IP组为5.8个月,两组患者中位肿瘤无进展生存期与中位生存期比较,无统计学差异(P>0.05)。结论 对氟尿嘧啶类药物基础化疗失败后的进展期胃癌患者行多西他赛联合顺铂或伊立替康联合顺铂方案二线治疗疗效相近,能明显提升患者生活质量,且不良反应小。
多西他赛;伊立替康;顺铂;二线治疗;进展期胃癌
(ThePracticalJournalofCancer,2017,32:992~995)
胃癌是临床常见的消化系统高度异质性恶性肿瘤,可发生于任何年龄,每年死亡病例约70万[1]。中国是胃癌高发区,严重威胁着我国人民的生命健康[2]。胃癌初期多无症状或仅有轻微症状,诊断率较低,当患者临床症状明显时,病理分期多已发展至晚期,仅以手术方案无法进行根治。临床多使用氟尿嘧啶类药物行基础一线化疗,以尽可能延长患者生存期。但因胃癌对化疗相对敏感且晚期胃癌总体预后较差,多数患者不可避免地出现肿瘤进展或复发转移[3]。因此,一线治疗失败后设计新的方案行合理二线治疗,对延长复治者的无进展生存期和总生存时间具有重要意义。本文回顾性分析了120例进展期胃癌患者,旨在探究氟尿嘧啶类药物基础化疗失败后DP方案和IP方案二线治疗进展期胃癌疗效。
1 资料与方法
1.1一般资料
回顾性分析2014年3月至2016年3月于我院接受氟尿嘧啶类药物基础化疗失败的进展期胃癌患者120例,按照二线治疗方案的不同,分为DP组与IP组。DP组65例,IP组55例。其中DP组,男性36例,女性29例;年龄30~72岁,平均年龄(52.18±1.83)岁;病理类型:中低分化腺癌43例,黏液腺癌14例,印戒细胞癌8例;根据AJCC病理分期标准[4],Ⅲb期35例,Ⅳ期30例;转移灶:腹腔淋巴结转移36例,肝脏转移24例,锁骨上淋巴结转移12例,骨转移7例,肺转移5例,盆腔种植转移5例,胰腺转移3例,脾转移3例。IP组,男性30例,女性25例;年龄31~72岁,平均年龄(51.13±2.13)岁;病理类型:中低分化腺癌39例,黏液腺癌11例,印戒细胞癌5例;病理分期:Ⅲb期29例,Ⅳ期26例;转移灶:腹腔淋巴结转移30例,肝脏转移20例,锁骨上淋巴结转移10例,骨转移8例,肺转移4例,盆腔种植转移4例,胰腺转移2例,脾转移2例。两组患者在性别、年龄、病理类型、转移灶分布等方面比较,差异无统计学意义(P<0.05),具有可比性。所有患者均符合以下标准:①具有典型的进展期胃癌临床表现,并经细胞学与病理学检查确诊。②均接受过氟尿嘧啶类药物基础化疗,病情出现肿瘤进展或复发转移。③患者均为期30天左右未进行放疗和化疗。④卡氏评分得分≥60分,预计生命周期≥3个月。⑤无严重的骨髓抑制者、骨髓造血功能障碍和心肝肾脑等器质性损害,全身无化疗禁忌。⑥患者及其家属均签署化疗知情书。⑦临床资料完整。本研究已获得医学伦理委员会的批准。
1.2 方法
每次化疗前半小时,给予患者静脉注射3 mg格拉司琼10 mg地塞米松进行常规止吐。两组患者在用药期间每周复查一次血常规,生化,尿常规及心电图。出现Ⅲ~Ⅳ度白细胞减少及血小板减少及时应用IL-11治疗。所有患者均化疗2~6个疗程。并随访至2016年10月31日,尚生存的病例列为截尾数据。
1.2.1 DP组化疗方案 35 mg/m2多西他赛(浙江海正药业股份有限公司,国药准字号H20093092)注入100 mL生理盐水中并持续静脉滴入1 h,d1、d8。在使用多西他赛前1 d,同时口服8 mg地塞米松,2次/d,连用3 d,预防液体潴留综合征及过敏反应。20 mg/m2顺铂(云南生物谷药业股份有限公司,国药准字号H20043888)静脉滴入,d1~d4。21 d为1个疗程。
1.2.2 IP组化疗方案 65 mg/m2伊立替康(齐鲁制药有限公司,国药准字号H20084572)注入250 mL生理盐水中并持续静脉滴入90 min,d1、d8。20 mg/m2顺铂(云南生物谷药业股份有限公司,国药准字号H20043888)静脉滴入,d1~d4。21 d为1个疗程。
1.3 观察指标
观察两组患者临床疗效、生活质量、不良反应以及生存情况。①临床疗效评定:采用RECIST标准[5],以肿瘤最长径的总和来测量,分为4个级别。第一级,完全缓解,指至少持续28天,肿瘤病灶完全消失;第二级,部分缓解,指至少持续28天,肿瘤体积缩小30%或以上;第三级,稳定,既没有部分缓解,也未出现病灶进展;第四级,进展,病灶增大20%,病灶增大前未出现完全缓解、部分缓解、稳定表现。临床治疗有效率=(完全缓解例数+部分缓解例数)÷总例数×100%,临床治疗控制率=(完全缓解例数+部分缓解例数+稳定例数)÷总例数×100%。②生活质量评定:采用卡氏评分标准[6],得分与健康状况呈正相关。③生存情况采用Kaplan-Meier法进行分析,无进展生存期指从化疗开始到肿瘤进展或患者死亡的时间;总生存期为从化疗开始至死亡或末次随访的时间。④不良反应评定:采用美国NICC制定的毒性评价标准[7]。
1.4 统计学方法
应用SPSS 19.0软件对研究中得到数据进行统计学分析。两组计量结果比较采用t检验,计数资料比较用χ2检验,P<0.05为差异具有统计学意义。
2 结果
2.1 两组患者临床疗效比较
DP组患者临床有效率与控制率与IP组比较,差异无统计学意义(P>0.05),见表1。
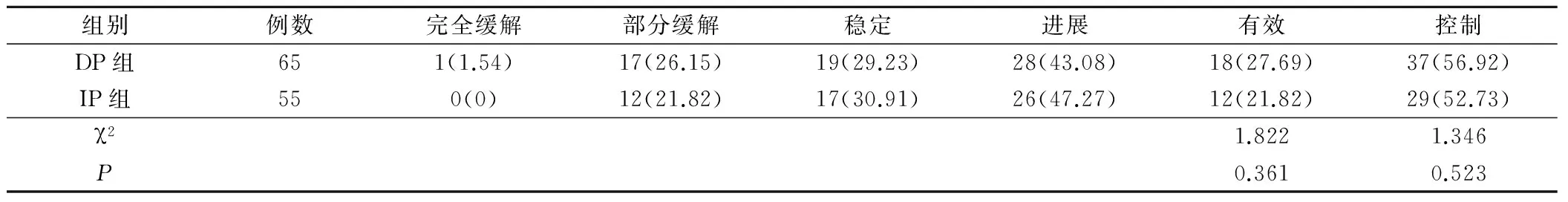
表1 两组患者临床疗效比较(例,%)
2.2 两组患者治疗前后生活质量比较
治疗前后,两组患者体质量与卡氏评分比较,差异无统计学意义(P>0.05)。DP组与IP组治疗后均较本组治疗前体质量与卡氏评分有明显提升,差异具有统计学意义(P<0.05),见表2。
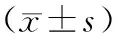
表2 两组患者治疗前后生活质量比较
注:#为与同组治疗前比较,P<0.05。
2.3 两组患者不良反应情况比较
DP组与IP组白细胞减少、血小板减少、血红蛋白减少、恶心、呕吐、乏力、肝功能损害、神经毒性发生率比较,无统计学差异(P>0.05);DP组腹泻、胆碱能综合征发生率明显低于IP组,脱发、口腔黏膜炎发生率明显高于IP组,差异均具有统计学意义(P<0.05),见表3。
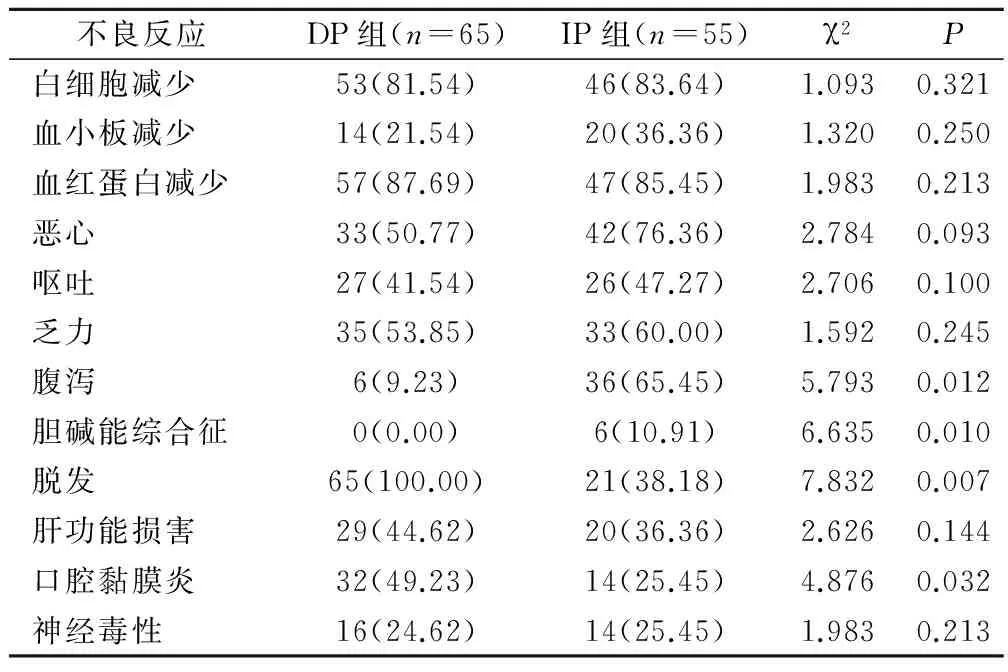
表3 两组患者不良反应情况比较(例,%)
2.4 两组患者生存情况比较
截至2016年10月31日,DP组生存5例,IP组生存4例。DP组肿瘤无进展生存期为2.3~6.5个月,中位肿瘤无进展生存期为4.1个月;IP组中位肿瘤无进展生存期范围为2.1~6.4个月,中位肿瘤无进展生存期为4.5个月。DP组总生存期为3.5~6.9个月,中位生存期为6.1个月;IP组总生存期为2.2~6.6个月,中位生存期为5.8个月。两组患者中位肿瘤无进展生存期与中位生存期比较,差异无统计学意义(P>0.05)。
3 讨论
胃癌的发病率在全球范围内居恶性肿瘤第2位。在确诊的病例中,90%以上为进展期胃癌[8]。进展期胃癌患者即使经一线治疗,5年生存率也仅在35%~40%,且易局部复发和多途径转移[9]。一线化疗失败后约有将近一半以上患者选择继续化疗。经一线治疗失败后的进展期胃癌患者体质量有所下降,同时,化疗耐受性较差。选择何种二线化疗方案来控制患者病情越来越引起人们的重视。然而,目前尚无1个国际所接受的标准二线化疗方案。因此,本文旨在探究氟尿嘧啶类药物基础化疗失败后DP方案和IP方案二线治疗进展期胃癌疗效。
本研究发现,两组患者治疗后临床有效率与控制率、生活质量差异无统计学意义(P>0.05)。其中,两组患者生活质量均较治疗前明显提升(P<0.05)。说明DP与IP方案二线治疗进展期胃癌疗效相近,且都具有明显的抗肿瘤活性,治疗效果良好。这与朱益平[10]研究结果一致。多西他赛是1种细胞周期特异性抗微管药物,作用机制是特异性地结合到微管的β位上,从而加强微管蛋白聚合作用和抑制微管解聚作用,导致形成稳定的非功能性微管束,将肿瘤细胞阻断于M期,破坏有丝分裂[11]。与顺铂不产生交叉耐药。伊立替康为半合成喜树碱类衍生物,在体内被代谢为活性中间体SN-38(7-乙基-10-羟基喜树碱),可特异性地与拓扑异构酶Ⅰ结合,抑制其活性,使单链裂解-结合循环过程被阻断,阻止断裂单链的再连接,从而阻碍DNA复制[12]。
同时发现,DP组腹泻、胆碱能综合征发生率明显低于IP组,脱发、口腔黏膜炎发生率明显高于IP组,差异均具有统计学意义(P<0.05)。这可能与多西他赛与伊立替康的药理毒理不同有关。DP组与IP组在白细胞减少、血小板减少等其他不良反应发生率比较,无统计学差异(P>0.05)。在化疗过程中所有患者经相应处理后均能恢复,并无治疗相关死亡的发生。说明DP与IP治疗方案安全性较高。此外,在使用多西他赛药物的过程中,具有明显的药物细胞滞留时间长的特点,因此在多西他赛使用过程中给予常规地塞米松预处理,以防止液体潴留综合征及过敏反应。姜凤娥等[13]采用伊立替康联合替吉奥方案治疗二线晚期胃癌,同时也发现患者常见不良反应主要是Ⅰ/Ⅱ度的恶心、呕吐、骨髓抑制等,Ⅲ/Ⅳ度的血液学毒性反应和腹泻。毒性反应较轻微,患者多可耐受,没有出现感染性发热或死亡的病例。
并且,截至2016年10月31日,两组患者中位肿瘤无进展生存期与中位生存期比较,差异无统计学意义(P>0.05),但两种方案患者的中位生存期仍然较短。为避免耐药出现,二线化疗方案应尽可能选择非患者一线化疗药物。因此在临床中,应根据患者个人以及对各种毒副反应的耐受力的不同,选择具体二线化疗方案,以尽可能最大化患者的二线化疗获益机率。本研究的不足之处在于,此次回顾性分析的患者例数较少,缺乏前瞻性研究,待进一步改进。在以后的研究中可进一步纳入更多患者,并进行更高质量的随机对照试验。
综上,对氟尿嘧啶类药物基础化疗失败后的进展期胃癌患者行多西他赛联合顺铂或伊立替康联合顺铂方案二线治疗疗效相似且不良反应小,明显提升患者生活质量。临床可根据患者对不良反应的耐受力加以确定具体的化疗方案。
[1] 宋哲宇,王大广,李腾飞,等.家族性胃癌与散发性胃癌的临床特点及预后〔J〕.中国老年学杂志,2016,36(2):360-362.
[2] 季加孚.我国胃癌防治研究三十年回顾〔J〕.中国肿瘤临床,2013,50(22):1345-1351.
[3] 杜春霞,陈闪闪,刘潇衍,等.重组人血管内皮抑素联合多西他赛、铂类和氟尿嘧啶类一线治疗进展期胃癌的临床观察〔J〕.临床肿瘤学杂志,2014,19(10):925-928.
[4] 陈长春,郭小芳,袁子龙,等.依据AJCC2010胃癌新分期标准探讨术前CT检查对于胃癌T分期诊断的临床价值〔J〕.临床放射学杂志,2013,32(7):984-987.
[5] 王 健,曹 东,顾文静,等.WHO标准与RECIST标准评价恶性肿瘤治疗效果的比较〔J〕.中国基层医药,2013,20(5):652-654.
[6] 芦 兰,许绿叶,师幸伟,等.自体CIK细胞对晚期胃癌肿瘤标志物及生活质量的影响〔J〕.广东医学,2014,35(5):698-700.
[7] 邱 冬,李 杭,姜桂林,等.培美曲塞联合铂类治疗晚期非小细胞肺癌的临床疗效及安全性观察〔J〕.山东医药,2013,53(33):40-42.
[8] 朱元增,孙培春,吴 刚,等.腹腔镜辅助D2根治术治疗远端进展期胃癌的疗效〔J〕.中国老年学杂志,2013,33(19):4697-4698.
[9] 孔 曼,裴文仲,杨建东,等.替吉奥联合奥沙利铂治疗进展期胃癌的临床疗效观察〔J〕.首都医科大学学报,2013,34(3):446-449.
[10] 朱益平,盛莉莉,王 潞,等.DP与IP方案二线治疗进展期胃癌临床观察〔J〕.中华肿瘤防治杂志,2016,23(11):732-738.
[11] 王 涛,赵 磊,李 榆,等.周剂量多西他赛联合顺铂与周剂量多西他赛联合奥沙利铂治疗晚期胃癌的临床研究〔J〕.中国癌症杂志,2015,24(2):150-154.
[12] 李建旺,黄春珍,元建华,等.伊立替康联合顺铂对比伊立替康单药二线治疗晚期胃癌的临床研究〔J〕.临床肿瘤学杂志,2016,21(6):540-544.
[13] 姜凤娥,孙 萍.伊立替康联合替吉奥二线治疗晚期胃癌的临床观察〔J〕.现代肿瘤医学,2014,21(8):1905-1907.
(编辑:吴小红)
Comparison of Efficacy of DP and IP Regimen as Second-line Treatment for Advanced Gastric Cancer Failed Fluorouracil Chemotherapy
RENPing,HUChunyan.
SecondAffiliatedHospitalofHe'nanUniversityofScienceandTechnology,Luoyang,471000
Objective To explore the efficacy of docetaxel combined with cisplatin (DP)and irinotecan combined with cisplatin (IP)as second-line treatment for advanced gastric cancer failed fluorouracil chemotherapy.Methods 120 cases of advanced gastric cancer patients who had failed fluorouracil chemotherapy were retrospectively analyzed.According to the different second-line treatment options,they were divided into DP group and IP group.DP group had 65 patients,they received docetaxel plus cisplatin chemotherapy,55 IP group had 55 patients,they received irinotecan combined with cisplatin chemotherapy.The clinical efficacy,quality of life,adverse reactions,and survival of the 2 groups were compared.Results The clinical efficiency and control rate of DP group were respectively 27.69% and 56.92%,and of IP group were 21.82% and 52.73%,there was no significant difference (P>0.05).After treatment,body mass and the Karnofsky score of the 2 groups were significantly increased (P<0.05),but there was no statistical difference between the 2 groups (P>0.05).There was no significant difference between the 2 groups in leukopenia,thrombocytopenia,reduction of hemoglobin,nausea,vomiting,fatigue,liver function impairment,neurotoxicity (P>0.05).Diarrhea and cholinergic syndrome incidence rates of DP group were 9.23% and 0%,which were significantly lower than IP group of 65.45%、10.91%(P<0.05),alopecia and mucositis incidence rates were 100% and 49.23%,which were significantly higher than IP group of 38.18%、25.45%(P<0.05).By October 31 2016,5 patients in the DP group were alive,and 4 patients in the IP group were alive.Median progression-free survival time of DP group was 4.1 months,IP group was 4.5 months;median overall survival time of DP group was 6.1 months,IP group was 5.8 months.There was no significant difference in median progression-free survival time and median overall survival time between the 2 groups(P>0.05).Conclusion
IP and DP as second-line treatment for advanced gastric cancer failed fluorouracil chemotherapy have similar efficacy,it can evidently increase the quality of life of patients,and the adverse reaction is small.
Irinotecan;Docetaxel;Cisplatin;Second-line treatment;Advanced gastric cancer
471000 河南科技大学第二附属医院
10.3969/j.issn.1001-5930.2017.06.036
R735.2
A
1001-5930(2017)06-0992-04
2016-12-21
2017-04-25)

