正元胶囊辅助培门冬酶联合化疗治疗儿童急性淋巴细胞白血病的临床分析
董 琳 王 丽 许 诣 沈文婷
正元胶囊辅助培门冬酶联合化疗治疗儿童急性淋巴细胞白血病的临床分析
董 琳 王 丽 许 诣 沈文婷
目的 探讨正元胶囊辅助培门冬酶联合化疗治疗儿童急性淋巴细胞白血病(ALL)的疗效及对患儿血清中白细胞介素(IL-6)和肿瘤坏死因子(TNF)-α水平的影响。方法 将90例儿童ALL随机分为对照组和观察组,均45例。对照组采取培门冬酶注射液组成的VDPAP方案。观察组在对照组基础上于缓解期内服正元胶囊,4粒/次,3次/天,连续治疗8周。比较2组近期疗效、治疗6个月和1年后的无事件生存率以及不良反应发生率。检测2组儿童ALL血清中IL-6和TNF-α的水平。结果 观察组患儿的近期总缓解率为84.44%,显著高于对照组的64.44%(P<0.05)。对照组6个月和1年无事件生存率分别为95.56%和86.67%,观察组为97.78%和93.33%,2组无事件生存率比较均无统计学差异(P>0.05)。观察组患儿的肝功能损害、骨髓抑制、低白蛋白血症、口腔溃疡、胃肠道反应及凝血功能异常的发生率均少于对照组,但2组间差异无统计学意义(P>0.05)。治疗后,观察组治疗后患儿血清中IL-6和TNF-α水平明显高于对照组(P<0.01)。结论 正元胶囊辅助培门冬酶联合化疗治疗儿童ALL的疗效明显,且安全性好,可能与其提高儿童ALL血清中IL-6和TNF-α水平有关。
正元胶囊;培门冬酶;儿童;急性淋巴细胞白血病
(ThePracticalJournalofCancer,2017,32:978~981)
儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)是最常见的儿童恶性肿瘤。近年来,儿童ALL的临床治疗取得较大进展,如新型靶向药物的出现、联合化疗的应用以及支持治疗措施的改善等使儿童ALL成为疗效最好的恶性肿瘤之一[1-2]。目前化学药物治疗仍是儿童ALL的首选疗法,但单纯化学药物措施常引起一些不良反应等,甚至可导致患儿死亡[3]。故减少儿童ALL疗程中的不良反应,提高疾病的缓解率仍是当前面临的重要医学难题[4]。近年临床证实中医药对儿童急性淋巴细胞白血病可增强患者的抗肿瘤效果,改善预后等[5]。祖国中药与化疗药物合用治疗儿童ALL的研究尚少见。本研究分析了正元胶囊辅助培门冬酶对儿童ALL预后的影响,以提高儿童ALL的临床治疗效果,并初步探讨了其可能作用机制。
1 资料与方法
1.1 一般资料
本组病例选择我院2013年1月至2015年1月收治的ALL儿童90例(对照组和观察组各45例)。对照组:男性30例,女性15例;年龄3~15岁,平均(9.31±1.15)岁;低危型17例,中危型13例,高危型15例。观察组:男性29例,女性16例;年龄2.5~15岁,平均(9.20±1.18)岁;低危型19例,中危型12例,高危型14例。2组ALL儿童基本资料的差异均无统计学意义(P>0.05)。诊断标准:参考《儿童急性淋巴细胞性白血病诊疗建议》(第4次修订草案)[6],所有病例经临床、免疫分型以及细胞化学染色等确诊。入选标准:①满足急性淋巴细胞白血病诊断的患儿;②无药物过敏史患儿;③生化指标检查无肝肾功能损害患儿;④患儿家属知情,且签知情同意书。排除标准:①因严重不良反应等中途退出患儿;②伴出凝血异常患儿;③病历资料缺失患儿;④精神患儿。
1.2 方法
对照组:治疗参见《儿童急性淋巴细胞性白血病诊疗建议》(第4次修订草案)[6]进行。具体采用VCR、DNR、PEC-Asp和Pred组成的VDPAP方案:长春新碱(VCR):2 mg/(m2·d),静脉注射,d8、d15、d22、d29;口服强的松(Pred):40 mg/m2,d1~d30;柔红霉素(DNR):30 mg/(m2·d)m2,静脉滴注,d8、d9;培门冬酶(PEG-Asp):2 500 U/m2,肌肉注射,d10、d24。用药第(19±2)d复查骨髓象,对骨髓白血病细胞数≤0.25(M1、M2状态)儿童继用原治疗方案,对骨髓白血病细胞数>0.25加用DNR(30 mg/m2)2次。观察组:在对照组基础上在缓解期口服正元胶囊,4粒/次,3次/d,连续治疗8周。
1.3 观察指标
①2组患儿的近期疗效,参考文献报道[6]拟定标准:完全缓解(CR):患儿的症状基本消失;PLT>100×109/L,外周血象结果(男)Hb≥110 g/L或(女)≥100 g/L,外周血分类无白血病细胞,中性粒细胞绝对值≥1.5×109/L;骨髓象结果为原+幼稚淋巴细胞小于5%,巨核细胞、红细胞正常。部分缓解(PR):骨髓象结果为原+幼稚淋巴细胞小于5%~20%;或症状、血象中有1项未符合完全缓解患儿。未缓解(NR):未符合部分缓解患儿。总缓解率=(CR+PR)例数/总例数×100%。②2组生存率:观察2组患儿6个月和1年期无事件生存率。③2组治疗过程中不良反应:观察2组疗程中肝功能损害、骨髓抑制、低白蛋白血症、口腔溃疡、胃肠道反应及凝血功能异常情况。④2组患儿血清白细胞介素(IL-6)和肿瘤坏死因子(TNF)-α水平,标本收集:晨起空腹下抽取患儿的静脉血,室温下离心,小心收取血清,-20 ℃保存备测;采取酶联免疫吸附法(Elisa)与治疗前后检测。
1.4 统计学方法
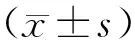
2 结果
2.1 2组近期疗效比较
观察组患儿的近期总缓解率为84.44%,显著高于对照组的64.44%(χ2=0.30,P<0.05),见表1。
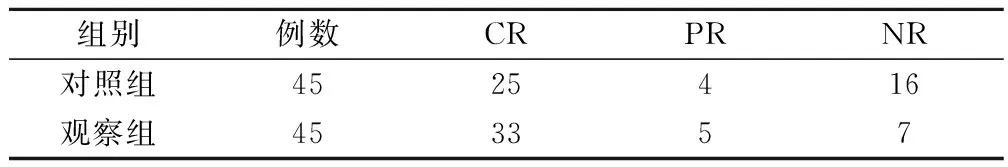
表1 2组近期疗效比较/例
2.2 2组无病生存率比较
对照组6个月和1年无事件生存率分别为95.56%(43/45)和86.67%(39/45),观察组为97.78%(44/45)和93.33%(42/45),2组无事件生存率比较,差异均无统计学意义(P>0.05)。
2.3 不良反应发生比较
观察组患儿的肝功能损害、骨髓抑制、低白蛋白血症、口腔溃疡、胃肠道反应及凝血功能异常的发生率均少于对照组,但2组间差异无统计学意义(P>0.05),见表2。
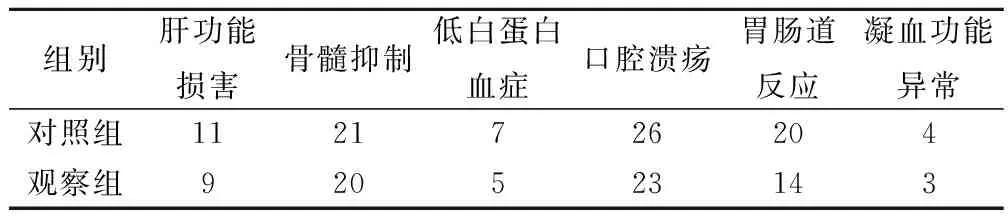
表2 2组不良反应发生率比较/例
2.4 2组患儿血清中IL-6和TNF-α水平比较
治疗后,2组患儿血清中IL-6和TNF-α水平均显著升高(P<0.01)。观察组治疗后患儿血清中IL-6和TNF-α水平明显高于对照组(P<0.01),见表3。
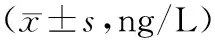
表3 2组血清中IL-6和TNF-α水平比较
注:a为与本组治疗前比较,P<0.01;b为与对照组治疗后比较,P<0.01。
3 讨论
随着儿童ALL治疗方案的不断改进,其5年生存率已达到了80%以上,然而一些高危病例或特殊亚型尚无有效治疗手段,且常规化疗副反应所致合并症对儿童的康复存在较大威胁[7]。PEG-ASP为新型门冬酰胺酶制剂的一种,具有门冬酰胺酶的生物活性和更长的半衰期,一次用药可替代左旋门冬酰胺酶的的多次用药,且PEG-Asp免疫原性降低,过敏反应显著降低,其对儿童ALL的治疗作用已得到学者较为一致的肯定[8]。国内随机对照研究证实采用含培门冬酶的VDPAP方案与含左旋门冬酰胺酶的VDLP方案治疗儿童ALL,其疗效、不良反应相似,但前者具有作用时间长和使用方便的优点[9]。本研究以含培门冬酶的VDPAP方案作为对照观察,其在缓解疾病、生存率及不良反应方面均有一定积极疗效。
近年临床表明,对儿童ALL应用中西医结合疗法可通过干扰蛋白合成、抗有丝分裂、诱导分化即诱导凋亡等途径发挥治疗作用[10]。正元胶囊是由淫羊藿、生晒参、女贞子、龟粉、炙黄芪、鳖粉、炒白术、陈皮组成,具有益气健脾、补肾填精之功效,常用于肿瘤放、化疗之辅助用药,与化疗合用有助于提高化疗效果,提高NK细胞活性和免疫功能等[11]。
本研究应用正元胶囊辅助培门冬酶联合化疗对儿童ALL发挥了良好治疗效果。本组资料显示,观察组患儿的近期总缓解率为84.44%,显著高于对照组64.44%(P<0.05)。对照组6个月和1年无事件生存率分别为95.56%和86.67%,观察组为97.78%和93.33%,2组无事件生存率差异均无统计学意义(P>0.05)。观察组患儿的肝功能损害、骨髓抑制、低白蛋白血症、口腔溃疡、胃肠道反应及凝血功能异常的发生率均少于对照组,但2组间比较无显著性差异(P>0.05)。因此,正元胶囊辅助培门冬酶联合化疗治疗儿童ALL发挥了增效减毒的效果。
IL-6能促进活化B淋巴细胞的分化成熟,与白血病、淋巴瘤等联系密切[10]。研究发现,急性ALL患者的T22细胞数量明显减少,而急性ALL患者体内的IL-6含量降低会抑制其体内的T22细胞的分化发育,与急性ALL病程呈明显负相关[12-13]。TNF-α能增强细胞毒性淋巴细胞的抗肿瘤效应,与急性ALL密切相关,文献报道称TNF-α基因多态性通过影响患者体内的细胞因子水平,从而影响急性ALL的发生、发展[14-15]。本组资料显示,与对照组比较,正元胶囊辅助培门冬酶治疗可进一步提高儿童ALL血清中IL-6和TNF-α水平,提示了其可能作用机制之一。
综上,正元胶囊辅助辅助培门冬酶治疗儿童ALL可显著提高疾病的缓解率,减少不良反应发生,其作用机制可能与上调IL-6和TNF-α有关。由于本研究纳入的样本量较小,确切作用和相关机制仍需更多试验验证。
[1] 苏 萌,叶启东.白血病靶点治疗的研究进展〔J〕.国际儿科学杂志,2014,41(3):270-273.
[2] 韩争争,郭秀彬,袁 平,等.培门冬酶联合化疗治疗儿童急性淋巴细胞白血病疗效观察〔J〕.遵义医学院学报,2015,38(5):506-508.
[3] 王谷云,姚红霞,林丽娥.不同剂量甲氨蝶呤治疗儿童急性淋巴细胞白血病的安全性观察〔J〕.中国生化药物杂志,2014,34(1):102-103.
[4] 程道海,陆 华,黄振光,等.联合用药对大剂量甲氨蝶呤化疗治疗儿童急性淋巴细胞白血病肾毒性及血药浓度的影响〔J〕.肿瘤防治研究,2015,42(11):1148-1151.
[5] 颜培花,严 媚,王学梅,等.黄芪注射液对儿童急性淋巴细胞白血病近期预后的影响〔J〕.中国当代儿科杂志,2014,16(2):141-146.
[6] 中华医学会儿科学分会血液学组,《中华儿科杂志》编辑委员会.儿童急性淋巴细胞白血病诊疗建议(第四次修订)〔J〕.中华儿科杂志,2014,52(9):641-644.
[7] 王慧慧,文飞球.儿童急性淋巴细胞白血病治疗进展〔J〕.中国实用儿科杂志,2012,27(10):791-794.
[8] 中国临床肿瘤学会(CSCO).培门冬酶治疗急性淋巴细胞白血病和恶性淋巴瘤中国专家共识〔J〕.中国肿瘤临床,2015,42(24):1149-1158.
[9] 培门冬酶Ⅱ期临床试验协作组.培门冬酶与左旋门冬酰胺酶治疗儿童急性淋巴细胞白血病的随机对照研究〔J〕.中华血液学杂志,2008,29(1):29-33.
[10] 程 志,吴 艺.中西医结合治疗儿童急性淋巴细胞白血病25例〔J〕.四川中医,2004,22(11):68-69.
[11] 任亚东,施 猛,孙秋艳,等.HPLC法测定正元胶囊中淫羊藿苷的含量〔J〕.亚太传统医药,2014,10(11):16-18.
[12] 刘立民,张兴霞,张彦明,等.急性髓系白血病患者外周血T22细胞水平的变化〔J〕.中华血液学杂志,2012,33(2):133-135.
[13] 刘立民,张兴霞,赵广圣,等.急性淋巴细胞白血病患者外周血T22细胞水平的变化及意义〔J〕.中华血液学杂志,2012,33(12):985-988.
[14] 鞠秀丽,孙念政,刘继玲,等.儿童急性淋巴细胞白血病患者T淋巴细胞免疫功能的研究〔J〕.临床血液学杂志,2004,17(2):84-86.
[15] 赵洪云,陈运贤,林旭滨,等.肿瘤坏死因子基因多态性与急性淋巴细胞白血病的相关研究〔J〕.癌症,2003,22(8):861-866.
(编辑:甘 艳)
Clinical Analysis of Zhengyuan Capsule Combined with Polyethylene Glycolconjugated Asparaginase for Children with Acute Lymphoblastic Leukemia
DONGLin,WANGLi,XUYi,etal.
HuanggangCenterHospital,Huanggang,438000
Objective To investigate the efficacy of Zhengyuan capsule combined with polyethylene glycolconjugated asparaginase for children with acute lymphoblastic leukemia(ALL),and its influence on serum levels of interleukin(IL)-6 and tumor necrosis factor(TNF)-α.Methods 90 cases of children with ALL were randomly divided into the control group and the observation group,with 45 cases in each group.The control group was given with PEG-Asp containing VDPAP regimen.Based on the control group,the observation group received Zhengyuan capsule during catabasis,4 grains/time,tid,for 8 weeks.Recent efficacy,6-month and 1-year survival rates after treatment,and adverse reactions were compared in both groups.Serum levels of IL-6 and TNF-α were detected in both groups.Results Total remission rate of the observation group was 84.44%,which was remarkably higher than that of the control group,64.44%(P<0.05).6-month and 1-year survival rates were 95.56% and 86.67%,respectively,which were not obviously lower than the control group 97.78% and 93.33%(P>0.05).Liver function injury,bone marrow suppression,hypoalbuminemia,oral mucosal lesions,gastrointestinal reactions,and coagulation disorders in the observation group were less than those of the control group,but there had no statistically significant between the 2 groups(P>0.05).Serum levels of IL-6 and TNF-α in the observation group were remarkably higher than the control group (P<0.01).Conclusion Zhengyuan capsule combined with polyethylene glycolconjugated asparaginase for children with acute lymphoblastic leukemia(ALL) is effective,which is related to increasing serum levels of IL-6 and TNF-α.
Zhengyuan capsuler;Olyethylene glycolconjugated asparaginase;Childhood;Acute lymphoblastic leukemia(ALL)
438000 湖北省黄冈市中心医院(董 琳);430000 湖北省妇幼保健院(王 丽);430023 湖北省襄阳市中心医院(许 诣,沈文婷)
沈文婷
10.3969/j.issn.1001-5930.2017.06.032
R733.71
A
1001-5930(2017)06-0978-04
2017-01-09
2017-04-10)

