改良FOLFOX6化疗方案联合奥曲肽对于改善晚期肝癌患者临床症状及生活质量的效果分析
赵善琳 韦 燕 曾俊韶 卢小玲
改良FOLFOX6化疗方案联合奥曲肽对于改善晚期肝癌患者临床症状及生活质量的效果分析
赵善琳 韦 燕 曾俊韶 卢小玲
目的 探讨改良FOLFOX6化疗方案联合奥曲肽对于改善晚期肝癌患者临床症状及生活质量的效果。方法 选择105例晚期原发性肝癌患者,按照随机数字法将患者分实验组与对照组。对照组患者采用改良FOLFOX6化疗方案治疗,实验组则在对照组的基础上加用奥曲肽注射液进行治疗。比较2组患者的临床疗效、生活质量提高率、临床症状改善率及毒副作用。结果 实验组肝癌患者治疗的总有效率为58.49%,显著高于对照组30.77%,2组差异具有统计学意义(P<0.05)。实验组患者的生活质量提高率为52.83%,明显优于对照组30.77%,2组差异具有统计学意义(P<0.05)。2组患者经相应的治疗后临床症状均有不同程度上的改善,实验组在腹腔积液、腹胀、疲乏及肝痛症状改善有效率上明显优于对照组,比较差异均具有统计学意义(P<0.05);而食减改善有效率比较差异无统计学意义。实验组白细胞和血小板减少程度均显著优于对照组,比较差异均具有统计学意义(P<0.05)。结论 改良FOLFOX6化疗方案联合奥曲肽对于晚期肝癌患者具有较高的临床疗效,能较好地改善患者的临床症状,提高生活质量,且安全性高,不良反应较少。
改良FOLFOX6化疗方案;奥曲肽;晚期肝癌患者;临床症状;生活质量
(ThePracticalJournalofCancer,2017,32:946~949)
原发性肝癌为临床常见的消化系统恶性肿瘤,全球每年都会有20~30万的新增病例,在恶性肿瘤的死亡率中位居第二[1]。传统的FOLFOX4化疗方案对于晚期的肝癌患者有一定的效果,但存在较多的不良反应,而改良FOLFOX6化疗方案减轻了不良反应,但仍达不到理想目标。有研究指出,改良FOLFOX6化疗方案联合奥曲肽对于治疗晚期肝癌患者可取得理想效果[2]。为探讨改良FOLFOX6化疗方案联合奥曲肽对于改善晚期肝癌患者临床症状及生活质量的效果,本次研究选择105例晚期原发性肝癌患者作为研究对象,取得了较好效果,现报告如下。
1 资料与方法
1.1 临床资料
选择2010年1月至2016年1月在我院接受治疗的105例原发性晚期肝癌患者,均经病理学检查确诊或临床诊断为晚期原发性肝癌,且预计生存期均在3个月以上。按照随机数字法将患者分实验组与对照组,实验组53例,对照组52例。实验组男性31例,女性22例;年龄38~75岁,平均年龄(55.31±11.26)岁;KPS评分60~80分,平均(68.97±5.92)分。对照组男性29例,女性23例;年龄37~72岁,平均年龄(54.63±11.86)岁;KPS评分60~80分,平均(68.16±6.12)分。2组患者在性别、年龄、KPS评分等一般临床资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 纳入、排除标准
纳入标准:(1)病理检查确诊为原发性肝癌;或经慢性肝病背景,影像学检查结果以及血清AFP水平三大因素临床诊断为原发性肝癌:①具有肝硬化以及HBV和/或HCV感染(HBV和/或HCV抗原阳性)的证据;②典型的HCC影像学特征;③血清AFP≥400 μg/L持续1个月或≥200 μg/L持续2个月;(2)肿瘤分期为Ⅲ期以上;(3)KPS评分≥60分;(4)无化疗禁忌证;(5)预计生存时间>3 个月;(6)患方知情同意用药方案,自愿参与实验,实验内容符合伦理学要求。排除标准:(1)排除其他恶性肿瘤转移;(2)排除合并凝血障碍、感染、肾衰竭以及多器官功能衰竭者;(3)伴有精神障碍者。
1.3 方法
对照组采用单纯改良FOLFOX6化疗方案治疗,具体如下:奥沙利铂85 mg/m2·d,静脉滴注2 h,d1;亚叶酸钙400 mg/m2·d,静脉滴注2 h,d1;氟尿嘧啶400 mg/m2,静脉滴注,d1;5-FU 2 400 mg/m2·d,静脉滴注6 h。14天为1个周期,连续2个治疗周期为1个疗程。
实验组在对照组改良FOLFOX6化疗方案的基础上加用奥曲肽注射液进行治疗,将0.2 mg奥曲肽溶入到100 ml 5%葡萄糖溶液,静脉滴注,每天2次,1个治疗周期为2周,连续2个治疗周期为1个疗程。
1.4 疗效评定标准
肿瘤近期客观疗效参考实体肿瘤的疗效评价标准1.1版[3]:(1)完全缓解(CR):所有靶病灶动脉期强化消失;(2)部分缓解(PR):所有目标病灶的长径总和减少≥30%;(3)稳定(SD):变化介于 PR 和 PD 之间;(4)进展(PD):所有目标病灶的长径总和增加至少在 20%,并且长径总和增加的绝对值在5 mm以上;或者是出现新的病灶。
1.5 生活质量评定
根据KPS评定标准为指标[4]:患者接受治疗后KPS评分增加≥10分为提高;治疗后KPS评分增加或减少<10 分为稳定;治疗后KPS评分减少≥10 分为降低。
1.6 骨髓毒性评价
参照《抗癌药物毒性分级标准》[5]:①外周血白细胞分级:0 度:≥4.0×109/L;Ⅰ度:3.0×109/L至4.0×109/L;Ⅱ度:2.0×109/L至3.0×109/L;Ⅲ度:1.0×109/L至2.0×109/L;Ⅳ度:<1.0×109/L。②外周血血小板分级:0度:≥10.0×1012/L;Ⅰ度:7.5×1012/L至10.0×1012/L;Ⅱ度:5.0×1012/L至7.5×1012/L;Ⅲ度:2.5×1012/L至5.0×1012/L;Ⅳ度:<2.5×1012/L。
1.7 统计学处理
采用SPSS 18.0统计学软件对数据进行统计学分析。计数资料采用χ2检验,计量资料采用t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 2组晚期肝癌患者近期疗效比较
实验组肝癌患者治疗的总有效率为58.49%,显著高于对照组30.77%,2组比较,差异具有统计学意义(P<0.05)。见表1。
2.2 2组肝癌患者生活质量比较
实验组患者的生活质量提高率为52.83%,明显优于对照组30.77%,2组比较,差异具有统计学意义(P<0.05)。见表2。
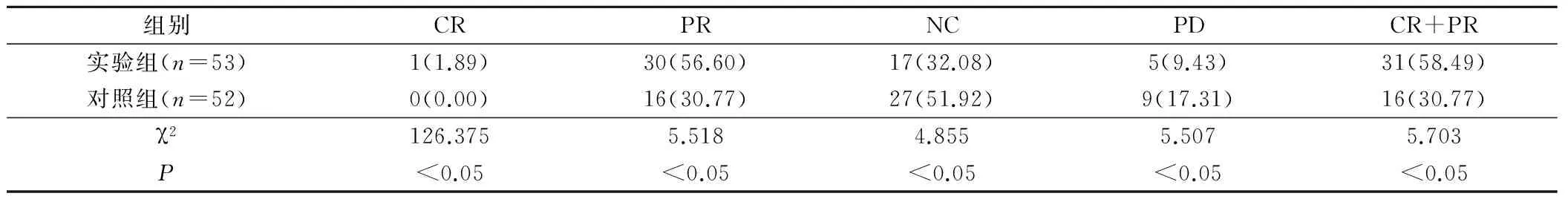
表1 2组中晚期肝癌患者近期疗效比较(例,%)
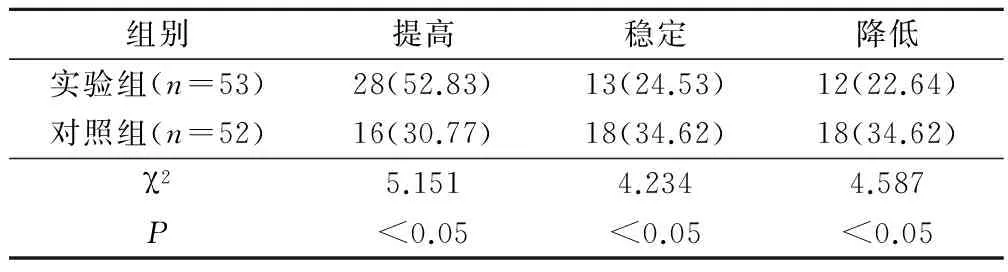
表2 2组肝癌患者生活质量比较(例,%)
2.3 2组肝癌患者临床症状改善有效率比较
2组患者经相应的治疗后临床症状均有不同程度上的改善,实验组在腹腔积液、腹胀、疲乏及肝痛症状改善有效率上明显优于对照组,比较差异均具有统计学意义(P<0.05);而食减改善有效率比较,差异无统计学意义。见表3。
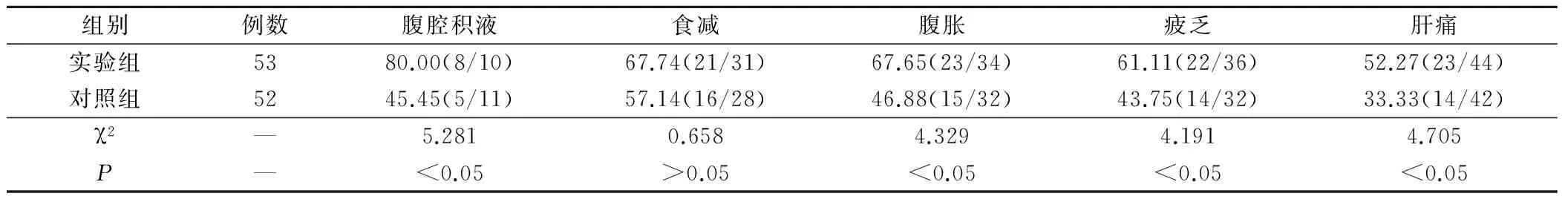
表3 2组肝癌患者临床症状改善有效率比较/%
2.4 2组患者不良反应
实验组白细胞和血小板减少程度均显著优于对照组,比较差异均具有统计学意义(P<0.05)。见表4。

表4 2组患者白细胞和血小板减少程度比较/例
3 讨论
原发性肝癌为消化系统比较常见的恶性肿瘤,由于早期漏诊率较高,而在临床确诊时多为晚期,失去了根治性手术治疗的机会,系统性化疗就成为了治疗的首选方案[6-7]。目前针对肝癌患者有多种化疗方案,缺乏相关统一的化疗方案标准。EACH研究[8]结果显示:由奥沙利铂、亚叶酸钙、氟尿嘧啶组成的FOLFOX4方案在有效率、无进展生存期方面均明显优于单药多柔比星,并有延长总生存期的趋势。因此,FOLFOX4方案被国家卫生部颁发的《原发性肝癌诊疗规范(2011年版)》收录,推荐用于治疗晚期HCC。但由于FOLFOX4方案静脉炎发生率较高,而其同源的FOLFOX6方案神经毒性发生率较高,导致某些患者不能耐受甚至终止化疗。近年来NCCN指南已不建议使用上述方案,改良FOLFOX6化疗方案减少了FOLFOX4方案中的氟尿嘧啶静推次数,降低静脉炎发生率,而同时又把FOLFOX6方案的奥沙利铂用量降低到FOLFOX4方案的剂量,从而减轻神经毒性,在治疗消化道恶性肿瘤方面得到了广泛应用,而临床缓解率、总生存率等与FOLFOX4、FOLFOX6相比无明显差异,较多柔比星而言更具有优势。虽然改良FOLFOX6在中晚期肝癌中的应用较其他化疗方案优势明显,但也具有一定的不良反应。有研究指出,奥曲肽联合改良FOLFOX化疗方案可协同抵抗恶性肿瘤,既能延长肝癌患者的生存周期,又能很好地提高肝癌患者的生活质量,并且不良反应较少[9-10]。
奥曲肽为人工合成的天然生长抑素衍生物,在胰腺炎、上消化道出血等的治疗领域中得到了广泛应用,疗效显著。在治疗恶性肿瘤方面,奥曲肽作用机制为抑制肿瘤细胞的增殖及诱导细胞凋亡而发挥抗肿瘤的效果[11-12]。在肝癌的治疗中,奥曲肽能够诱导人肝癌细胞分泌胰岛素样生长因子结合蛋白-1(IGFBP-1),胰岛素样生长因子(IGF-1)能够促进癌细胞的生长增殖,IGFBP-1与IGF-1结合致使IGF-1水平降低,从而发挥抑制肝癌细胞的生长增殖;还能通过肝癌细胞表面SSTR的介导发挥抑制肿瘤细胞的增殖[13-15]。奥曲肽可抑制N-亚硝基吗啉对肝癌细胞的诱导作用,能够缩小、减少癌结节;其能够抑制促肿瘤生长因子、激素的生成,发挥对机体免疫功能的调节作用,抑制肿瘤血管的生成。奥曲肽还可诱导肝癌细胞的凋亡,提高抑癌基因 p53 的表达[16-18]。
在本次研究中,实验组肝癌患者治疗的总有效率为58.49%,显著高于对照组的30.77%,2组比较差异具有统计学意义(P<0.05)。实验组患者的生活质量提高率为52.83%,明显优于对照组30.77%的生活质量提高率,2组比较有显著性差异(P<0.05),与临床研究一致[19-20]。2组患者经相应的治疗后临床症状均有不同程度上的改善,实验组在腹腔积液、腹胀、疲乏及肝痛症状改善有效率上明显优于对照组,比较差异均具有统计学意义(P<0.05),而食减改善有效率比较差异无统计学意义。实验组白细胞和血小板减少程度均显著优于对照组,比较差异均具有统计学意义(P<0.05),与临床研究相一致[21-22]。
综上所述,改良FOLFOX6化疗方案联合奥曲肽对于晚期原发性肝癌患者具有较高的临床疗效,能较好地改善患者的临床症状及提高生活质量,且安全性高,不良反应较少,值得在临床推广。但因本研究为单中心、小样本研究,需多中心、随机对照的大型Ⅲ期临床研究进一步研究证实。
[1] 陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡〔J〕.中国肿瘤,2014,23(1):1-10.
[2] 但汉雷,李恕军,郭文俊,等.中晚期肝癌多学科综合介入治疗的临床研究〔J〕.总装备部医学学报,2012,14(2):73-76.
[3] Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)〔J〕.Eur J Cancer,2009,45(2):228-247.
[4] 柏 和.基层医生肿瘤诊治手册〔M〕.北京:北京大学医学出版社,2008:356.
[5] 周际昌.实用肿瘤内科学〔M〕.第2版.北京:人民卫生出版社,1999:29.
[6] 陈乃杰,吴丹红,赖义勤,等.消癌平联合化疗治疗中晚期肝癌的临床分析〔J〕.光明中医,2009:24(6):1111-1112.
[7] 张海鸽.改良FOLFOX方案联合奥曲肽治疗晚期肝癌的疗效及安全性〔J〕.中国现代药物应用,2016,10(3):178-179.
[8] Qin S,Bai Y,Lim HY,et al.Randomized,multicenter,ope- n-label study of oxaliplatin plus fluorouracil/leucovorin versus doxorubicin as palliative chemotherapy in patients with advanced hepatocellular carcinoma from Asia〔J〕.J Clin Oncol,2013,31(28):3501-3508.
[9] 张国云.改良FOLFOX方案联合奥曲肽治疗晚期肝癌的临床疗效及安全性评价〔J〕.中国临床药理学杂志,2015,31(8):606-608.
[10] 路 颖.改良FOLFOX方案联合奥曲肽治疗晚期肝癌的临床评价〔J〕.航空航天医学杂志,2016,27(3):331-333.
[11] 程化文.用奥曲肽注射液联合改良的FOLFOX化疗方案治疗中晚期原发性肝癌的效果分析〔J〕.当代医药论丛,2015,13(6):1-2.
[12] 滕丽莹,黄桂敏,黄秋环,等.舒适护理对肝癌介入术后生活质量的分析〔J〕.国际护理学杂志,2013,32(7):1472-1474.
[13] 万克艳,李 微,杨 铮,等.基于FACT-Hep量表的肝癌患者生活质量影响因素分析〔J〕.广东医学,2015,36(18):2889-2893.
[14] 刘玉莲,闻利红.护理干预对肝癌介入术后患者并发症及生活质量的影响〔J〕.安徽医药,2014,23(11):2205-2207.
[15] 朱建军,刘 英,赵 桐,等.EORTC QLQ-C30量表在肝癌患者生活质量评价中的应用〔J〕.河北医药,2014,36(24):3740-3742.
[16] 郑文娟,孙 雯,蒋贵兰,等.医院到家庭连续护理对肝癌患者化疗依从性和生活质量的影响〔J〕.中华现代护理杂志,2016,22(2):160-163.
[17] 苏颖颖,于惠玲.综合护理干预对肝癌介入治疗患者生活质量的影响〔J〕.中华现代护理杂志,2015,21(1):62-64.
[18] 李 玲,程 云,陈 莺,等.认知行为干预对肝癌患者负性情绪及生活质量的影响〔J〕.国际护理学杂志,2015,34(1):75-77.
[19] 康朔麟,饶智国,杨 波,等.康艾注射液对肝癌患者TACE术后生活质量的影响〔J〕.现代肿瘤医学,2015,23(1):92-94.
[20] 齐 越,秦 杰,柳 迪,等.肝癌介入治疗术后患者实施连续护理的效果〔J〕.中华现代护理杂志,2013,19(25):3088-3091.
[21] 丁文金,李飞平,龚光文,等.TACE 联合索拉菲尼与TACE 治疗巴塞罗那B 期肝癌的临床对比研究〔J〕.肿瘤药学,2015,5(3):230-234.
[22] 殷 英,温瑞娟,万丽红,等.肝癌患者TACE术后的抑郁与生活质量的调查及相关性分析〔J〕.临床医学工程,2014,21(8):1077-1078.
(编辑:甘 艳)
Effect of Modified FOLFOX6 Chemotherapy Regimen Combined with Octreotide in Improving Clinical Symptoms and Quality of Life of Patients with Advanced Hepatocellular Carcinoma
ZHAOShanlin,WEIYan,ZENGJunshao,etal.
GuigangPeople'sHospital,Guigang,537100
Objective To explore the effect of modified FOLFOX6 chemotherapy regimen combined with octreotide in improving clinical symptoms and quality of life of patients with advanced hepatocellular carcinoma.Methods 105 patients with advanced hepatocellular carcinoma were randomly divided into the experimental group and the control group,the control group were treated with modified treatment,the experimental group on the basis of the control group received octreotide injection,clinical efficacy,quality of life improvement rates,improvement rates of clinical symptoms and side effects of the 2 groups were compared.Results The total effective rate of the experimental group was 58.49%,which was significantly higher than 30.77% of the control group,the difference was statistically significant(P<0.05).The quality of life of the experimental group was increased by 52.83%,which was significantly higher than 30.77% of the control group,the difference was statistically significant(P<0.05).Clinical symptoms of the 2 groups were improved after corresponding treatment.Ascites,bloating,fatigue,liver pain symptoms efficiency improvement rate of the experimental group was superior to the control group,the difference was statistically significant(P<0.05),while efficiency improvement rate of food minus of the 2 groups had no statistically significant difference.White cells and platelets reduction degree of the experimental group were significantly better than the control group,the difference was statistically significant(P<0.05).Conclusion Modified FOLFOX6 chemotherapy regimen with octreotide for advanced hepatocellular carcinoma have high clinical efficacy and safety,it can improve clinical symptoms and quality of life with less toxicity.
Modified FOLFOX6 chemotherapy;Octreotide;Advanced liver cancer patients;Clinical symptoms;Quality of life
537100 广西贵港市人民医院
10.3969/j.issn.1001-5930.2017.06.022
R735.7
A
1001-5930(2017)06-0946-04
2016-07-11
2016-12-08)

