替莫唑胺联合放疗治疗胶质瘤患者的生存情况分析
万志先 王雄伟 高 涢
替莫唑胺联合放疗治疗胶质瘤患者的生存情况分析
万志先 王雄伟 高 涢
目的 探讨分析替莫唑胺联合放疗治疗对胶质瘤患者生存情况的影响。方法 选取64例胶质瘤患者为研究对象,采用数字表法将其平均分成两组,对照组患者在术后行放疗,观察组患者在放疗基础上联合应替莫唑胺化疗,比较两组患者治疗后的生存情况及不良反应情况。结果 观察组临床疾病控制率(50.00%)明显高于对照组(25.00%),有统计学意义(P<0.05);观察组患者无进展生存时间为(11.24±3.09)个月和生存时间为(15.64±3.87)个月,较对照组患者的无进展生存时间[(6.09±1.97)个月]和生存时间[(8.71±2.56)个月]明显要长,有统计学意义(P<0.05);观察组患者白细胞下降、头皮溃疡、恶心呕吐、腹泻、血小板计数下降等不良反应发生率均低于对照组,均可自行缓解或对症用药后可控制。结论 胶质瘤患者术后采用替莫唑胺联合放疗治疗,与单纯的放疗相比较,能够有效控制肿瘤生长情况,延长患者无进展生存时间和总生存时间,治疗期间不良反应少,安全有效。
替莫唑胺;化疗;放疗;胶质瘤;生存情况
(ThePracticalJournalofCancer,2017,32:1024~1027)
胶质瘤属于颅内恶性肿瘤,且具有异质性,癌变细胞其形态、特征、生物学特性及免疫原性对放疗的敏感性不尽相同[1]。因此有些细胞可能对某种化疗药物敏感,加之放疗能引起肿瘤局部血管闭塞,影响药物渗入,因此在放疗基础上联合药物化疗对提高临床治疗效果,改善患者生存情况是十分必要的[2]。替莫唑胺作为一种新型口服的广谱抗肿瘤药,毒性低,在机体内能够广泛分布,对治疗胶质瘤有一定的临床意义[3]。为进一步探讨分析替莫唑胺联合放疗治疗对胶质瘤患者生存情况的影响,特选取64位术后确诊为胶质瘤的患者为研究对象,预后经长期随访后,分析后现报告如下。
1 资料与方法
1.1 一般资料
选取2012年1月至2014年1月在入住我院肿瘤内科的64例胶质瘤患者为研究对象,其中36例男性,28例女性,年龄27~79岁,平均年龄(47.17±12.49)岁。采用随机数字表法将其平均分成两组,每组32例。对照组中男性患者20例,女性患者12例,年龄27~77岁,平均年龄(47.02±13.38)岁,,病程3个月~6年,平均病程(2.68±0.75)年;观察组中男性患者16例,女性患者16例,年龄29~79岁,平均年龄(47.91±11.85)岁,病程4个月~7年,平均病程(2.95±0.99)年;两组患者一般资料方面无明显差异(P>0.05),可比性强。
纳入标准:①所有患者年龄均≥18岁,经病理及实验室检查确诊为胶质瘤;②生命体征平稳的患者,能理解、执行指令的患者;③血象转移无癌细胞的远处转移,患者无化疗放疗禁忌症;④经过本院医学伦理委员会的批准后正式实施,所有患者及其家属均对本次研究目的、检查方法知情同意,主动签署了知情同意书。排除标准:①心、肝功能严重障碍的患者;②妊娠期及哺乳期的女性患者;③不愿参加本研究者。
1.2 方法
对照组患者在治疗期间仅行放疗,具体方法如下:患者取仰卧位,采用热塑面膜保护面部,给予电子计算机断层扫描,扫描范围为患者头顶直到锁骨头下方2~3 cm处,层距保持在3 mm左右,并给予增强扫描检查。将扫描结束后的图像结果传导至三维计划系统给予重建,与核磁共振成像进行融合,并给予靶区勾画。根据患者的病情调整首程的放射治疗剂量,所有患者均使用6MVX线给予IMRT扫描,分割次数:每天1次,每周5天,每次分割剂量为1.78~2.41 Gy。pGTV总剂量为48.2~76.5 Gy。
观察组患者在放疗基础上联合应替莫唑胺化疗(生产厂家为江苏天士力帝益药业有限公司,国药准字H20040637),用药方式为口服,用药剂量每天75 mg/m2,进行4个周期的放疗后应用TMZ进行辅助化疗,用药剂量为每天150 mg/m2,连续5天,空腹口服,每28天1个周期,如无血象变化则增至每天200 mg/m2。治疗期间为减轻患者脑水肿,还需要给予地塞米松(生产厂家为广西万德药业股份有限公司,国药准字H20113234)等预处理,静脉注射化疗药物期间要进行心电监护,严密观察患者各项生命指标。治疗后每1~2个月进行临床检查,并行核磁共振(MRI)强扫描观察患者肿瘤生长情况。
1.3 观察指标
比较两组患者疾病控制率情况[4]:部分缓解(PR),胶质瘤无生长情况,肿瘤直径最大径之和减少比例至少4周维持在≥30%的标准;疾病稳定(SD):胶质瘤生长情况界于PR和PD之间;疾病进展(PD):胶质瘤大小有明显增长,肿瘤最大径之和增加20%以上,并伴有新的病灶产生。临床疾病控制率即为PR与SD之和。
对所有研究对象进行长期随访,随访时间为患者出院后到患者死亡或试验结束。比较两组患者的无进展生存时间和生存时间。肿瘤进展的评定标准为肿瘤直径超过放疗前的25%或新的肿瘤出现,肿瘤无明显生长及复发的时间间期即为患者的无进展生存时间。
比较两组患者在治疗期间白细胞下降,头皮溃疡,恶心呕吐,腹泻,血小板计数下降等不良反应发生情况。
1.4 统计学处理
2 结果
2.1 两组患者经过治疗后临床疾病控制率情况
观察组临床疾病控制率明显高于对照组,有统计学意义(χ2=4.2667,P=0.0389),见表1。

表1 两组患者经过治疗后临床疾病控制率情况比较(例,%)
2.2 两组患者的无进展生存时间和生存时间比较
经长期随访,观察组患者无进展生存时间和生存时间较长,与对照组相比有统计学意义(P<0.05),见表2。

表2 两组患者无进展生存时间和生存时间比较月)
2.3 两组不良反应发生情况比较
两组患者经过治疗,观察组患者白细胞下降、头皮溃疡、恶心呕吐、腹泻和血小板计数下降发生率低于对照组,但无统计学意义(P>0.05),见表3。
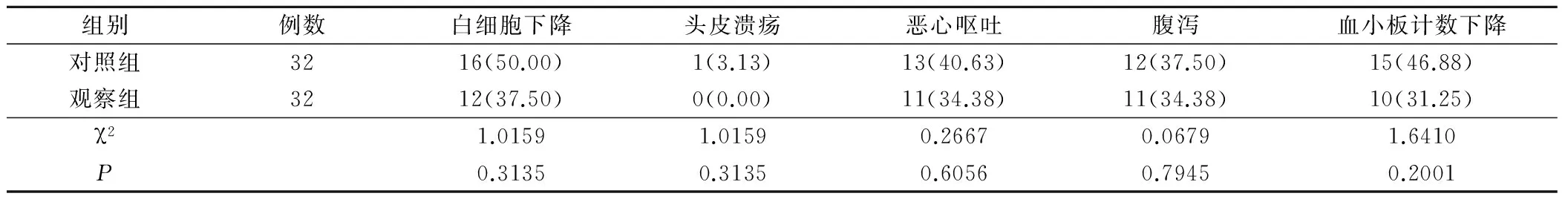
表3 两组患者经过治疗后不良反应的发生情况(例,%)
3 讨论
胶质瘤作为颅内常见且高发的恶性肿瘤,发病率占颅内原发性肿瘤的50%,是起源于神经胶质细胞,发生于神经外胚层的癌性病变[5]。美国脑肿瘤研究协作组统计胶质瘤,单纯手术的平均生存期为17周,手术联合放疗的平均生存期为37.5周,手术、放疗、化疗3种治疗方式联用后可延长生存期达51周,可见化疗对延长胶质瘤的生存期具有一定疗效[6-7]。本研究力求找到1种安全有效的化疗药物来配合手术与放射治疗,替莫唑胺作为1种新型口服的广谱抗肿瘤药,不良反应少,在机体内能够广泛分布,加快药物渗入病变组织的速度,对治疗胶质瘤有一定的临床意义。
本研究对两组患者实施不同治疗结果显示,采用替莫唑胺联合放疗可有效控制肿瘤病变的进展速度,与单纯应用放疗相比统计学上有意义(P<0.05)。单纯放射治疗可造成胶质瘤患者脑部组织结构改变,甚至会出现纤维化增生,进而导致患者再次接受放射治疗的敏感性降低[8-9];另外由于人体脑部解剖位置的特殊性,其周围毗邻很多重要的组织器官,多次放射治疗可能会加重恶性肿瘤周边正常组织器官的损伤,还能引起肿瘤局部血管闭塞,药物渗入受阻[10]。在放疗基础上,联合替莫唑胺进行化疗,能够增加肿瘤细胞对药物的敏感性,间接发挥抗肿瘤活性的作用[11]。替莫唑胺在生理PH条件下行非酶转化,结构发生变化生成咪唑-4-酰胺(MTIC)等,这些活性产物对肿瘤细胞DNA的甲基化起到一定影响作用,造成肿瘤细胞单链或双链的断裂,继而阻碍DNA的复制,使肿瘤细胞凋谢死亡[12-13]。在药代动力学方面,替莫唑胺也具有显著的优势,替莫唑胺结构上具有较长的碳链和亲脂基团,因此脂溶性良好,能够透过血脑屏障,1 h后血药浓度达峰值,经患者机体充分吸收后成为活性MTIC,活性MTIC经肝脏代谢分解的代谢产物也具有一定的细胞毒性,能够进一步对肿瘤细胞起到消灭的作用;因此在替莫唑胺联合放疗治疗后,肿瘤无明显生长及复发[14]。
可见,替莫唑胺具有良好的放疗增效性,为进一步观察患者预后生存情况良好与否,本研究对胶质瘤患者在出院后进行长期随访,随访时间为患者出院后到患者死亡或试验结束,结果显示观察组患者无进展生存时间和生存时间较对照组显要长,且生存情况更为良好,统计学上有意义(P<0.05)。替莫唑胺作为1种新型口服的广谱抗肿瘤药,毒性低,在机体内能够广泛分布,且增效性并非短期有效,而是长期耐受有效的,对延长患者生存时间意义重大[15]。治疗后有效保证了无进展生存时间和生存时间的延长,这在很大程度的增加了患者战胜病魔的信心,患者心态状态得到良好的调节。另外,研究结果显示[16],无论是单纯放疗,还是化疗与放疗相结合,在治疗后患者白细胞数量都会有不同程度的下降,头皮溃疡,恶心呕吐,腹泻,血小板计数下降等不良反应。替莫唑胺可引起骨髓抑制,继而引发白细胞和血小板数量的减少,多出现在2~3周。但长期随访结果看来,这类不良反应均会在停药两周后恢复;其他不良反应,如恶心呕吐、疲乏等,常为轻中度,可自行缓解或对症用药后可控制[17]。替莫唑胺用药后,患者不良反应具有预知性和可控性,这也在很大程度减少了患者对癌症治疗的恐惧。
综上所述,胶质瘤患者术后采用替莫唑胺联合放疗治疗,能够有效控制肿瘤生长情况,患者预后生存情况良好,与单纯的放疗相比较不良反应可控制。
[1] 董俊杰,舒 钧.骨质疏松性股骨粗隆间骨折的综合治疗进展〔J〕.中国骨质疏松杂志,2013,19(6):635,640.
[2] Black DM,Reid IR,Cauley JA,et al.The Effect of 6 versus 9 Years of Zoledronic Acid Treatment in Osteoporosis:A Randomized Second Extension to the HORIZON-Pivotal Fracture Trial(PFT)〔J〕.J Bone Miner Res,2015,30(5):934-944.
[3] 王 刚,李树东,吕雪松,等.PFNA解剖钢板与DHS治疗股骨粗隆间骨折合并老年骨质疏松症患者的疗效对比研究〔J〕.河北医学,2016,22(4):606-609.
[4] 李 伟,许永武.人工股骨头置换术与内固定治疗高龄骨质疏松股骨粗隆间骨折的比较〔J〕.实用临床医学,2013,14(1):57-59,108.
[5] 王宝鹏,李光磊,张 冰,等.两种方法治疗高龄股骨粗隆间骨折疗效比较〔J〕.中国矫形外科杂志,2015,23(8):701-704.
[6] Barwar N,Meena S,Aggarwal SK,et al.Dynamic hip screw with locking side plate:a viable treatment option for intertrochanteric fracture〔J〕.Chin J Traumatol,2014,17(2):88-92.
[7] 郑季南,方 钧,陈敏葵,等.人工髋关节置换术治疗老年股骨颈骨折〔J〕.中国骨与关节损伤杂志,2013,28(2):140-141.
[8] 范家强,付海涛,苑举辉,等.老年女性生物型髋关节置换术后抗骨质疏松治疗对假体稳定性的影响〔J〕.中国老年学杂志,2015,35(5):1214-1216.
[9] 陈维新.股骨近端抗螺旋髓内钉手术治疗老年不稳定型股骨粗隆间骨折的效果观察〔J〕.转化医学电子杂志,2015,2(1):47-49.
[10] Soucanye de Landevoisin E,Bertani A,Candoni P,et al.Proximal femoral nail antirotation(PFN-ATM)fixation of extra-capsular proximal femoral fractures in the elderly:retrospective study in 102 patients〔J〕.Orthop Traumatol Surg Res,2012,98(3):288-295.
[11] 徐忠龙,童培建,马镇川,等.GTR钢板+Ⅰ期人工股骨头置换治疗高龄不稳定型合并骨质疏松性股骨粗隆间骨折的临床观察〔J〕.浙江临床医学,2016,18(2):314-315.
[12] 梅盛前,肖 捷.老年骨质疏松合并股骨粗隆间骨折采用关节置换法治疗疗效及对骨密度的影响分析〔J〕.浙江创伤外科,2016,21(3):502-503.
[13] 吕 波,王 跃,朱建辛,等.人工关节置换治疗高龄重度骨质疏松性股骨粗隆间骨折的中期疗效随访〔J〕.中华关节外科杂志(电子版),2014,8(3):286-289.
[14] 王 雷,刘庆宽,张元民,等.全髋与半髋置换治疗老年股骨颈骨折的比较〔J〕.中国组织工程研究,2013,17(22):4013-4017.
[15] 刘成功,戚 超,张海宁,等.关节置换法与内固定法治疗老年骨质疏松合并股骨粗隆间骨折的临床对比分析〔J〕.现代生物医学进展,2016,16(4):741-743.
[16] 马 健,杨明贵,段 政,等.股骨近端锁定钢板、PFNA和人工髋关节置换术治疗老年股骨粗隆间骨折的疗效比较〔J〕.中国骨与关节损伤杂志,2013,28(8):762-763.
[17] Freistuhler M,Raschke M,Stange R.Arthroplasty for fractures of the femur near the hipjoint〔J〕.Z Orthop Unfall,2013,151(5):533-551.
(编辑:吴小红)
Survival Analysis of Temozolomide and Radiation Therapy for Glioma Patients
WANZhixian,WANGXiongwei,GAOYun.
TheFirstClinicalMedicalCollegeoftheThreeGorgesUniversity,Yichang,443003
Objective To investigate the effect of temozolomide combined with radiotherapy on the survival of glioma patients.Methods 64 cases of glioma patients were selected and equally divided into 2 groups by using the digital number method,the control group were given radiotherapy after surgery,and the observation group were treated with temozolomide chemotherapy and radiation therapy.The survival and adverse reactions between the 2 groups of patients after treatment were compared.Results Clinical disease control rate(50.00%) in the observation group was significantly higher than that of the control group(25.00%),the difference was statistically significant(P<0.05);the progression-free survival time(11.24±3.09) months and survival time(15.64±3.87) months in the observation group were obviously longer than those of the control group[progression-free survival time(6.09±1.97) months and survival time(8.71±2.56) months],the differences were statistically significant(P<0.05);the incidence of adverse reactions such as leukopenia,scalp ulcers,nausea,vomiting,diarrhea,and decreased platelet counts in the observation group were lower than those of the control group,all reactions can relieve itself or can be controlled by symptomatic treatment.Conclusion Postoperative temozolomide combined with radiotherapy is superior to radiotherapy alone,it can effectively control the tumor growth,prolong progression-free survival and overall survival time,induce less adverse reactions,and it is safe and effective.
Temozolomide;Chemotherapy;Radiotherapy;Glioma;Survival
443003 三峡大学第一临床医学院,湖北省宜昌市中心人民医院
王雄伟
10.3969/j.issn.1001-5930.2017.06.046
R739.41
A
1001-5930(2017)06-1024-04
2016-07-22
2017-04-20)

