miR-214在胃癌患者外周血中的表达及其临床意义
陈 琳 白义凤 罗树春
miR-214在胃癌患者外周血中的表达及其临床意义
陈 琳 白义凤 罗树春
目的 探讨miR-214在胃癌中的表达及临床意义。方法 采用实时荧光定量PCR法,检测40例胃癌患者癌组织及癌旁组织中miR-214的差异表达;同时检测血浆miR-214在56例胃癌患者及40例正常组织中的表达。结果 miR-214在胃癌组织中的表达水平明显高于癌旁组织;与正常组织比较,胃癌患者中的血浆miR-214表达明显增高;血浆miR-214表达与患者性别、年龄无关,与疾病分期及生存期密切相关,差异具有统计学意义(P<0.05);Cox回归分析发现疾病分期、miR-214的表达可作为独立的预后因子(P<0.05)。结论 循环miR-214表达与胃癌肿瘤分期和生存时间相关,检测循环miR-214可能作为评估胃癌患者临床预后的靶基因。
胃癌;实时荧光定量PCR;循环miR-214
(ThePracticalJournalofCancer,2017,32:894~899)
胃癌是最常见的消化系统恶性肿瘤,在恶性肿瘤死亡率中居第二位,我国是胃癌的高发区,胃癌确诊的患者约90%为进展期,五年生存率不足25%[1]。因此早发现、早诊断、早治疗仍然是包括胃癌在内的所有肿瘤诊治的关键[2]。MicroRNA是1种内源性的非编码RNA(ncRNA),由17~25个碱基组成的单链RNA分子,广泛存在于各种生物体中,在转录和转录后水平调控细胞生命活动。近年来的研究发现miRNA在很多肿瘤中异常表达,与肿瘤的形成、侵袭转移、分期预后、治疗反应、疗效预测等密切相关[3-4]。血浆里同样可以检测到miRNA,循环的miRNA来源于肿瘤组织,受内源性RNA酶的保护[5]具有较好的稳定性和特异性。可作为潜在的无创性诊断、治疗和预后评估的分子生物学标志物[6]。目前在淋巴瘤、前列腺癌、胃癌、结直肠癌患者血浆中检测到肿瘤相关的miRNA[7-9]。miR-214是miRNAs家族中的1个重要分子,在前期大量的研究表明miR-214在不同组织来源肿瘤中表达水平也各有不同,其表达水平与肿瘤的临床特征具有相关性,也可通过不同途径影响肿瘤的发生、进展以及药物治疗耐药性等多个方面[10]。研究发现,miR-214 在鼻咽癌[11],骨肉瘤[12],胶质瘤[13],膀胱癌[14-15]等肿瘤中表达升高。Yang等[16]发现,在353 例的临床胃癌 miRNA 表达谱中,let-7g 和 miR-433 的低表达与miR-214的高表达是胃癌浸润度、侵袭、淋巴结转移及分期的独立危险因素;Wang等[17]的研究发现miR-214,miR-221和miR-222 在胃癌间充质干细胞及胃癌组织中高表达,其表达与淋巴结转移、静脉血栓和TNM分期相关,以上研究结果高度提示 miR-214在胃癌浸润转移当中发挥重要的作用。然而关于血浆miR-214在胃癌患者血液标本中的表达及与临床预后的关系的研究目前国内外尚未见相关报道。
1 材料与方法
1.1 临床标本收集
56例胃癌患者血液标本为确诊胃癌后尚未行放化疗和手术治疗的标本,其中40例接受手术治疗,16例未行手术,标本取自2008年1月至2013年3月就诊于四川省人民医院肿瘤科、胃肠外科的患者,本研究经本院伦理委员会批准,所有患者均签署知情同意书。随访:56例患者出院后均随访,随访方式为电话随访和复查随访,随访内容包括一般情况、临床症状及影像学检查。随访起点为确诊日期,末次随访时间为2013年3月31日,至随访截止日,依然生存20例,死亡36例,无失访病例。
1.2 RNA的提取
血浆RNA提取:500 μL低温保存的血浆标本,置于冰上融化,且充分混匀。加入500 μL TRIzol,vortex 剧烈震荡30 s,室温静置5 min;加200 μL异丙醇,颠倒混匀,vortex 剧烈震荡2 min(至液体透明),室温静置5 min;4 ℃,离心半径6.9 cm,13 000 r/min离心15 min将上清液移至新eppendorf管;加500 μL三氯甲烷,颠倒混匀,vortex剧烈震荡1 min,室温静置5 min;4 ℃,离心半径6.9 cm,13 000 r/min离心15 min,将上清移至新的eppendorf 管;加0.75体积的异丙醇至上清中,颠倒混匀,室温静置10 min;4 ℃,离心半径6.9 cm,13 000 r/min离心10 min,沉淀RNA;吸弃上清,沉淀用体积分数75%乙醇洗1次;4 ℃,离心半径6.9 cm,7 500 r/min离心5 min,沉淀RNA;吸净乙醇,30 μLDEPC水溶解RNA。
组织RNA提取:收集胃癌癌组织及癌旁组织(约50~100 mg)在液氮中磨成粉末后,加入1 ml Trizol液研磨(样品总体积不超过所用Trizol体积的10%),分别移入去RNA酶的EP管中,提取总RNA。
1.3 实时荧光定量PCR分析miR-214的表达
将上述血浆及组织中提取的RNA进行逆转录和实时荧光定量PCR。逆转录反应程序为:16 ℃ 30 min,42 ℃ 30 min,85 ℃ 10 min。结束后立即将cDNA产物取出,快速置于冰上冷却,后续所有步骤均在冰上进行。将cDNA产物稀释3~4倍,然后混匀并从中吸取2 μl(20 μl体系)做为定量PCR的模板,剩余产物存放于-20 ℃。PCR反应在ABI7500实时定量PCR反应仪上进行,程序为(95 ℃3 min,);40 cycles×(95 ℃ 12 s,62 ℃ 1 min);95 ℃ 15 s 。反应结束后确认Real Time PCR的扩增曲线和融解曲线,进行PCR定量时制作标准曲线等。3次独立实验后得到的数据运用公式2-△△Ct的方法进行分析[18]。△△ct=(待测样品的目的基因的Ct的平均值-待测样本的看家基因的Ct的平均值)-(对照样品的目的基因的Ct的平均值一对照样本的看家基因的Ct的平均值)。
1.4 统计学方法
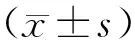
2 结果
2.1 临床病理特征
56例胃癌患者血液标本为确诊胃癌后尚未行放化疗和手术治疗的标本,其中40例接受手术治疗,16例未行手术,其中男性27例,女性29例;年龄30~82岁,中位年龄53岁,53岁以下患者25例,53岁以上患者31例;其中胃腺癌50例,平滑肌肉瘤1例、鳞癌2例、腺鳞癌2例、类癌1例。临床分期:Ⅰ期(T1N0M0-T1N1M0)患者15例,Ⅱ期(T1N2M0-T3N0M0)12例,Ⅲ期(T2N2M0-T4N0M0)13例,Ⅳ期(任何TN,M1)16例。56例患者中合并糖尿病者3例,合并其他心血管疾病者2例。40例胃癌组织标本及癌旁组织标本为胃癌术后活检组织,所有标本均为经病理学检查确诊的胃癌,全部病例获取前均未行化疗和放疗,临床资料完整。40例正常血液标本取自正常人体检血液标本,体检证实未患肿瘤及其他疾病(表1)。
2.2 miR-214 在胃癌患者血液及组织中的表达
采用QRT-PCR对40例胃癌组织标本中miR-214的表达进行检测,结果提示miR-214在胃癌患者癌组织中的表达较癌旁组织明显增高,差异具有统计学意义(图1A,P<0.001)。ROC曲线比较miR-214在胃癌组织和癌旁组织中的表达,曲线下面积(AUC)为0.707(95% CI=0.519~0.874,P=0.009,图1B及表2)。根据ROC曲线,将miR-214=0.674作为判定胃癌的阈值,根据这个阈值,预测其敏感度、特异度、真阳性率和假阴性率分别为65.8%(95% CI,53.2~75.3),88.3%(95% CI,77.1~99.9),100.0%(95% CI,83.5~99.6),43.5%(95% CI,25.5~65.2)。
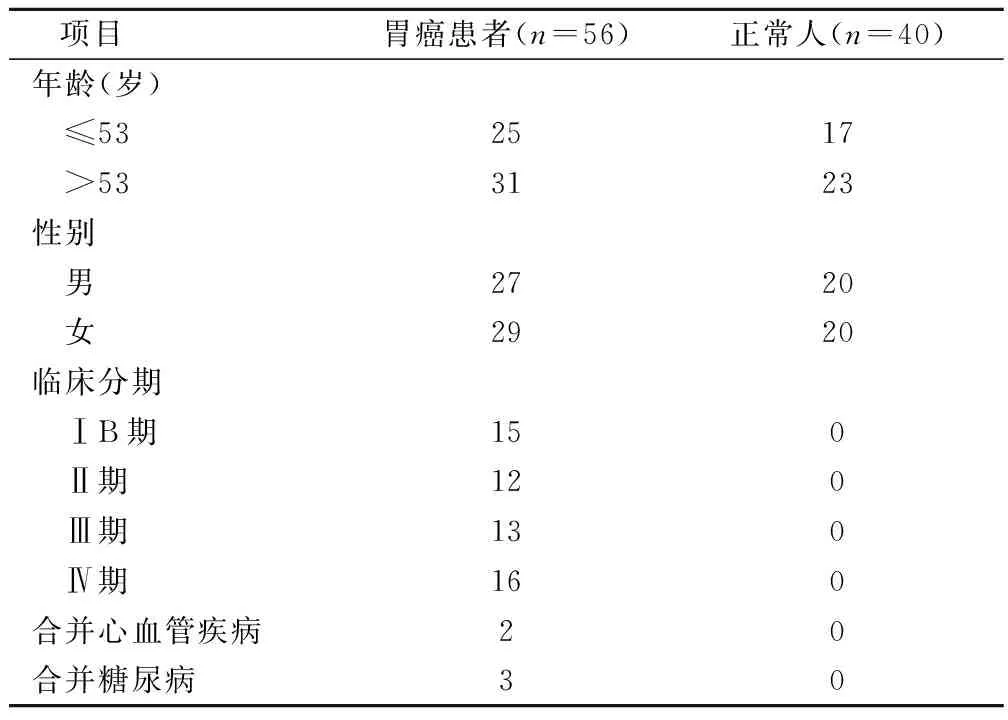
表1 胃癌患者及正常人的临床特征/例
同时,采用QRT-PCR对56例胃癌患者和40例正常人血浆中miR-214的表达进行检测,结果提示miR-214在56例胃癌患者血浆中其表达明显高于健康对照组,差异具有统计学意义(P<0.001,图2A,表2),ROC曲线图提示曲线下面积为0.820(95% CI =0.740~0.900,P<0.001,图2B)。miR-214=0.62作为判定胃癌的阈值,根据这个阈值,预测其敏感度、特异度、真阳性率和假阴性率分别为61.3%(95% CI,50.32~72.17),83.6%(95% CI,78.7~99.6),100.00%(95% CI,85.5~99.9),45.5%(95% CI,26.31~64.27)。
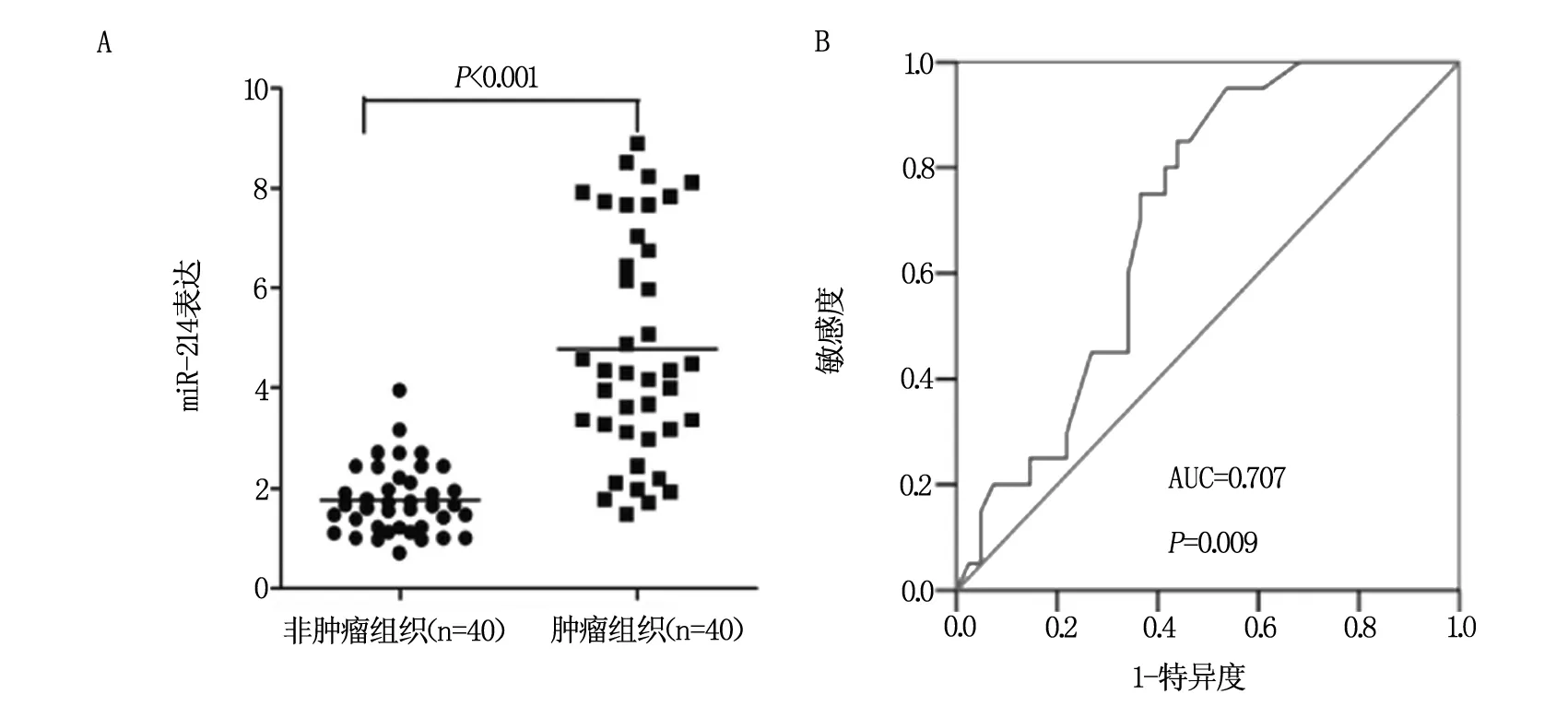
A为QRT-PCR检测m,B为ROC曲线分析。
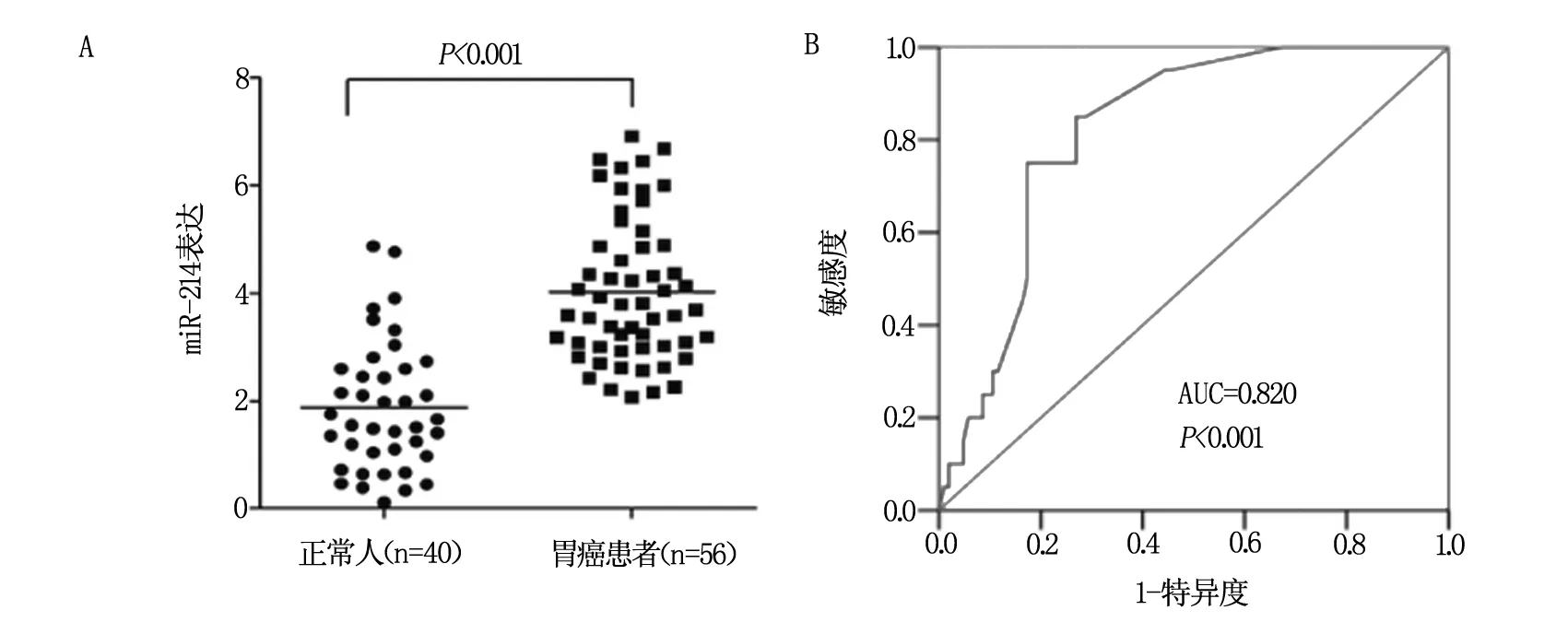
A为QRT-PCR检测;B为ROC曲线分析。
2.3 miR-214表达与胃癌临床病理特征的关系
分析循环miR-214的表达与胃癌患者年龄、性别、疾病分期的关系,结果发现,miR-214表达与患者性别、年龄无相关性,差异无统计学意义(表2)(P均大于0.05);与疾病分期密切相关,差异具有统计学意义(P均<0.001;表2)。
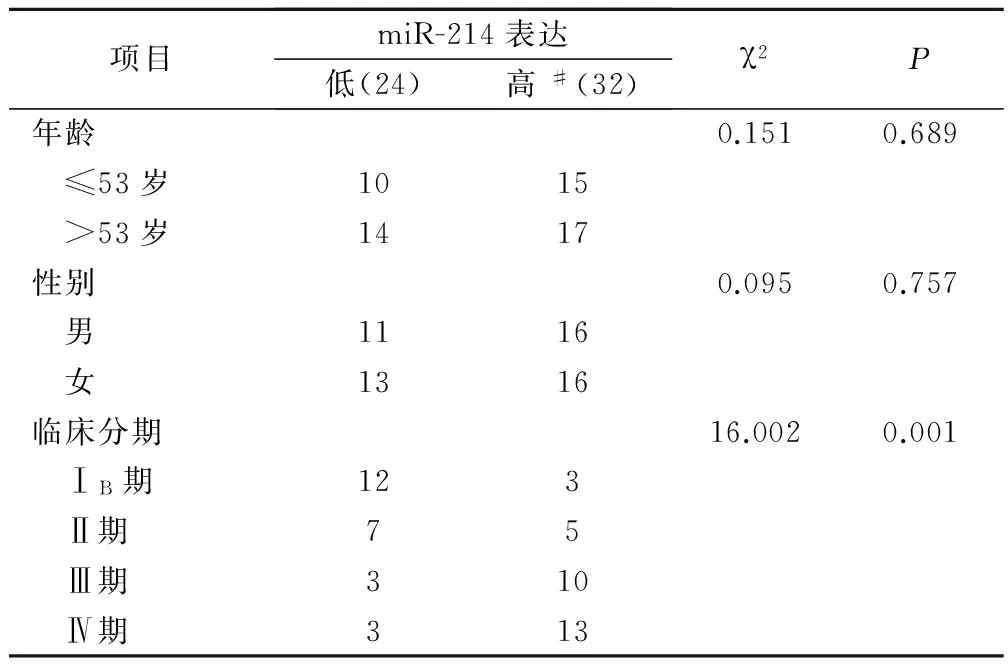
表2 miR-214表达与患者临床特征的关系/例
#以2-△△ct<1为miR-214低表达,2-△△ct>1为miR-214高表达[19]。
2.4 胃癌患者生存分析
采用Kaplan-Meier法估计患者生存时间,结果发现男性患者与女性患者的生存时间无统计学意义(χ2=12.525,P=0.830),不超过53岁的患者与53岁以上患者生存时间无统计学意义(χ2=7.049,P=0.902);miR-214低表达者的生存时间长于高表达者,差异具有统计学意义(χ2=17.774,P<0.001);患者的TNM分期越晚者生存时间越短,差异具有统计学意义(χ2=61.180,P<0.001)见图3A,B。
Cox回归分析患者的性别、年龄、疾病分期及miR-214表达与患者预后的关系,发现疾病分期和miR-214可作为独立的预后因子,TNM分期越晚的相对危险度为7.642,95%相对危险度的可信区间为(2.329~25.080),差异具有统计学意义(W=11.250,P=0.001);miR-214高表达的相对危险度为8.632,95%相对危险度的可信区间为(4.015~23.351),差异具有统计学意义(W=8.224,P=0.004)见表3。
3 讨论
我国胃癌具有发病率高、早期诊断率低、5年生存率低等特点。胃癌的早期诊断率仍徘徊在10%~20%,是导致其死亡率居高居不下的主要原因之一[2]。目前手术治疗是唯一经证实的可能会治愈胃癌的手段,但即便是已行胃癌根治术的患者,仍有大部分会出现复发或转移。术后的辅助放化疗对控制胃癌的复发或转移可能有效。化疗在晚期胃癌患者的综合性治疗中亦发挥重要作用,然而耐药一直以来是胃癌化疗遇到一个很大瓶颈[20-21]。由此得出,胃癌的早期诊断和及时有效的治疗是提高其5年生存率的关键,所以寻找敏感而特异性强的分子标志物、明确治疗的分子靶标以及正确的进行预后评估则是至关重要的任务。miRNA在不同种肿瘤中的差异表达及其与肿瘤的分类和诊断的相关性,提示其可能成为肿瘤预后检测的重要生物标志分子[8]。过去一直认为 miRNAs可能被细胞外大量存在的RNA酶所降解,初期研究主要针对细胞内miRNAs。2008 年,牛津大学 Lawrie 等[22]首次报道B 细胞淋巴瘤血清中miR-155,miR-210及miR-21 增高。随后大量实验证明miRNAs可以广泛而稳定地存在于细胞外液,包括血清、血浆、组织间液及各类体液中,统称为循环miRNAs(circulating miRNAs)[23]。迄今已报道在健康人血液循环中约含有1800多种miRNAs。循环miRNAs作为1种非创伤性检测标志物,是人类疾病诊断与防治新的研究靶标。有关循环miRNAs作为生物标志物的研究目前主要集中于肿瘤,约占总体研究报道的80%左右。Lawrie 等[22]首次报道B细胞淋巴瘤血清中miR-155、miR-210及miR-21增高,且血清miR-21水平高的患者无复发生存期更长。Wong 等[24]发现 miR-184 不仅高表达于舌鳞状细胞癌组织局部,也表达于外周血中,其水平在手术后显著降低。Mitchell 等[25]用基因芯片和测序技术直接测定前列腺癌患者与小鼠模型血浆中的miRNAs,证实血浆中miR-141可用于前列腺癌的鉴别诊断。Wu 等[26]报道乳腺癌 患者血清中 miR-21 和 miR-29 显著升高,可望成为乳腺癌的生物标志物。还有研究显示,血浆 miR-200c可能作为预测胃癌预后及生存时间的生物学标记物;miR-421 及miR-375作为诊断晚期胃癌的1个功能性标志物[27-28]。然而关于循环miR-214在胃癌血浆中的表达及其意义目前尚未见相关报道。我们采用QRT-PCR分别对40例胃癌患者癌组织及癌旁组织,56例胃癌病人和40例正常人血浆中miR-214的表达进行检测,发现胃癌病人组织标本中miR-214的相对表达水平明显高于癌旁组织;循环中miR-214的相对表达水平明显高于健康对照组。ROC曲线分析证实miR-214作为区分胃癌患者和正常对照的潜在分子标记。miR-214的表达与患者的性别、年龄无相关性,与患者的疾病分期及生存期密切相关。采用Kaplan-Meier法估计患者生存时间,患者的生存时间与性别、年龄无关,与疾病的分期及miR-214的表达相关。Cox回归分析发现疾病分期和miR-214可能作为独立的预后因子。我们的研究结果与Zhang等[29]在胰腺癌中发现miR-214在胰腺癌中是高表达的,并且miR-214可通过抑制靶基因ING4的表达从而降低胰腺癌细胞对吉西他滨化疗药物的敏感性。Yu等[30]的研究也表明miR-214可提高人舌鳞癌细胞株的化疗敏感性一致。本研究结果可能为基于miR-214判断胃癌预后的研究提供一定的理论基础和治疗靶点,然而影响胃癌预后的因素很多,miR-214是通过何种途径影响胃癌的发生、发展及其机制目前尚未完全阐明,值得进一步研究。
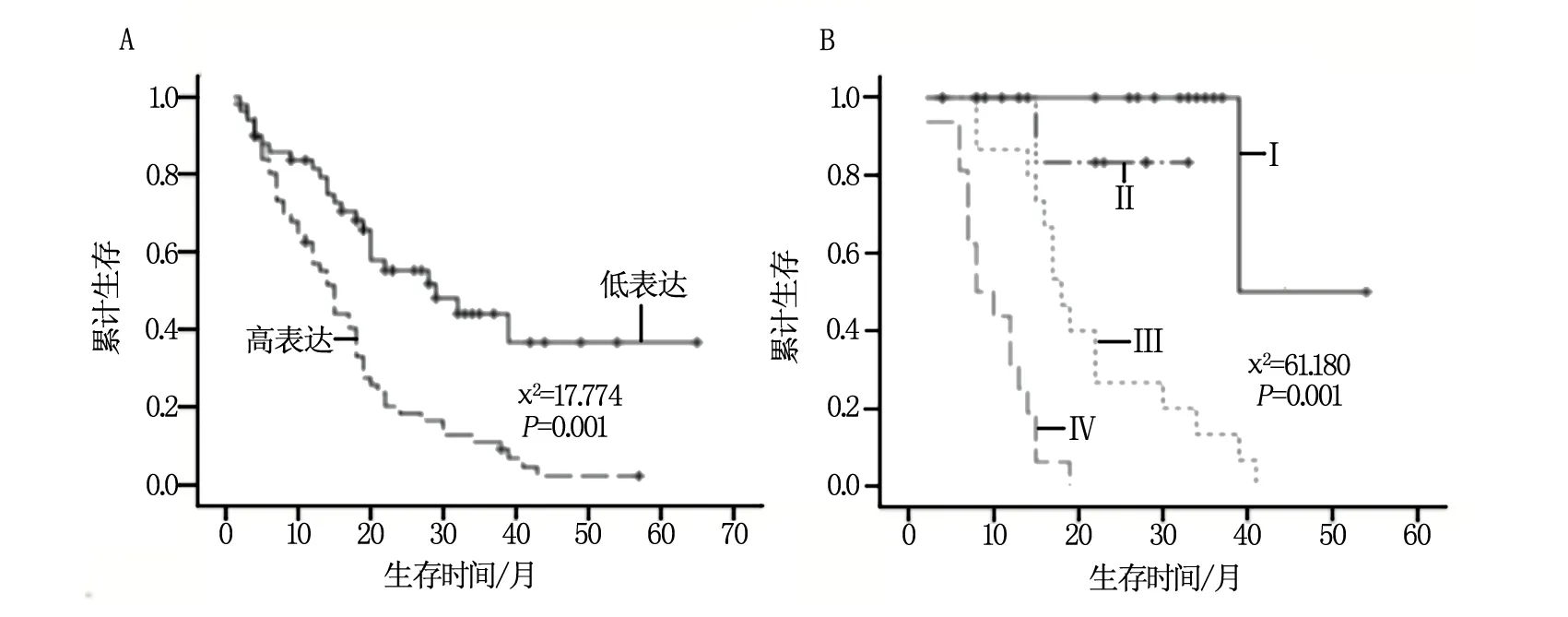
图3 miR-214表达及疾病分期与患者生存时间的关系
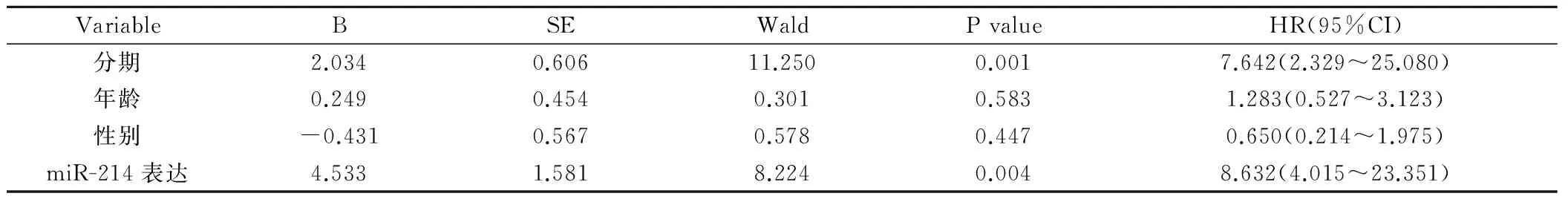
表3 Cox回归分析疾病分期和miR-214表达与胃癌预后的关系
[1] Ali Z,Deng Y,Ma C.Progress of research in gastric cancer〔J〕.J Nanosci Nanotechnol,2012,12(11):8241-8248.
[2] Pietrantonio,F,F De Braud,V Da Prat,et al.A review on biomarkers for prediction of treatment outcome in gastric cancer〔J〕.Anticancer Res,2013,33(4):1257-1266.
[3] Krell J,Frampton AE,Stebbing J.MicroRNAs in the cancer clinic〔J〕.Front Biosci(Elite Ed),2013,5:204-213.
[4] Chou J,Shahi P,Werb Z.microRNA-mediated regulation of the tumor microenvironment〔J〕.Cell Cycle,2013,12(20):3262-3271.
[5] Allegra A,Alonci A,Campo S,et al.Circulating microRN- As:new biomarkers in diagnosis,prognosis and treatment of cancer〔J〕.Int J Oncol,2012,41(6):1897-1912.
[6] Huang Z,Huang D,Ni S,et al.Plasma microRNAs are pro- mising novel biomarkers for early detection of colorectal cancer〔J〕.Int J Cancer,2009,4(1):89-95.
[7] Ilhan-Mutlu A,Wagner L,Preusser M.Circulating biomarkers of CNS tumors:an update〔J〕.Biomark Med,2013,7(2):267-285.
[8] Redova M,Sana J,Slaby O.Circulating miRNAs as new blood-based biomarkers for solid cancers〔J〕.Future Oncol,2013,9(3):387-402.
[9] Sita-Lumsden A,Dart DA,Waxman J,et al.Circulating microRNAs as potential new biomarkers for prostate cancer〔J〕.Br J Cancer,2013,108(10):1925-1930.
[10] Wang X,Chen J,Li F,et al.MiR-214 inhibits cell growth in hepatocellular carcinoma through suppression of beta-catenin〔J〕.Biochem Biophys Res Commun,2012,428(4):525-531.
[11] Zhang ZC,Li YY,Wang HY,et al.Knockdown of miR-214 promotes apoptosis and inhibits cell proliferation in nasopharyngeal carcinoma〔J〕.PLoS One,2014,9(1):e86149.
[12] Xu Z,Wang T.miR-214 promotes the proliferation and invasion of osteosarcoma cells through direct suppression of LZTS1〔J〕.Biochem Biophys Res Commun,2014,449(2):190-195.
[13] Wang S,Jiao B,Geng S,et al.Combined aberrant expression of microRNA-214 and UBC9 is an independent unfavorable prognostic factor for patients with gliomas〔J〕.Med Oncol,2014,31(1):767.
[14] Kim SM,Kang HW,Kim WT,et al.Cell-Free microRNA-214 From Urine as a Biomarker for Non-Muscle-Invasive Bladder Cancer〔J〕.Korean J Urol,2013,54(11):791-796.
[15] Srivastava A,Goldberger H,Dimtchev A,et al.MicroRNA profiling in prostate cancer--the diagnostic potential of urinary miR-205 and miR-214〔J〕.PLoS One,2013,8(10):e76994.
[16] Yang TS,Yang XH,Wang XD,et al.MiR-214 regulate gastric cancer cell proliferation,migration and invasion by targeting PTEN〔J〕.Cancer Cell Int,2013,13(1):68.
[17] Wang M,Zhao C,Shi H,et al.Deregulated microRNAs in gastric cancer tissue-derived mesenchymal stem cells:novel biomarkers and a mechanism for gastric cancer〔J〕.Br J Cancer,2014,110(5):1199-1210.
[18] Hu A,Huang JJ,Xu WH,et al.miR-21 and miR-375 microRNAs as candidate diagnostic biomarkers in squamous cell carcinoma of the larynx:association with patient survival〔J〕.Am J Transl Res,2014.6(5):604-613.
[19] Yang L,Hu H,Deng Y,et al.Role of SPHK1 regulates m- ulti-drug resistance of small cell lung cancer and its clinical significance〔J〕.Zhongguo Fei Ai Za Zhi,2014,17(11):769-777.
[20] Oba K,Paoletti X,Bang YJ,et al.Role of chemotherapy for advanced/recurrent gastric cancer:an individual-patient-data meta-analysis〔J〕.Eur J Cancer,2013,49(7):1565-1577.
[21] Taketa T,Sudo K,Wadhawa R,et al.Adjuvant therapy in gastric cancer:what is the optimal approach〔J〕.Curr Oncol Rep,2013,15(2):146-151.
[22] Lawrie CH,Gal S,Dunlop HM,et al.Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma〔J〕.Br J Haematol,2008,141(5):672-675.
[23] Tie Y,Liu B,Fu H,et al.Circulating miRNA and cancer diagnosis〔J〕.Sci China C Life Sci,2009,52(12):1117-1122.
[24] Wong TS,Liu XB,Wong BY,et al.Mature miR-184 as Potential Oncogenic microRNA of Squamous Cell Carcinoma of Tongue〔J〕.Clin Cancer Res,2008,14(9):2588-2592.
[25] Mitchell PS,Parkin RK,Kroh EM,et al.Circulating micro- RNAs as stable blood-based markers for cancer detection〔J〕.Proc Natl Acad Sci USA,2008,105(30):10513-10518.
[26] Wu Q,Lu Z,Li H,et al.Next-generation sequencing of microRNAs for breast cancer detection〔J〕.J Biomed Biotechnol,2011,2011(1110-7243):597145.
[27] Zhou H,Xiao B,Zhou F,et al.MiR-421 is a functional marker of circulating tumor cells in gastric cancer patients〔J〕.Biomarkers,2012,17(2):104-110.
[28] Zhang WH,Gui JH,Wang CZ,et al.The identification of miR-375 as a potential biomarker in distal gastric adenocarcinoma〔J〕.Oncol Res,2012,20(4):139-147.
[29] Zhang XJ,Ye H,Zeng CW,et al.Dysregulation of miR-15a and miR-214 in human pancreatic cancer〔J〕.J Hematol Oncol,2010,3(1):46.
[30] Yu ZW,Zhong LP,Ji T,et al.MicroRNAs contribute to the chemoresistance of cisplatin in tongue squamous cell carcinoma lines〔J〕.Oral Oncol,2010,46(4):317-322.
(编辑:吴小红)
Expression and Significance of miR-214 in Patients with Gastric Cancer
CHENLin,BAIYifeng,LUOShuchun.
SichuanProvincialPeople'sHospital,Sichuan,610000
Objective To analyze the expression of miR-214 in gastric cancer,and its clinical significance.Methods The expression of miR-214 were confirmed in primary gastric cancer tissues and para-carcinoma tissues by QRT-PCR;Meanwhile,the expression of plasma miR-214 were detected in 56 consecutive gastric cancer patients and 40 healthy volunteers and the clinical significance was evaluated.Results Expression of miR-214 was significantly higher in gastric cancer tissues than in para-carcinoma tissues;Plasma miR-214 concentrations were significantly higher in gastric cancer patients than that in normal people(P<0.05);The expression of plasma miR-214 were not associated with gender,and age(P>0.05),but significantly correlated with overall survival and clinical stage(P<0.001).Cox regression analysis found that plasma miR-214 expression and disease stage were independent prognostic factors for the gastric cancer patients.Conclusion Plasma miR-214 is related with clinical stage and survival of gastric cancer,it could be a useful biomarker for evaluation of prognosis of gastric cancer.
Gastric cancer;QRT-PCR;miR-214
610000 四川省人民医院
罗树春
10.3969/j.issn.1001-5930.2017.06.007
R735.2
A
1001-5930(2017)06-0894-06
2016-06-08
2017-04-10)

