水飞蓟宾对心肌缺血再灌注损伤大鼠心功能和氧化应激的影响
曹旭丹,任春梅,和田田,刘健
• 论著 •
水飞蓟宾对心肌缺血再灌注损伤大鼠心功能和氧化应激的影响
曹旭丹1,任春梅1,和田田2,刘健1
目的 研究水飞蓟宾(silibinin,SIL)对心肌缺血再灌注损伤大鼠的心功能和氧化应激的影响。 方法 将100只实验用SD大鼠随机分为假手术组,模型组和SIL低剂量[100 mg/(kg·d)]预处理组、中剂量[200 mg/(kg·d)]预处理组、高剂量[400 mg/(kg·d)]预处理组,每组各20只。SIL预处理组术前7 d开始灌胃给药。7 d后结扎大鼠冠状动脉30 min后再通建立心肌缺血再灌注损伤模型,再灌注时间为6 h。通过高分辨率超声影像系统检测舒张末期左室内径(LVIDd)和收缩末期左室内径(LVIDs)、短轴缩短率(FS)、射血分数(EF)及每搏输出量(SV);生化分析法测定血清中心肌酶含量;HE染色法观察心肌组织形态结构改变;比色法测定心肌组织中抗氧化酶活性和丙二醛(MDA)含量;Western blotting法测定心肌组织NF-κB蛋白表达;TUNEL染色法观察心肌细胞凋亡状况。 结果 与模型组比较,经SIL中、高剂量预处理能够明显降低急性心肌梗死大鼠LVIDd并显著提高FS、EF和SV;可显著降低血清中心肌酶(谷草转氨酶、肌酸磷酸激酶、乳酸脱氢酶)含量,提高心肌组织中抗氧化酶(超氧化物歧化酶、谷胱甘肽过氧化物酶、过氧化氢酶)活性并显著降低MDA含量;此外,还可显著降低NF-κB蛋白表达量,并且明显改善心肌细胞凋亡状况,显著降低凋亡指数(AI),差异均具有统计学意义(P <0.05~0.01)。 结论 SIL具有改善心肌缺血再灌注损伤大鼠心功能并抑制其氧化应激损伤的作用,表现出对急性心肌梗死具有一定的保护作用。
水飞蓟宾;心肌缺血再灌注;心功能;氧化应激
冠状动脉粥样硬化性心脏病(冠心病,CHD)是最为常见的心血管系统疾病,其中急性心肌梗死(AMI)是CHD的危急重症,致死率高居疾病谱第二位[1],且AMI发病率逐年上升。临床上采取溶栓、介入手术等及时恢复血流灌注的方法,能够挽救部分AMI患者的生命,但缺血再灌注损伤的存在严重影响患者预后,是临床上亟待解决的难题。水飞蓟宾(Silibinin,SIL)是一种具有抗氧化、抑制炎症反应、促进细胞再生等多种生物学作用的水飞蓟素[2-4],是菊科植物水飞蓟的主要活性成分之一。有研究发现,SIL能够通过抑制神经细胞凋亡、降低氧化应激损伤而对脑组织缺血再灌注损伤起到保护作用[5,6],但SIL是否能够抑制氧化应激反应及改善心功能而对心肌缺血再灌注损伤起到一定的保护作用尚未见文献报道。本实验通过建立心肌缺血再灌注损伤大鼠模型,研究SIL对心肌缺血再灌注损伤大鼠心功能和氧化应激的影响。
1 材料与方法
1.1 实验动物 8周龄SD大鼠(雄性,250~300 g,SPF级)购自河北省实验动物中心,许可证号:SCXK(冀)2013-1-003。
1.2 实验药物与试剂 水飞蓟宾胶囊(天津天士力制药股份有限公司,药品规格:35 mg/粒,批号:20150709);谷草转氨酶(AST)、肌酸磷酸激酶(CPK)、乳酸脱氢酶(LDH)试剂盒及HE、TUNEL染色试剂盒(北京博奥森生物技术有限公司,其批号分别为:150518、150324、150602、141225、150130);超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)试剂盒(南京建成生物工程研究所,批号为:20151613、20150109、20150526、20141218);TTC(美国Sigma公司,批号:M2128)。
1.3 主要仪器 小动物人工呼吸机(DW-2000型,上海恒勤仪器设备有限公司); 生物机能实验系统(BL-420S型,成都泰盟科技有限公司);石蜡切片机(RM-2135型,德国Leica公司);紫外-可见分光光度计(UV762型,上海楚定分析仪器有限公司);全自动生化分析仪(BS-200型,深圳迈瑞生物医疗电子股份有限公司);高分辨率超声影像系统(Vevo 770型,加拿大Visual Sonics公司)。
1.4 实验方法
1.4.1 模型的制备与分组 取100只实验用SD大鼠随机分为假手术组,模型组和SIL低剂量[100 mg/ (kg·d)]、中剂量[200 mg/(kg·d)]、高剂量[400 mg/(kg·d)]预处理组(n=20),SIL预处理组术前7 d开始灌胃给药。采用麻醉后分离并结扎冠状动脉,30 min后松开动脉夹恢复血流灌注的方法建立大鼠心肌缺血再灌注模型,实验过程中实施心电图监测:心电图示ST段抬高或T波高耸表示心肌缺血,松开动脉夹恢复血流灌注后抬高的ST段降低或高耸的T波恢复表示心肌再灌注成功。再灌注6 h后,取材并进行各项指标检测。1.4.2 超声检测 各组随机取6只大鼠,采用Vevo770高分辨率超声影像系统于取材前行超声检测,检测方法:于左侧胸骨旁取左室乳头肌水平短轴切面,测量舒张末期左室内径(LVIDd)、收缩末期左室内径(LVIDs)、短轴缩短率(FS)、射血分数(EF)及每搏输出量(SV),所有检测指标均取连续3个心动周期的平均值。
1.4.3 血清中心肌酶含量的测定 待超声检测完成后,实施麻醉、开腹经腹主动脉取血并于室温离心(1500 rpm,10 min)后取血清,通过生化分析仪测定血清中心肌酶含量。
1.4.4 心肌组织形态结构的观察 各组大鼠随机选取6只,取心脏组织并置于4%多聚甲醛溶液中进行固定(12 h),经常规脱水、石蜡包埋、切片和脱蜡水化处理后,进行HE染色,通过显微镜观察心肌组织形态结构的变化。
1.4.5 测定抗氧化酶活性和MDA含量 各组剩余8只大鼠取心脏组织,剪碎后加入适量冷裂解液进行研磨匀浆,经离心(3000 rpm, 10 min)后取上清液,采用比色法,通过紫外-可见分光光度计测定各组大鼠心肌组织中抗氧化酶(SOD、GSHPx、CAT)活性和MDA含量。
1.4.6 检测NF-κB蛋白表达 取1.4.5制备的心肌组织匀浆液,4℃低温12000 rpm离心10 min后取下层沉淀,通过BCA法测定蛋白浓度、沸水浴加热5 min行蛋白变性、上样(每孔上样量30 ug),经SDS-PAGE凝胶电泳后转PVDF膜、5%脱脂奶粉室温封闭2 h,一抗(NF-kB,β-actin)4℃孵育过夜后洗膜、二抗(1:100)室温孵育1 h后经ECL系统显影。以β-actin为内参,以条带灰度值测定NF-κB相对表达量。
1.4.7 心肌细胞凋亡状况的观察 经1.4.4制备的石蜡切片经脱蜡水化处理后,按照TUNEL说明进行操作,通过光学显微镜观察各组大鼠心肌细胞凋亡状况。计算凋亡指数(AI):每张染色切片分别在相同选取不重叠的6个视野,分别计数每个视野中的细胞总数和凋亡细胞数,各组取平均值后计算AI,AI(%)=(阳性细胞数/细胞总数)×100%。
1.5 统计学处理 运用SPSS 17.0进行数理统计分析,计量资料采用均值±标准差(±s)的方式表示,两组间均数比较采用LSD-t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠超声检测结果 与假手术组比较,模型组大鼠LVIDd、LVIDs显著升高(P<0.05),FS、EF、SV显著降低(P<0.01);而与模型组比较发现经SIL中、高剂量预处理能够降低心肌缺血再灌注损伤大鼠LVIDd并显著提高FS、EF和SV(P<0.05),经SIL高剂量预处理能够显著降低LVIDs(P<0.05)(表1)。
表1 各组大鼠超声检测结果(±s)
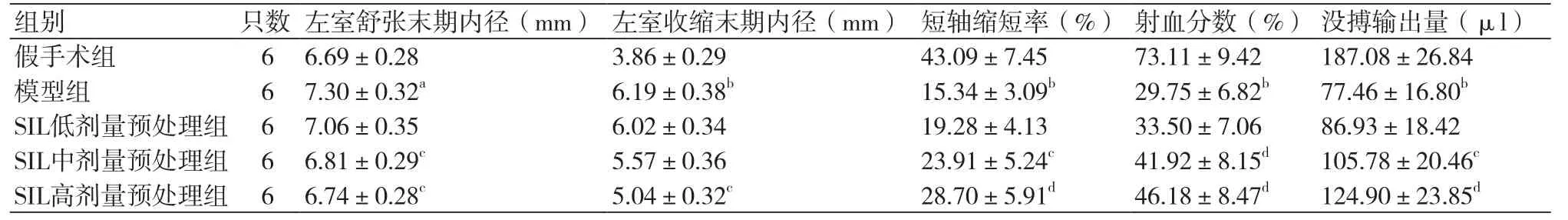
表1 各组大鼠超声检测结果(±s)
注:与假手术组比较,aP<0.05,bP<0.01;与模型组比较,cP<0.05,dP<0.01
组别 只数 左室舒张末期内径(mm) 左室收缩末期内径(mm) 短轴缩短率(%) 射血分数(%) 没搏输出量(μl)假手术组 6 6.69±0.28 3.86±0.29 43.09±7.45 73.11±9.42 187.08±26.84模型组 6 7.30±0.32a6.19±0.38b15.34±3.09b29.75±6.82b77.46±16.80bSIL低剂量预处理组 6 7.06±0.35 6.02±0.34 19.28±4.13 33.50±7.06 86.93±18.42 SIL中剂量预处理组 6 6.81±0.29c5.57±0.36 23.91±5.24c41.92±8.15d105.78±20.46cSIL高剂量预处理组 6 6.74±0.28c5.04±0.32c28.70±5.91d46.18±8.47d124.90±23.85d
2.2 各组大鼠血清心肌酶含量测定结果 与假手术组比较,模型组大鼠血清心肌酶(AST、CPK、LDH)含量显著升高(P<0.01);而与模型组比较发现经SIL中、高剂量预处理能够显著降低心肌缺血再灌注损伤大鼠血清中AST、CPK、LDH含量(P<0.05)(表2)。
2.3 各组大鼠心肌组织形态结构的观察结果 各组大鼠心肌组织形态结构如图1所示,与假手术组比较,模型组大鼠呈现心肌纤维紊乱:心肌细胞呈数量减少,空泡变性,胞核固缩、深染等病理性形态结构改变;而与模型组比较,SIL各预处理组大鼠心肌组织病变呈不同程度减轻,以SIL高剂量组治疗效果最为显著。
2.4 各组大鼠心肌组织中抗氧化酶活性和MDA含量测定结果 与假手术组比较,模型组大鼠抗氧化酶(SOD、GSH-Px、CAT)活性显著降低(P <0.01),MDA含量显著升高(P<0.01);与模型组比较发现经SIL中、高剂量预处理能够显著提高心肌缺血再灌注损伤大鼠心肌组织中SOD、CAT活性(P<0.05)并显著降低MDA含量(P <0.01)(表3)。
表2 各组大鼠血清中AST、CPK、LDH含量(±s)
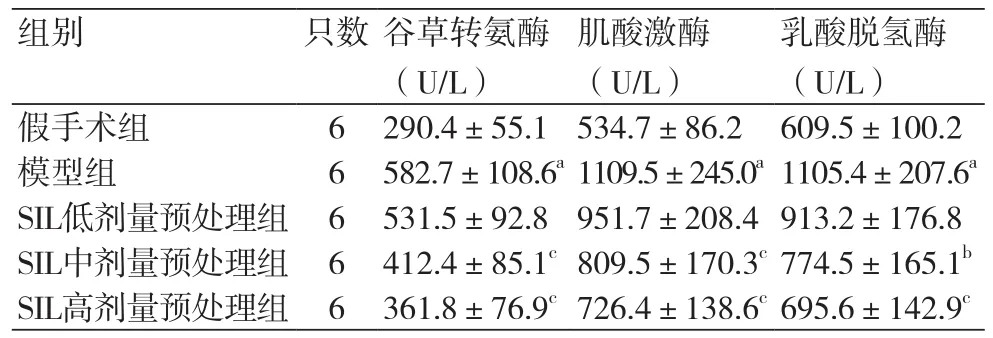
表2 各组大鼠血清中AST、CPK、LDH含量(±s)
注:AST:;CPK:;LDH:;与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP<0.01
乳酸脱氢酶(U/L)假手术组 6 290.4±55.1 534.7±86.2 609.5±100.2模型组 6 582.7±108.6a1109.5±245.0a1105.4±207.6aSIL低剂量预处理组 6 531.5±92.8 951.7±208.4 913.2±176.8 SIL中剂量预处理组 6 412.4±85.1c809.5±170.3c774.5±165.1bSIL高剂量预处理组 6 361.8±76.9c726.4±138.6c695.6±142.9c组别 只数谷草转氨酶(U/L)肌酸激酶(U/L)
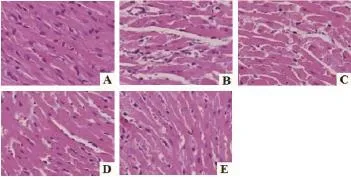
图1 各组大鼠心肌组织病理性形态结构改变(HE×400)(A:假手术组;B:模型组;C:低剂量预处理组;D:中剂量预处理组;E:高剂量预处理组)
2.5 各组大鼠心肌组织NF-κB蛋白表达检测结果如图2及表4所示,与假手术组比较,模型组大鼠NF-κB蛋白表达量显著升高(P<0.01);而与模型组比较发现经SIL中、高剂量预处理能够显著下调心肌缺血再灌注损伤大鼠心肌组织NF-κB蛋白表达(P<0.01)。
2.6 各组大鼠心肌细胞凋亡状况 如图3所示,与假手术组比较,模型组大鼠心肌细胞凋亡明显增多;而与模型组比较,SIL各预处理组大鼠心肌细胞凋亡数量呈不同程度显著减少,以SIL高剂量预处理组效果最为显著。计算AI并进行数据统计分析发现,与假手术组比较,模型组大鼠心肌组织AI显著升高(P<0.01);而与模型组比较,经SIL中、高剂量预处理能够显著降低心肌缺血再灌注损伤大鼠心肌组织AI值(P <0.01)。
3 讨论
表3 各组大鼠心肌组织抗氧化酶活性和MDA含量(±s)
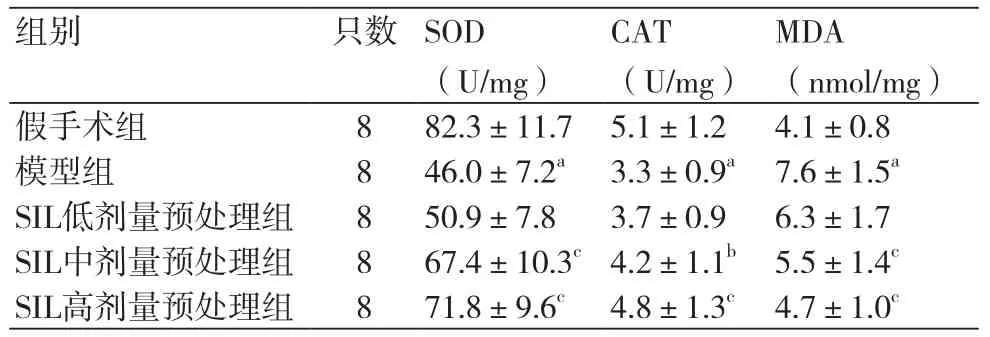
表3 各组大鼠心肌组织抗氧化酶活性和MDA含量(±s)
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP <0.01
MDA (nmol/mg)假手术组 8 82.3±11.7 5.1±1.2 4.1±0.8模型组 8 46.0±7.2a3.3±0.9a7.6±1.5aSIL低剂量预处理组 8 50.9±7.8 3.7±0.9 6.3±1.7 SIL中剂量预处理组 8 67.4±10.3c4.2±1.1b5.5±1.4cSIL高剂量预处理组 8 71.8±9.6c4.8±1.3c4.7±1.0c组别 只数SOD (U/mg)CAT (U/mg)

图2 各组大鼠心肌组织中NF-κB蛋白表达(Western blotting)(A:假手术组;B:模型组;C-SIL:低剂量预处理组;D-SIL:中剂量预处理组;E-SIL:高剂量预处理组)
表4 各组大鼠心肌组织NF-κB蛋白表达和凋亡指数(AI)(±s)
表4 各组大鼠心肌组织NF-κB蛋白表达和凋亡指数(AI)(±s)
注:与假手术组比较,aP<0.01;与模型组比较,bP<0.05,cP <0.01
组别 只数 NF-κB/β-actin AI(%)假手术组 6 0.11±0.04 3.4±1.1模型组 6 0.53±0.17a57.1±9.8aSIL低剂量预处理组 6 0.46±0.20 46.9±10.2 SIL中剂量预处理组 6 0.40±0.15b27.4±6.5cSIL高剂量预处理组 6 0.27±0.08c21.3±5.7c
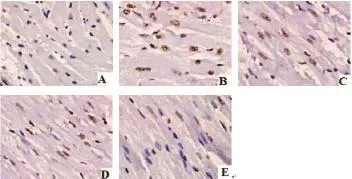
图3 各组大鼠心肌细胞凋亡状况(TUNEL×400)(A:假手术组;B:模型组;C:低剂量预处理组;D:中剂量预处理组;E:高剂量预处理组)
心肌缺血再灌注损伤发病机制非常复杂,既往研究发现心功能异常、氧化应激反应以及继发性心肌细胞凋亡是心肌缺血再灌注损伤发生发展的重要病理机制[7-9],为我们研发能够有效防治心肌缺血再灌注损伤的新型药物提供了思路。水飞蓟宾是一种具有多种生物学作用的水飞蓟素[2-4],本实验通过灌胃给予SIL进行预处理、夹闭冠状动脉30 min后松夹恢复血流再灌注的方法制备的心肌缺血再灌注损伤大鼠模型进行研究,发现经SIL预处理能够有效改善心肌组织病变、抑制细胞凋亡,提示SIL对缺血再灌注损伤大鼠具有一定的保护作用。
心脏组织超声影像检测是直接反映心功能的方法,而血清中心肌酶(AST、CPK、LDH)含量则能够反映心肌细胞损伤程度,间接反映心功能状况。本研究发现,经SIL预处理能够有效降低心肌缺血再灌注损伤大鼠舒张末期左室内径(LVIDd)及收缩末期左室内径(LVIDs),提高短轴缩短率(FS)、射血分数(EF)、每搏输出量(SV),降低血清中心肌酶(AST、CPK、LDH)含量,提示SIL具有抑制心肌细胞损伤、改善心功能的作用。
氧自由基(ROS)代谢失常是导致机体氧化应激损伤的病理基础,抗氧化酶(SOD、CAT)对维持体内ROS动态平衡发挥着重要作用[10,11]。抗氧化酶活性降低时导致ROS过剩引起机体过氧化损伤而生成丙二醛(MDA),所以氧化酶活性和过氧化终产物MDA含量能够反映机体氧化应激损伤程度。本研究发现,经SIL预处理能够显著改善抗氧化酶(SOD、CAT)活性、降低MDA含量,提示SIL预处理具有降低心肌缺血再灌注大鼠氧化应激损伤的作用。
氧化应激损伤是诱发细胞凋亡的重要因素,NF-κB是连接氧化应激和细胞凋亡的“桥梁”。生理状态下,NF-κB以无活性形式存在于胞质中,而当细胞受到ROS攻击时,NF-κB将被活化并暴露出核定位信号而进入胞核内,与凋亡相关基因如c-myc等NF-κB调控元件结合,促进基因转录并诱导细胞凋亡[12];此外,活化的NF-κB蛋白还能够促进巨噬细胞活化和浸润、诱导促凋亡信号释放而导致细胞凋亡[13]。本研究发现,经SIL预处理能够有效下调心肌缺血再灌注损伤大鼠心肌组织NF-κB蛋白表达、抑制心肌细胞凋亡,间接反映SIL具有抑制心肌缺血再灌注损伤大鼠氧化应激损伤的作用。
综上所述,SIL可能通过改善心肌缺血再灌注损伤大鼠心功能并抑制其氧化应激损伤而对心肌缺血再灌注损伤大鼠表现出一定的保护作用。
[1] Xu T,Li W,Teo K,et al. Association of psychological risk factors and acute myocardial infarction in China: the INTER-HEART China study[J]. Chin Med J,2011,124(14):2083-8.
[2] 武艳强,王慧娟,冯社军,等. 水飞蓟宾对H2O2诱导大鼠H9C2心肌细胞氧化应激损伤的保护作用[J]. 现代药物与临床,2015,30(5): 503-8.
[3] Xie Z,Ding SQ,Shen YF. Silibinin activates AMP-activated protein kinase to protect neuronal cells from oxygen and glucose deprivationre-oxygenation[J]. Biochem Biophys Res Commun,2014,454(2): 313-9.
[4] Wang YX,Cai H,Jiang G,et al. Silibinin Inhibits Proliferation, Induces Apoptosis and Causes Cell Cycle Arrest in Human Gastric Cancer MGC803 Cells Via STAT3 Pathway Inhibition[J]. Asian Pac J Cancer Prev,2014,15(16):6791-8.
[5] 王利平,孙贤义. 水飞蓟宾胶囊对急性脑梗死患者氧化应激水平和炎症指标的影响[J]. 微循环学杂志,2012,22(1):59-61.
[6] 张秀侠. 水飞蓟宾对局灶性脑缺血再灌注损伤大鼠保护作用的研究[J]. 安徽医药,2016,20(3):445-9.
[7] Zhao YJ,Wang YL,Du LJ,et al. Effect of spermine preconditioning on myocardial ischemia/reperfusion injury and cardiomyocyte apoptosis in isolated perfused rat heart. Chin Pharmacol Bull,2012,28(8): 1135-40.
[8] Han ShX,Yao HL,Li YY,et al. Protective effects of Cuscuta chinensis Lam. extract on myocardial ischemia/reperfusion injury in rats. Chin Pharmacol Bull,2011,27(4):533-6.
[9] 任宏强,赵利,王忠,等. 复方丹参滴丸对急性心肌梗死大鼠心肌细胞凋亡和凋亡相关蛋白的影响[J]. 中国动脉硬化杂志,2013, 21(12):1084-8.
[10] Lartigue A,Burlat B,Coutard B,et al. The megavirus chilensis Cu, Zn-superoxide dismutase: the first viral structure of a typical CCS-independent hyperstable dimeric enzyme[J]. J Virol, 2014, 2588(14): 254-61.
[11] Jin Y,Liu K,Peng J,et al. Rhizoma dioscoreae nipponicae polysaccharides protect HUVECs from H2O2-induced injury by regulating PPARγ factor and the NADPH oxidase/ROS-NF-κB signal pathway[J]. Toxicol Lett,2014,232(1):149-58.
[12] Deshpande SS,Angkeow P,Huang J,et al. Rac1 inhibits TNF-alphainduced endothelial cell apoptosis: dual regulation by reactive oxygen species[J]. FASB J,2000,14(12):1705-14.
[13] Zhang Q,Huang WD,Lv XY,et al. Ghrelin protects H9c2 cells from hydrogen peroxide-induced apoptosis through NF-κB and mitochondria-mediated signaling[J]. Eur J Pharmacol,2011,654(2): 142-9.
本文编辑:李丹花,田国祥
Influence of silibinin on heart function and oxidative stress in rats with myocardial ischemia-reperfusion injury
CAO Xu-dan*, REN Chun-mei, HE Tian-tian, LIU Jian.*Central Hospital of Handan City, Handan 056001, China.
CAO Xu-dan, E-mail: hdzxyycxd@163.com
Objective To study the influence of silibinin (SIL) on heart function and oxidative stress in rats with myocardial ischemia-reperfusion injury. Methods SD rats (n=100) were randomly divided into sham-operation group, model group, low-dose SIL group [100 mg/(kg·d)], mid-dose SIL group [200 mg/(kg·d)] and high-dose SIL group [400 mg/(kg·d), each n=20]. All SIL groups were give pretreatment by oral SIL 7 d before the operation, and after 7 d the rats were given ligation of coronary artery for 30 min for establishing the model of myocardial ischemia-reperfusion injury, and the reperfusion time was for 6 h. The indexes of left ventricular end-diastolic inner diameter (LVEDd), left ventricular end-systolic diameter (LVESd), fraction shortening (FS), ejection fraction (EF) and stroke volume (SV) were detected through high resolution ultrasound imaging system. The content of serum myocardial enzyme was detected by using biochemical method, changes of histo-morphology structure were observed after HE staining, levels of antioxidase and malondialdehyde (MDA) were detected by using chromatoptometry, expression of myocardial NF-κB protein was detected by using Western blotting, and myocardial apoptosis was observed by using TUNEL method. Results Compared with model group, LVEDd decreased significantly, and FS, EF and SV increased significantly, level of myocardial enzyme (AST, CPK, LDH) was significantly reduced, activities of antioxidase (SOD, GSH-Px, CAT) were promoted, and MDA level was significantly reduced, and expression of NF-κB protein was significantly reduced, myocardial apoptosis was significantly relieved, and apoptosis index (AI) was significantly reduced (P<0.05 to P<0.01) in mid-dose SIL group and high-dose SIL group. Conclusion SIL has the effects of improving heart function and inhibiting oxidative stress damage, and plays a preventive role to acute myocardial infarction in rats with myocardial ischemia-reperfusion injury.
Silibinin; Myocardial ischemia-reperfusion; Heart function; Oxidative stress
R541.4
A
1674-4055(2017)05-0573-04
邯郸市科学技术研究与发展计划项目(1523108145)
1056001 邯郸,邯郸市中心医院心血管外科;2056001邯郸,邯郸市中心医院手术室
曹旭丹,E-mail:hdzxyycxd@163.com
10.3969/j.issn.1674-4055.2017.05.16

