禽流感H9N2病毒样颗粒疫苗佐剂的筛选及其对鸡的免疫效果评价
周康森,顾 盼,王玲玲,吴胜昔,蔡家利
(重庆理工大学 药学与生物工程学院, 重庆 400054)
禽流感H9N2病毒样颗粒疫苗佐剂的筛选及其对鸡的免疫效果评价
周康森,顾 盼,王玲玲,吴胜昔,蔡家利
(重庆理工大学 药学与生物工程学院, 重庆 400054)
为使禽流感H9N2病毒样颗粒疫苗尽早投入市场,有效防控H9N2禽流感的流行,拟从油乳、ISA 206和微球佐剂中筛选出一种最适用于禽流感H9N2病毒样颗粒疫苗的佐剂。首先对H9N2病毒样颗粒血凝效价及血凝素(HA)含量的测定,然后制备出禽流感H9N2病毒样颗粒油乳疫苗、ISA 206佐剂疫苗、微球疫苗,并对其稳定性、无菌性和安全性等进行检验。通过溶菌酶含量、血凝抑制试验以及T淋巴细胞刺激指数等试验检测其非特异性免疫和特异性免疫水平。结果表明:微球VLP疫苗组溶菌酶含量高于其他各疫苗组(p﹤0.01),能引起非特异性免疫;微球VLPs(口服)疫苗组的血凝抑制滴度高于其他各疫苗组(p﹤0.01),抗体增长趋势与阳性对照组无显著差异(p>0.05),产生了有效的体液免疫应答;微球VLP疫苗(口服)疫苗组T淋巴细胞刺激指数最高。微球口服疫苗其免疫原性强,安全稳定,能诱导机体产生有效的免疫应答,可为新型病毒样颗粒疫苗佐剂的选择提供参考。
H9N2禽流感病毒;病毒样颗粒; 佐剂;微球
禽流感(avian influenza,AI)是由禽流感病毒(avian influenza virus,AIV)引起家禽感染的一类传染性疾病,给家禽养殖业造成了巨大的经济损失[1-4]。H9N2亚型属低致病性禽流感病毒虽然不会导致感染家禽大批量死亡,但因其传播速度快,能使蛋鸡产蛋量下降等特点,其危害性不容忽视[2,5-6]。目前,我国主要采用免疫预防与捕杀相结合的措施来控制H9N2亚型禽流感病毒的爆发。市场上主要以灭活疫苗、亚单位疫苗和减毒活疫苗来预防H9N2亚型禽流感的流行,但因这几类疫苗存在免疫效果差和安全性等问题,因此研发一种新品种疫苗迫在眉睫。
近年来,利用分子生物学等相关技术已成功构建了H9N2亚型病毒样颗粒(virus-like particles,VLP)[4,7-10],因其在形态上与真正的病毒粒子相似且具有与完整病毒相似的免疫原性以及不含核酸,所以在动物机体内不能自主复制,安全性高。佐剂可以增强抗原的免疫原性或改变免疫类型,但目前尚未有用于病毒样颗粒使用的佐剂[11-13]。本研究主要用油乳佐剂、ISA 206佐剂和微球佐剂与禽流感H9N2亚型病毒样颗粒制成不同佐剂类型的病毒样颗粒疫苗,并检测其非特异性免疫和特异性免疫情况,筛选出最适合于禽流感H9N2亚型病毒样颗粒的佐剂,为研制出新型病毒样颗粒疫苗提供参考。
1 材料与方法
1.1 毒种与实验动物
H9N2病毒尿囊液及H9N2亚型病毒样颗粒,由重庆理工大学药学与生物工程学院实验室制备并保存。1日龄SPF鸡,购于长寿区长水鸡厂,笼养至10日龄用于免疫实验。
1.2 主要试剂和仪器
BCA检测试剂盒购自上海生工生物工程技术服务有限公司。血凝素ELISA检测试剂盒及溶菌酶测试盒购自上海酶联生物技术有限公司。鸡淋巴细胞分离液购自天津瀚洋生物制品科技有限公司。酶标仪购自美国Thermo Fisher公司。冷冻干燥机购自基因有限公司。
1.3 H9N2亚型病毒样颗粒血凝效价及血凝素(HA)含量测定
采用血球凝集实验[10]检测VLPs的血凝效价。在V型血凝板中,各孔加入30 μL生理盐水,取等量待测样品,通过倍比稀释至第12孔,进行平行3次实验,并以生理盐水作为阴性对照。然后加入30 μL 1%鸡血红细胞,混匀后37 ℃静置30 min,观察结果。取制备好的H9N2亚型病毒样颗粒上清液,4 ℃、1 000 r/min离心5 min,并采用血凝素(HA)定量ELISA检测试剂盒测定上清液的血凝素(HA)含量。
1.4 病毒样颗粒疫苗的制备与质量检验
1.4.1 油乳佐剂疫苗
准确量取司盘-80 6 mL、白油94 mL,分别与1 g硬脂酸铝加热混合均匀制得硬脂酸铝浓度为0.5%的油相。取适量H9N2亚型病毒样颗粒上清液与吐温-80 混合制得含5%吐温-80的水相,湿热灭菌,冷却至室温备用。油相与水相按3∶1的体积比高速搅拌乳化,2 min/次,共3次,即得油乳剂疫苗,分装并保存于4 ℃冰箱备用。按疫苗生产规程对制备好的油乳疫苗进行黏度检验、无菌检验和稳定性检验等相关检验[11,14]。
老人怏怏不乐地跟进来,站在门口,说,我只想种几棵豆角……我知道草坪是用来看的,可是不过几棵豆角,绝对影响不了观赏……
1.4.2 ISA206佐剂疫苗
按照ISA206佐剂使用说明书进行乳化,匀速搅拌ISA206佐剂,并不断滴加病毒液,混匀后高速搅拌乳化,乳化时间为30 s,间隔为30 s,共10次。制得的ISA206佐剂疫苗分装并置于4 ℃冰箱保存备用。取制备好的ISA206疫苗进行相关检验[5,14]。
1.4.3 微球佐剂疫苗
称量10 g NaSO4溶于100 mL去离子水中,制得10%(质量体积分数)硫酸钠溶液。称取2.5 g壳聚糖溶于980 mL去离子水中,加入20 mL乙酸和10 g吐温-80,充分混匀,制得含2%(体积分数)乙酸和1%吐温-80(质量体积分数)的0.25%壳聚糖溶液,121℃湿热灭菌备用。在无菌条件下,将2 mL 10%硫酸钠溶液以1 mL/min的速度逐滴滴入200 mL 0.25%壳聚糖溶液中,超声20 min,以2 700 r/min的速度离心20 min,取沉淀并洗涤3次,将制备好的微球冷冻干燥。冷冻干燥后的微球与适量病毒样颗粒上清液吸附一定时间,即得微球佐剂疫苗。按疫苗生产相关文献及规程[10]对其进行释放度、无菌检验等相关检验。
1.5 试验动物分组与疫苗免疫
将140只10日龄雏鸡随机分成7组,每组20只,分别为油乳VLP疫苗组、ISA206VLP疫苗组、微球VLP疫苗(口服)、微球VLP疫苗(注射)、VLPs组、H9N2灭活疫苗组及阴性对照组(阴性对照组以PBS为水相制备的疫苗免疫)。疫苗组鸡血凝素(HA)免疫剂量为10 μg/只。除微球VLP疫苗(口服)组外,其他各组均采用颈部皮下注射方式免疫。
1.6 非特异性免疫水平测定
试验鸡免疫后第0、14、28 d各组随机抽取1 mL 鸡血液,分离血清,按溶菌酶测试盒说明书测定各组试验鸡溶菌酶含量。
1.7 抗体的检测
免疫后0、3、7d以及每隔1周,采集各疫苗组及对照组鸡的血液0.3~0.4 mL,分离血清,通过血凝抑制试验[15-16]检测特异性抗体效价。
1.8 T淋巴细胞刺激指数的测定
免疫后第14、28、56 d,随机采取疫苗组和对照组鸡的血液,并按淋巴细胞分离方法快速分离淋巴细胞。分离得到的淋巴细胞洗涤后用MTT法[1,17]测定T淋巴细胞增殖能力,从而判断各组细胞免疫水平。
2 结果
2.1 H9N2亚型病毒样颗粒血凝效价及血凝素(HA)含量测定
H9N2亚型病毒样颗粒血凝试验结果显示: H9N2亚型病毒样颗粒的血凝效价达1∶256,与H9N2病毒尿囊液血凝效价接近(见表1)。采用血凝素(HA)含量ELISA检测试剂盒测定其血凝素(HA)含量,结果显示血凝素(HA)含量为0.23 mg/mL。
2.2 病毒样颗粒疫苗的制备与质量检验
对单相W/O型白油佐剂疫苗和双相W/O/W型ISA206佐剂疫苗进行加速稳定试验,结果显示:经加速离心后未出现分层现象,将制备好的疫苗在(4±2)℃条件下放置12个月,未出现破乳现象。对微球佐剂疫苗在模拟胃液和人工肠液中释放速率进行测定,结果表明:微球佐剂疫苗在模拟胃液及人工肠液中匀速缓慢释放H9N2亚型病毒样颗粒(见表2)。3种佐剂疫苗在硫乙醇酸盐培养基(T.G)和酪胨琼脂(G.A)培养基上无菌生长。用30日龄健康未免疫鸡肌肉或颈部皮下注射油乳佐剂VLP疫苗2 mL,饲养14 d,试验组与对照组鸡均未出现死亡或出现严重不良反应,精神状态良好,采食量正常。
2.3 非特异性免疫水平测定
如表3所示,疫苗免疫前各组鸡的溶菌酶含量无显著差异(p>0.05),在免疫试验阶段,溶菌酶的含量随着鸡日龄的增大而增高,其非特异性免疫能力越强。免疫后第14 d和 28 d,微球VLP疫苗组溶菌酶含量均高于其他各组,并存在显著差异(p<0.05),其他各疫苗组与对照组均无显著差异(p>0.05)。结果表明:微球佐剂疫苗可引起试验鸡非特异性免疫,而其他佐剂疫苗则不能。

表1 血球凝集试验结果
注:﹢表示凝集;﹣表示不凝集;±表示疑似凝集

表2 微球佐剂疫苗在模拟胃液和人工肠液中释放后上清液的A562吸光度
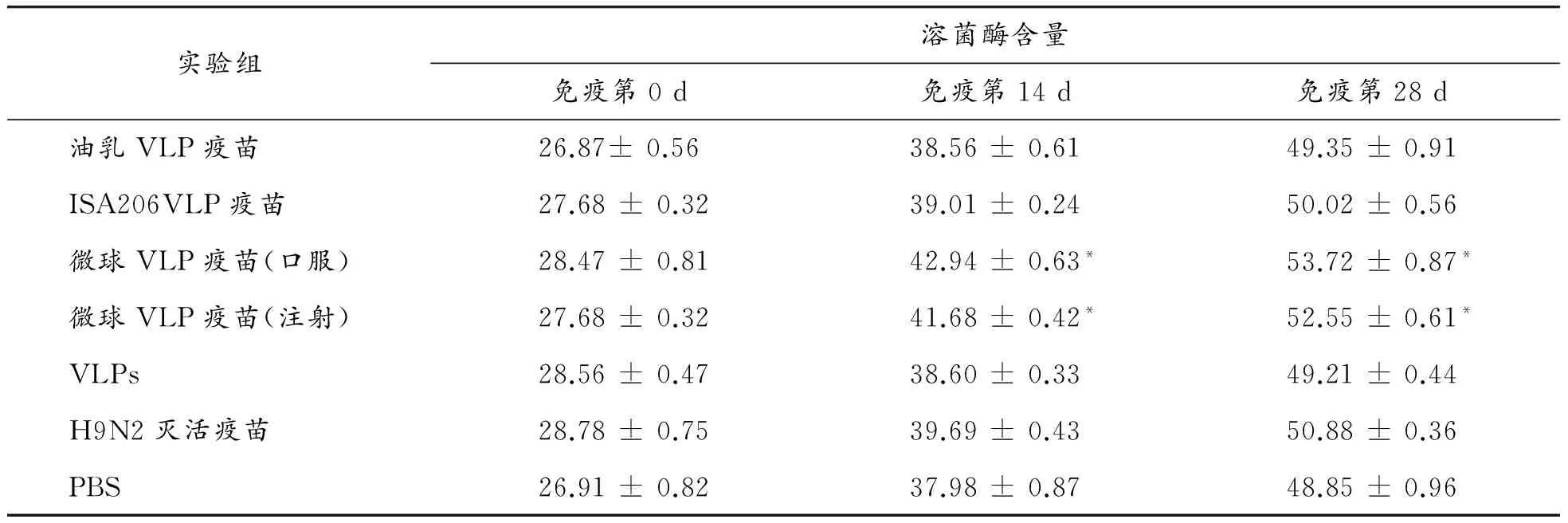
表3 各组溶菌酶含量 μg·mL-1
2.4 抗体的检测
不同佐剂疫苗组血凝抑制滴度结果如图1所示,可见免疫后4周,各疫苗组血凝滴度上升到6Log2以上,仅微球VLP(口服)疫苗组与H9N2灭活疫苗(阳性对照组)无显著性差异,说明微球佐剂能提高H9N2病毒样颗粒的免疫原性。免疫后90 d内检测动物体内特异性抗体消长规律曲线(见图2),结果表明:免疫后2周,微球VLP疫苗(口服)血凝抑制滴度为7.95±0.57 Log2,在免疫后第5周,其血凝抑制滴度高达9.68±0.65 Log2,在免疫后第90 d,其血凝抑制滴度降至5.45±0.61 Log2。各疫苗组的特异性抗体持续时间较长且抗体滴度较高,其中微球VLP疫苗(口服)与阳性对照疫苗组抗体消长趋势相似,故采用口服给药方式进行免疫动物,其免疫原性较好。
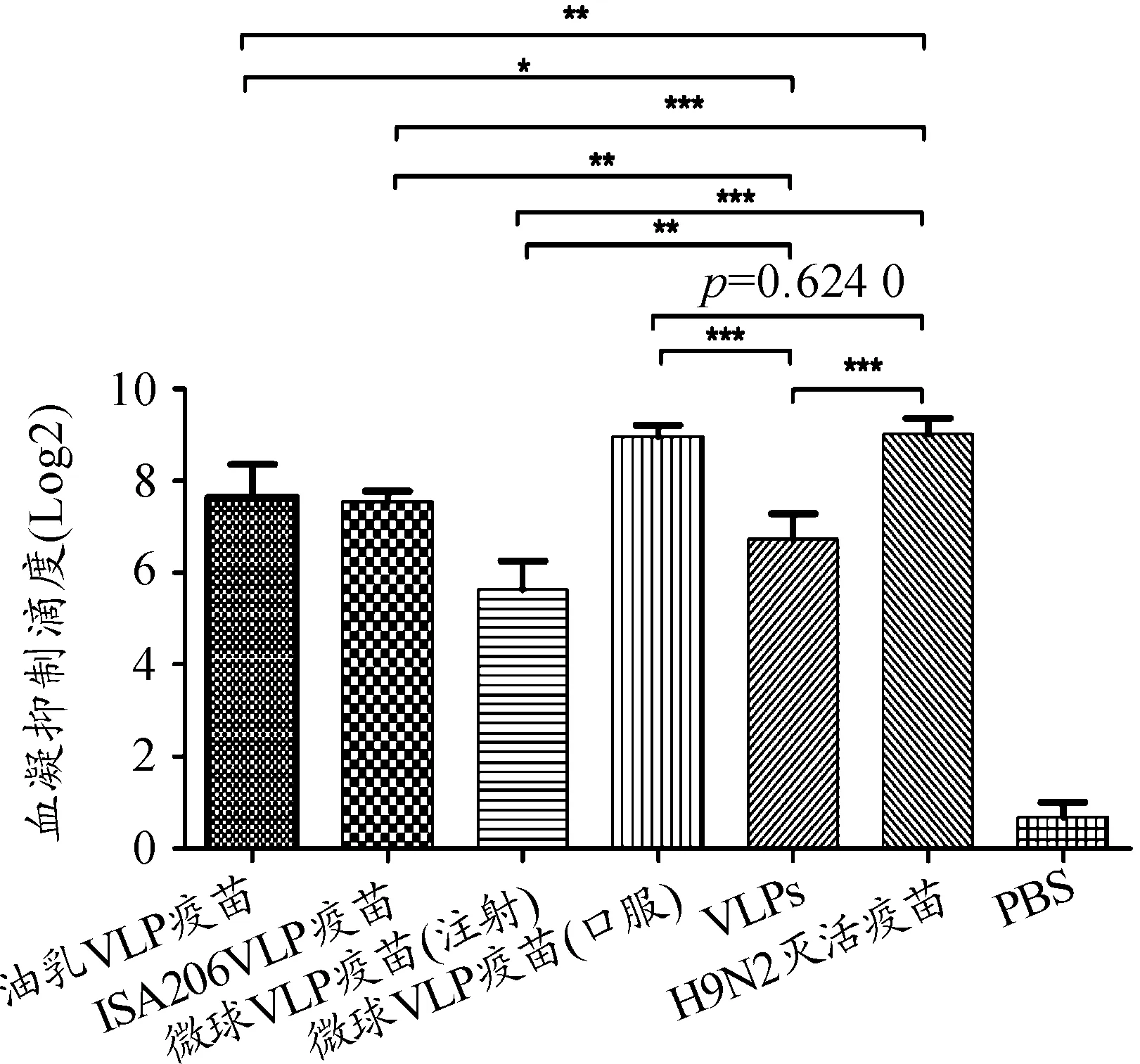
图1 不同佐剂H9N2病毒样颗粒疫苗血清抗体滴度的测定

图2 免疫后各组蛋鸡体内特异性抗体增长曲线
2.5 T淋巴细胞刺激指数的测定
MTT法检测T淋巴细胞增殖能力结果如图3所示。由图3可见:各疫苗组与PBS(阴性对照组)之间存在显著性差异(p<0.01);仅微球VLP疫苗(口服)疫苗组与H9N2灭活疫苗(阳性对照)组之间存在显著差异(p<0.01),其他疫苗组均与阳性对照组无显著差异;微球VLP疫苗(口服)疫苗组与其他3组疫苗组间存在显著差异(p<0.01)。微球VLP疫苗(口服)疫苗组刺激指数最高,为1.505 6,但未达到有效刺激值(有效刺激指数应大于等于3)。因此,从数据上可以看出各疫苗组均未产生有效的细胞免疫。

图3 T淋巴细胞刺激指数的测定
3 讨论
近年来,我国多次爆发H9N2亚型禽流感疫情,该病毒能引起鸡输卵管黏膜充血、水肿、变形,产蛋量下降,对我国家禽养殖业造成了严重的经济损失。目前,用于预防H9N2亚型禽流感病毒的疫苗主要有全病毒灭活疫苗、亚单位疫苗和减毒活疫苗,而我国市场上的H9N2亚型禽流感疫苗均为针对特定毒株制备而成的全病毒灭活疫苗,其存在生产周期长、产量小等缺点,已经无法满足预防需求。国外学者[18]利用杆状病毒表达系统研制的H9N2亚型禽流感病毒重组HA 蛋白亚单位疫苗,能引起机体有效的免疫应答。亚单位疫苗安全性高,无任何疫苗灭活剂,但其生产成本及设备要求高,无法实现大规模生产等缺点。利用反向遗传学技术制成的减毒活疫苗,其免疫原性强于灭活疫苗,但存在返毒风险,这类疫苗已不允许在禽类中使用。
与传统禽流感疫苗生产相比,病毒样颗粒疫苗不依赖于鸡胚生产,采用体外细胞培养方式,具有良好免疫原性,安全性高,无返毒风险。到目前为止,已经探索了几种可作为疫苗候选类型的VLPs。多种病毒如人免疫缺陷病毒、人乳头瘤病毒、麻疹病毒、乙型肝炎病毒等的结构蛋白都能在各种不同的表达系统中自动组装成病毒样颗粒[19]。H9N2亚型禽流感病毒样颗粒在结构和形态上与完整的病毒非常相似,能刺激机体产生较为强烈的免疫应答。将制备好的H9N2亚型病毒样颗粒疫苗免疫SPF鸡后未出现采食量减少和精神萎靡等现象,仅油乳佐剂与H9N2灭活疫苗疫苗组SPF鸡免疫后出现黄豆大小肿块,肿块在免疫后2周消失,疫苗安全性好。免疫佐剂能增进抗原呈递细胞(APC)对抗原的加工及呈递,增强机体对抗原的特异性免疫应答,而本身并无抗原性。通过对蛋鸡溶菌酶含量的测定发现:微球VLP疫苗(口服/注射)组蛋鸡体内溶菌酶含量高于其他各疫苗组,引起了非特异性免疫应答。通过特异性免疫水平的检测发现:不加任何佐剂的VLPs疫苗组SPF鸡产生特异性抗体效价较低,与其他疫苗组有显著差异(p<0.01),并且其抗体持续时间较短;加入佐剂的各疫苗组蛋鸡的特异性抗体产生快,效价较高。微球佐剂在胃肠液内具有缓释作用,因此微球佐剂疫苗(口服)疫苗组引起机体产生的抗体水平比油乳佐剂和ISA 206佐剂疫苗组高,与H9N2灭活疫苗(阳性对照组)无显著差异。MTT法检测细胞免疫水平结果发现:即使试验各组均未引起有效的细胞免疫,但是微球佐剂疫苗(口服)疫苗组刺激指数显著高于其它各疫苗组,说明微球佐剂能够引起T淋巴细胞增殖。
本研究对H9N2亚型病毒样颗粒疫苗佐剂进行筛选及免疫效果评价,结果发现:微球佐剂能增强病毒样颗粒的免疫原性,免疫副作用小,免疫持续时间长,可作为H9N2亚型病毒样颗粒疫苗的佐剂。
[1] 郭建强,张智清.病毒样颗粒技术的研究进展[J].中国疫苗和免疫,2009(2):167-173.
[2] 陆海融,樊晓晖.禽流感病毒H9N2的研究进展.[J].广西医学,2005,27(5):699-701.
[3] BOUVIER N M,PALESE P.The biology of influenza viruses[J].Vaccine,2008,26:D49-D53.
[4] ZHANG L,LU J,CHEN Y,et al.Characterization of Humoral Responses Induced by an H7N9 Influenza Virus-Like Particle Vaccine in BALB/C Mice[J].Viruses,2015,7(8):4369-4384.
[5] 张立霞,于在江,周剑芳,等.流感病毒样颗粒疫苗研究进展[J].病毒学报,2009,30(5):402-408.
[6] 李建丽,马仲彬,王泽霖,等.禽流感病毒遗传变异及其分子机制[J].中国动物检疫,2004,21(6):44-46.
[7] SHEN H,XUE C,LV L,et al.Assembly and immunological properties of a bivalent virus-like particle (VLP) for avian influenza and Newcastle disease[J].Virus Res,2013,178(2):430-436.
[8] ZHOU J,WANG D,GAO R,et al.Biological features of novel avian influenza A (H7N9) virus[J].Nature,2013,499(7459):500-503.
[9] NOH J Y,PARK J K,LEE D H,et al.Chimeric Bivalent Virus-Like Particle Vaccine for H5N1 HPAI and ND Confers Protection against a Lethal Challenge in Chickens and Allows a Strategy of Differentiating Infected from Vaccinated Animals (DIVA)[J].PLoS One,2016,11(9):e0162946.
[10]YU J,SHI F S,HU S.Improved immune responses to a bivalent vaccine of Newcastle disease and avian influenza in chickens by ginseng stem-leaf saponins[J].Vet Immunol Immunopathol,2015,167(3/4):147-155.
[11]王建英,田雪文.免疫佐剂及其作用机制[J].山东师范大学学报(自然科学版),2006,21(1):127-129.
[12]陈孝婷,谢小荣,申联滨.新型佐剂在破伤风抗毒素血浆生产中的应用研究[J].微生物学免疫学进展,2006,34(2):35-38.
[13]贾英,王小蒙,张建春.206佐剂乳化工艺的研究[C]//首届中国兽药大会-兽医生物制品学、兽医微生物学学术论坛论文集.2008:372-376.
[14]BLACK S.Safety and effectiveness of MF-59 adjuvanted influenza vaccines in children and adults[J].Vaccine,2015,33:B3-5.
[15]YU H Q,CAI X Q,LIN Z X,et al.Rapid and specific detection of porcine parvovirus using real-time PCR and High Resolution Melting (HRM) analysis[J].BMC Vet Res,2015,11(1):46.
[16]LIU Y V,MASSARE M J,PEARCE M B,et al.Recombinant virus-like particles elicit protective immunity against avian influenza A(H7N9) virus infection in ferrets[J].Vaccine,2015,33(18):2152-2158.
[17]LEE D H,PARK J K,SONG C S.Progress and hurdles in the development of influenza virus-like particle vaccines for veterinary use[J].Clin Exp Vaccine Res,2014,3(2):133-139.
[18]KANG S M,KIM M C,COMPANS R W.Virus-like particles as universal influenza vaccines[J].Expert Rev Vaccines,2012,11(8):995-1007.
[19]QUAN F S,HUANG C,COMPANS R W,et al.Virus-like particle vaccine induces protective immunity against homologous and heterologous strains of influenza virus[J].J Virol,2007,81(7):3514-3524.
(责任编辑 刘 舸)
Screening and Immune Protection Evaluation of Different Adjuvanted Avian Influenza H9N2 Virus-Like Particle Vaccines in Chicken
ZHOU Kang-sen,GU Pan,WANG Ling-ling,WU Sheng-xi,CAI Jiao-li
(College of Pharmacy and Bioengineering, Chongqing University of Technology, Chongqing 400054,China)
In order to have effectively prevention and control of avian influenza H9N2 pandemic, three kind of adjuvanted avian influenza H9N2 virus-like particle vaccines (oil-emulsion,ISA 206 and microspheres) were developed and selected to get the best one for avian influenza H9N2 VLPs by immunity evaluation in chicken. The HA assay was performed to demonstrate the agglutination activity of VLPs and the HA protein content was evaluated by the standard quantification method that is indirect ELISA assay. Then the stability, sterility and security of H9N2 VLPs vaccines were tested before vaccination. HI assay was used to assess the functional antibodies in the sera of immunized chicken to HA. Determination of T lymphocyte stimulation index and lysozyme content were investigated by MTT and lysozyme content detection kit. The results show that chicken orally vaccinated with the microspheres H9N2 VLPs generated higher lysozyme content and HI titers of antibody against H9N2 viruses than other groups(p<0.01) and little or no cellular immune response. The microspheres H9N2 VLPs vaccines provided the best safety, sterility and immunogenicity to chicken and these results indicate a reference for the choice of adjuvanted avian influenza H9N2 VLPs vaccines.
avian influenza H9N2; virus-like particle; adjuvant; microsphere
2017-02-25 基金项目:重庆高校优秀成果转化资助项目(KJZH14212)
周康森(1990—),男,重庆人,硕士研究生,主要从事疫苗与诊断技术研究,E-mail:18290434625@163.com;蔡家利 (1956—),男,重庆人,博士,教授,主要从事动物疫病诊断技术与疫苗研制研究,E-mail:cjl@cqut.edu.cn。
周康森,顾盼,王玲玲,等.禽流感H9N2病毒样颗粒疫苗佐剂的筛选及其对鸡的免疫效果评价[J].重庆理工大学学报(自然科学),2017(5):99-104.
format:ZHOU Kang-sen,GU Pan,WANG Ling-ling,et al.Screening and Immune Protection Evaluation of Different Adjuvanted Avian Influenza H9N2 Virus-Like Particle Vaccines in Chicken[J].Journal of Chongqing University of Technology(Natural Science),2017(5):99-104.
10.3969/j.issn.1674-8425(z).2017.05.017
S855.3
A
1674-8425(2017)05-0099-06

