靶向癌胚抗原载药纳米超声造影剂体外抑制卵巢癌细胞生长
周 航,黄晓玲*,李 攀,尚婷婷,朱蕾蕾,王志刚
(1.重庆医科大学附属第一医院超声科,重庆 400016;2.重庆医科大学超声影像学研究所,重庆 400016)
靶向癌胚抗原载药纳米超声造影剂体外抑制卵巢癌细胞生长
周 航1,黄晓玲1*,李 攀2,尚婷婷2,朱蕾蕾2,王志刚2
(1.重庆医科大学附属第一医院超声科,重庆 400016;2.重庆医科大学超声影像学研究所,重庆 400016)
目的 制备靶向癌胚抗原(CEA)载药相变型PLGA纳米粒(Ab-PTX-NPs),探讨该纳米粒的体外寻靶及抑制肿瘤细胞生长的效能。方法 乳化溶剂挥发法联合碳二亚胺法制备靶向CEA载紫杉醇纳米粒(Ab-PTX-NPs),采用马尔文粒径分析仪检测其粒径大小。采用高效液相色谱法检测紫杉醇包封率及载药量,恒温摇床透析法检测该纳米粒体外释药特征。激光共聚焦显微镜及流式细胞术观察该纳米粒体外寻靶情况,CCK-8试剂检测卵巢癌细胞存活率。结果 制备的Ab-PTX-NPs粒径为(397.70±99.95)nm,紫杉醇包封率及载药量分别为(67.26±4.15)%和(6.31±0.39)%。抗CEA单克隆抗体与纳米粒连接率为(92.74±5.75)%。共聚焦显微镜下观察到靶向组卵巢癌SKOV3细胞周围见较多造影剂黏附,流式细胞术测得靶向组细胞平均荧光强度明显高于其余各组(P<0.05),CCK-8试剂法测得靶向组在24 h时,细胞存活率高于纯药组(P<0.05),而低于无靶组(P<0.05),当48 h时,靶向组与纯药组细胞存活率差异无统计学意义(P>0.05)。结论 成功制备靶向CEA载药相变型PLGA纳米粒,该纳米粒经低功率聚焦超声治疗仪(LIFU)致相变后可明显增强超声显影,且载药量高,释药快,靶向能力强。
卵巢肿瘤;超声检查;造影剂;紫杉醇;靶向治疗
卵巢癌是女性最常见的生殖系统肿瘤之一,其发病率仅次于宫颈癌和子宫内膜癌而居第3位,但病死率却高居第1位[1]。因此,早期准确地诊断与治疗,对其预后至关重要。随着超声分子影像学的发展,聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]纳米粒以其良好的生物组织相容性和生物安全性,已被用于肿瘤的分子显像与治疗等研究[2-4]。纳米粒的出现,突破了传统超声造影剂粒径大(2~8 μm[5]),只能用于血池显影的局限性。同时,将临床常用的广谱化疗药物紫杉醇(paclitaxel, PTX)包载入PLGA,制成多功能纳米粒,不仅可避免由于药物疏水性带来的给药困难,还可避免有机溶剂引起的过敏反应。但提高PLGA多功能纳米粒对肿瘤组织靶向超声造影和治疗的效率,一直是研究的难点。本研究拟制备一种靶向癌胚抗原(carcino-embryonic antigenm, CEA)载紫杉醇相变型PLGA纳米粒(Ab-PTX-NPs),探讨其对卵巢癌细胞的体外寻靶能力及抑制肿瘤细胞生长情况。
1 材料与方法
1.1 试剂与仪器
1.1.1 材料和试剂 聚乳酸-乙醇酸(PLGA-COOH,聚合比50∶50,MW:1.2万,济南岱罡生物工程有限公司);紫杉醇原料药(西安昊轩生物有限公司);聚乙烯醇(PVA,Sigma);全氟戊烷(perfluoropentane, PFP,Strem Chemicals)。碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)均购自Sigma公司。荧光染料DiI、DiO、DAPI、异硫氰酸荧光素(FITC)。人卵巢癌SKOV3细胞株由重庆医科大学超声影像学研究所提供。胎牛血清、1640培养液购自Gibco公司。CCK-8购自博奥森公司。
1.1.2 仪器 激光粒径测量仪(Zetasizer Nano ZS90,Malvern),声振仪(Sonics & Materials,美国),磁力搅拌器,JSM-7800F电子显微镜(JEOL,日本),低功率聚焦超声治疗仪(LIFU)为重庆医科大学超声分子影像学研究所研制,百盛超声诊断仪(ESAOTE S.p.A,意大利),TCSSP2激光共聚焦显微镜(Lecia公司,德国),倒置荧光显微镜,高效液相色谱分析仪(Waters e2695,德国)。
1.2 载紫杉醇相变型PLGA纳米粒的制备 单乳化法制备载紫杉醇相变型PLGA纳米粒(PTX-NPs)。将溶有50 mg PLGA及5 mg PTX的2 ml二氯甲烷溶液、适量PFP及10 ml 5%(W)PVA水溶液充分混合后,于冰水浴中声振,加入20 ml 2%(V/V)异丙醇水溶液,磁力搅拌器搅拌2~5 h,经双蒸水离心洗涤 2~3次后制得PTX-NPs,以磷酸缓冲盐溶液(PBS)重悬为5 mg/ml(以加入PLGA的总质量计)的溶液,4 ℃冰箱保存。同样方法,仅在溶解PLGA时不加入紫杉醇原料药,制备不含紫杉醇的纳米粒(NPs)。
1.3 抗CEA单克隆抗体与PTX-NPs的共价连接 抗CEA单克隆抗体(Ab)与PTX-NPs的共价连接采用碳二亚胺法。先将PTX-NPs重悬于MES缓冲液(pH=6.0)中,加入适量EDC及NHS,室温下摇床孵育45 min,后离心双蒸水洗涤3次后,MES缓冲液(pH=8.0)重悬PTX-NPs,加入Ab(质量比PLGA∶Ab=20∶1),摇床室温孵育2~3 h,离心、洗涤后制成靶向CEA载紫杉醇相变型纳米粒(Ab-PTX-NPs)。取少许Ab-PTX-NPs用PBS重悬,加入适量FITC标记的山羊抗兔IgG抗体(二抗),4 ℃摇床孵育1 h,离心、洗涤后,采用激光共聚焦显微镜观察二者连接情况,流式细胞术检测其连接率。
1.4 纳米粒的一般特性检测 光镜及扫描电镜下观察Ab-PTX-NPs的形态,采用马尔文粒径仪检测其粒径及表面电位。LIFU致相变后观察Ab-PTX-NPs相变后超声显影情况。取1 ml Ab-PTX-NPs(浓度 10 mg/ml),离心后采用CH2Cl2溶解沉淀,高效液相色谱(high-performance liquid chromatography, HPLC)法检测溶液中PTX含量,色谱条件:流动相为乙腈∶水=45∶55(V/V),检测波长227 nm,进样量20 μl,并按以下公式计算PTX的包封率及载药量:PTX包封率(%)=PTX检出量/PTX总投放量×100%;载药量(%)=PTX检出量/Ab-PTX-NPs总重量×100%。恒温摇床透析法检测其体外释药特性,绘制体外释药特性曲线。将一定量Ab-PTX-NPs用PBS重悬,装入透析袋后放入缓释液(含30%乙醇),37 ℃,摇床温柔摇育,每隔一定时间点采集缓释液1 ml,HPLC法检测PTX含量,每次取液后补充等量缓释液。

图1 Ab-PTX-NPs形态特征 A.光镜图(×600); B.扫描电镜图(×30 000); C.马尔文粒径分布图
1.5 人卵巢癌SKOV3细胞培养及体外寻靶 卵巢癌SKOV3细胞培养采用含10%胎牛血清、1%链霉素—青霉素(双抗)的1640培养基,贴壁培养于 250 ml培养瓶中,置于孵箱(37 ℃,5% CO2)培养。取对数生长期细胞,按适当浓度接种于一次性共聚焦培养皿中,分为靶向组、无靶组、抗体阻断组和阴性对照组。靶向组加入DiI标记的Ab-PTX-NPs;无靶组加入DiI标记的PTX-NPs;抗体阻断组先加入适量抗CEA单克隆抗体,孵箱孵育2 h,PBS冲洗多次后,再加入等量DiI标记的Ab-PTX-NPs。孵箱孵育45 min后,PBS冲洗多次,加入4%多聚甲醛固定细胞,DAPI染细胞核,PBS冲洗后,采用激光共聚焦显微镜观察各组造影剂靶向情况。将细胞培养于6孔板中,每孔细胞数为1×105个,各组加入相应DiI标记的纳米粒,阴性对照组仅加入等量1640培养基,孵箱孵育45 min后,流式细胞术检测各组细胞平均荧光强度。
1.6 体外抑制卵巢癌SKOV3细胞生长 取对数生长期SKOV3细胞,以1×104/孔浓度接种于96孔板,分为靶向组、无靶组、抗体阻断组、纯药组、无药组、阴性对照组,每组复孔数为5个。靶向组每孔加入100 μl Ab-PTX-NPs(浓度为2 mg/ml,1640培养液重悬);无靶组每孔加入等量PTX-NPs;抗体阻断组先每孔加入适量抗CEA单克隆抗体,孵箱孵育2 h,PBS冲洗 3~5次后,每孔加入与靶向组等量Ab-PTX-NPs;纯药组每孔加入含PTX(10 μg/ml)的等量新鲜1640培养液;无药组每孔加入等量NPs;阴性对照组每孔加入100 μl新鲜1640培养基。各组孵箱培养45 min,PBS冲洗3~5次,并加入100 μl新鲜培养基,继续孵箱培养24 h、48 h后,采用CCK-8试剂法检测细胞存活率。
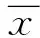
2 结果
2.1 纳米粒的一般特性 马尔文粒径分析仪检测Ab-PTX-NPs、PTX-NPs及NPs 3种造影剂粒径分布分别为(397.70±99.95)nm、(405.80±141.00)nm、(311.00±103.90)nm。光镜下观察Ab-PTX-NPs呈圆形,大小均匀,扫描电镜观察其形态呈球形,粒径大小分布均匀(图1)。LIFU致相变作用后B模式及造影模式下超声显影均显著增强(图2)。PTX标准曲线方程为Y=1.356759×105+6.969440×104X(R2=0.999 961),PTX的包封率及载药量分别为(67.26±4.15)%和(6.31±0.39)%。体外释药特性曲线显示,紫杉醇释药快,且释药率高,48 h时释药率已近70%(图3)。
2.2 抗CEA单克隆抗体与PTX-NPs的连接情况 激光共聚焦显微镜下观察到DiI染色的PTX-NPs(红色荧光)与FITC标记山羊抗兔IgG(绿色荧光)融合呈橙黄色,抗CEA抗体与PTX-NPs成功连接(图4)。流式细胞术显示二者连接率为(92.74±5.75)%(图5)。

图2 LIFU致Ab-PTX-NPs相变前后体外超声显影情况 相变前B模式(A)和造影模式(B),相变后B模式(C)和造影模式(D)

图3 Ab-PTX-NPs中PTX体外释药特性曲线
2.3 造影剂靶向SKOV3细胞情况 激光共聚焦显微镜显示靶向组SKOV3细胞周围见较多带红色荧光(DiI染色)的造影剂聚集(图6),流式细胞术检测靶向组细胞平均荧光强度高于无靶组、抗体阻断组和阴性对照组(P均<0.05,图7)。体外抑制细胞生长结果显示,24 h时,各组细胞存活率差异有统计学意义 (F=18.413,P<0.001),靶向组细胞存活率接近40%,低于无靶组、抗体阻断组、无药组和阴性对照组 (P均<0.05),仅高于纯药组(P<0.05);48 h时,各组细胞存活率差异有统计学意义(F=36.584,P<0.01),靶向组的细胞存活率已下降至5%左右,与无靶组、抗体阻断组、无药组和阴性对照组比较差异有统计学意义(P均<0.05),与纯药组比较差异无统计学意义(P>0.05),见图8。
3 讨论
卵巢癌是女性最常见的生殖系统肿瘤之一,其治疗方式主要为手术、化疗等多模式联合治疗[6-7],但化疗药物的直接使用常造成不同程度的毒副作用。紫杉醇作为卵巢上皮性癌化疗的核心药物之一,由于其疏水性,需使用无水乙醇等有机溶剂溶解,增加了其成品药的毒副作用。随着超声分子影像学的发展,各种壳成分的纳米级超声造影剂相继出现[8-10],使突破肿瘤新生血管内皮细胞间隙,实现对卵巢癌的早期诊断成为可能。PLGA作为一种高分子复合物,具有较好的生物组织相容性和可降解性,已被诸多学者[2-3]用于超声造影研究及药物和基因递送的载体。CEA在卵巢癌、乳腺癌、肺癌、胰腺癌等恶性肿瘤中高表达[11],故可将其设为靶向研究的靶点。本研究将紫杉醇包载入PLGA制成相变型PLGA纳米粒,并将抗CEA单克隆抗体与纳米粒共价连接,使其具备CEA靶向性,并通过体外寻靶与抑瘤实验,探讨其体外靶向卵巢癌细胞的效能。抗CEA单克隆抗体与PTX-NPs共价连接采用碳二亚胺法,该方法链接效率高,且操作简便[12-13]。
本研究以PLGA为壳层结构制备Ab-PTX-NPs,包裹PFP作为相变材料,该纳米颗粒可顺利穿过肿瘤血管内皮细胞间隙,当其在肿瘤组织内靶向浓聚时,利用超声波空化效应及声孔效应致相变原理[14],通过LIFU作用致PFP由液相转变为气相,纳米颗粒随之转变为微泡,从而实现超声造影的功能;结果表明,LIFU可成功实现Ab-PTX-NPs相变,从而增强B模式及造影模式超声显影。
有学者[15-16]制备的包裹紫杉醇药物的PLGA纳米粒,其体外释药研究均显示紫杉醇可在一定时间达到较高程度的释放。本研究制备的Ab-PTX-NPs,体外释药快,呈突释,且在48 h时释药率已接近70%。
为提高靶向性,笔者将纳米粒与细胞共孵育时间设定为45 min,以减少因细胞吞噬作用造成的影响。体外寻靶实验结果显示,靶向组细胞平均荧光强度高于其余各组(P均<0.05),细胞生长抑制实验结果表明,在24 h时,靶向组SKOV3细胞存活率接近40%,低于除纯药组外的其余各组(P均<0.05),48 h时,存活率已下降至5%左右,与纯药组相当,低于其余各组(P均<0.05),提示靶向CEA载药PLGA纳米粒对卵巢癌SKOV3细胞具有较高的体外靶向与杀伤效能。
本研究的不足:未对所制备的靶向载药纳米超声造影剂超声显影条件进一步优化;未评价该纳米粒在体内的寻靶能力和抗肿瘤效果。
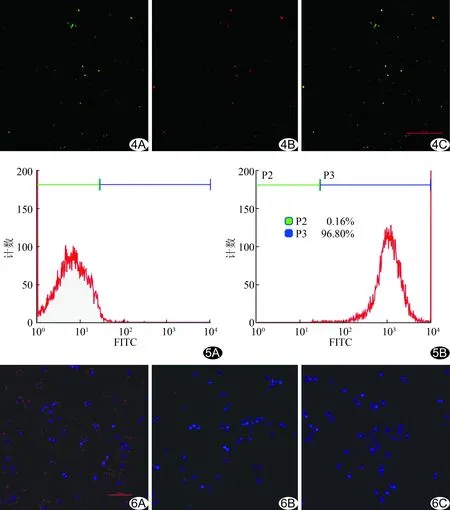
图4 激光共聚焦显微镜观察抗CEA单克隆抗体与造影剂连接情况(×400) A.FITC标记山羊抗兔IgG呈绿色荧光; B.DiI标记的PTX-NPs呈红色荧光; C.两者融合图 图5 流式细胞术显示抗CEA单克隆抗体与造影剂连接率 A. PTX-NPs; B. Ab-PTX-NPs 图6 激光共聚焦显微镜观察Ab-PTX-NPs体外靶向SKOV3细胞情况,红色为DiI染色的造影剂,蓝色为DAPI染色的细胞核(×400) A.靶向组; B.无靶组; C.抗体阻断组

图7 SKOV3细胞平均荧光强度 *:与其余各组比较,P<0.05 图8 24 h、48 h各组SKOV3细胞生长抑制率 *:与其余各组比较,P<0.05;#:两组间比较,P<0.05;&:两组间比较,P>0.05
总之,本研究成功制备CEA靶向载紫杉醇相变型PLGA纳米粒,该造影剂粒径小,超声造影效果好,紫杉醇包封率高,释药快,且可特异性靶向卵巢癌细胞表面CEA受体,较好地抑制卵巢癌SKOV3细胞生长。
[1] Zhang F, Zhang ZL. The diagnostic value of transvaginal sonograph (TVS), color Doppler, and serum tumor marker CA125, CEA, and AFP in ovarian cancer. Cell Biochem Biophys, 2015,72(2):353-357.
[2] Mullick Chowdhury S, Wang TY, Bachawal S, et al. Ultrasound-guided therapeutic modulation of hepatocellular carcinoma using complementary microRNAs. J Control Release, 2016,238:272-280.
[3] 周航,黄晓玲,过源,等.链霉亲和素化载紫杉醇相变型PLGA纳米粒的制备及体外超声显影.中国介入影像与治疗学,2016,13(9):571-575.
[4] 张斌,冉海涛,王志刚,等."适配子-PLGA纳米粒"靶向超声/光声相变造影剂的制备.中国医学影像技术,2014,30(11):1609-1613.
[5] Sun C, Panagakou I, Sboros V, et al. Influence of temperature, needle gauge and injection rate on the size distribution, concentration and acoustic responses of ultrasound contrast agents at high frequency. Ultrasonics, 2016,70:84-91.
[6] Schmid BC, Oehler MK. New perspectives in ovarian cancer treatment. Maturitas, 2014,77(2):128-136.
[7] Mittica G, Genta S, Aglietta M, et al. Immune checkpoint inhibitors: A new opportunity in the treatment of ovarian cancer? Int J Mol Sci, 2016,17(7):pii:E1169.
[8] 唐琴,朱深银,常淑芳,等.两种相变型多功能纳米粒的制备及体外特性比较.中国介入影像与治疗学,2016,13(10):636-641.
[9] Zhao YZ, Zhang M, Wong HL, et al. Prevent diabetic cardiomyopathy in diabetic rats by combined therapy of aFGF-loaded nanoparticles and ultrasound-targeted microbubble destruction technique. J Control Release, 2016,223:11-21.
[10] Meng M, Gao J, Wu C, et al. Doxorubicin nanobubble for combining ultrasonography and targeted chemotherapy of rabbit with VX2 liver tumor. Tumour Biol, 2016,37(7):8673-8680.
[11] Sagi-Dain L, Lavie O, Auslander R, et al. CEA in evaluation of adnexal mass: Retrospective cohort analysis and review of the literature. Int J Biol Markers, 2015,30(4):e394-e400.
[12] Jain SK, Haider T, Kumar A, et al. Lectin-conjugated clarithromycin and acetohydroxamic acid-loaded PLGA nanoparticles: A novel approach for effective treatment of H. pylori. AAPS PharmSciTech, 2016,17(5):1131-1140.
[13] 夏琼,冉海涛,王志刚,等.VCAM-1靶向双模态光声/超声纳米级分子探针的制备及其体外寻靶实验.中国医学影像技术,2016,32(3):333-337.
[14] Sheeran PS, Daghighi Y, Yoo K, et al. Image-guided ultrasound characterization of volatile sub-micron phase-shift droplets in the 20—40 MHz frequency range. Ultrasound Med Biol, 2016,42(3):795-807.
[15] Esfandyari-Manesh M, Mostafavi SH, Majidi RF, et al. Improved anticancer delivery of paclitaxel by albumin surface modification of PLGA nanoparticles. Daru, 2015,23:28.
[16] Fonseca C, Simões S, Gaspar R. Paclitaxel-loaded PLGA nanoparticles: Preparation physicochemical characterization and in vitro anti-tumoral activity. J Control Release, 2002,83(2):273-286.
Carcino-embryonic antigen targeted and drug loaded ultrasound nanoparticle agents inhibit growth of ovarian cancer cells in vitro
ZHOUHang1,HUANGXiaoling1*,LIPan2,SHANGTingting2,ZHULeilei2,WANGZhigang2
(1.DepartmentofUltrasound,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China; 2.InstituteofUltrasoundImaging,ChongqingMedicalUniversity,Chongqing400016,China)
Objective To prepare carcino-embryonic antigen (CEA) targeted and paclitaxel loaded phase-shifting PLGA nanoparticles (Ab-PTX-NPs), and investigate the targeting capability and inhibition to the ovarian cancer cell in vitro. Methods Single-emulsion/solvent evaporation (O/W) and carbodiimide method were used to prepare the Ab-PTX-NPs. The size of nanoparticles was determined by Malvern analyzer. The encapsulation and drug loaded efficiency of paclitaxel were detected by high performance liquid chromatography. And the drug release characteristics was measured by dialysis method in constant temperature shaker. The targeting ability of Ab-PTX-NPs to the ovarian cancer SKOV3 cell was evaluated by the laser scanning confocal microscope and flow cytometry. And the inhibition ability of Ab-NPs was investigated by the CCK-8 assays. Results The size of Ab-PTX-NPs was (397.70±99.95)nm. The encapsulation efficiency and drug loading capacity of PTX were (67.26±4.15)% and (6.31±0.39)%, respectively. The conjugating rate of Anti-CEA antibody was (92.74±5.75)%. The targeting study in vitro showed that such a number of contrast agents landed around the SKOV3 cells in targeting group, and the mean fluorescence intensity of ovarian cells in targeting group was significantly higher than other groups (P<0.05). After 24 h, the viability rate of ovarian cells in targeting group was lower than the non-target group (P<0.05), only higher than that of the pure PTX group (P<0.05). But there was no significant difference between the targeting group and the pure PTX group (P>0.05) at 48 h. Conclusion The CEA targeted and paclitaxel loaded phase-shifting PLGA nanoparticles are successfully prepared. It can enhance ultrasound imaging well after activated by LIFU. With high drug-loading efficiency and fast drug release velocity, the Ab-PTX-NPs appeares great targeted ability.
Ovarian neoplasms; Ultrasonography; Contrast media; Paclitaxel; Targeting therapy
国家临床重点专科建设项目(国卫医办函[2013]544号)。
周航(1988—),男,四川雅安人,在读硕士。研究方向:超声造影。E-mail: zhouh528@163.com
黄晓玲,重庆医科大学附属第一医院超声科,400016。E-mail: huangxiaoling_4@163.com
2016-11-04
2017-04-14
R445.1; R737.31
A
1003-3289(2017)06-0816-06
10.13929/j.1003-3289.201611023

