睾丸实性肿块的CT和MRI表现特征
贾承晔,张晓琴,杨 署,刘丽君
(1.内蒙古自治区人民医院影像医学科,内蒙古 呼和浩特 010017;2.内蒙古医科大学附属医院放射科,内蒙古 呼和浩特 010059)
睾丸实性肿块的CT和MRI表现特征
贾承晔1,张晓琴1,杨 署1,刘丽君2*
(1.内蒙古自治区人民医院影像医学科,内蒙古 呼和浩特 010017;2.内蒙古医科大学附属医院放射科,内蒙古 呼和浩特 010059)
目的 分析睾丸实性肿块性病变的影像学特征。方法 回顾性分析18例经病理证实的睾丸实性肿块性病变的CT、MR影像资料,对病灶的部位、密度/信号、大小、形态、边缘以及强化方式等进行分析。结果 18例实性肿块性病变中精原细胞瘤5例,1例肿块巨大,伴点状钙化,4例T2WI可见低信号分隔;淋巴瘤4例,均为原发性弥漫大B细胞淋巴瘤,T2WI以低信号为主;孤立性纤维瘤1例,密度低于肌肉;内胚窦瘤1例,密度/信号不均匀,增强均呈明显网格状持续强化;非特异性炎性肿块4例,2例累及附睾,密度/信号不均;结核性肿块3例,1例边缘可见钙化点,2例表现为稍短T2信号为主的混杂信号肿块。结论 结合患者临床及影像学特征,部分睾丸实性肿块可明确诊断。
睾丸;体层摄影术,X线计算机;磁共振成像
睾丸实性肿块性病变包括肿瘤性及非肿瘤性病变。睾丸实性肿块恶性多见[1],因病理类型不同,其影像学特征各异,CT及MR检查对睾丸实性肿块定位准确,可清晰显示肿块的内部特征及与周围的关系。本研究通过分析经病理证实的18例睾丸实性肿块性病变的影像学特点,旨在提高对睾丸实性肿块性病变的认识。
1 资料与方法
1.1一般资料 收集2013年2月—2015年12月蒙古自治区人民医院经手术及病理证实的睾丸实性肿块性病变18例,均为单侧病变,年龄29~65岁,平均(47.7±12.3)岁,右侧10例,左侧8例;主要临床表现为无痛性睾丸肿大10例,肿大伴不同程度疼痛8例;病程1个月~4年。患者术前行CT或MR检查,其中5例行CT检查,12例行MR检查,1例行CT及MR检查,且检查前均未接受活检、放化疗等。
1.2仪器与方法 CT扫描:采用GE Light Speed VCT 64排螺旋CT机,管电压120 kV,管电流200 mA,扫描层厚5 mm,重建层厚1.25 mm;增强扫描采用双筒高压注射器,经肘静脉注射非离子型对比剂优维显(碘普罗胺,300 mgI/ml)75 ml,速度3.5 ml/s,后以相同速度注射30 ml生理盐水,分别于注射后30 s和60 s行动脉期和静脉期扫描。
MR检查:采用GE Signa HDX 3.0T扫描仪,体部多通道相控阵列线圈。采用常规轴位、矢状位TSE序列T1WI(TR 500 ms,TE 7 ms)、T2WI(TR 2 325 ms,TE 80 ms),层厚4 mm,层间距2 mm;轴位、冠状位T2WI脂肪抑制序列(TR 3 338 ms,TE 80 ms),层厚4 mm,层间距2 mm;动态增强扫描采用三维肝脏快速容积采集(liver acquisition with volume acceleration, LAVA)序列,TR 3.05 ms,TE 1.37 ms,层厚3 mm,FOV 380 mm×380 mm,矩阵256×256,对比剂为Gd-DTPA,剂量0.1 mmol/kg体质量,于注射对比剂后15 s开始扫描,动态连续无间隔扫描10期,每期约36 s。
1.3图像分析 CT及MRI图像分别由2位高年资医师进行盲法阅片,意见有分歧时经协商达成一致,分析病灶的部位、密度/信号、大小、形态、边缘以及强化方式等。
2 结果
18例患者中,肿瘤性病变11例,其中精原细胞瘤5例,淋巴瘤4例,内胚窦瘤1例,孤立性纤维瘤1例;非肿瘤性病变7例,包括非特异性炎性肿块4例,结核性肿块3例。
2.1肿瘤性病变 5例精原细胞瘤中,1例行CT平扫及增强检查,病灶位于右侧睾丸,肿块巨大,最长径约14 cm,密度不均,有点状细小钙化灶,钙化直径1~3 mm,增强扫描明显不均匀强化,并伴腹股沟区多发肿大淋巴结及少量盆腔积液;4例行MR平扫及增强检查,病灶均位于左侧睾丸,T1WI均呈等信号,1例T2WI呈不均匀等/稍高信号,3例T2WI呈不同程度低信号,低于睾丸信号,4例肿块T2WI均可见更低信号分隔,增强扫描早期不同程度强化,随时间延迟,信号逐渐减低。
4例淋巴瘤均为原发性弥漫大B细胞淋巴瘤,均位于右侧睾丸,均行MR平扫及增强扫描,T1WI以等/低信号为主,T2WI呈均匀低信号,增强后呈轻中度强化,其中1例T1WI信号不均,可见小片状短T1信号,T2WI以低信号为主,信号不均匀,边缘清楚,增强后不均匀明显强化(图1)。
1例孤立性纤维瘤位于左侧睾丸,CT平扫肿块呈软组织密度,密度略高于水而低于肌肉密度,病灶密度不均,边缘欠光整。
1例内胚窦瘤位于左侧睾丸,肿块最大径约4.8 cm,呈类圆形,边界尚清楚,CT平扫密度不均匀,T1WI及T2WI呈等/稍低混杂信号,信号明显不均,CT及MR增强后肿块均呈明显不均匀网格状持续强化(图2)。实验室检查血清甲胎蛋白(alpha fetoprotein, AFP)明显增高(>1 000 ng/ml)。
2.2非肿瘤性病变 4例非特异性炎性肿块中,位于右侧睾丸2例,左侧睾丸2例,累及附睾2例。2例接受CT平扫及增强扫描,CT表现为睾丸肿大,呈软组织密度肿块,病变局限,密度不均,边缘分界欠清楚,增强扫描明显不均匀强化;2例接受MR平扫及增强扫描,平扫表现为附睾肿胀,信号不均,病变呈等/稍长T1稍长T2信号,增强后明显强化;1例伴小灶性脓腔形成,脓腔呈长T1长T2信号,DWI呈高信号,增强扫描呈环形强化,并可见鞘膜积液。
3例结核性肿块均位于右侧睾丸,2例累及附睾。1例接受CT平扫,表现为稍高密度结节,边缘可见钙化点,形态欠规整,密度欠均匀;2例接受MR平扫及增强扫描,表现以实性为主的肿块样病变,信号不均,1例呈等/稍长T1稍短T2信号为主的混杂信号,1例呈稍短T1稍短T2信号为主的混杂信号,增强后明显不均匀强化,并伴鞘膜增厚(图3)。
3 讨论
睾丸位置表浅,超声检查简便易行,可用于睾丸病变的动态观察和疗效监测,是临床常用的筛查和随访方法,但对肿块型炎性病变或不典型肿瘤超声难以鉴别;CT和MRI分辨率高,可清晰显示病变与周围组织的关系,在睾丸实性肿块性病变的定位、定性诊断方面具有明显优势[2]。MRI可显示肿块的范围及外侵程度,分辨肿块内囊变、出血、坏死及不同的组织成分,CT可发现肿块内的钙化,并分析钙化形态,增强扫描后分析肿块的血供特点,结合年龄、实验室检查等可以对部分实性肿块做出准确判断。

图1 患者62岁,右侧睾丸淋巴瘤 A.T1WI示肿块信号不均,可见小片状短T1信号; B.T2WI以低信号为主,信号不均匀; C.增强后肿块不均匀明显强化 图2 患者44岁,左侧睾丸内胚窦瘤 A.T2WI呈不均匀等/稍低混杂信号; B、C.MRI(B)及CT(C)增强后均呈明显不均匀网格状强化
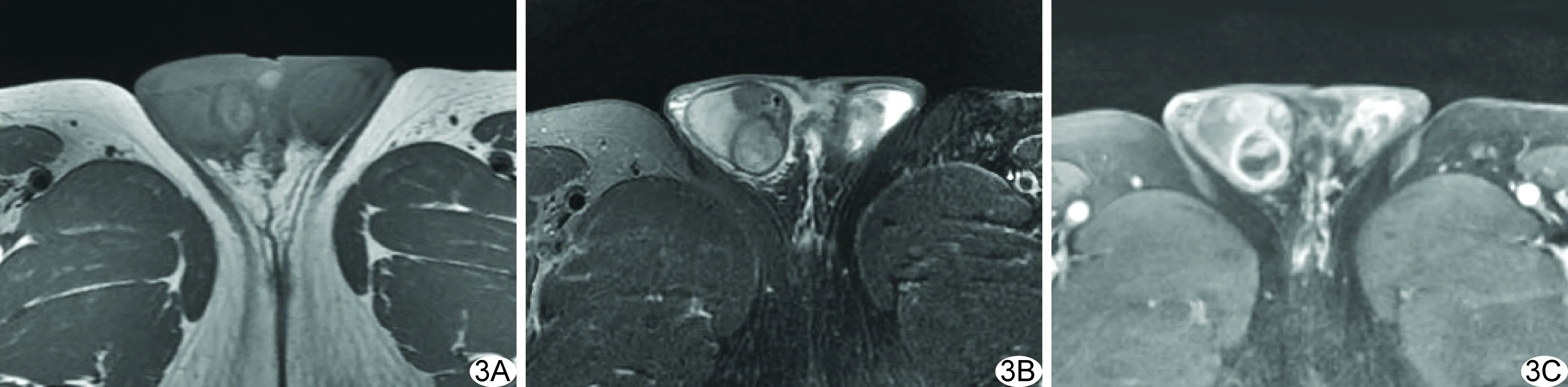
图3 患者56岁,右侧睾丸结核 A.平扫T1WI病变呈等/稍短信号; B.T2WI呈稍短T2为主的混杂信号,内可见间隔; C.增强后病变呈不均匀明显强化
3.1肿瘤性病变 睾丸肿瘤多数为原发肿瘤且多为恶性。主要分为生殖细胞肿瘤和非生殖细胞肿瘤,其中前者占90%~95%,包括精原细胞瘤、胚胎癌、绒毛膜上皮癌,而以精原细胞瘤最为常见。睾丸良性肿瘤少见,主要为成熟型畸胎瘤。
精原细胞瘤多发生在中青年,CT平扫呈软组织肿块,肿块体积多较大,密度欠均匀,可见点状钙化,多边界清楚。本组1例伴腹股沟区淋巴结转移;MR T2WI呈低信号及增强扫描分隔样强化是其较特征性的表现[3-5],本组3例T2WI呈不同程度低信号,MR增强后肿块内可见纤维血管的分隔样强化,其强化程度超过肿瘤组织,与既往研究[3-5]报道一致。内胚窦瘤儿童多见,血清AFP显著升高是其重要的生物学特性。本组中1例是成人患者,年龄44岁,AFP显著升高。有学者[6]报道内胚窦瘤增强后表现为明显不均匀强化,强化幅度可与周围血管相似,本例CT及MR平扫密度/信号不均匀,未见明确脂肪、钙化等多种成分,增强后明显不均匀强化,强化呈网格状。少数精原细胞瘤伴AFP升高,但仅为轻度升高[7],密切结合患者发病年龄、AFP结果,对非精原细胞类的生殖细胞肿瘤的鉴别非常重要。此外,黄梦娜等[8]报道22例生殖细胞瘤中,精原细胞瘤的平均ADC值低于非精原细胞瘤,DWI及ADC值有助于对两者的鉴别。
非生殖细胞瘤中睾丸淋巴瘤多见于60岁以上老年患者,与精原细胞瘤好发于青壮年不同。有研究[9]报道左右侧发病率为3∶10,本组4例均单侧发病,且均位于右侧。淋巴瘤T1WI呈等低信号,T2WI以低信号为主,可因出血坏死呈混杂信号,增强后呈轻中度均匀强化,亦有增强后呈不均匀显著强化的报道[10-11]。本组1例T1WI信号不均,可见小片状短T1出血信号,增强后不均匀明显强化。孤立性纤维瘤可发生于全身各部位,以胸腔最常见[12-13]。本组1例患者仅行CT平扫,其密度略高于水,提示该类肿瘤黏液样变性的特点。研究[14]报道孤立性纤维瘤富血供,具有延迟强化的特点,但本例未行增强扫描。
3.2非肿瘤性病变 睾丸非特异性炎性病变,临床多表现为阴囊区肿痛,常合并附睾炎,多继发泌尿道与其他部位感染,影像学表现为睾丸或附睾弥漫性肿大,多伴鞘膜积液,慢性炎性肿块患者可有急性发作病程。本组4例均可见睾丸肿大,2例附睾明显肿胀且伴鞘膜积液,其中1例脓肿形成。睾丸结核多由输精管蔓延所至,故多合并输精管改变,可增粗变硬,呈串珠样,睾丸、附睾亦可均受累,若出现较典型的病灶周边钙化或淋巴结钙化,有助于结核的诊断。结核病灶影像表现与病理成分相关,干酪性脓肿形成时可表现为囊实性,呈低密度/长T1长T2信号,增强呈环形强化或强化不均,而增殖期病灶主要由肉芽组织构成,实性成分为主,增强扫描明显强化,本组3例病灶,其中1例因CT发现点状钙化而首先考虑结核的诊断。2例T2WI呈相对低信号,可能与局部纤维化有关。
3.3肿瘤性病变与非肿瘤性病变的鉴别诊断 对于伴疼痛、肿大等典型临床症状或附睾受累的表现,诊断睾丸炎性病变并不困难。但当病灶局限,症状不典型时,需与肿瘤性病变相鉴别。本组1例睾丸非特异性炎性肿块误诊为睾丸肿瘤,忽略了患者睾丸轻度触痛的症状及既往有睾丸炎性病变的病史,且其影像表现中病灶内未见明显坏死区而误诊。1例睾丸结核性肿块其内见不典型分隔样强化,误诊为精原细胞瘤。如伴睾丸、精索受累和睾丸鞘膜积液,应考虑到淋巴瘤的可能[15],但淋巴瘤一般轻度强化,而炎性病变一般明显持续强化可有助于鉴别。
3.4本研究的局限性 ①作为回顾性研究,对于病例的选择存在偏倚。②部分病变样本量较少,孤立性纤维瘤及内胚窦瘤分别仅1例。③DWI已成为常规扫描序列,本研究未涉及DWI及ADC值在睾丸病变中的应用。有待进一步扩大样本量,并结合多模态成像进一步研究。
总之,睾丸实性肿块性病变的术前诊断有一定困难,根据肿块的大小、边缘、密度/信号特点、强化方式等综合分析,并结合组织学特性、发病率、发病年龄及特殊的激素分泌异常,部分睾丸实性肿块可明确诊断。
[1] Park SB, Lee WC, Kim JK, et al. Imaging features of benign solid testicular and paratesticular lesions. Eur Radiol, 2011,21(10):2226-2234.
[2] Woodward PJ, Sohaey R, O'Donoghue MJ, et al. From the archives of the AFIP: Tumors and tumor like lesions of the tesitis radiologic-pathologic correlation. Radiographics, 2002,22(1):189-216.
[3] 王亮,张雪峰,王琦,等.睾丸精原细胞瘤的MRI诊断与鉴别诊断.中国中西医结合影像学杂志,2015,13(2):126-128.
[4] 刘仁伟,吴志清,冯丰坔,等.睾丸精原细胞瘤的MRI表现.中国医学影像学技术,2012,28(5):982-985.
[5] Ueno T, Tanaka YO, Nagata M, et al. Spectrum of germ cell tumos: From head to toe. Radiographics, 2004,24(2):387-404.
[6] 杨小英,王娅宁,雷延成,等.小儿睾丸内胚窦瘤CT诊断.医学影像学杂志,2013,23(7):1098-1100.
[7] 陈明旺,江新青,郭永梅,等.睾丸肿瘤的影像表现与肿瘤标记物及病理对照分析.实用放射学杂志,2013,29(12):1979-1982,1991.
[8] 黄梦娜,高雪梅,程敬亮,等.DWI结合ADC值鉴别诊断睾丸生殖细胞瘤.中国医学影像技术,2017,33(1):89-92.
[9] 陈智勇,齐琳,王建松,等.睾丸原发非霍奇金淋巴瘤.中华泌尿外科杂志,2009,30(5):351-353.
[10] Tsili AC, Argyropoulou MI, Giannakis D, et al. Primary diffuse large B-cell testicular lymphoma: Magnetic resonance imaging finding. Andrologia, 2012,44(Suppl 1):845-847.
[11] 梁长松,陈忠,陈泽文,等.睾丸非霍奇金淋巴瘤的MRI表现(2例报告并文献复习).罕少疾病杂志,2013,20(4):44-47.
[12] Zhanlong M, Haibin S, Xiangshan F, et al. Variable solitary fibrous tumor locations: CT and MR imaging features. Medicine (Baltimore), 2016,95(13):e3031.
[13] Herijoelision AR, Cavalleri A, Cucchi JM, et al. Solitary intraperitoneal fibrous tumor: Report of the three cases. Clin Imaging, 2011,35(4):315-319.
[14] 王关顺,刘云霞,高得培,等.孤立性纤维性肿瘤的CT和MRI表现.放射学实践,2013,28(4):455-458.
[15] 龙德云,杜开齐,柳杰,等.原发性睾丸淋巴瘤的MRI表现及其鉴别诊断.中国医学影像技术,2013,29(6):972-975.
CT and MRI features of testicular solid lesions
JIAChengye1,ZHANGXiaoqin1,YANGShu1,LIULijun2*
(1.DepartmentofRadiology,InnerMongoliaAutonomousRegionPeoplesHospital,Huhhot010017,China;2.DepartmentofRadiology,theAffiliatedHospitalofInnerMongoliaMedicalUniversity,Huhhot010059,China)
Objective To analyze the imaging features of testicular solid lesions. Methods The CT and MR findings of 18 cases of testicular solid lesions confirmed by pathology were retrospectively reviewed. The location, attenuation/signal, size, shape, edge, and enhancement patterns of lesions were analyzed. Results In all of the 18 cases, 5 cases were seminomas, 1 of them was huge with punctate calcification, 4 of them had low signal separations in T2WI. Lymphomas were in 4 cases, and all of them were primary diffuse large B cell lymphoma; T2WI was priority with low signal. Solitary fibrous tumor was in 1 case, and the attenuation was lower than that of muscle. Embryo in sinus tumor were in 1 case, and the attenuation/signal was unhomogeneous; the continued enhancement liking grid was obviously seen after contrast injection. Nonspecific inflammatory masses were in 4 cases with involving epididymis in 2 cases, and the attenuation/signal was unhomogeneous. Tuberculous mass were in 3 cases, and 1 case with points of calcificationwas on the edge of lesion, 2 cases characterized by short T2 signals. Conclusion It is possible to make an accurate diagnosis by the combination of clinical data with imaging features in most of the testicular solid lesions.
Testicular neoplasms; Tomography, X-ray computed; Magnetic resonance imaging
贾承晔(1981—),女,内蒙古巴彦淖尔人,硕士,副主任医师。研究方向:泌尿生殖系统影像学。E-mail: jiachengye@126.com
刘丽君,内蒙古医科大学附属医院放射科,010059。
E-mail: 771563910@qq.com
2016-09-06
2017-02-16
R737.21; R445
A
1003-3289(2017)06-0929-04
10.13929/j.1003-3289.201609028

