短葶山麦冬块根发育期光合日变化特征对水分胁迫的响应
范海兰, 陈 灿, 谢安强, 林 晗, 李 键, 洪 伟, 吴承祯
(1.福建农林大学林学院, 福建 福州 350002;2. 福建省森林生态系统经营与过程重点实验室, 福建 福州 350002;3.武夷学院生态与资源工程学院, 福建 南平 354300)
短葶山麦冬块根发育期光合日变化特征对水分胁迫的响应
范海兰1,2, 陈 灿1,2, 谢安强1,2, 林 晗1,2, 李 键1,2, 洪 伟1,2, 吴承祯2,3
(1.福建农林大学林学院, 福建 福州 350002;2. 福建省森林生态系统经营与过程重点实验室, 福建 福州 350002;3.武夷学院生态与资源工程学院, 福建 南平 354300)
以盆栽短葶山麦冬为材料,研究块根发育的 3 个时期不同土壤水分处理(对照(CK)、轻度胁迫(W1)、中度胁迫(W2)、重度胁迫(W3)4个处理)下短葶山麦冬光合参数和水分利用效率日变化特征。结果表明,不同土壤水分条件下短葶山麦冬光合速率均在10:00 达到最大值,光合速率日变化总体表现为单峰型曲线。3 个时期光合速率日最大峰值和日平均值都表现为 CK>W1>W2>W3,3 个时期的蒸腾速率和气孔导度均表现为 CK>W1>W2>W3,水分利用效率(WUE)日均值以 W3 最大,并且上午时段大于下午时段。不同土壤水分条件下光合速率、气孔导度和水分利用效率日均值和日峰值均表现为块根膨大前期>块根发生后期>块根发生中期,而蒸腾速率日均值则表现为块根发生中期>块根发生后期>块根膨大前期。综合分析表明,不同生育时期,水分胁迫导致净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)下降,提高了WUE,Pn下降的原因在不同生育时期表现不同,进入块根膨大期后短葶山麦冬光合速率与水分利用效率表现为上升趋势。
短葶山麦冬; 光合日变化; 水分胁迫; 块根发育
短葶山麦冬(Liriopemuscari(Decne.) Bailey) 亦称福建麦冬,其块根内含有皂苷类化合物和山麦冬多糖等活性成分,具有抗肿瘤、提高免疫活性及护肝等药理作用[1-2],是中国重要的传统中药之一。光合作用是药用植物的重要生理过程之一,其效率高低是药用植物产量高低的决定因素。光合作用对水分胁迫极为敏感,通过研究不同土壤水分条件下药用植物光合作用的日变化特征,可以加深对药用植物光合特性及其变化规律的理解。前人已就短葶山麦冬化学成分、药理活性、栽培措施等方面开展了研究[1-3],而有关水分胁迫对短葶山麦冬光合日进程影响的研究尚未见报道。本研究以福建泉州短葶山麦冬GAP示范基地主栽短葶山麦冬为材料,通过短葶山麦冬对4个土壤水分梯度响应的模拟试验,分析在块根发育、发生和膨大3个不同时期光合日变化特征对土壤水分胁迫的响应规律,为短葶山麦冬种植的水分管理提供理论依据,并为进一步理解不同水分条件下植物地上部分与地下部分之间的关系奠定基础。
1 材料与方法
1.1 试验材料
供试短葶山麦冬为福建省泉州市罗溪镇短葶山麦冬GAP建设示范基地主栽品种。2008-04-01分株移栽于31 cm × 30 cm × 28 cm 的聚乙烯塑料盆中,每盆装匀质土约10 kg,供试土壤基本性状为:田间持水量为29.7%,pH值5.16,有机质20.2 g·kg-1,速效磷 8.70 mg·kg-1,速效钾65.12 mg·kg-1。在福建农林大学森林生态研究所进行培养,培养期间进行适当的管护,防病虫害,并保证土壤水分充足,使之不会成为植株生长的限制因子。同时,为减少由于试验地微环境造成的系统误差,试验期间定期转动花盆位置。
1.2 试验设计
水分控制参照HSIAO[4]的方法划分为4个土壤水分水平:对照 (CK)、轻度干旱 (W1)、中度干旱(W2)和严重干旱(W3)。土壤含水量分别为土壤田间持水量(Field capacity,FC)的80%、65%、50%和35%。2008-08选取长势一致的短葶山麦冬作为研究材料,每处理各30盆,共计120盆。8月下旬开始按试验设计要求进行水分胁迫处理,不浇水待土壤水分分别自然消耗至设定标准后,用称重补水法控制土壤含水量在设定范围内,使各处理的土壤含水量维持在较稳定的水平。2008-09-03达到控水梯度,此后每天用称重法控制土壤水分含量。
1.3 光合日进程测定
相对于其他一些药用植物,目前短葶山麦冬各生育时期的划分并不明确,未有相关文献专门报道,而只是零星出现在一些研究中[3]。结合已有的生育时期划分,本试验光合测定时间大体上可以与短葶山麦冬以下生育时期相对应,分别是块根发生中期(11-11)、块根发生后期(12-10)和块根膨大前期(1-11),日平均气温分别为 22.8 ℃、18.2 ℃和 14.3 ℃。分别在此 3 个时期选择晴朗的天气,采用GFS-3000(德国 Walz )光合仪测定光合速率和环境因子日变化,自8: 00-16: 00每隔 2 h 测 1 次,重复 3 次,结果取平均值。测定指标包括短葶山麦冬的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、叶片温度(TL)、大气温度(Ta)、气体流量(Flow)、胞间 CO2浓度(Ci)、大气 CO2浓度(Ca)、光合有效辐射(PAR) 等指标,并计算叶片水分利用效率(WUE=Pn/Tr)[7]。
2 结果与分析
2.1 短葶山麦冬净光合速率日变化对水分胁迫的响应
不同生育时期短葶山麦冬净光合速率日变化对不同程度水分胁迫的响应格局表现出一定的差异。在块根发生中期,CK 的净光合速率明显高于其他 3 个处理。CK 和 W1 随着光照强度的增强,净光合速率迅速升高,至10:00左右达到最大值,峰值分别为 6.57 和 4.59μmol·m-2·s-1,之后持续快速下降,均表现为宽大的单峰型曲线。W2 和W3 的净光合速率日变化亦为单峰曲线,均在10:00 达到峰值,峰值分别为 4.96 和 3.85μmol·mm-2·s-1,分别比对照下降 24.5%和 41.5%,各水分胁迫处理净光合速率日均值3.13、3.03 和 2.92μmol·mm-2·s-1,分别比 CK(日均值为4.26μmol·mm-2·s-1)下降 26.4%、28.8%和 31.4%;在块根发生后期,各土壤水分条件下净光合速率均属单峰型曲线,CK,W1 和W2 均在10:00达到高峰,峰值分别为7.53、7.27 和 6.40μmol·mm-2·s-1,之后持续下降,W3 在12:00左右达到最大值,峰值为5.09μmol·mm-2·s-1表现为午间高峰型,此时期 CK 光合速率日均值为4.45μmol·mm-2·s-1,其它 3个处理分别为3.81、3.50 和 3.10μmol·mm-2·s-1,分别比 CK 降低了 14.4%、21.4% 和 30.2%。在块根膨大前期,CK 从10:00-14:00 呈现持续相对较高的净光合速率,峰值出现在 14:00,其值为 9.21μmol·mm-2·s-1,W1 净光合速率日变化出现光合“午睡”现象,即表现为午间降低的双峰型,在 12:00 出现低谷,第一峰值和第二峰值均分别出现在10:00和14:00,且午前的峰值均大于午后的峰值,其值为分别为 9.40 和 7.73μmol·mm-2·s-1;W2 和W3 的净光合速率日变化为单峰型曲线,峰值亦出现在10:00,峰值分别为9.03 和6.33μmol·mm-2·s-1,此时期各土壤水分条件净光合速率日均值分别为 7.10、6.45、5.72 和 4.29μmol·mm-2·s-1。3 个时期光合速率日最大峰值和日平均值都表现为 CK>W1>W2>W3,并且随着生育进程的推进,光合速率的日变化受水分胁迫影响更为强烈,在块根膨大前期,此时已胁迫 130 d,光合速率日变化在12:00-16:00 表现出明显的规律,随着水分胁迫的增强光合速率呈明显下降之势(图1)。
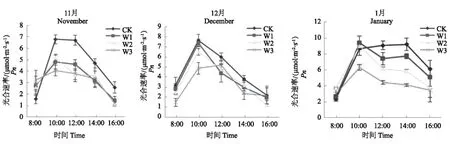
图1 水分胁迫对不同生育期短葶山麦冬净光合速率(Pn)日变化的影响Fig.1 Effects of water stress on the diurnal variation of Pn of Liriope muscari (Decne.) Bailey at different stages
2.2 短葶山麦冬蒸腾速率(Tr)日变化对水分胁迫的响应
在块根发生中期,4 种水分处理下,短葶山麦冬蒸腾速率的日变化均呈单峰曲线,但其峰值出现的时间存在一定差异,在中度胁迫处理下峰值发生前移。随着气温升高,各土壤水分条件下蒸腾速率迅速提高,CK,W1和W3的峰值出现在 12:00,峰值分别为3.17、2.14 和 1.85 mmol·m-2·s-1,而 W2 的峰值出现在10:00,峰值为 1.92 mmol·m-2·s-1,之后均表现为急速下降之势,此时期W1、W2和W3蒸腾速率日均值分别比 CK 下降 32.7%、37.6% 和 41.9%(图2)。在块根发生后期,CK和 W3 蒸腾速率均在12:00出现明显的峰值,峰值分别为 2.08 和 1.42 mmol·m-2·s-1。W1 和W2 则是从12:00-14:00时段维持较高的蒸腾速率,14:00 达到最大值,其值分别为 1.46 和 1.34 mmol·m-2·s-1,此时期W1、W2和W3蒸腾速率日均值分别比对照下降 23.4%、39.8% 和 49.4%。在块根膨大前期,CK、W1和 W3 的峰值出现在12:00,峰值分别为3.46、2.30 和 1.54 mmol·m-2·s-1,W2 在12:00-14:00时段维持较高的蒸腾速率,14:00 出现最大值(2.51 mmol·m-2·s-1),此时期W1、W2 和 W3 蒸腾速率日均值分别比 CK 下降 2.8%、13.2% 和 48.4%。此3个时期,短葶山麦冬蒸腾速率日峰值和日均值均表现为 CK>W1>W2>W3,重度胁迫降幅增大。当土壤水分充足时,植物为了避免高温灼伤叶片,通过蒸腾作用带走叶片热量,增大气孔开度。午后随着气温升高和光照的加强,为了维持叶片细胞的水分,气孔关闭,蒸腾速率因之大幅度下降。在土壤水分严重不足时,叶部水分亏缺提早出现,在中午之前叶肉细胞间隙的水气饱和程度就明显降低,张开度明显减小或关闭,蒸腾速率就开始下降,并且难以恢复到较高的水平,日变化差值逐渐缩小,之后一直都维持在较低水平。但是中午的蒸腾速率依然是全天里最大的,这可能是植物的一种保护机制,通过蒸腾来降低叶片温度以保护植物免受高温的伤害。
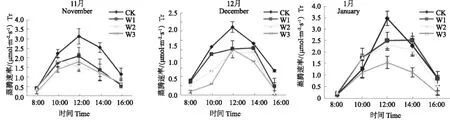
图2 水分胁迫对不同生育期短葶山麦冬蒸腾速率(Tr)日变化的影响Fig. 2 Effects of water stress on the diurnal variation of Tr of Liriope muscari (Decne.) Bailey at different stages
2.3 短葶山麦冬气孔导度日变化对水分胁迫的响应
气孔导度对环境因子的变化十分敏感,凡是影响植物光合作用和叶片水分状况的各种因素都有可能对气孔导度造成影响[5]。适宜的光照强度和温度有利于气孔开张,使气孔导度增大。否则,气孔导度降低,胞间CO2浓度下降,影响光合作用。3 个时期短葶山麦冬气孔导度值均表现为 CK>W1>W2>W3。在块根发生中期,不同土壤水分条件下短葶山麦冬气孔导度的日变化均呈单峰型曲线,CK,W1 和 W2的峰值出现在 10:00,W3 峰值出现在 12:00,此时期W1、W2 和 W3 气孔导度日均值分别比 CK 下降34.4%、40.6% 和 47.2%(图3)。在块根发生后期,4 种水分条件下亦表现为单峰曲线,CK 和 W1 气孔导度均在 10:00 出现明显的峰值,W2 和 W3 峰值出现在 12:00,之后迅速下降,此时期 W1、W2 和 W3 气孔导度日均值分别比 CK 下降25.3%、45.2% 和 58.7%。在块根膨大前期,CK、W2 和 W3 气孔导度呈现单峰曲线,CK 在 12:00 出现最大值,W2 和 W3 的峰值均出现在 10:00,而 W1 气孔导度日变化表现为轻微双峰曲线,峰值分别出现在 10:00 和 14:00,与其净光合速率日变化趋势一致,此时期 W1、W2 和 W3 气孔导度日均值分别比 CK 下降8.2%、22.8% 和 56.2%。
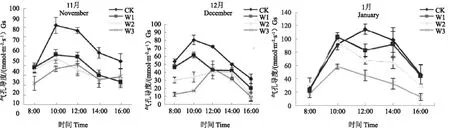
图3 水分胁迫对不同生育期短葶山麦冬气孔导度(Gs)日变化的影响Fig. 3 Effects of water stress on the diurnal variation of Gs of Liriope muscari (Decne.) Bailey at different stages
2.4 短葶山麦冬胞间 CO2浓度(Ci)和气孔限制值日变化对水分胁迫的响应
在块根发生中期CK、W1 和 W2 条件下胞间 CO2浓度(Ci)的日变化表现为两头高中间低的格局,均近似于“W”型,在12:00 出现一个微峰,W3 在8:00-12:00与其它处理不同,呈逐渐上升趋势,在12:00时达到一个峰值后下降,14:00 出现一个低谷后又上升(图4)。在块根发生后期(2008-12),CK和 W1条件下Ci日变化表现为偏 “V型”,10:00 出现低谷后又缓慢上升,W2 条件下Ci日变化表现为“V”型,在正午 12:00 出现低谷后以开始增加,W3 的Ci基本呈逐渐上升的态势。在块根膨大前期(2009-01),各土壤水分条件下Ci日变化呈现倒“U”型曲线,CK、W1 和 W3 均在正午 12:00 达到峰值,而 W2 则在 14:00 出现峰值。
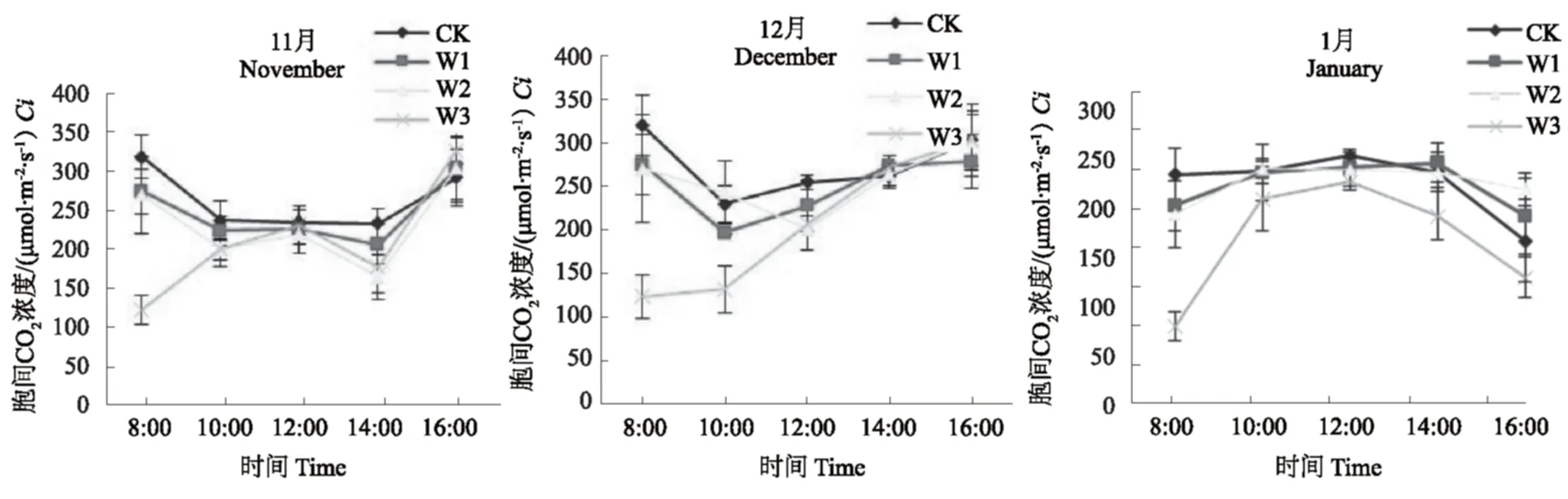
图4 水分胁迫对不同生育期短葶山麦冬胞间CO2浓度(Ci)日变化的影响Fig.4 Effects of water stress on the diurnal variation of Ci of Liriope muscari (Decne.) Bailey at different stages
光合作用的主要限制部位是由气孔或者叶肉细胞变化引起的,FAEQUHAR等[6]认为,影响Pn下降有气孔限制和非气孔限制两方面因素,气孔限制是Gs的下降,阻止了 CO2的供应;非气孔限制是叶肉细胞光合能力的下降,使叶肉细胞利用 CO2的能力降低,从而使胞间 CO2含量升高。一般用气孔限制值(Ls) 和Ci变化方向作为判别依据和标准,其中Ci是关键指标,当Pn和Gs下降时,若Ls增大和Ci降低,则为气孔限制,若Ls减小和Ci增大或不变,则为非气孔限制[6]。结合图1、图4和图5可知,短葶山麦冬 Pn 下降的原因在不同生育期表现不同。在块根发生中期,CK 和 W1 在10:00-12:00是由是由 CO2从外界向细胞内扩散的阻力增加,光合碳固定底物减少的气孔因素引起的,而 W2 和 W3 主要是由叶肉细胞光合活性降低的非气孔限制所致;各土壤水分条件12:00-14:00Pn下降是由气孔因素引起的,14:00-16:00 主要是由非气孔限制引起的。在块根发生后期,CK、W1和 W3Pn下降主要是由非气孔因素引起的,而 W2 处理在 10:00-12:00Pn下降主要是由气孔限制引起的。在块根膨大前期,W1、W2 和 W3 条件下10:00-12:00Pn下降主要是由非气孔限制引起的,12:00-16:00 Pn 下降主要是由气孔因素所致。
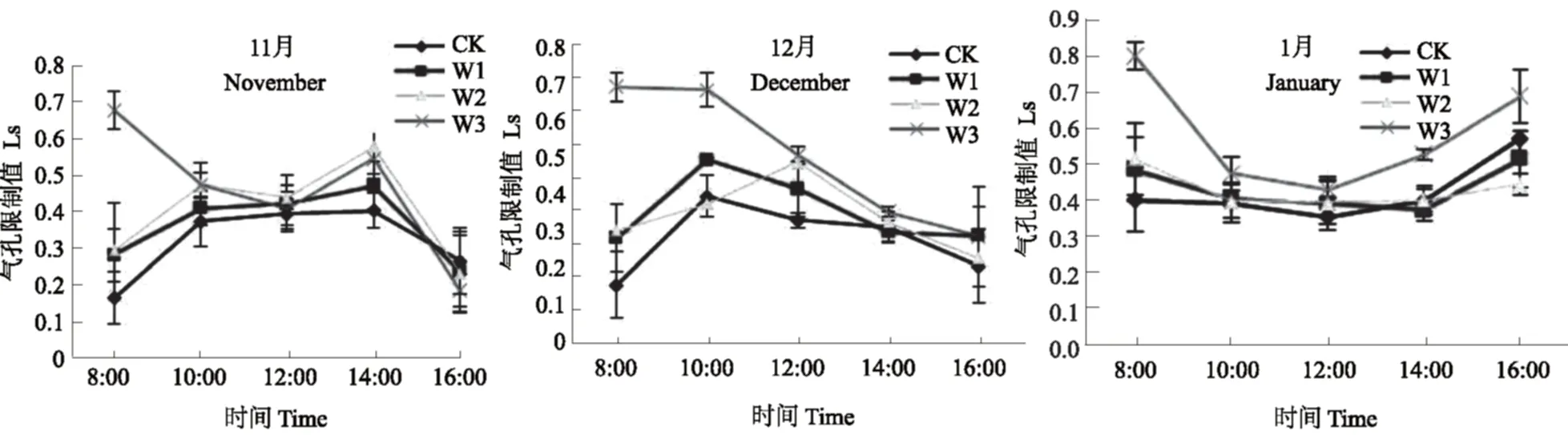
图5 水分胁迫对不同生育期短葶山麦冬胞间气孔限制值(Ls)日变化的影响Fig. 5 Effects of water stress on the diurnal variation of Ls of Liriope muscari (Decne.) Bailey at different stages
2.5 短葶山麦冬水分利用效率(WUE)日变化对水分胁迫的响应
在块根发生中期(2008-11)各土壤水分条件下水分利用效率最大值均出现在上午8:00,之后均呈下降之势,与 CK 相比,W1、W2 和W3 的水分利用效率日均值分别增加16.7%、17.4%和60.8%,说明此时期水分胁迫可提高水分利用效率(图6)。在块根发生后期,CK的水分利用效率表现为逐渐下降之势,而 W1、W2 和 W3在 10:00 出现第1次峰值之后下降至 14:00 达到低谷之后反弹,在 16:00 出现第 2 个高峰,水分利用效率的日平均值表现为 W3(7.09μmol·mmmol-1)>W2(6.52μmol·mmmol-1)>W1(4.51μmol·mmmol-1)>CK(3.80μmol·mmmol-1),W1、W2 和 W3 的水分利用效率日均值分别比对照增加18.6%、71.7%和86.6%。在块根膨大前期,各土壤水分条件下水分利用效率表现相似的变化规律,均呈现为两头高中间低的格局,这是由于午间光合速率下降和蒸腾速率升高同时存在的缘故,此时期亦是 W3 具有最大的日平均水分利用效率,与 CK 相比,W1、W2 的水分利用效率日均值分别降低了8.9%和10.8%,W3 较 CK 增加了 38.7%。并且此 3 个时期上午时段 WUE 均明显高于下午。

图6 水分胁迫对不同生育期短葶山麦冬水分利用效率(WUE)日变化的影响Fig. 6 Effects of water stress on the diurnal variation of WUE of Liriope muscari (Decne.) Bailey at different stages
3 结论与讨论
与其他山麦冬属植物相似,短葶山麦冬净光合速率最大值出现时间亦在 10:00[8]。植物遭受水分胁迫后光合速率降低时Ci是降低还是升高来判断是气孔限制还是非气孔限制[9]。一般条件下,栽培植物的光合作用日变化曲线有双峰型、单峰型、波动型、平缓型等几种类型。有关水分胁迫条件下植物净光合速率日变化曲线未有一致结论。郭卫华等[10]研究表明,随水分胁迫的增强,中间锦鸡儿的净光合速率日变化曲线逐渐从典型的单峰型转变成双峰型,出现光合“午睡”现象。柯世省等[11]研究表明,随着水分胁迫的加重,云锦杜鹃的光合日变化曲线由典型的双峰型逐渐转变为峰值很小的单峰型,峰值的降低在轻度水分胁迫下由气孔限制引起,而在中度和重度水分胁迫下则由非气孔限制引起。张香凝等[12]研究表明,L.tridentat树种的净光合速率日变化曲线随着干旱胁迫的加重都变成了单峰曲线。何军等[5]研究认为,牛心朴子和甘草的光合、蒸腾日变化在土壤水分适宜的时期为双峰曲线,在高光照低土壤水分的情况下为单峰曲线,且土壤水分含量越低,午后光合速率下降越快。本研究表明不同生育期各土壤水分条件下净光合速率日变化总体上表现为单峰型曲线(块根发生中期 W2 和块根膨大前期 W1 除外)。
植物叶片的光合作用日动态变化特征能够反映出一天中植物进行干物质积累和光合等生理代谢的持续能力,同时也是分析环境因子如何影响植物生长和代谢的重要手段之一。由SPAC (土壤—植物—大气连续体) 系统原理可知,土壤水分的可利用性、叶片气孔阻力及空气的水汽压差等参数都是影响水分在此体系中运输能力的主要因素,从而在一定程度上影响植物体的光合生理变化[13],当土壤水分变少时,土壤水势降低,土壤水分可利用性亦随之降低[14]。光合 “午睡” 现象是在一定的土壤水分状况下发生的[9]。根系可感测土壤水分状况,并据此调控气孔行为[15]。水分胁迫对植物光合的抑制包括气孔抑制和非气孔抑制,前者是指水分胁迫使气孔导度下降,CO2进入叶片受阻而使光合下降;后者是指光合器官光合活性的下降[15]。在土壤干旱及正常供水条件下,光合午休的发生都是以气孔限制为开端的,而非气孔限制在午休发生之后才参与进来。干旱条件下植物光合作用的非气孔限制作用加剧,对午休的贡献相应加大。本研究表明短葶山麦冬Pn下降的原因在不同生育期表现不同。在块根发生中期,CK和W1在10:00-12:00是由CO2从外界向细胞内扩散的阻力增加,光合碳固定底物减少的气孔因素引起的,而W2和W3主要叶肉细胞光合活性降低的非气孔限制所致;各土壤水分条件12:00-14:00Pn下降是由气孔因素引起的,14:00-16:00主要是由非气孔限制引起的。在块根发生后期,CK、W1和W3Pn下降主要是由非气孔因素引起的,而W2处理在10:00-12:00下降主要是由气孔限制引起的。在块根膨大前期,W1、W2和W3条件下10:00-12:00Pn下降主要是由非气孔限制引起的,12:00-16:00Pn下降主要是由气孔因素所致,此与以往许多研究结果不同,其原因可能由于植物种类、胁迫历时、测定时间及环境条件差异所致。另外,地下部分的生长发育活动(如块根的生长发育)如何对植物叶片光合特性产生影响还有待进一步深入研究。短葶山麦冬一般在10月进入块根生长期之后块根膨大要持续到翌年3-4月,本研究中光合速率、气孔导度和水分利用效率日均值和日峰值均表现为块根膨大前期>块根发生后期>块根发生中期,即块根膨大期具有较高的光合速率。贾媛媛等[16]研究表明,地黄进入根系膨大期后,正是块根的迅速膨大造成叶片Pn较苗期与花期明显升高,这反映了根类药用植物地上部份与地下部份紧密联系。
[1] 程志红,吴弢,余伯阳, 等.短葶山麦冬化学成分的研究[J].中草药,2005,36(6) : 823-826.
[2] TIAN Y Q,KOU J P,LI L Z,et al. Anti-inflammatory effects of aqueous extract from Radix Liriope muscari and its major active fraction and component[J].Chinese Journal of Natural Medicines,2011(3) : 222-226.
[3] 范海兰,洪伟,吴承祯等.水分胁迫对短葶山麦冬生长和总皂苷量的影响[J]. 应用与环境生物学报,2011,17(3) : 345-349.
[4] HASIO T C. Plant responses to water stress[J]. Ann Rev Plant Physiol, 1973, 24: 519-570.
[5] 何军,许兴,李树华, 等.不同时期牛子心朴子和甘草光合蒸腾日变化的研究[J].西北植物学报,2003,23(10):1676-1681.
[6] Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis[J]. Annual Review of Plant Physiology, 1982, 33: 317-345.
[7] 王云龙,许振柱,周广胜.水分胁迫对羊草光合产物分配及其气体交换特征的影响[J].植物生态学报,2004, 28(6):803-809.
[8] 王晓玲,孙吉雄,石雷, 等.三种山麦冬属植物光合特性研究[J].草原与草坪,2006(3):31-34.
[9] 许大全.光合作用气孔限制分析中的一些问题[J].植物生理学通讯,1997,33(4):241-244.
[10]郭卫华,李波,黄永梅, 等.不同程度的水分胁迫对中间锦鸡儿幼苗气体交换特征的影响[J]. 生态学报,2004,24(12):2716-2722.
[11]柯世省,杨敏文.水分胁迫对云锦杜鹃光合特性日变化的影响[J].福建林业科技,2007,34(3):10-13; 22.
[12]张香凝,孙向阳,王保平, 等.土壤水分含量对Larrea tridentata苗木光合生理特性的影响[J].北京林业大学学报,2008,30(2):95-101.
[13]蒋高明. 植物生理生态学[M] . 北京: 高等教育出版社,2004 :98-100; 161-169.
[14]MOLLES M C. Ecology: concepts and applications (4nd)[M]. New York: Higher education Press and the McGraw-Hill Book Co. 2007.
[15]崔志青,贺德先,赵全志,等.光对作物根系影响研究进展[J].河南农业大学学报, 2005, 39 (4) : 387 - 389.
[16]贾媛媛, 何玉杰,梁宗锁, 等.不同水分处理对地黄光合特性的影响[J].西北农林科技大学学报(自然科学版),2009,37(8):182-186.
(责任编辑:李 莹)
Study on the response of diurnal variation characteristics of photosynthesis ofLiriopemuscari(Decne.) Bailey to water stress during the tuber development
FAN Hailan1,2, CHEN Can1,2, XIE Anqiang1,2, LIN Han1,2, LI Jian1,2, HONG Wei1,2, WU Chengzhen2,3
(1.College of Forestry, Fujian Agricultural and Forestry University, Fuzhou 350002, China;2.Fujian Provincial Key Laboratory of Forest Ecosystem Processing and Management, Fuzhou 350002, China; 3.College of Ecology and Resource Engineering, Wuyi University, Nanping 354300, China)
Four different levels of water stress, mild water stress (W1, 65% FC), moderate water stress (W2, 50% FC), severe water stress (W3, 35% FC) and the control (CK, 80% FC) were applied to study the effects of water stress on the diurnal change of photosynthetic characteristics ofLiriopemuscari(Decne.) Bailey at different growth stages. The net photosynthetic rate reached a maximum at 10:00am under different soil moisture conditions. The diurnal variation of net photosynthetic rate presented a one-peak curve overall. At theso three stages, the maximum peak and average value of photosynthetic rate were expressed as CK> W1> W2> W3, and transpiration rate and stomatal conductance were CK> W1> W2> W3. Under different soil moisture conditions, the daily average and peak value of net photosynthetic rate, stomatal conductance and water use efficiency were early stage of tuber-expanding>later stage of tuber-producing>middle stage of tuber-producing, while the daily average value of transpiration rate was manifestedas as middle stage of tuber-producing>later stage of tuber-producing>early stage of tuber-expanding. Comprehensive analysis showed that at different growth stages, water stress decreased the net photosynthetic rate (Pn), transpiration rate (Tr) and stomatal conductance (Gs), while improve water use efficiency (WUE), reasons for the decline ofPnperformance at different growth stages were different. Net photosynthetic rate and water use efficiency showed an upward trend after entering the root enlargement stage.
Liriopemuscari(Decne.) Bailey; diurnal variation of photosynthesis; water stress; tuber development
2016-06-27
福建省自然科学基金项目(2014J05029)
范海兰(1978-),女,福建南平人,副教授,博士,主要从事植物生理生态学研究。
1000-2340(2017)01-0087-07
Q945.79
A

