毛脉酸模愈伤组织诱导及生物活性成分分析
徐明远,王谦博,崔红花,谢彦梅,岳赛男,吴柏艳,郭盛磊,丁常宏,王振月*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.广东药科大学附属第一医院药学部,广东 广州 510000;3.广东药科大学中药学院,广东 广州 510006;4.西冶地矿实验测试有限责任公司,四川 成都 610051;5.正大天晴药业集团股份有限公司,北京 100000;6.哈药集团三精制药公司,黑龙江 哈尔滨 150060)
毛脉酸模愈伤组织诱导及生物活性成分分析
徐明远1,王谦博2,崔红花3,谢彦梅4,岳赛男5,吴柏艳6,郭盛磊1,丁常宏1,王振月1*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.广东药科大学附属第一医院药学部,广东 广州 510000;3.广东药科大学中药学院,广东 广州 510006;4.西冶地矿实验测试有限责任公司,四川 成都 610051;5.正大天晴药业集团股份有限公司,北京 100000;6.哈药集团三精制药公司,黑龙江 哈尔滨 150060)
目的:建立诱导毛脉酸模愈伤组织的培养方法。方法:比较不同激素配比条件下不同外植体愈伤组织的诱导;采用高效液相色谱法,比较愈伤组织与幼苗中7种指标成分的含量差异。结果:子叶诱导产生的愈伤组织出愈早,量多,增殖快,颜色鲜艳,有生命活力,利于继代培养和进一步进行悬浮细胞的培养;子叶在2号培养基(MS+6-BA 3.0 mg/L+2,4-D 0.1 mg/L)中诱导状况良好,愈伤组织诱导率高,并且愈伤组织生长速度快,愈伤组织为黄绿色,比较疏松,有利于愈伤组织进一步的悬浮细胞培养;愈伤组织中多数化学成分的峰面积较大,所测的7种生物活性成分中,愈伤组织中的白藜芦醇苷和白藜芦醇的含量低于幼苗根,其余5种成分含量均高于幼苗根,尤其是在愈伤组织中检测到了少量的酸模素成分。结论:子叶为诱导愈伤组织的外植体,2号培养基(MS+6-BA 3.0 mg/L+2,4-D 0.1 mg/L)为诱导愈伤组织的最适培养基;愈伤组织含有幼苗根中的全部化学成分,有5种化学成分的含量高于幼苗根,而且还测得有少量酸模素的存在。
毛脉酸模;愈伤组织;诱导
毛脉酸模(R.gmelini)是蓼科(Polygonaceae)酸模属多年生草本植物,原植物名为毛脉酸模[1],黑龙江省部分地区称之为洋铁叶,羊蹄叶[2],产东北、华北、陕西、甘肃、青海(门源)、新疆(阿勒泰)[3]。民间以根入药,对淋病、上呼吸道感染性疾病、癣病和疮毒有确切疗效。主要含白藜芦醇、白藜芦醇苷、大黄素、大黄酚、大黄素甲醚酸模素、大黄酚苷。具有抗肿瘤、抗真菌、抗病毒和抗氧化等作用[4-7]。因具有周期短、可控性强、不受外界条件限制等优点,植物组织培养和大规模植物细胞培养已成为提高药用植物繁育速度、保持优良性状或改良品种及解决药用植物资源匮乏的最有前景的途径[8-10]。本文研究毛脉酸模不同外植体愈伤组织诱导以及培养基条件,同时对愈伤组织与幼苗中7种指标成分的含量进行了对比分析。以期为该药用植物快繁体系的建立和进一步细胞培养获取主要生物活性成分奠定基础。
1 实验材料
1.1 仪器
250-GB型光照培养箱(上海跃进医疗器械厂);二级B2型生物安全柜(北京东联哈尔仪器制造有限公司);电热手提式压力蒸汽消毒器(哈尔滨市松花江医疗器械厂);DK-S24型电热恒温水浴锅(上海森信实验仪器有限公司;ZK-82B型真空干燥箱:上海市实验仪器总厂);美国Waters高效液相色谱仪(Waters 600型泵,2487型二极管阵列检测器,Empower色谱工作站);Mettler电子天平AE 240;DIKMA微孔滤膜(0.45 μm)。
1.2 药品
毛脉酸模幼苗,出芽后生长约30 d的健康幼苗,取子叶和根为外植体。取自黑龙江中医药大学药用植物园温室。样品毛脉酸模幼苗根为生长3个月的干燥根,采于黑龙江中医药大学药用植物园;样品毛脉酸模愈伤组织为组织培养获得。白藜芦醇、白藜芦醇苷均由美国SIGMA公司提供,大黄素、大黄酚、大黄素甲醚均由中国药品生物制品检定所提供,酸模素、大黄酚苷由课题组成员从毛脉酸模植物中提取分离得到,经波谱分析鉴定结构,归一化法计算,含量在98%以上。95%医用酒精(山东利尔康消毒科技有限公司);升汞(分析纯,北京恒业中远化工有限公司);95%乙醇(工业级,哈尔滨市新达化工厂);甲醇(分析纯,北京化工厂);甲醇(色谱纯,美国DIKMA试剂公司);磷酸(分析纯,天津市天河化学试剂厂);水(饮用纯净水,杭州娃哈哈集团有限公司)。
2 实验方法
2.1 无菌材料的获得
选取生长健康的毛脉酸模幼苗,用自来水冲洗,洗去泥沙,转入超净工作台中。无菌条件下,材料用95%医用酒精浸泡(稍搅荡)30 s,后用无菌水冲洗2~3遍,再用0.1%升汞(HgCl2)水溶液浸泡3 min,再用无菌水冲洗3~5遍,最后用无菌滤纸吸干水分,备用[11]。
2.2 愈伤组织的诱导
培养基: MS培养基为基础培养基,添加3%蔗糖,0.9%琼脂粉,调pH 5.8。以植物生长调节剂6-BA和2,4-D为主要因素,以不同的质量浓度:①6-BA:3.0、4.0、5.0 mg/L;②2,4-D:0.1、0.3 mg/L;以不加任何激素的MS培养基为空白对照组,共7个处理方式,见表1。将子叶切成6 mm×3 mm大小,根茎切成1cm长度,将两种外植体分别接种于上述培养基中培养,诱导产生愈伤组织。于光照恒温培养箱中培养,培养温度(25±2)℃,光照14 h/d ,光照强度1 500~2 000 Lx。
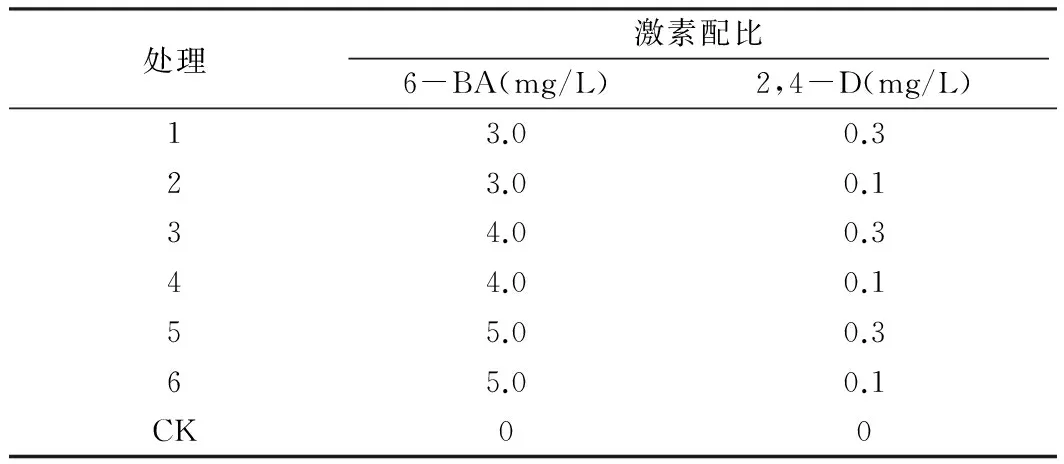
表1 愈伤组织诱导培养基
每5 d观察生长状况,30 d后统计愈伤组织诱导情况。每处理30个培养皿,每个培养皿接种5个外植体,重复3次。公式如下:愈伤组织诱导率=产生愈伤组织的外植体数/未污染的外植体总数×100%。
2.3 愈伤组织化学成分的HPLC分析
2.3.1 色谱条件
色谱柱Thermo C18分析柱(250 mm×4.6 mm,5 μm),预柱Phenomenex ODS-C18(4.0 mm×3.0 mm),流动相为甲醇,0.1%磷酸水,梯度洗脱条件:0~70 min,30%~100%甲醇;流速:1.0 mL/min;检测波长:254 nm;柱温:40℃;进样量:20 μL。
2.3.2 供试样品的制备
幼苗期(生长3个月)毛脉酸模根,阴干,粉碎过80目筛,60℃干燥至恒重;愈伤组织,阴干,粉碎过80目筛,60℃干燥至恒重。分别精密称定毛脉酸模幼苗根粉末和愈伤组织粉末0.5 g,置索氏提取器中加入50%乙醇70 mL,提取时间为4 h,滤过,60℃水浴蒸干。残渣分别用25 mL甲醇溶解并定容至刻度,此溶液再过0.45 μm的微孔滤膜,弃去初滤液取续滤液作为供试品溶液。
3 结果
3.1 愈伤组织诱导培养基的选择
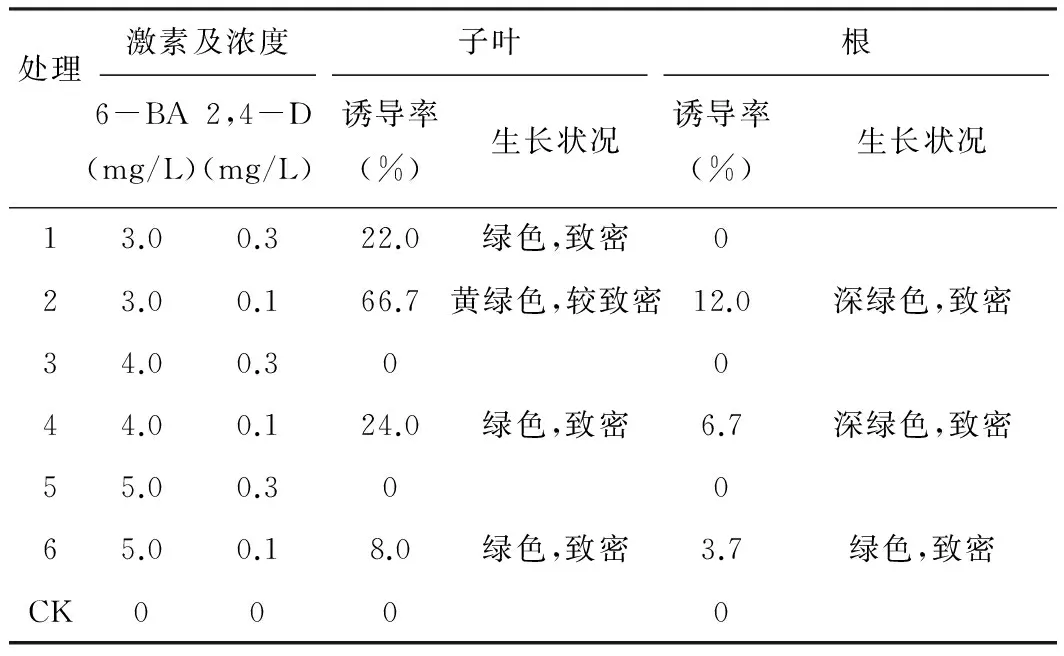
表2 愈伤组织诱导情况
注:以上实验均设3次重复
从表2中可以看出,在空白对照组,不添加任何植物生长激素的MS培养基上,不能诱导产生愈伤组织,说明毛脉酸模愈伤组织的诱导产生,需要植物生长调节剂的刺激诱导。外植体子叶的愈伤组织诱导率明显高于外植体根,根的愈伤组织诱导率极低。经观察得知,根诱导的愈伤组织颜色均为深绿色,量少,致密,生长缓慢,不利于愈伤组织的继代增殖培养。子叶诱导产生的愈伤组织出愈早,量多,增殖快,颜色鲜艳,有生命活力,利于继代培养和进一步进行悬浮细胞的培养。故选择子叶为诱导愈伤组织的外植体。
由表2得知,子叶在2号培养基(MS+6-BA 3.0 mg/L+2,4-D 0.1 mg/L)中诱导状况良好,愈伤组织诱导率高,并且愈伤组织生长速度快,愈伤组织为黄绿色,较致密,见图1,有利于愈伤组织进一步的悬浮细胞培养。综合以上实验结果,选择2号培养基(MS+6-BA 3.0 mg/L+2,4-D 0.1 mg/L)为诱导愈伤组织的最适培养基。

图1 毛脉酸模愈伤组织
3.2 愈伤组织化学成分的HPLC分析
利用高效液相色谱获得毛脉酸模幼苗根和愈伤组织的色谱图,见图2,并根据7种标准品的回归方程计算得到了上述两种样品的化学成分含量,对样品中所测的7种生物活性成分的含量进行了比较。
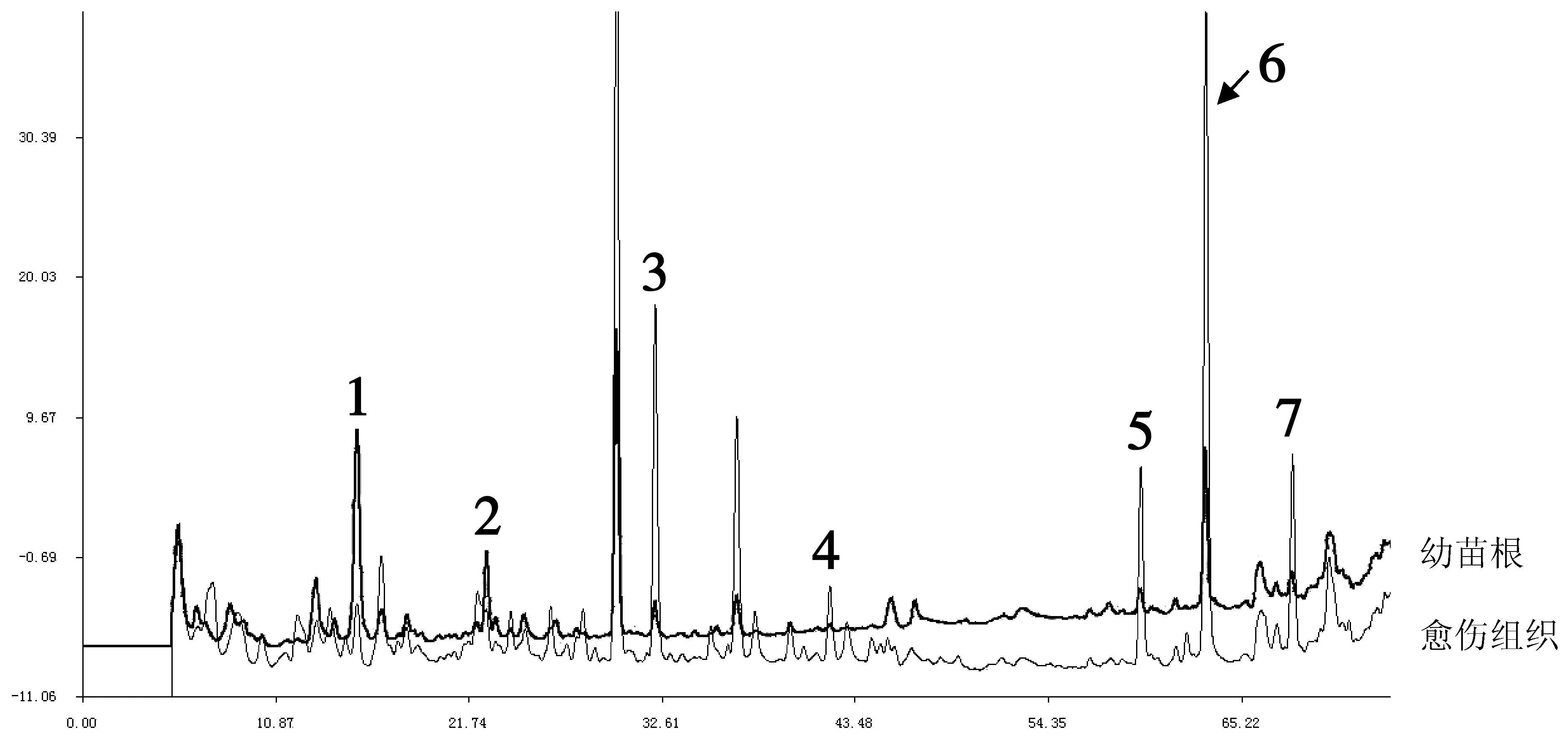
图2 愈伤组织及幼苗根色谱图注:1.为白藜芦醇苷;2.为白藜芦醇;3.为大黄酚苷;4.为酸模素;5.为大黄素;6.为大黄酚;7.为大黄素甲醚
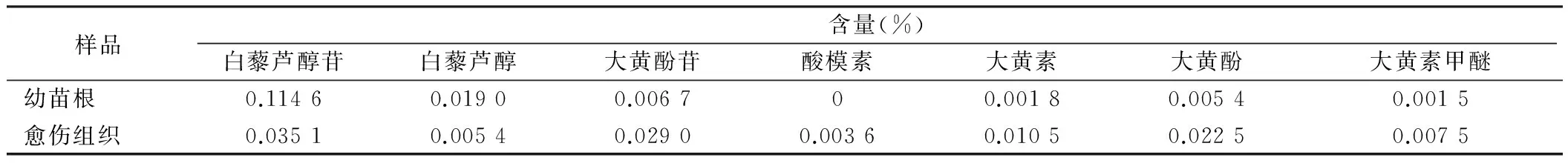
表3 样品化学成分含量
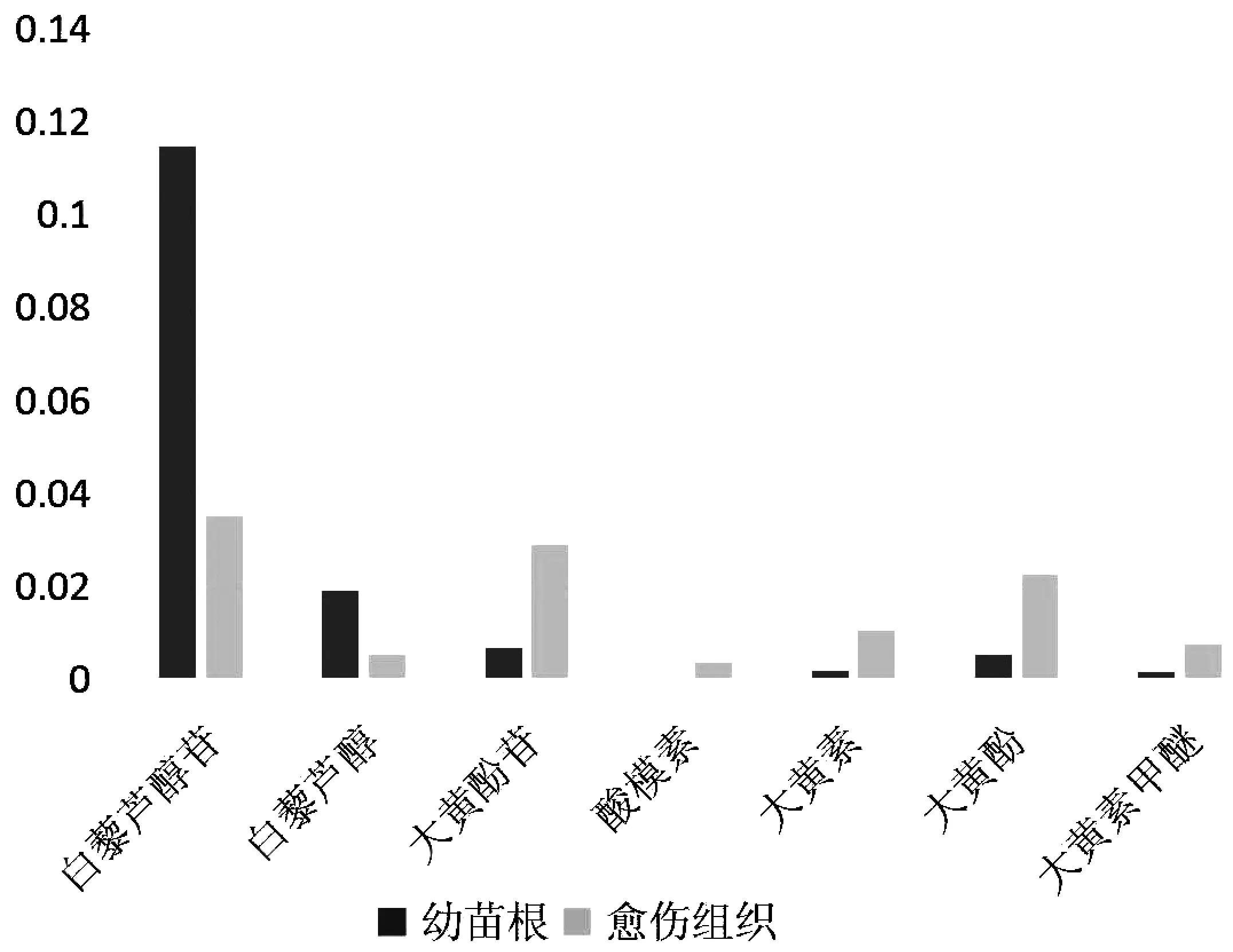
图3 愈伤组织和幼苗根化学成分含量对比
由表3,图3得知,愈伤组织中多数化学成分的峰面积较大,所测的7种生物活性成分中,愈伤组织中的白藜芦醇苷和白藜芦醇的含量低于幼苗根,其余5种成分含量均高于幼苗根,尤其是在愈伤组织中检测到了少量的酸模素成分。
4 讨论
植物次生代谢产物是药物、健康食品、食物添加剂和精细化工品等的重要来源,结构的复杂性导致其化学合成困难。因此不管化学合成的手段多么先进,仍不能取代生物资源作为植物次生代谢产物的来源以从中开发药物和健康食品[12]。本课题组前期研究结果证明其是一个有开发价值的药用植物,目前该药仍以野生资源为主[13-17],并没有进行人工驯化和规模性的栽培。本研究以诱导率和生长状况为指标对毛脉酸模外植体和培养基进行筛选,最终确定选择子叶为外植体,在MS+6-BA 3.0 mg/L+2,4-D 0.1 mg/L培养基中,愈伤组织诱导情况最好,通过继代培养可诱导出大量,比较疏松,有生命活力的愈伤组织。本研究仅是对诱导条件和外植体的筛选进行了初步研究,后续应选取毛脉酸模中有效指标成分进行筛选。利用高效液相色谱,分析毛脉酸模幼苗根和愈伤组织的化学成分含量,在所测的7种化学成分中,愈伤组织含有幼苗根中的全部化学成分,其中有5种化学成分的含量高于幼苗根,而且还测得有少量酸模素的存在。本研究进行成分分析的为第1 代愈伤组织, 下一步还需对其进行筛选和驯化以建立悬浮细胞培养体系。本研究结果对毛脉酸模的繁殖和细胞培养获取其主要药效物质具有一定的参考意义。
[1] 傅沛云.东北草本植物志(卷2)[M].北京:科学出版社,1959:24.
[2] 谢宗万,余友琴.全国中草药名鉴(上册)[M].北京:人民卫生出版社,1996:274-276.
[3] 国科学院中国植物志编辑委员会.中国植物志(第25卷)[M].北京:科学出版社,1979:147-166.
[4] 刘奂,马微微,岳赛男,等.毛脉酸模体外抗菌及抗病毒作用的实验研究[J].哈尔滨商业大学学报(自然科学版),2014,30(2):154-156.
[5] 李延冰,王振月,李晓毛.中草药毛脉酸模抑菌实验研究[J].中医药信息,1992,9(5):27.
[6] 王振月,唐先明,康毅华,等.毛脉酸模提取物体内抗肿瘤作用的实验研究[J].实用医学杂志,2013,29(16):2652-2655.
[7] 任秀明,王谦博,刘奂,等.毛脉酸模化学成分及其相关成分的活性研究进展[J].中医药信息,2014,31(6):124-126.
[8] 刘军,彭菲.紫锥菊的组织培养和植株再生[J].植物生理学通讯,2004,40(5):577.
[9] Koroch A, Juliani H R, Kapteyn J, et al. In vitro regeneration of Echinacea purpurea from leaf explants[J]. Plant cell, tissue and organ culture, 2002, 69(1): 79-83.
[10] 王伯初,刘万钱,段传人.紫锥菊的组织培养及其实用快速繁殖[J].重庆大学学报(自然科学版),2005,28(5):120-122.
[11] 谢彦梅,许岩,常丰华,等.毛脉酸模无菌苗的制备及下胚轴愈伤组织诱导的研究[J].中医药信息,2012,29(2):98-100.
[12] Rao S R, Ravishankar G A.Plant cell cultures: Chemical factories of secondary metabolites[J].Biotechnol Adv,2002,20(2):101-153.
[13] 王振月,叶万辉,杨润福.毛脉酸模药材资源的调查研究[J].中药材,1996,19(12):603-605.
[14] 王星星,王振月,王博,等.毛脉酸模内生真菌RGT-S4生长曲线及菌丝体化学成分初步研究[J].中医药学报,2013,41(5):17-19.
[15] 周玉,孙晓佳,孙莹,等.响应面法分析优化毛脉酸模多糖提取工艺[J].中医药学报,2013,41(3):48-52.
[16] 门敬菊,王振月,王宗权.植物生长调节剂对毛脉酸模根中白藜芦醇及白藜芦醇苷的影响[J].中医药学报,2011,39(5):60-62.
[17] 康毅华,门敬菊,王宗权,等.植物生长调节剂对毛脉酸模根中蒽醌类成分及生物量的影响[J].中医药学报,2010,38(3):71-74.
Analysis of Induction and Bioactive Constituents ofRumexGmeliniCallus
XU Ming-yuan1, WANG Qian-bo2, CUI Hong-hua3,XIE Yan-mei4,YUE Sai-nan5, WU Bai-yan6, GUO Sheng-lei1, DING Chang-hong1, WANG Zhen-yue1
(1.HeilongjiangUniversityofChineseMedicine,Harbin150040,China; 2.TheFirstAffiliatedHospitalofGuangdongMedicalUniversity,Guangzhou510000,China; 3.CollegeofTraditionalChineseMedicine,GuangdongPharmaceuticalUniversity,Guangzhou510006,China;4.XiyeMineralTestCo.Ltd.,Chengdu610051,China; 5.CTTQPharmaceuticalLtd,Beijing100000,China;6.SanjingPharmaceuticalCompany,Harbin150060,China)
Objective: To establish a culture method of callus induction forRumexgmelini. Methods: The callus inductions of different explants were compared under different hormone conditions. The content difference of seven kinds of components was also compared in the callus tissue and seedlings by HPLC method. Results: The callus of cotyledons grew early, with large quantity, fast proliferation, bright color, and full vitality, which was beneficial to the subculture and further culture of suspension cells. The cotyledons were induced well in No.2 culture medium (MS+6-BA 3.0 mg /L+2,4-D 0.1 mg/L), with high induction rate and fast growth speed. The callus is yellow-green and loose, which was good for further culture of cell suspension. The peak areas of most chemical components in the callus were larger. In terms of the seven bioactive components, polydatin and resveratrol in the callus were less than those in the seedling root. The contents of the other five components in the callus, in which a little amount of musizin was especially detected, were more than those in the seedling roots. Conclusion: The research suggests that the cotyledon may be the explants for callus induction, optimal medium is No.2 culture medium (MS+ 6-BA 3 mg/l+2,4-D 0.1 mg/l). The callus contained all the chemical elements in the seedling roots, of which the contents of five components were higher than those in the seedling roots, a little amount of musizin was also found.
Rumexgmelini; Callus; Induction
2016-07-07
2016-08-15
国家自然科学基金项目(30970300);哈尔滨科技创新人才研究专项基金项目(2010rfxxs031)
徐明远(1980-),男,博士研究生,临床药师,主要从事中药药效物质基础研究,中药资源开发利用与资源质量评价工作。
*通讯作者:王振月(1955-),男,教授,博士研究生导师,主要从事中药资源开发利用与资源质量评价、中药材规范化生产理论与调控技术。
R285
A
1002-2392(2017)03-0041-04

