莱菔硫烷对C57BL/6小鼠急性酒精性肝损伤的保护作用
李宝龙,单毓娟,刘旭,李松滨,刘永武,姜波
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.哈尔滨工业大学,黑龙江 哈尔滨 150090)
莱菔硫烷对C57BL/6小鼠急性酒精性肝损伤的保护作用
李宝龙1,单毓娟2*,刘旭1,李松滨1,刘永武1,姜波1
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.哈尔滨工业大学,黑龙江 哈尔滨 150090)
目的:研究莱菔硫烷对酒精诱发的肝脏功能异常的保护作用。方法:雄性C57BL/6 小鼠按体质量随机分为5组(n=12):阴性对照组、酒精模型组、SFN处理组(SFN的剂量分别为10 mg/kg、20 mg/kg、40 mg/kg),先给处理组动物经口灌胃不同剂量的SFN共10 d(1次/d),在末次灌胃SFN后,立即给予酒精模型组和SFN处理组动物酒精(5 g/kg),每12 h 1次,共3次,末次给予酒精4h后结束整个实验,常规HE染色观察肝脏病理变化,采用半自动生化分析仪检测血清、肝匀浆中相关指标的表达水平。结果:病理学和血清学指标表明,成功建立了小鼠急性酒精性肝损伤模型,莱菔硫烷能明显减轻酒精对肝脏的病理学损伤,高剂量莱菔硫烷保护组的作用明显,莱菔硫烷能保护酒精对AST、ALT、ALP3种代谢酶功能的损伤,莱菔硫烷能提高肝匀浆抗氧化酶SOD和GSH-Px活性,降低脂质过氧化物MDA的水平。结论: 莱菔硫烷能保护酒精对肝脏功能的损伤,其主要作用机制与SFN提高了酒精代谢的关键酶SOD和GSH-Px活性密切相关。
莱菔硫烷;肝损伤;酒精代谢;抗氧化
有研究显示,全球人均年酒精的摄入量已达6.2 L[1],过量摄入酒精将危及多种器官的正常功能,从而增加疾病风险。肝脏是人体重要的代谢、解毒器官,也是受酒精毒害的首要器官。在酒精性肝损伤的发病机制中,氧化性应激损伤起了关键的作用。莱菔硫烷(sulforaphane, SFN)富含于十字花科蔬菜中,具有代谢解毒、抗氧化、组蛋白去乙酰化等活性[2-7],是一种极具开发价值的Ⅱ相代谢酶诱导剂[8]。同时莱菔硫烷作为一种间接抗氧化剂,可通过激活抗氧化酶活性和升高抗氧化物的水平来发挥强大的抗氧化作用[9]。据此推测莱菔硫烷能通过抗氧化途径来保护急性酒精摄入后对肝脏的损伤作用。为验证上述假设,本研究拟通过预先给予莱菔硫烷以诱导体内部的抗氧化能力,随后急性投予酒精,探究莱菔硫烷的保护性作用及可能机制。
1 材料和方法
1.1 主要试剂
莱菔硫烷购自LKT laboratories公司(英国)。GSH-Px、SOD和MDA检测试剂盒购自南京建成生物科技有限公司(南京,中国)。Bradford 蛋白检测试剂盒购自碧云天生物技术研究所(上海,中国);AST、ALT和 ALP检测试剂盒购自中生北控生物科技公司(北京,中国)。
1.2 实验动物及饲养
SPF级雄性C57BL/6 小鼠(5周龄)购自北京维通利华实验动物技术有限公司,合格证号SCXK(京)2012-0001,在屏障环境内经过5天的适应性喂养后进行正式分组及实验。在实验期间实验动物自由饮水、摄食。SPF级60Co辐照灭菌小鼠维持饲料购自北京科澳协力饲料有限公司。动物实验室温度22~24℃、相对湿度55%~60%、照明12 h/12 h昼夜交替进行。
1.3 实验动物分组及处理
60只雄性C57BL/6 小鼠按体质量随机分为5组(n=12),分别是阴性对照组、酒精模型组、SFN处理组(SFN的剂量分别为10 mg/kg、20 mg/kg、40 mg/kg)。实验开始时,给处理组动物经口灌胃不同剂量的SFN,每天1次,灌胃10 d。急性酒精性肝损伤模型参照Carson 和 Pruett的方法构建,动物在末次灌胃SFN后,立即给予酒精模型组和SFN处理组动物酒精(5 g/kg),每12 h 1次,共给予3次,末次给予酒精4 h后,眼球取血制备血清,颈椎脱臼处死动物。阴性对照组给予等热量的葡萄糖。
1.4 肝脏组织病理检查
剪取肝脏右叶,以10%福尔马林溶液固定,常规石蜡包埋,4 μm连续切片,HE染色,制片后光学显微镜下观察肝组织基本病理变化。
1.5 肝匀浆制备及氧化还原指标的测定
取0.5 g肝左叶在预冷的生理盐水(NS)中漂洗数次,滤纸吸干后加入4.5 mL预冷NS匀浆。用眼科剪尽快剪碎组织块,并于玻璃器皿中制成10%肝组织混悬液,然后在4℃条件下以10 000 r/min离心20 min,取上清(即为肝匀浆)分装于EP管中,置于冰箱(-80℃)中冷冻保存。按照试剂盒说明,用酶标仪测定超氧化物歧化酶(SOD)活性、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)含量。
1.6 血清肝功能生化指标测定
血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)的活性采用中生北控生物科技公司的试剂盒,用半自动生化分析仪进行测定。
1.7 统计学处理
2 实验结果
2.1 SFN对酒精引起的肝脏病理学异常的保护作用
光镜下观察,阴性对照组小鼠肝脏组织结构完整,细胞索以中央静脉为中心向四周呈放射状整齐排列,肝小叶轮廓清晰,肝细胞呈多边形,细胞分界清,核圆而清晰,位于细胞中央,细胞质丰富,无脂肪变性和炎症反应,见图1A。模型组小鼠肝小叶界限不清,肝细胞浆出现不同程度的空泡变性,以肝包膜下的肝细胞为明显,轻者肝细胞浆松化呈网状,重者胞体肿大或呈球形,胞浆透明,肝窦受压、紊乱。小叶各带可见散在的点、灶状坏死,主要见于中央静脉周围区,坏死灶及肝窦内可见较多量嗜中性粒细胞、淋巴细胞及单核细胞浸润,见图1B。高剂量SFN预保护组细胞索排列较整齐,肝细胞呈现多边形,细胞分界清,核圆而清晰,位于细胞中央,细胞质未见脂肪滴,见图1C。低、中剂量的SFN组肝细胞中浊肿明显减轻,有散在炎细胞浸润,肝细胞内偶有小脂滴,见图1E和1D。
2.2 莱菔硫烷对小鼠血清中ALT、AST、ALP水平的影响
由表1可知,与阴性对照组相比,酒精模型组小鼠血清中ALT水平明显升高(P<0.01),为模型组ALT水平的3.9倍,AST、ALP水平也有升高(P<0.05),分别为模型组的1.27倍、1.51倍,提示酒精引起了肝脏的损伤。给予莱菔硫烷后,与酒精模型组相比,低剂量组ALT、AST、ALP水平未出现差异性变化,中剂量组ALT、AST、ALP水平明显降低(P<0.01或P<0.05),高剂量组ALT、ALP水平也明显降低(P<0.01),并具有剂量-效应关系;而AST水平仅在中剂量SFN预保护组有显著性差异。

图1 酒精对肝脏摄入的影响及SFN的保护作用(×400)注:A.阴性对照组;B.酒精模型组;C.SFN(40 mg/kg);D.SFN(20 mg/kg);E.SFN(10 mg/kg)

表1 莱菔硫烷对小鼠血清中相关代谢酶活性的影响
注:与阴性对照组相比,#P<0.05,##P<0.01;与酒精模型组相比,*P<0.05,**P<0.01
2.3 SFN对酒精引起的肝脏氧化性损伤的保护作用
由表2可知,急性酒精刺激后,酒精模型组肝组织中的抗氧化酶SOD、GSH-Px活性分别降低27%和34%,而MDA含量升高较为明显,达86%(P<0.01)。中、高剂量SFN 能够明显的保护酒精对GSH-Px活力的抑制作用,与模型组(274.92±79.76)相比,约升高30%~32%;SFN对SOD活性的保护作用呈剂量-效应关系,与模型组比较,约升高17%~46%,以中高剂量SFN的保护作用更加强烈。SFN能明显降低MDA产生,降低幅度在39%~43%(P<0.05),且呈剂量-效应关系。
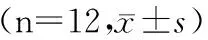
表2 SFN对小鼠肝组织抗氧化酶和MDA的影响
注:与阴性对照组相比,#P<0.05,##P<0.01;与酒精模型组相比,*P<0.05,**P<0.01
3 讨论
本研究结果表明,SFN能增强抗氧化酶的活性、抑制脂质过氧化物的生成,从而保护酒精对肝脏功能的损伤作用。急性酒精刺激后,肝组织中表现出的空泡变性、肝细胞浆疏松化甚至肿大;肝小叶散在的点、灶状坏死及肝窦内炎性细胞的浸润,均说明了肝脏受损。高剂量(40 mg/kg)SFN能够明显保护肝脏组织,其组织学表现已经接近了阴性对照组,说明SFN能够保护急性酒精性肝损伤。
酒精摄入后造成肝损害,其明显特征是细胞酶外漏至血浆[10]。本研究发现急性酒精摄入后, AST、ALT、ALP等水平的增高,提示肝功能受损,该结果与前人结果一致[10];同时ALT的变化比AST敏感,有可能是由于二者亚细胞定位不同所致,ALT位于细胞质,而AST位于线粒体中,只有损伤比较严重时AST释放量才增加。Seung HK等[11]人研究发现,SFN可改善CCl4所致肝组织中MDA生成。脂质过氧化反应是导致酒精性肝损伤的重要原因。自由基的生成以及脂质过氧化物的产生在酒精产生肝内外毒性的机制上扮演了重要角色[12]。酒精通过细胞色素P450 2E1(CYP2E1)和乙醇脱氢酶(ADH)介导生成很多自由基,引发脂质过氧化反应,导致肝细胞损伤[13]。MDA是细胞脂质过氧化反应中具有代表性的产物,其含量的多少预示脂质过氧化的强度。因此测定组织中MDA的含量常可反映脂质过氧化反应的强弱,间接反映细胞损伤程度[14]。SOD清除过多的超氧化阴离子,并将其转化成H2O2,再由GSH-Px和CAT进一步氧化成O2和H2O,减少自由基的产生,降低脂质过氧化的生成并加速其清除,从而减轻肝细胞损伤[15-16]。SFN正式通过抑制上述一系列的级联式反应中的关键酶如SOD和GSH-Px,加强了机体清除MDA的能力,最终保护了肝脏功能。
综上,本研究结果表明SFN预保护后,再给予小鼠急性酒精刺激,能明显保护小鼠急性酒精性肝损伤;其初步作用机制与SFN提高了酒精代谢的关键酶SOD和GSH-Px活性有关。
[1] Rehm J., Mathers C., Popova S., et al. Global burden of disease and injury and economic cost attributable to alcohol use and alcohol-use disorders[J]. The Lancet,2009,373(9682):2223-2233.
[2] Tortorella SM, Royce SG, Licciardi PV, et al. Dietary sulforaphane in cancer prevention: The role of epigenetic regulation of HDAC inhibition[J]. Antioxid Redox Signal,2015,22(16):1382-1424.
[3] Dinkova-Kostova AT and Kostov RV. Glucosinolates and isothiocyanates in health and disease[J]. Trends in Molecular Medicine,2012(18):337-347.
[4] Liang H, Yuan Q. Natural sulforaphane as a functional chemopreventive agent: including a review of isolation, purification and analysis method[J]. Crit Rev Biotechnol,2012,32(3):218-234.
[5] Lee JH, Moon MH, Jeong JK, et al. Sulforaphane induced adipolysis via hormone sensitive lipase activation, regulated by AMPK signaling pathway[J]. Biochemical and Biophysical Research Communications,2012,426:492-497.
[6] 孟鑫雨,王金库,刘旭,等.莱菔硫烷神经保护作用研究进展[J].中医药信息,2016,33(2):108-111.
[7] 黄睿,丁忠庆,何灿霞,等.莱菔硫烷对HCY致内皮细胞炎症损伤的治疗作用[J].中医药信息,2013,30(2):14-16.
[8] Tan XL, Spivack SD. Dietary chemoprevention strategies for induction of phase Ⅱ xenobiotic-metabolizing enzymes in lung carcinogenesis: a review[J]. Lung cancer,2009,65(2):129-137.
[9] De Figueiredo SM, Binda NS, Nogueira-Machado JA, et al. The antioxidant properties of organosulfur compounds (sulforaphane)[J]. Recent Pat Endocr Metab Immune Drug Discov., 2015,9(1):24-39.
[10] Baldi E, Burra P, Plebani M, et al. Serum malondialdehyde and mitochondrial aspartate aminotransferase activity as markers of chronic alcohol intake and alcoholic liver disease[J]. Ital J Gastroenterol,1993(25):429-432.
[11] Baek SH, Park M, Suh JH, et al. Protective effects of an extract of young radish (Raphanus sativus L) cultivated with sulfur(sulfur-radish extract) and of sulforaphane on carbon tetrachloride-induced hepatotoxicity[J]. Biosci Biotechnol Biochem,2008(72):1176-1182.
[12] Nordmann R. Alcohol and antioxidant systems[J]. Alcohol,1994(29):513-522.
[13] Lieber CS. New concepts of the pathogenesis of alcoholic liver disease lead to novel treatments[J]. Curr Gastroenterol Rep,2004(6):60-65.
[14] Park CM, Cho CW, Rosenfeld ME, et al. Methionine supplementation accelerates oxidative stress and nuclear factor kappaB activation in livers of C57BL/6 mice[J]. J Med Food,2008(11):667-674.
[15] 耿广琴,杨志军,杨秀娟,等.道地黄芩与甘肃产黄芩对急性肝损伤小鼠保肝作用的比较研究[J].中医药学报,2015,43(3):42-44.
[16] 徐强,韦永昌,徐启铭,等.益肝胶囊对免疫性肝损伤小鼠HMGB1蛋白表达的影响[J].中医药学报,2016,44(6):48-50.
Preventive Effects of Sulforaphane on Acute Alcoholic Hepatic Injury Model of C57BL/6 Mice
LI Bao-long1, SHAN Yu-juan2, LIU Xu1, LI Song-bin1, LIU Yong-wu1, JIANG Bo1
(1.HeilongjiangUniversityofChineseMedicine,Harbin150040,China;2.HarbinInstituteofTechnology,Harbin150090,China)
Objective:To investigate the effects of sulforaphane (SFN) on abnormal function of liver induced by alcohol. Methods:Male C57BL/6 mice were randomly divided into 5 groups (n=12), which were the negative control group, alcohol model group, and SFN pretreatment group (10 mg/kg, 20 mg/kg, 40 mg/kg). Mice were daily gavaged SFN with different dose for ten days. At the end of last intake of SFN, mice in groups of the alcohol model and SFN pretreatment were gavaged alcohol(5 g/kg) every 12 hours for 3 times. The whole experiment was ended after 4 hours of last alcohol intake. HE staining was performed to check the pathological changes of liver. Blood and liver homogenates were collected to measure the expression levels of the relevant indicators by semi-automatic biochemistry analyzer. Results: The acute hepatic injury model was successfully established in C57BL/6 mice, as shown by indicators of pathology and serum. SFN, in high dose especially could lessen the pathological damage induced by alcohol. Also SFN significantly inversed the activities of AST, ALT and ALP induced by alcohol. SFN obviously activated the anti-oxidant enzymes including SOD and GSH-Px. Additionally, SFN pretreatment could inhibit the alcohol-induced MDA level, products of lipid peroxidation in dose-dependent way. Conclusion: SFN can protect the functions of liver damaged by alcohol. The main mechanisms may be associated with enhancing the antioxidant-enzymes, which are in charge of the metabolisms of alcohol.
Sulforaphane; Hepatic Injury/Liver damage; Alcohol metabolism; Antioxidant
2016-05-03
2016-12-30
黑龙江省教育厅科学技术研究项目(12541763);国家自然科学基金面上项目(81573135)
李宝龙(1973-), 男,博士,副教授,硕士研究生导师,主要从事中药及植物提取物抗衰老研究。
*通讯作者:单毓娟(1972-),女,博士,教授,博士研究生导师,主要从事植物化学物的生物活性及分子机制研究。
R285.5
A
1002-2392(2017)03-0013-03

