生酮饮食对癫痫大鼠海马的保护作用及机制研究
蒋艳 王宝辉 贾濛濛 卢裕强 裘涛 章正祥 侯群
生酮饮食对癫痫大鼠海马的保护作用及机制研究
蒋艳 王宝辉 贾濛濛 卢裕强 裘涛 章正祥 侯群
目的 探讨生酮饮食(KD)对戊四氮(PTZ)点燃大鼠海马损伤及哺乳动物雷帕霉素钯蛋白(mTOR)通路表达的作用机制。方法 将55只雄性SD大鼠隔日腹腔注射PTZ制作癫痫动物模型直至完全点燃,另5只大鼠(空白对照组)腹腔注射0.9%氯化钠溶液。完全点燃后的44只大鼠随机分成4组,即正常食物(ND)+PTZ组、ND+PTZ+雷帕霉素(RAP)组、KD+PTZ组、KD+PTZ+RAP组,每组11只,均予侧脑室置管并再次给予隔日腹腔注射PTZ,共5次;其中ND+PTZ+RAP组、KD+PTZ+RAP组给药前30min侧脑室注射RAP,ND+PTZ组、KD+PTZ组予以等量人工脑脊液。观察并比较5组大鼠癫痫发作等级,海马区神经元密度,海马区pS6、S6、pAkt、Akt、pAMPK、AMPK的表达(采用Western blot法检测)。结果 KD+PTZ组大鼠癫痫发作等级明显低于ND+PTZ组(P<0.01);KD+PTZ+RAP组发作等级明显低于ND+PTZ组及ND+PTZ+RAP组(均P<0.05)。海马CA1区神经元密度:KD+PTZ组明显大于ND+PTZ组(P<0.05),KD+PTZ+RAP组大于ND+PTZ+RAP组(P<0.05),ND+PTZ+RAP组大于ND+PTZ组(P<0.05)。与空白对照组相比,ND+PTZ组pS6/S6、pAkt/Akt蛋白表达增加(均P<0.05),其余4组pAMPK/AMPK蛋白表达均增高(均P<0.05);与ND+PTZ组相比,KD+PTZ组pS6/S6、pAkt/Ak蛋白表达均降低(均P<0.05),pAMPK/AMPK蛋白表达增高(P<0.05);与ND+PTZ组相比,ND+PTZ+RAP组pS6/S6、pAkt/Akt蛋白表达均明显降低(均P<0.05);与KD+PTZ组相比,KD+PTZ+RAP组pS6/S6、pAkt/Akt蛋白表达明显降低(均P<0.05);与ND+PTZ+RAP组相比,KD+PTZ+RAP组pS6/S6蛋白表达明显下降(P<0.05),pAMPK/AMPK增高(P<0.05)。结论 KD具有抗癫痫发作、减少神经元丢失的作用,这种保护作用可能与其对mTOR通路的抑制有关,且其上游可能通过抑制Akt通路的磷酸化、激活AMPK通路的磷酸化来调节mTOR通路。
生酮饮食 哺乳动物雷帕霉素钯蛋白信号通路 癫痫 海马 神经保护
生酮饮食(KD)是一种“高脂肪、低碳水化合物、适量蛋白”的饮食方案,目前用于治疗难治性癫痫,但相关作用机制尚未清楚。学者推测KD对癫痫的神经保护主要体现在减少癫痫发作的“外源性”干预以及通过“内源性”信号通路调节作用来修复癫痫发作所破坏的正常神经环路。哺乳动物雷帕霉素钯蛋白(mTOR)通路是一个在生理和病理状态下发挥不同作用的重要信号通路,在癫痫的发生中起着重要的作用,是KD“内源性”神经保护机制的重要通路。本研究选择雄性SD大鼠,分别在戊四氮(PTZ)点燃后给予正常食物(ND)与KD,观察并比较两组大鼠癫痫发作的严重程度、海马神经元密度,检测mTOR及其上游调控通路的关键蛋白表达,并与给予mTOR通路抑制剂雷帕霉素(RAP)的大鼠进行比较,以探讨KD对癫痫大鼠海马的保护作用及可能机制。
1 材料和方法
1.1 材料和仪器 选择出生后42d(P42)雄性SD大鼠,体重260~280g(上海斯莱克实验动物有限责任公司提供,清洁级Ⅱ级);ND(Slac-M01大鼠繁殖料,上海斯莱克公司提供),KD(4∶1配比,商品名:ketoCal,上海Nutricia公司提供)。主要仪器:恒温冰冻切片机(HM550,上海Microm公司),普通光学显微镜(日本Olympus公司),立体定位仪(512600,美国Stoelting公司);侧脑室给药套管(62003,深圳瑞沃德公司),Western blot装置(上海Bio-Rad公司)。主要试剂:PTZ(#P6500,上海Sigma-Aldrich公司),雷帕霉素(#37094,上海Sigma-Aldrich公司),BCA蛋白浓度测定试剂盒(江苏碧云天生物技术有限公司),pAkt(Ser473)兔单克隆抗体(#9271,1∶1 000,美国CST公司),Akt兔单克隆抗体(#4691,1∶1 000,美国CST公司),pAMPK(Thr172)兔单克隆抗体(#2535,1∶1 000,美国CST公司),AMPK兔单克隆抗体(#5831,1:1 000,美国CST公司),pS6(Ser240/244)兔单克隆抗体(#2215,1∶1 000,美国CST公司),S6兔单克隆抗体(#2217,1∶1 000,美国CST公司)。
1.2 方法
1.2.1 分组及建模 60只大鼠喂ND,随机选5只为空白对照组(0.9%氯化钠溶液,腹腔注射,1次/48h);其余55只大鼠予PTZ点燃(35mg/kg,腹腔注射,1次/48h),每次注射后放入透明观察箱20min,根据Racine发作等级评定标准[1]评价:无变化为0级,眨眼为1级,点头为2级,单肢阵挛为3级,双肢阵挛伴站立为4级,双肢阵挛伴站立、倒地为5级。大鼠连续3次发作等级为4级及以上则为“被完全点燃”。一旦完全点燃,停止继续注射PTZ,注射16次以上未完全点燃者不纳入本实验。共有44只大鼠完全点燃,随机分为4组,即ND+PTZ组(喂ND)、ND+PTZ+RAP组(喂ND)、KD+PTZ组(喂KD)、KD+PTZ+RAP组(喂KD),每组11只。
1.2.2 侧脑室置管给药 空白对照组、ND+PTZ组、ND+ PTZ+RAP组、KD+PTZ组、KD+PTZ+RAP组予戊巴比妥钠麻醉并固定于立体定位仪上,根据大鼠脑图谱[2],将脑室给药套管插入右侧侧脑室(前囟后0.8mm,右侧旁开1.5mm,深度3.8mm)并通过牙科水泥固定于颅骨,术后大鼠休养10d。空白对照组继续予隔日腹腔注射0.9%氯化钠溶液,其余4组继续予隔日腹腔注射35mg/kg PTZ,共5次;观察5组大鼠癫痫发作情况。通过PE管将侧脑室套管连于微量注射泵,ND+PTZ+RAP组、KD+ PTZ+RAP组每次PTZ腹腔给药前0.5h,将mTOR通路抑制剂RAP 5μl(浓度4ng/μl)缓慢泵入侧脑室,空白对照组、ND+PTZ组、KD+PTZ组侧脑室泵入等量人工脑脊液。
1.2.3 海马神经元计数 每组取5只大鼠行尼氏染色观察海马区神经元。行为学实验结束后予过量水合氯醛麻醉,以100ml PBS液、200ml 4%多聚甲醛溶液依次灌注后立即取脑,置入4℃4%多聚甲醛过夜,置于30%磷酸蔗糖溶液1~2d至标本沉底。行冠状冷冻切片(厚10μm),每个脑组织从前囟向后3.0、3.2、3.4、3.6、3.8mm各取一张。用0.1%焦油紫染色,在光学显微镜下观察海马CAl、CA3及DG区锥体细胞形态,计算单位面积下完整的锥体细胞数。
1.2.4 mTOR通路相关蛋白表达检测 每组取5只大鼠,末次PTZ给药后2h使用过量水合氯醛麻醉后直接断头,快速取右侧海马置入液氮速冻。Western blot时将组织剪碎,加入100μl预冷的裂解液、适量10%蛋白酶抑制剂Cocktail和磷酸酶抑制剂,冰上匀浆及离心后取上清液行总蛋白定量。将上清液与6×上样缓冲液混合后,沸水浴加热5min,离心取上清液。于4℃凝胶电泳,电转移lh至硝酸纤维膜,用5%脱脂奶粉溶液4℃封闭过夜,加入一抗体室温孵育2h,TFBS洗膜3次,每次10min;加入HRP标记的2抗,室温孵育膜2h,TBS洗膜4次,每次15min。
1.3 统计学处理 应用SPSS 16.0统计软件。所有计量资料符合正态分布,用表示。癫痫发作等级采用多组重复测量资料的双因素方差分析(Two-way ANOVA),两两比较采用Bonferroni法;海马神经元密度和Western blot结果采用单因素方差分析(One-way ANOVA),两两比较采用LSD-t法。
2 结果
2.1 KD对癫痫发作的影响 完全点燃后继续予PTZ,KD+PTZ组癫痫发作等级低于ND+PTZ组(P<0.05);KD+ PTZ+RAP组发作等级分别低于ND+PTZ组、ND+PTZ+ RAP组(均P<0.05);ND+PTZ+RAP组与ND+PTZ组比较差异无统计学意义(P>0.05);KD+PTZ+RAP组与KD+ PTZ组比较差异亦无统计学意义(P>0.05),见图1。
2.2 KD对海马区神经元密度的影响 海马CA1区代表性尼氏染色结果见图2。4组大鼠点燃后海马CA1、CA3及DG区神经元较空白对照组均有不同程度的丢失(均P<0.05),CA1区:KD+PTZ组神经元密度大于ND+PTZ组(P<0.01),KD+PTZ+RAP组神经元密度大于ND+PTZ+RAP组(P<0.05),ND+PTZ+RAP组神经元密度大于ND+PTZ组(P<0.05),KD+PTZ+RAP组与KD+PTZ组比较差异无统计学意义(P>0.05);CA3、DG区点燃后4组间比较差异均无统计学意义(均P>0.05),见表1。
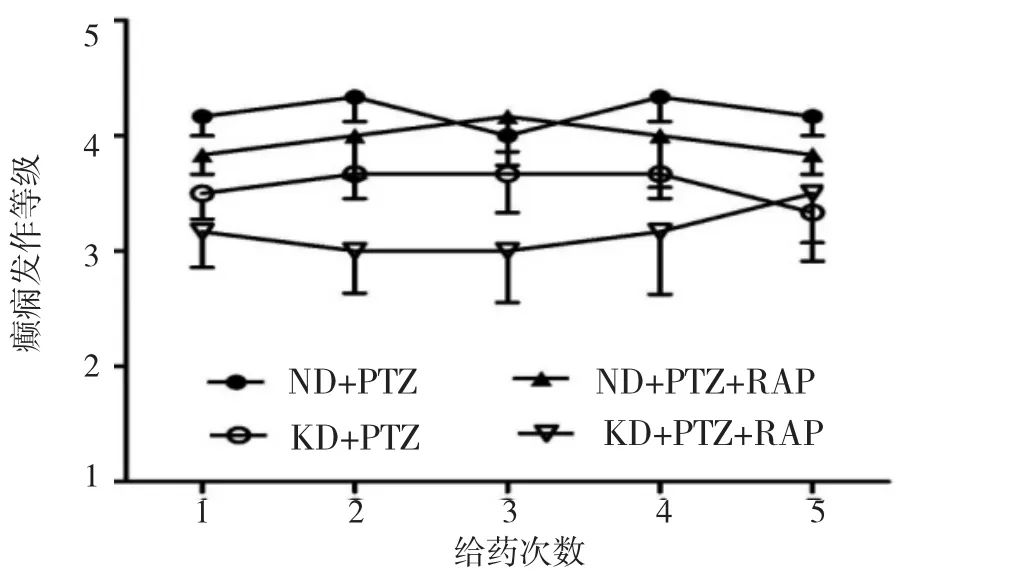
图1 5组大鼠点燃继续予PTZ的发作等级
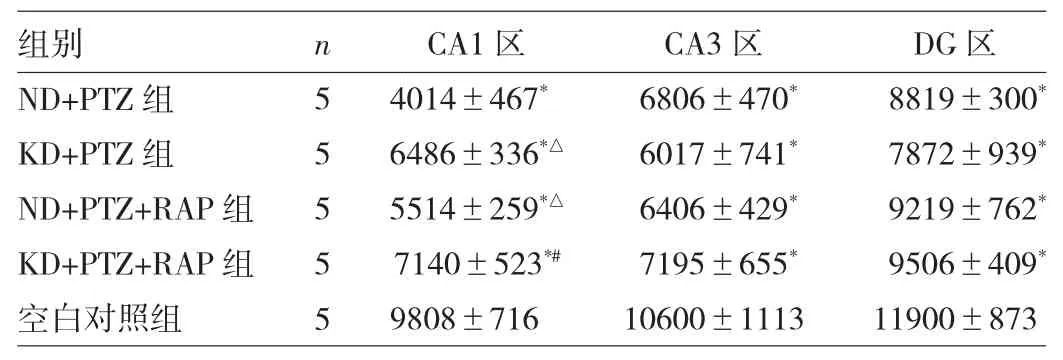
表1 5组大鼠海马CA1、CA3及DG区神经元密度比较(个/mm2)

图2 5组大鼠海马CA1区光学显微镜下所见(a:空白对照;b:ND+PTZ;c:ND+PTZ+RAP;d:KD+PTZ;e:KD+PTZ+RAP;尼氏染色,×40)
2.3 KD对mTOR通路的影响 与空白对照组相比,ND+PTZ组pS6/S6蛋白表达明显增加(P<0.05),提示癫痫发作可激活mTOR通路。与ND+PTZ组相比,KD+ PTZ组pS6/S6蛋白表达降低(P<0.05),提示KD可激活mTOR通路。加入RAP后,与空白对照组相比,KD+PTZ+RAP组、ND+PTZ+RAP组pS6/S6蛋白表达均明显降低(P<0.05);KD+PTZ+RAP组较KD+PTZ组明显降低(P<0.05);ND+PTZ+RAP组较ND+PTZ组明显降低(P<0.05);KD+PTZ+RAP组较ND+PTZ+RAP组明显降低(P<0.05),见图3。
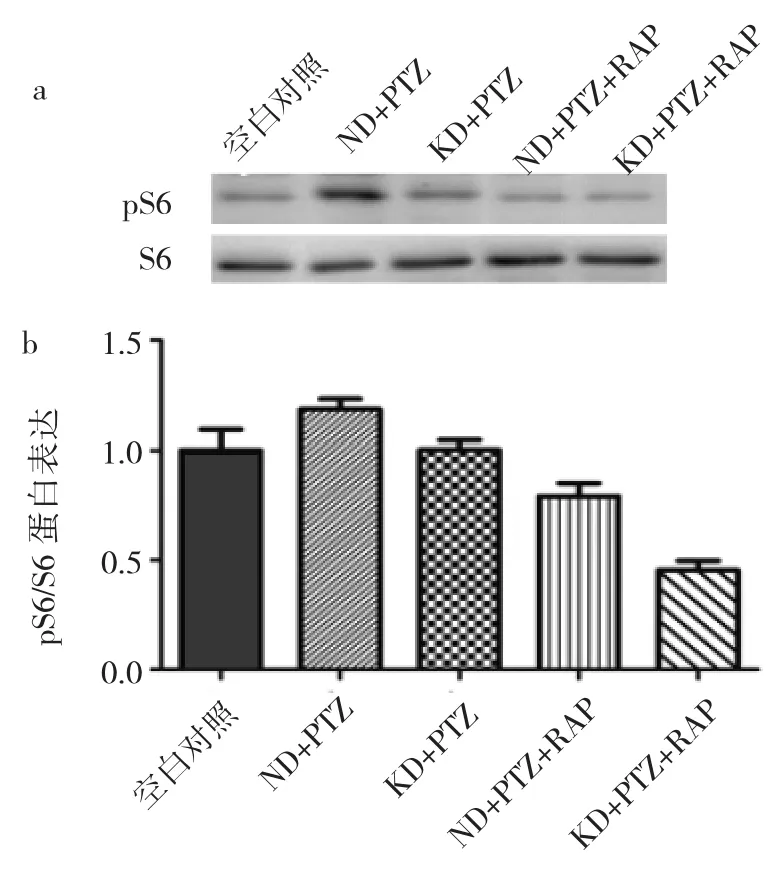
图3 5组大鼠海马组织pS6/S6蛋白表达(a:Western blot电泳图;b:空白对照组、ND+PTZ组、KD+PTZ组、ND+PTZ+RAP组、KD+PTZ+RAP组相对表达量分别为 1.00±0.09、1.18±0.05、1.00±0.42、0.79±0.06和0.45±0.04)
与空白对照组相比,ND+PTZ组pAkt/Akt蛋白表达明显增高(P<0.05),提示癫痫发作可激活Akt通路的磷酸化。与ND+PTZ组相比,KD+PTZ组pAkt/Akt蛋白表达明显降低(P<0.05),提示KD可抑制Akt磷酸化。加入RAP后Akt磷酸化进一步被抑制,KD+PTZ+RAP组pAkt/Akt蛋白表达较KD+PTZ组明显降低(P<0.05),ND+PTZ+RAP组较ND+PTZ组明显降低(P<0.05);KD+PTZ+RAP组与ND+PTZ+RAP组比较差异无统计学意义(P>0.05),见图4。
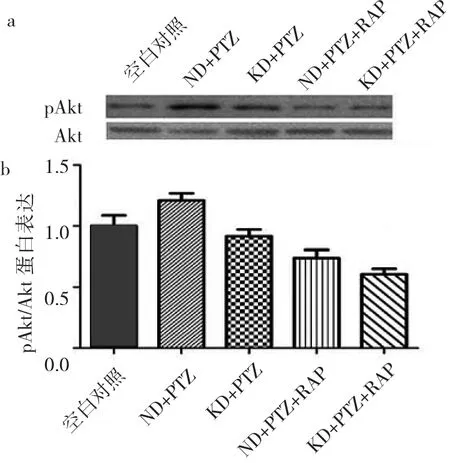
图4 5组大鼠海马组织pAkt/Akt蛋白表达(a:Western blot电泳图;b:空白对照组、ND+PTZ组、KD+PTZ组、ND+PTZ+RAP组、KD+PTZ+RAP组相对表达量分别为 1.00±0.09、1.20±0.06、0.92±0.05、0.74±0.07和0.61±0.46)
与空白对照组相比,其余4组大鼠点燃后pAMPK/ AMPK蛋白表达均明显增高(均P<0.05),提示癫痫发作可激活AMPK通路磷酸化。与ND+PTZ组相比,KD+ PTZ组pAMPK/AMPK蛋白表达增高(P<0.05),提示KD可激活AMPK通路。加入RAP后,KD+PTZ+RAP组pAMPK/AMPK蛋白表达较ND+PTZ+RAP组增高(P<0.05);KD+PTZ+RAP组与KD+PTZ组、ND+PTZ+RAP组与ND+PTZ组分别比较,差异均无统计学意义(均P>0.05),见图5。

图5 5组大鼠海马组织pAMPK/AMPK蛋白表达(a:Western blot电泳图;b:空白对照组、ND+PTZ组、KD+PTZ组、ND+PTZ+RAP组、KD+PTZ+RAP组相对表达量分别为1.00±0.08、1.35±0.12、1.69±0.07、1.57±0.10和1.94±1.43)
3 讨论
本研究结果显示KD可降低完全点燃大鼠的癫痫发作等级,提示KD有抗癫痫发作作用;这与Hansen等[3]研究结果一致。癫痫发作可导致海马神经元数量减少,而KD能减少点燃大鼠CA1区神经元的丢失;该结果与笔者前期在慢性杏仁核点燃模型中发现KD减少海马CA1区神经元丢失相一致[4],亦支持前期“在PTZ模型中发现KD对认知的保护作用”的研究结果[1]。
在生理情况下,mTOR信号通路上游调节因子主要包括机体营养、能量状态、生长因子和应激等[5];在病理情况(创伤性脑损伤、缺氧、应激等)下,mTOR信号通路被激活,下游多条通路被激活,可调节中枢神经系统内突触可塑性及神经元存活[6-7]。目前在多种与癫痫高度相关的疾病(结节性硬化、局灶性皮质发育不良等)中观察到mTOR信号通路发生改变,并在多种癫痫动物模型中证实该信号通路激活具有促进癫痫形成的作用[8-10]。Zhang等[11]发现在急性PTZ给药模型中急性发作后数小时内mTOR通路激活,而慢性期无效。在KA模型中,mTOR通路激活呈双时相。本研究显示完全点燃大鼠末次PTZ给药后2h海马mTOR通路关键蛋白pS6的表达增加,提示mTOR通路被激活;KD+PTZ组海马pS6表达低于ND+PTZ组,提示KD抑制了部分mTOR通路的激活。以上结果与McDaniel等[12]在KA模型中的研究结果相一致。KD是一种能量及营养状况相对缺乏的饮食,它能降低胰岛素水平,对mTOR通路具有抑制。本研究同时检测了上游Akt、AMPK两条主要可能影响mTOR通路的调控因子,发现pAkt在癫痫发作后增高,给予KD后pAkt的增高被抑制,可见pAkt与pS6的变化趋势一致,提示pAkt在KD抑制mTOR通路的过程中起到正调控mTOR通路的作用。pAMPK在颅内的表达存在争议,McDaniel等[12]研究发现在生理状态下KD仅增加肝脏pAMPK,对脑内pAMPK无影响,但Genzer等[13]发现给予KD后脑内pAMPK增加了约40%。本研究结果显示在PTZ点燃这一病理状态下,海马的pAMPK在发作后增高,推测其目的是促进细胞内ATP的供应,这种增高可能与癫痫发作引起大量的能量消耗有关。本研究结果还显示给予KD后pAMPK进一步增加,这与Jeon等[14]在小鼠KA模型中发现KD下调pAM PK相反,笔者推测pAMPK的激活可能具有双重作用,即Jeon等[14]在给KA前就给予KD,反映的是pAMPK在KD的抗癫痫形成过程中的改变,此时pAMPK的增高是一种有害因素,予KD来抑制AMPK磷酸化,从而起到神经保护的作用;然而本研究先将大鼠点燃,再给予KD,测定的是pAMPK在KD的抗癫痫发作中的表达,此时pAMPK的增高是一种保护作用,它能有效负调控mTOR通路,减少下游的细胞死亡,起到神经保护作用。
由于PAP的剂量、动物模型及研究方法不同,目前对RAP通过抑制mTOR通路影响癫痫发作和癫痫发生的研究结果存在差异。Zeng等[10]在KA模型中发现癫痫发作早期给予RAP能有效抑制神经元死亡,从而抑制癫痫的发生;晚期给予RAP虽阻断mTOR的慢性激活,减少苔藓纤维发芽,但对减少神经元死亡无效。Guo等[15]认为RAP预先处理可能比RAP后处理更能有效地保护神经元,且RAP预先处理并非通过直接影响神经元的兴奋性起作用。本研究比较了KD和RAP后处理对癫痫发作及海马神经元的影响,发现KD可抑制癫痫发作,对海马神经元有保护作用,RAP后处理对ND组神经元数量亦有保护作用,但RAP是否参与KD对海马神经元的保护效应仍缺乏直接的依据,且RAP对ND、KD癫痫发作均无直接作用,故KD可能在减少癫痫损伤方面较RAP更有优势。
综上所述,本研究显示KD在戊四氮点燃模型中具有抗癫痫发作、抗神经元丢失的保护作用,可能与其对mTOR通路的抑制有关,且其上游可能通过抑制Akt通路的磷酸化及激活AMPK通路的磷酸化来调节mTOR通路。
[1] Jiang Y,Lu Y,Jia M,et al.Ketogenic diet attenuates spatial and item memory impairment in pentylenetetrazol-kindled rats[J]. Brain Res,2016,1646:451-458.
[2] Paxinos G,Watson C.The rat brain in stereotaxic coordinates[M]. 6th ed.London:Elsevier Inc,2007:110-113.
[3] Hansen S L,Nielsen A H,Knudsen K E,et al.Ketogenic diet is antiepileptogenic in pentylenetetrazole kindled mice and decrease levels of N-acylethanolamines in hippocampus[J].Neurochem Int,2009,54(3-4):199-204.
[4] Jiang Y,Yang Y,Wang S,et al.Ketogenic diet protects against epileptogenesis as well as neuronal loss in amygdaloid-kindling seizures[J].Neurosci Lett,2012,508(1):22-26.
[5] Wong M.Mammalian target of rapamycin(mTOR)inhibition as a potential antiepileptogenic therapy:From tuberous sclerosis to common acquired epilepsies[J].Epilepsia,2010,51(1):27-36.
[6] Amiel E,Everts B,Freitas T C,et al.Inhibition of mechanistic target of rapamycin promotes dendritic cellactivation and enhances therapeutic autologous vaccination in mice[J].J Immunol,2012, 189(5):2151-2158.
[7] Park K K,Liu K,Hu Y,et al.Promoting axon regeneration in the adult CNS by modulation of the PTEN/mTOR pathway[J].Science, 2008,322(5903):963-966.
[8] Zeng LH,Xu L,Gutmann D H,et al.Rapamycin prevents epilepsy in a mouse model of tuberous sclerosis complex[J].Ann Neurol,2008,63(4):444-453.
[9] Huang X,Zhang H,Yang J,et al.Pharmacologicalinhibition of the mammalian target of rapamycin pathway suppresses acquired epilepsy[J].Neurobiol Dis,2010,40(1):193-199.
[10] Zeng L H,Rensing N R,Wong M.The mammalian target of rapamycin signaling pathway mediates epileptogenesis in a modeloftemporallobe epilepsy[J].J Neurosci,2009,29(21):6964-6972.
[11] Zhang B,Wong M.Pentylenetetrazole-induced seizures cause acute,but not chronic,mTOR pathway activation in rat[J].Epilepsia,2012,53(3):506-511.
[12] McDaniel S S,Rensing N R,Thio L L,et al.The ketogenic diet inhibits the mammalian target of rapamycin(mTOR)pathway[J]. Epilepsia,2011,52(3):e7-e11.
[13] Genzer Y,Dadon M,Burg C,et al.Ketogenic diet delays the phase of circadian rhythms and does not affect AMP-activated protein kinase(AMPK)in mouse liver[J].MolCellEndocrinol,2015, 417:124-130.
[14] Jeon B T,Lee D H,Kim K H,et al.Ketogenic diet attenuates kainic acid-induced hippocampal cell death by decreasing AMPK/ACC pathway activity and HSP70[J].NeurosciLett,2009, 453(1):49-53.
[15] Guo D,Zeng L,Zou J,et al.Rapamycin prevents acute dendritic injury following seizures[J].Annals of Clinical and Translational Neurology,2016,3(3):180-190.
Ketogenic diet attenuates hippocampus injury in pentylenetetrazol-kindled seizure and its relation to mammalian target of rapamycin pathway suppression in rats
JIANG Yan,WANG Baohui,JIA Mengmeng,et al.Department of Neurology,Zhejiang Provincial Hospital of Traditional Chinese Medicine,Hangzhou 310006,China
Ketogenic dietmTOR signaling pathway Seizure Hippocampus Neuroprotection
2016-11-02)
(本文编辑:陈丹)
10.12056/j.issn.1006-2785.2017.39.12.2016-1784
国家自然科学基金项目(81301113、81302938);浙江省自然科学基金项目(LY16H270002)
310006 杭州,浙江省中医院神经内科(蒋艳、贾濛濛、卢裕强、裘涛、章正祥、侯群),中心实验室(王宝辉)
侯群,E-mail:houqun168@163.com
【 Abstract】 Objective To investigate the effect of ketogenic diet on hippocampus injury in pentylenetetrazol-kindled seizure and its relation to mammalian target of rapamycine(mTOR)pathway in rats. Methods The PTZ-kindled seizure model was induced by intra-ventricular infusion of 35mg/kg pentylenetetrazol(PTZ)in male Sprague-Dawley(SD)rats.Forty four rats, in which the seizure was fully kindled,were divided into 4 groups with 11 rats in each group.Rats in ND+PTZ and ND+PTZ+RAP groups were fed with normal diet,while those in KD+PTZ and KD+PTZ+RAP were fed with ketogenic diet.The mTOR pathway inhibitor rapamycin(RAP)was given to rats in ND+PTZ+RAP and KD+PTZ+RAP groups by intra-ventricular infusion 30min before PTZ injection.The seizure stages and the neuron in hippocampal CA1,CA3 and DG regions were counted.And the expressions of pS6,S6,pAkt,Akt,pAMPK and AMPK were detected by Western blot. Results The seizure stage of the kindled rats in the KD+PTZ group was lower than that of ND+PTZ group significantly(P<0.05).The stages of KD+PTZ+RAP group were lower than those of ND+PTZ and ND+PTZ+RAP groups significantly(P<0.05).The density of neuron in hippocampal CA1 subarea in KD+PTZ group was higher than ND+PTZ group significantly(P<0.05),and the density of KD+PTZ+RAP was higher than ND+PTZ+RAP group(P<0.05).Additionally,the density of ND+PTZ+RAP was higher than ND+PTZ(P<0.05).Western blot result shows that the expression of phosphor-S6 to total S6(pS6/S6)and phosphor-Akt to total Akt(pAkt/Akt)was increased in ND+PTZ group compared to control(P<0.05).The expression levels of phosphor-AMPK to total AMPK (pAMPK/AMPK)in all kindledgroups were higher than those of non-kindled control groups(P<0.05).Compared to the ND+PTZ group,the expression levels of pS6/S6 and pAkt/Akt were decreased (P<0.05),while the pAMPK/AMPK was increased in KD+PTZ group (P<0.05). Compared to the KD+PTZ group,the expression of pS6/S6 and pAkt/Akt in KD+PTZ+RAP group were decreased(P<0.05). Similarly,compared to the ND+PTZ group,the expression of pS6/S6 and pAkt/Akt in ND+PTZ+RAP group was also significantly decreased (P<0.05).Moreover,compared to ND+PTZ+RAP,the expression level of pS6/S6 in KD+PTZ+RAP group was decreased significantly(P<0.05),while the expression level of pAMPK/AMPK was increased(P<0.05). Conclusion Our study indicated that ketogenic diet has the anti-seizure and neuronal protective effect in PTZ kindled rat model,which may be related to the mTOR pathway suppression.Moreover,the mTOR pathway is modulated by both the inhibition of Akt and activation of AMPK pathway.

