沉默缺氧诱导因子-2α对乳腺癌细胞化疗敏感性的影响
李 娜,贺国洋,李永真,王志慧
沉默缺氧诱导因子-2α对乳腺癌细胞化疗敏感性的影响
李 娜,贺国洋,李永真,王志慧
目的 探讨缺氧诱导因子-2α(hypoxia inducible factor-2α, HIF-2α)siRNA对人乳腺癌细胞增殖及化疗药物敏感性的影响。方法 RNA干扰技术沉默MCF-7细胞中HIF-2α的表达;采用免疫细胞化学和RT-PCR法检测转染后HIF-2α基因的表达,CoCl2模拟缺氧条件下,采用MTT比色法和流式细胞术检测不同剂量的化疗药物(5-氟尿嘧啶、阿霉素和紫杉醇)在HIF-2α沉默后对细胞生长抑制率和细胞凋亡的影响。结果 经HIF-2α siRNA处理的MCF-7细胞中HIF-2α基因表达明显下调(P<0.05),HIF-2α siRNA处理的MCF-7细胞在不同剂量化疗药物作用后,细胞生长抑制率和细胞凋亡率与对照组相比其明显增加,化疗药物敏感性明显增强(P<0.05)。结论 HIF-2α siRNA具有促进化疗药物诱导乳腺癌MCF-7细胞凋亡、抑制增殖及增强化疗药物敏感性的作用,沉默HIF-2α有望成为乳腺癌基因治疗的新途径。
乳腺肿瘤;缺氧诱导因子-2α;RNA干扰;化疗敏感性
局部缺氧是实体肿瘤微环境普遍存在的一种现象[1],缺氧亦是影响恶性肿瘤预后的重要因素。缺氧诱导因子-2α(hypoxia inducible factor-2α, HIF-2α)是其中最主要的调节肿瘤细胞应对局部缺氧等微环境而发生适应性反应的调节因子。课题组前期实验结果表明,HIF-2α促进乳腺癌细胞的生长、浸润和转移,与乳腺癌的发生、发展关系密切[2-3],同时课题组还证实HIF-2α可以调控多药耐药基因1(multiple drug resistance 1, MDR1)的表达,参与乳腺癌多药耐药的形成。目前,是否可以通过干扰HIF-2α的表达来逆转乳腺癌的耐药性尚未见相关文献报道。本文拟通过沉默HIF-2α基因的表达,分析其对乳腺癌细胞化疗敏感性的影响,为逆转乳腺癌多药耐药提供新思路。
1 材料与方法
1.1 材料 RT-PCR试剂盒和PCR试剂盒等均购自Invitrogen公司;TRIzol试剂、SuperScript First-Strand Synthesis System引物均由上海生工公司合成;β-actin抗体购自Santa Cruz公司;HIF-2α兔抗人多克隆抗体购自武汉博士德生物公司;5-氟尿嘧啶、阿霉素和紫杉醇购于Pharmasia公司。DMSO购于Sigma公司;MCF-7细胞株由本实验室保存。荧光显微镜为日本Nikon公司产品。
1.2 方法
1.2.1 细胞培养与基因转染 将建立好的缺氧乳腺癌细胞在含有100 U/mL青霉素和100 μg/mL链霉素、10%胎牛血清的完全培养基中37 ℃、5%CO2条件下培养,待细胞长至85%融合时,参照Invitrogen公司Lipofectamine 2000说明书进行转染,设置空白对照组(MCF-7组)、MCF-7/HIF-2α siRNA 组、MCF-7/无义siRNA组,细胞转染9 h后,更换新鲜完全培养基。
1.2.2 RT-PCR法检测转染后各组细胞中HIF-2α mRNA的表达 RNA提取按照Trizol RNA提取试剂盒说明书进行,cDNA第一条链体外逆转录合成,以cDNA为模板,扩增HIF-2α mRNA。引物序列HIF-2α上游:5′-TGAAAACGAGTCCGAAGCC-3′,下游:5′-GTGGCTGACTTGAGGTTGA-3′;GAPDH上游:5′-ATTCATCTCTCCTCTCCCA-3′,下游:5′-GTTGGTGGTTGGTACTGT-3′,PCR反应条件:94 ℃×2 min,94 ℃×1 min、50 ℃×1 min和72 ℃延伸30 s,28个循环;72 ℃延伸5 min。预期扩增片段大小分别为342 bp和580 bp。取5 μL用1.5%琼脂糖凝胶电泳,在凝胶成像仪上成像并测定分析。
1.2.3 免疫细胞化学法检测转染后各组细胞中HIF-2α蛋白的表达 取少量消化后收集的上述转染后细胞制作细胞涂片,经10%中性福尔马林固定20 min,HIF-2α蛋白表达按常规免疫细胞化学染色法进行检测。DAB染色阳性显色为棕黄色颗粒,主要位于细胞质和细胞核。所有切片均采用HPIAS-1000高清晰图像处理系统进行图像分析,每张切片随机选取5个视野,取其平均光密度(optical density,OD)的平均值进行统计学分析。
1.2.4 MTT法检测乳腺癌细胞增殖活性 以每毫升1.5×105个将MCF-7细胞接种于96孔板,每孔加200 μL含10%胎牛血清和CoCl2(终浓度为100 μmol /L)的PRMI 1640培养液,5%CO2、37 ℃孵箱中培养24 h。转染24 h后各组加入5-氟尿嘧啶(终浓度10 μg/L)、阿霉素(终浓度1.0 μg/mL)和紫杉醇(终浓度10 μg /mL),培养24 h后加入MTT(终浓度5 mg/mL)每孔20 μL,37 ℃孵育4 h,每孔吸去上清后加入二甲基亚砜(DMSO)200 μL,酶标仪上读取570 nm处吸光度值A570。计算各组细胞生长抑制率[抑制率=(空白对照组平均吸光度值-用药组平均吸光度值)/空白对照组平均吸光度值×100%],每组实验至少重复3次。
1.2.5 流式细胞术检测细胞凋亡率 将上述3种细胞接种于6 孔培养板,待细胞长至约70 %融合时,加入5-氟尿嘧啶(终浓度10 μg/mL)、阿霉素(终浓度1.0 μg/mL)和紫杉醇(终浓度10 μg /mL),同时用含100 μmol/L CoCl2的PRMI 1640培养液培养细胞24 h。收集细胞、洗涤固定后过夜。PBS冲洗1次,调整细胞浓度为每毫升106个细胞,加入含RNase(终浓度为0.25 mg/mL)的碘化丙啶(PI)染色液,室温避光染色30 min,流式细胞仪检测,Cell Quest分析细胞凋亡情况,低于G0/G1期DNA含量的细胞为凋亡细胞,其所占细胞总数的比例即为凋亡率,每组重复3次。

2 结果
2.1 各组细胞转染24 h后HIF-2α mRNA的表达 RT-PCR检测结果显示:HIF-2α mRNA的相对表达量在MCF-7/HIF-2α siRNA组为0.321±0.036,与MCF-7组(0.724±0.034)和MCF-7/无义siRNA组(0.686±0.039)相比显著降低(P<0.05)。对照组和MCF-7/无义siRNA组相比差异无显著性(P>0.05,图1、2)。

图1 各组细胞转染24 h后HIF-2α mRNA的表达
1.MCF-7/HIF-2α siRNA组;2.MCF-7组;3.MCF-7/无义siRNA组;*P<0.05

图2 转染24 h后各组细胞中HIF-2α mRNA的相对表达量
与其它各组相比,*P<0.05
2.2 各组细胞转染24 h后HIF-2α蛋白的表达 免疫细胞化学结果显示,在3组乳腺癌细胞中HIF-2α蛋白的表达主要定位于胞质(图3)。采用HPIAS-1000高清晰图像处理系统进行分析,HIF-2α蛋白的OD值在MCF-7/HIF-2α siRNA组明显低于转空质粒组MCF-7组和MCF-7/无义siRNA组细胞(P<0.05),MCF-7/无义siRNA组和MCF-7组细胞之间未见明显差异(P>0.05,表1)。
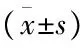
表1 转染后各组细胞中HIF-2α蛋白的表达
MCF-7/HIF-2α siRNA与MCF-7组、MCF-7/无义siRNA组比较,*P<0.05
2.3 细胞化疗敏感性检测 5-氟尿嘧啶、阿霉素和紫杉醇作用24 h后MCF-7/HIF-2α siRNA组、MCF-7组和MCF-7/无义siRNA组细胞抑制率详见表2。3种化疗药物处理后MCF-7/HIF-2α siRNA组细胞增殖抑制率均明显高于MCF-7组和MCF-7/无义siRNA组相应浓度时的细胞增殖抑制率(P<0.05);MCF-7组和MCF-7/无义siRNA组的细胞增殖抑制率,差异无统计学意义(P>0.05)。
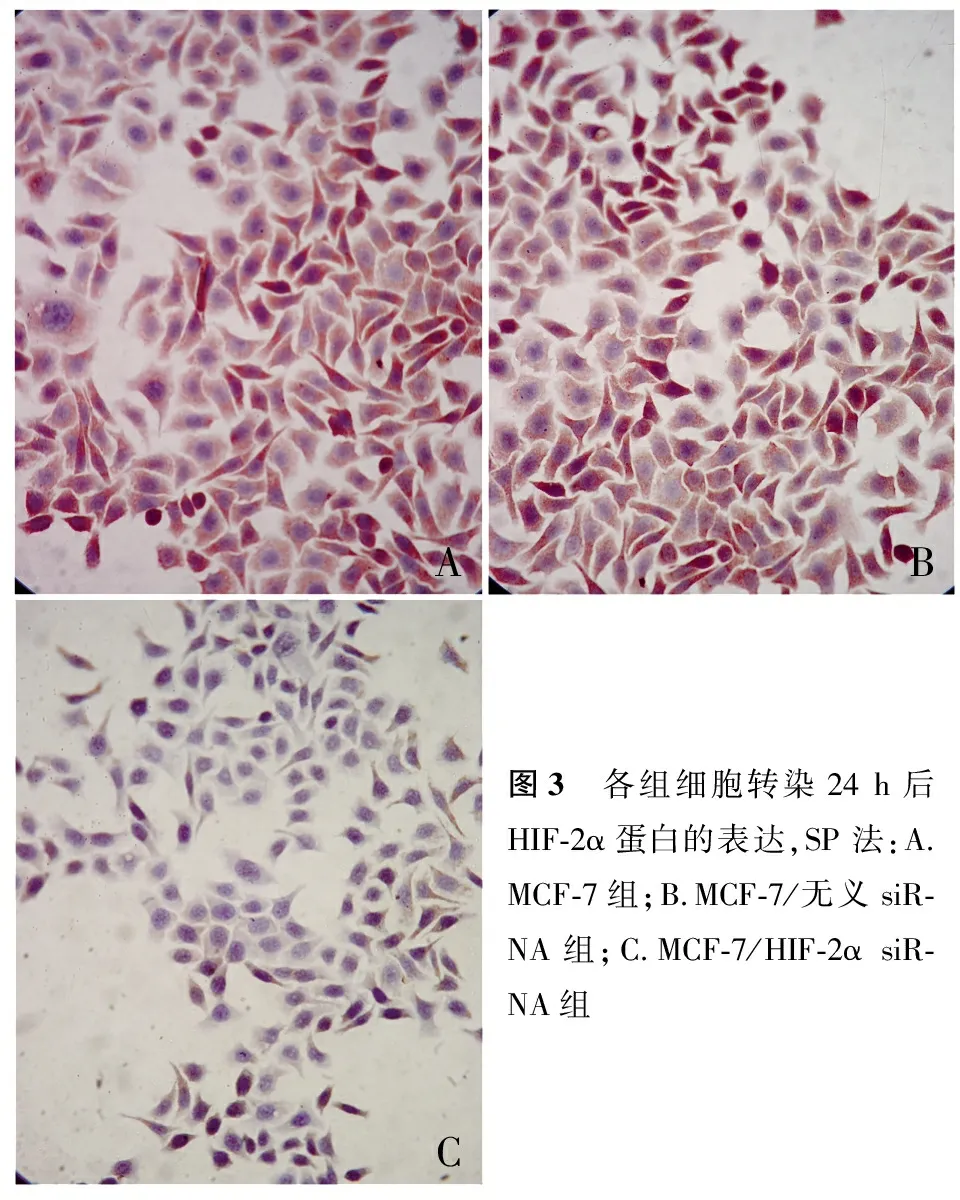
ABC图3 各组细胞转染24h后HIF⁃2α蛋白的表达,SP法:A.MCF⁃7组;B.MCF⁃7/无义siR⁃NA组;C.MCF⁃7/HIF⁃2αsiR⁃NA组
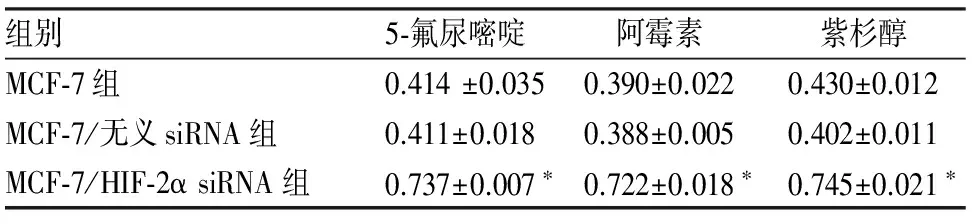
表2 化疗药物处理24 h后各组细胞的细胞抑制率(%)
MCF-7/HIF-2α siRNA组与MCF-7组、MCF-7/无义siRNA组比较,*P<0.05
2.4 细胞凋亡率检测 5-氟尿嘧啶、阿霉素和紫杉醇作用24 h后MCF-7/HIF-2α siRNA组、MCF-7组和MCF-7/无义siRNA组细胞凋亡率详见表3。3种化疗药物处理后MCF-7/HIF-2α siRNA组细胞的凋亡率均明显高于MCF-7组和MCF-7/无义siRNA组相应浓度时的细胞凋亡率(P<0.05)。MCF-7组和MCF-7/无义siRNA组间细胞凋亡率,差异无统计学意义(P>0.05,图4)。

表3 化疗药物处理24 h后各组细胞的细胞凋亡率(%)
MCF-7/HIF-2α siRNA组与MCF-7组、MCF-7/无义siRNA组比较,*P<0.05
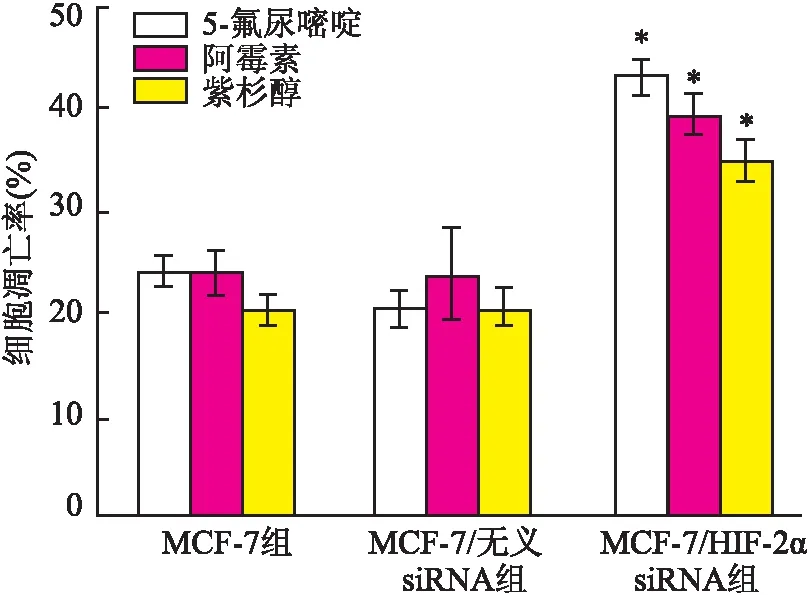
图4 化疗药物处理24 h后各组细胞的细胞凋亡率
与其它各组相比,*P<0.05
3 讨论
局部组织微环境的缺氧是实体肿瘤在生长过程中的常见现象,多由于组织增长过快和血供不足造成。介导肿瘤细胞对缺氧耐受最重要的转录因子是缺氧诱导因子[4],研究表明缺氧诱导因子调节的下游靶基因含有缺氧反应元件(hypoxic responsiveelement, HRE),缺氧诱导因子可与其结合,形成转录起始复合物,启动下游靶基因的转录[5],对肿瘤新生血管的形成、维持肿瘤细胞的能量代谢、促进肿瘤增殖和转移、化疗耐药等方面起重要作用[6]。临床上亦有许多证据表明,肿瘤细胞对缺氧的耐受可使肿瘤对放、化疗的抵抗性增加,缺氧存在可能是肿瘤细胞的一些耐药基因和蛋白的表达或活性增加的主要原因;该过程中缺氧诱导因子起关键性作用[7]。HIF是由HIF-α和HIF-β亚基组成的异源二聚体,目前发现的哺乳动物中有3种HIF-α亚基:HIF-1α、HIF-2α和HIF-3α,它们均可与HIF-β亚单位结合[8],既往对HIF-1α与实体肿瘤关系的相关报道较多,而对HIF-2α与肿瘤的关系却较少提及。课题组前期实验结果表明,缺氧可通过核转录因子HIF-2α上调乳腺癌细胞内MDR1的表达,从而使乳腺癌细胞获得多药耐药性。本实验主要通过干扰HIF-2α基因的表达,对乳腺癌细胞化疗敏感性的改变进行观察,为逆转乳腺癌多药耐药提供新思路。
本实验利用siRNA干扰MCF-7细胞中HIF-2α的表达,siRNA通常为21个核苷酸的双股RNA(dsRNA),采用不同转染技术可将siRNA导入细胞内,并专一性敲弱特定基因的表达。siRNA已成为分析基因功能与药物目标的一项重要工具[9]。我们利用Lipofectamine 2000介导将针对HIF-2α的siRNA片段转染到乳腺癌细胞中,特异性降解靶基因的表达。结果显示,转染后HIF-2α mRNA的水平明显降低,蛋白表达也明显降低。因此,MCF-7/HIF-2α siRNA有效沉默HIF-2α的表达。HIF-2α中VHL泛素-蛋白酶复合体与之结合的位点被CoCl2占据,从而竞争抑制HIF-2α与泛素-蛋白酶复合体的结合,使HIF-2α降解减少,增加细胞内HIF-2α蛋白的表达,CoCl2被广泛用来模拟缺氧环境[10]。本组前期课题组已经验证CoCl2(终浓度100 μmol/L)模拟缺氧环境培养各组细胞,并分别加入5-氟尿嘧啶(终浓度10 μg /mL)、阿霉素(终浓度10 μg /mL)和紫杉醇(终浓度10 μg /mL)作用细胞。MTT 检测结果表明,3种化疗药物处理MCF-7/HIF-2α siRNA组细胞的增殖抑制率均明显增高。流式细胞术检测结果也表明,3种化疗药物处理后MCF-7/HIF-2α siRNA组细胞的凋亡率均显著增加。与前期HIF-1α的报道一致,Gao等[11]发现吉西他滨和5-氟尿嘧啶能够抑制胆囊癌细胞的增殖和增强其化疗敏感性。因此,我们认为应用HIF-2α siRNA体外转染乳腺癌细胞,抑制乳腺癌细胞中HIF-2α蛋白的表达,提高化疗药物对癌细胞的杀伤力。
综上所述,乳腺癌是目前女性常见的恶性肿瘤,其发病率逐年上升,已严重威胁妇女健康。乳腺癌患者的主要治疗手段仍是手术、放疗、化疗和内分泌治疗,其中化疗是缓解和治疗乳腺癌的重要辅助性治疗,众所周知,乳腺癌化疗耐药是影响患者治疗效果的重要因素,本组通过干扰乳腺癌中HIF-2α蛋白的表达,增强乳腺癌细胞的化疗敏感性,为临床逆转乳腺癌的多药耐药、改善患者预后提供新思路。
[1] Liu W, Xin H, Eckert D T,etal. Hypoxia and cell cycle regulation of the von Hippel-Lindau tumor suppressor[J]. Oncogene, 2011,30(1):21-31.
[2] Wang H X, Qin C, Han F Y,etal. HIF-2α as a prognostic marker for breast cancerprogression and patient survival[J]. Genet Mol Res, 2014,13(2):2817-2826.
[3] 李 娜,王洪兴,张 洁,等. siRNA干扰缺氧诱导因子-2α对乳腺癌细胞增殖能力的影响[J]. 临床与实验病理学杂志, 2014,30(1):6-9.
[4] Tong W W, Tong G H, Chen X X,etal. HIF2α is associated with poor prognosis and affects the expression levels of survivin and Cyclin D1 in gastric carcinoma[J]. Int J Oncol, 2015,46(1):233-242.
[5] Li N, Wang H X, Zhang J,etal. Knockdown of hypoxia inducible factor-2α inhibits cell invasion via the downregulation of MMP-2 expression in breast cancer cells[J]. Oncol Lett, 2016,11(6):3743-3748.
[6] Amelio I, Melino G. The p53 family and the hypoxia-inducible factors (HIFs): determinants cancer progression[J]. Trends Biochem Sci, 2015,40(8):425-434.
[7] Mardilovich K, Shaw L M. Hypoxia regulates insulin receptor substrate-2 expression to promote breast carcinoma cell survival and invasion[J]. Cancer Res, 2009,69(23):8894-8901.
[8] Vaapil M, Helczynska K, Villadsen R,etal. Hypoxic conditions induce a cancer-like phenotype in human breast epithelial cells[J]. PLoS One, 2012,7(9):e46543
[9] 李 娜,王洪兴,贺国洋,等. 缺氧诱导因子-2α在不同侵袭能力乳腺癌细胞和组织中的表达及意义 [J]. 广东医学, 2013,34(12):1896-1898.
[10] 李 娜,王洪兴,张 洁,等. siRNA干扰缺氧诱导因子2α对乳腺癌细胞侵袭能力的影响及相关机制[J]. 中国老年学杂志, 2015,35(8):2171-2173.
[11] Gao H, Xie J, Peng J,etal. Hispidulin inhibits proliferation and enhances chemosensitivity of gallbladder cancer cells by targeting HIF-1α[J]. Exp Cell Res, 2015,332(2):236-246.
Effect of silencing of HIF-2α gene on chemosensitivity of human breast carcinoma cells
LI Na, HE Guo-yang, LI Yong-zhen, WANG Zhi-hui
(DepartmentofPathology,XinxiangMedicalUniversityofHenanProvince,Xinxiang453003,China)
Purpose To investigate the effects of hypoxia inducible factor-2α (HIF-2α) siRNA on proliferation and chemotherapy sensitivity of breast carcinoma MCF-7. Methods RNA interference was used to silence the expression of HIF-2α in MCF-7 cells. The changes of HIF-2α gene expression were detected by immunocytochemistry and RT-PCR. Under hypoxia environment simulated by CoCl2, MTT assay and flow cytometry (FCM) were used to measure cell growth inhibition rate and cell apoptosis of MCF-7 cells under different dosages of chemotherapeutic agents (5-fluorouracil, adriamycin, and paclitaxel). Results Expression of HIF-2α in MCF-7 were down-regulated by HIF-2α siRNA (P<0.05). The proliferation inhibition and apoptosis rates were evidently increased after transfection with HIF-2α siRNA (P<0.05), chemotherapy drug sensitivity was enhanced. Conclusion HIF-2α siRNA can induce the apoptosis and inhibit the proliferation and enhance the sensitivity of breast carcinoma MCF-7 cell line to chemotherapeutic agents. Blocking HIF-2α maybe a very promising strategy for breast carcinoma gene therapy in combination with chemotherapy.
breast neoplasm; hypoxia inducible factor-2 alpha; RNA interference; chemosensitivity
河南省自然科学基金面上项目(162300410220)、河南省卫生厅科技攻关资助(201403133)、河南省教育厅高等学校重点科研(16A310002)
河南省新乡医学院病理学教研室,新乡 453003
李 娜,女,博士,副教授。Tel:(0373)3029123,E-mail: lina@xxmu.edu.cn
时间:2017-5-17 23:53 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170517.2352.007.html
R 737.9
A
1001-7399(2017)05-0501-04
10.13315/j.cnki.cjcep.2017.05.007
接受日期:2017-03-02

