紫草素对小鼠卵母细胞发育成熟的影响※
滕 菲 姜广建
(北京中医药大学2014级硕士研究生,北京 100029)
紫草素对小鼠卵母细胞发育成熟的影响※
滕 菲 姜广建1
(北京中医药大学2014级硕士研究生,北京 100029)
目的 观察紫草素对小鼠卵母细胞发育成熟的影响,并探讨其作用机制。方法 采用6~8周龄ICR雌性小鼠的GV期未成熟卵母细胞,分别放入含有5、10、20、50 μg/mL浓度紫草素的4组培养液,另外再配置4组含有3-异丁基-1-甲基黄嘌呤(IBMX)抑制剂的紫草素培养液,并以不含紫草素的培养液为对照组。单纯含紫草素的各组培养液及对照组直接进行卵母细胞培养,含IBMX抑制剂的紫草素培养液先静置12 h后再洗脱IBMX进行卵母细胞培养。各组均培养2 h后统计生发泡破裂(GVBD)率,12 h后统计第一极体排出率,并显微镜下观察紫草素对卵母细胞纺锤体及第一极体排出的情况。结果 20、50 μg/mL紫草素对卵母细胞的发育成熟具有绝对抑制作用,GVBD率及第一极体排出率均为0;5 μg/mL紫草素对卵母细胞无明显抑制作用(P>0.05);10 μg/mL紫草素对卵母细胞的GVBD率无明显影响(P>0.05),但对第一极体排出率有明显抑制作用(P<0.05);显微镜下观察显示,对照组第一极体排出正常,仅有少量卵母细胞出现异常纺锤体形态,10 μg/mL紫草素组则第一极体排出受到抑制,出现大量卵母细胞异常纺锤体形态,纺锤体呈现无极、散极或者多极等异常现象。结论 高浓度的紫草素对卵母细胞发育成熟具有明显抑制作用,可影响纺锤体的形成和第一极体的排出,其作用机制可能与紫草素抑制卵母细胞能量代谢有关。
紫草素;卵母细胞;动物,实验;小鼠
紫草素是从中药紫草根部提取的萘醌类化合物,M2型丙酮酸激酶(PKM2)是糖酵解过程中关键的限速酶,研究表明紫草素及其类似物是一种有效的PKM2专一抑制剂[1]。肿瘤细胞增殖的能量来源途径是有氧糖酵解,大量实验研究表明,紫草素能够抑制肿瘤细胞中的PKM2,从而有效抑制肿瘤细胞的增殖[2-4]。卵母细胞中能量代谢途径也是有氧糖酵解,PKM2水平可影响卵母细胞能量代谢过程[5]。紫草素及其类似物是目前研究最多的PKM2抑制剂,主要用于抗肿瘤方面研究,尚未有紫草素对卵母细胞能量代谢影响的相关报道,故本实验拟对紫草素是否对卵母细胞能量代谢及发育成熟有影响展开研究。
1 材料与方法
1.1 动物 ICR雌性小鼠72只,6~8周龄,根据中国动物学会和中国科学院要求进行饲养,斯贝福(北京)生物技术有限公司提供,许可证号:SCXK(京)2014-0006。
1.2 仪器 二氧化碳(CO2)培养箱,美国Thermo Fisher Scientific公司;LSM 780激光共聚焦显微镜,德国Zeiss公司。
1.3 试剂 紫草素、二甲基亚砜(DMSO)、M2培养液、胎牛血清白蛋白(BSA)、甲醇、石蜡油、吐温20(Tween20)、聚乙二醇辛基苯基醚(Triton X-100)、α微管蛋白抗体(α-TubulinAb)、活细胞染料(Hoechst33342)、3-异丁基-1-甲基黄嘌呤(IBMX),均购自美国Sigma试剂公司;Anti-PKM2抗体,购自英国Abcam公司。
1.4 实验方法
1.4.1 卵母细胞的收集与培养 取6~8只雌性ICR小鼠,采用颈椎脱位法处死,快速取出小鼠卵巢,然后用刀片将卵巢剁碎,将未成熟的卵母细胞释放到M2培养液中。在显微镜观察下挑选出形态饱满折光性强且带有完整生发泡的GV期未成熟卵母细胞100~200个备用。
1.4.2 紫草素培养液的制备及分组 取10 mg紫草素用100 μL的DMSO稀释成100 mg/mL储备液,再取99 μL的M2培养液将1 μL的储备液稀释成1 mg/mL的工作液,再用M2培养液分别稀释成5、10、20、50 μg/mL的4组含不同浓度紫草素的培养液。再另取IBMX按1∶1 000的比率加入各组,配置成含IBMX的紫草素培养液(IBMX可抑制卵母细胞的发育成熟)。另外单独取DMSO加入M2培养液配成1∶5 000倍稀释的溶液作为对照组。将获取的GV期未成熟卵母细胞分别放入各组含不同浓度紫草素的培养液及对照组培养液中,每组20~30个。单纯含紫草素的各组培养液及对照组直接进行卵母细胞培养,含IBMX抑制剂的紫草素培养液先静置12 h,让紫草素充分进入细胞后,再洗脱IBMX进行卵母细胞培养。培养温度37 ℃,CO2浓度5%,湿度5%。各组均培养2 h后统计生发泡破裂(GVBD)率,12 h后统计第一极体排出率。
1.4.3 卵母细胞的GVBD率及第一极体排出率 各组卵母细胞常规培养2 h后,在显微镜下观察数出各组发生GVBD现象的卵母细胞个数,然后计算每组的GVBD率。12 h后再观察数出各组发生第一极体排出的卵母细胞个数,然后计算每组的第一极体排出率。该实验重复3次,取平均值。
1.4.4 纺锤体形态观察 将卵母细胞用含有4%多聚甲醛的磷酸缓冲盐溶液(PBS)(pH值7.4)进行固定30 min。在室温下用0.5%的Triton X-100透膜液进行处理20 min,之后将卵母细胞放入含1% BSA的磷酸二氢钾PBS封闭液中封闭1 h。在含有0.1% Tween 20和0.01% Triton X-100的PBS中分别清洗3次,每次时间间隔5 min。再用由M2培养液按1∶40 000比例稀释的α-Tubulin抗体进行纺锤体染色。4 ℃冰箱放置过夜,在含有0.1% Tween 20和0.01% Triton X-100的PBS中分别清洗3次,每次时间间隔5 min。洗脱过后用Hoechst33342进行染色体染色。最后,在盖玻片的四角用9∶1凡士林石蜡油做4个柱,把一滴封片剂点在载玻片中央,移入卵母细胞,盖上盖玻片,用激光共聚焦显微镜观察、拍照。
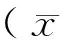
2 结 果
2.1 含IBMX的各组紫草素培养液及对照组培养后卵母细胞GVBD率及第一极体排出率情况比较 见表1。
由表1可见,20、50 μg/mL紫草素组卵母细胞GVBD率及第一极体排出率均为0,说明这2个浓度的紫草素对卵母细胞的发育成熟起到了绝对抑制作用,对卵母细胞具有细胞毒性。5 μg/mL紫草素组卵母细胞GVBD率及第一极体排出率与对照组比较差异均无统计学意义(P>0.05),说明5 μg/mL紫草素对卵母细胞无明显抑制作用。10 μg/mL紫草素组卵母细胞的GVBD率与对照组比较差异无统计学意义(P>0.05),但第一极体排出率比较差异有统计学意义(P<0.05),说明10 μg/mL紫草素对卵母细胞第一极体排出情况有明显抑制作用。
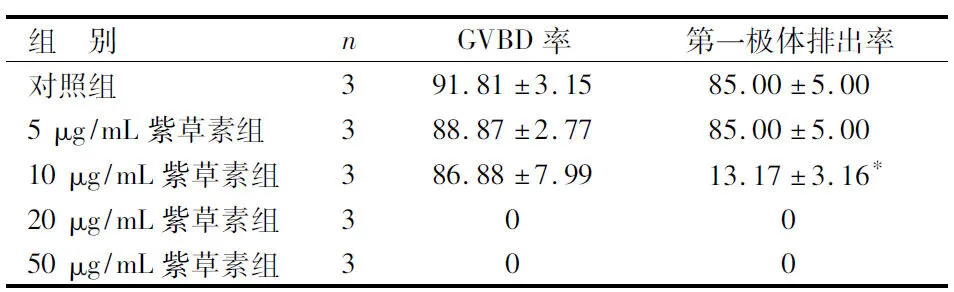
表1 含IBMX的各组紫草素培养液及对照组培养后 卵母细胞GVBD率及第一极体排出率情况比较 ±s
与对照组比较,*P<0.05
2.2 各组紫草素培养液及对照组培养后卵母细胞GVBD率及第一极体排出率情况比较 见表2。

表2 各组紫草素培养液及对照组培养后 卵母细胞GVBD率及第一极体排出率情况比较 ±s
与对照组比较,*P<0.05
由表2可见,20、50 μg/mL紫草素组卵母细胞GVBD率及第一极体排出率均为0,说明这2个浓度的紫草素对卵母细胞的发育成熟起到了绝对抑制作用,对卵母细胞具有细胞毒性。5 μg/mL紫草素组卵母细胞GVBD率及第一极体排出率与对照组比较差异均无统计学意义(P>0.05),说明5 μg/mL紫草素对卵母细胞无明显抑制作用。10 μg/mL紫草素组卵母细胞的GVBD率与对照组比较差异无统计学意义(P>0.05),但第一极体排出率比较差异有统计学意义(P<0.05),说明10 μg/mL紫草素对卵母细胞第一极体排出情况有明显抑制作用。如图1所示,对照组卵母细胞排出第一极体,10 μg/mL紫草素组未排出第一极体,且细胞质与透明带之间的卵周隙变大。

对照组 10 μg/mL紫草素组
图1 对照组和10 μg/mL紫草素组第一极体排出情况
2.3 10 μg/mL紫草素组及对照组卵母细胞的纺锤体形态观察 收集10 μg/mL紫草素组及对照组卵母细胞在显微镜下进行观察,对照组仅有少量卵母细胞出现异常纺锤体形态,10 μg/mL紫草素组则出现大量卵母细胞异常纺锤体形态,纺锤体呈现无极、散极或者多极等异常现象。说明10 μg/mL紫草素可干扰卵母细胞分裂过程中纺锤体的形成,从而影响卵母细胞发育成熟。见表3、图2。

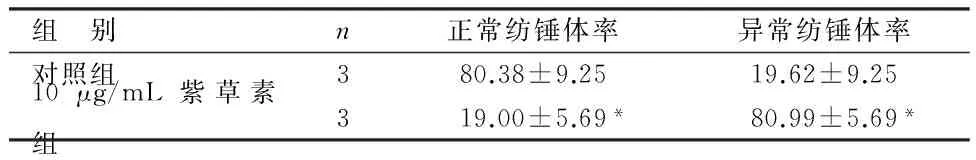
组 别n正常纺锤体率异常纺锤体率对照组380.38±9.2519.62±9.2510μg/mL紫草素组319.00±5.69*80.99±5.69*
与对照组比较,*P<0.05

染色体 纺锤体 染色体与纺缍体合并后
A:对照组正常形态的纺锤体呈梭形;B:10 μg/mL紫草素组异常纺锤体形态呈多极形态;C:10 μg/mL紫草素组异常纺锤体形态呈解聚状态
图2 10 μg/mL紫草素组及对照组纺锤体形态情况比较
由表3可见,10 μg/mL紫草素组正常纺锤体率及异常纺锤体率与对照组比较差异均有统计学意义(P<0.05)。
3 讨 论
哺乳动物的糖代谢过程是葡萄糖首先生成丙酮酸,然后再通过氧化磷酸化过程,线粒体利用丙酮酸和氧气(O2)通过丙酮酸脱氢酶催化形成乙酰辅酶A及CO2,乙酰辅酶A再参与三羧酸循环,最终以生成36个三磷酸腺苷(ATP)的形式产生能量。而有氧糖酵解是在有O2环境下,细胞大量摄取葡萄糖,然后经过一系列酶的催化生成磷酸烯醇式丙酮酸,然后再在一系列丙酮酸激酶(PK)催化下生成丙酮酸,但所产生的丙酮酸并不经过氧化磷酸化,而是在细胞质中酵解形成大量乳酸并只产生2个ATP,这种现象又称之为Warburg效应。有研究发现,不仅在肿瘤细胞中存在这种现象,在哺乳动物生殖细胞发育过程中也存在类似Warburg效应的现象[6-9]。实验研究表明,原生殖细胞(PGC)优先氧化丙酮酸而不是葡萄糖,除此以外原始卵泡氧化产物是乳酸,并且消耗的丙酮酸是葡萄糖的2倍多,说明在这个阶段同时存在着有氧糖酵解和线粒体丙酮酸的氧化,而且丙酮酸可能是主要的能量基质[10]。
紫草属于紫草科多年生草本植物,是中国传统中草药之一,最早记载于《神农本草经》,具有凉血活血、解毒透疹等功效。现代药理学研究表明,紫草具有抗菌、抗变态反应、抗肿瘤、解热、止血、降血糖等作用[11]。紫草素是从紫草根中提取的一种萘醌类化合物,对多种肿瘤,如小鼠腹水型肉瘤S180、子宫颈瘤U14、自发性乳腺肿瘤等具有抑制作用[12],还可诱导大肠癌CCL229细胞凋亡,且不同浓度的紫草素作用后CCL229细胞均具有明显的凋亡特征[13]。实验研究表明,PKM2是细胞糖酵解途径中的最后一个酶,也是一个重要的限速酶,并且还是肿瘤细胞中有氧糖酵解途径的关键酶,紫草素和它的类似物对肿瘤细胞的PKM2有专一性抑制作用,可在肿瘤细胞表达PKM2时有效抑制细胞糖酵解流,从而抑制肿瘤生长[14]。
本实验将卵母细胞放入含有不同浓度紫草素的培养液中进行培养观察,考虑到紫草素进入卵母细胞作用可能需要时间,所以我们采取了2种方法,一种是加入IBMX的培养液,先静置12 h后洗脱IBMX进行培养[15],另一种是直接放入含有不同浓度紫草素的培养液中培养。2种不同实验方法的结果共同得出5 μg/mL紫草素对卵母细胞的发育成熟无影响,而20、50 μg/mL紫草素可对卵母细胞产生绝对抑制作用,10 μg/mL浓度的紫草素对卵母细胞发育成熟有很大影响,2种方法的横向比较结果一致,因此我们选择了10 μg/mL紫草素组卵母细胞进行下一步研究。观察结果显示,10 μg/mL紫草素组卵母细胞发育停滞在了MI前期或者MI期,卵母细胞的第一极体排出也被干扰,第一极体排出率比较低下,并且纺锤体形态紊乱,组装未完成,纺锤体呈现无极、散极或者多极等异常现象。纺锤体的形成和卵母细胞第一极体排出都需要能量,且卵母细胞发育的能量大部分来自有氧糖酵解,PKM2是有氧糖酵解的关键酶,而紫草素对PKM2有专一性抑制作用,因此我们猜测紫草素对卵母细胞发育成熟的抑制作用是因为能量代谢过程被破坏而导致。
综上所述,高浓度的紫草素对卵母细胞发育成熟具有明显抑制作用,其作用机制可能与紫草素抑制卵母细胞能量代谢有关。将来可进一步研究紫草素对卵母细胞发育成熟的影响,探索在紫草素抑制作用下卵母细胞的其他能量代谢途径,从而有助于揭示在生殖过程中母体和胎儿的能量代谢需求,对与代谢紊乱有关生殖疾病的研究及防治具有重要意义。
[1] 陈晶.抑制M2型丙酮酸激酶是萘醌类化合物影响肿瘤细胞代谢和导致肿瘤细胞死亡的重要分子机制之一[D].杭州:浙江大学,2012.
[2] Chakravarty T,Crane CH,Ajani JA,et al.Intensity-modulated radiation therapy with concurrent chemotherapy as preoperative treatment for localized gastric adenocarcinoma[J].Int J Radiat Oncol Biol Phys,2012,83(2):581-586.
[3] 黄莉,宋化龙,崔家华,等.水溶性紫草素磺酸钠衍生物的设计合成及抗肿瘤活性[J].中国药物化学杂志,2016,26(5):361-368.
[4] 朱梦媛,王汝冰,周文,等.紫草素及其衍生物抗肿瘤作用研究进展[J].药学学报,2012,47(5):588-593.
[5] 蒋欣,徐阳.卵母细胞的葡萄糖代谢研究进展[J].国际生殖健康/计划生育杂志,2016,35(4):295-298.
[6] Metallo CM,Vander HM.Understanding metabolic regulation and its influence on cell physiology[J].Mol Cell,2013,49(3):388-398.
[7] Ward PS,Thompson CB.Metabolic Reprogramming: A Cancer Hallmark Even Warburg Did Not Anticipate[J].Cancer Cell,2012,21(3):297-308.
[8] Ferramosca A,Zara V.Bioenergetics of Mammalian Sperm Capacitation[J].Biomed Research International,2014,2014(2):902953.
[9] Smith DG,Sturmey RG.Parallels between embryo and cancer cell metabolism[J].Biochem Soc Trans,2013,41(2):664-669.
[10] Harris SE,Leese HJ,Gosden RG,et al.Pyruvate and oxygen consumption throughout the growth and development of murine oocytes[J].Mol Reprod Dev,2009,76(3):231-238.
[11] 王本祥.现代中药药理学[M].天津:天津科学技术出版社,1999:349-355.
[12] 路桂荣,廖静.紫草萘醌单体分离物的抗癌生物效应测试[J].中西医结合杂志,1990,10(7):422-425.
[13] 蒋英丽,宋今丹.新疆紫草素诱导人大肠癌细胞的凋亡[J].癌症:英文版,2001,20(12):1355-1358.
[14] 王晓娜,赵林.丙酮酸激酶M2抑制剂研究进展[J].齐鲁工业大学学报:自然科学版,2014,28(2):43-46.
[15] Conti M.Specificity of the cyclic adenosine 3',5'-monophosphate signal in granulosa cell function[J].Biol Reprod,2002,67(6):1653-1661.
(本文编辑:石 康)
Effects of shikonin on the maturation of mouse oocytes
TENGFei*,JIANGGuangjian.
*2014-GradeMasterofBeijingUniversityofTraditionalChineseMedicine,Beijing100029
Objective To observe the effect of shikonin on the maturation of mouse oocytes, and investigate its mechanism. Methods The immature oocytes of GV stage from 6 to 8 weeks old ICR female mice were put in four groups of shikonin nutrient solution that concentration was 5μg/mL, 10μg/mL, 20μg/mL and 50 μg/mL respectively. In addition, there were other four groups that shikonin nutrient solution contained 3-isobutyl 1-methyl xanthine (IBMX) inhibitor, and the nutrient solution with no shikonin was treated as control group. The oocytes were directly cultured in four groups that merely contained shikonin and the control group. The shikonin nutrient solution containing IBMX inhibitor was set aside 12 h and then eluted with IBMX, finally the oocytes were cultured. The rate of germinal vesicle breaking down (GVBD) after culturing 2 h was evaluated, and the first polar body discharge rate after culturing 12 h were evaluated. The effects of shikonin on oocytes spindle and the discharge of first polar body were observed.Results The concentration of 20μg/mL and 50 μg/mL of shikonin had an absolute inhibitory effect on the maturation of oocytes, and the rates of GVBD and the first polar body discharge were all zero. The concentration of 5μg/mL of shikonin had no obvious inhibitory effect on oocytes. The first polar body discharge in control group was normal, and only a few oocytes appeared abnormal spindle. The first polar body discharge in 10μg/mL shikonin group was restrained, and a large number of oocytes appeared abnormal spindle, and the spindle presents the anomalies such as the non-polar, sporadic polar, or multi-polar. Conclusion The high concentration of shikonin has an obviously inhibitory effect on the maturation of oocytes, can affect the formation of spindle and the first polar body discharge, its mechanism can be linked to the inhibition of shikonin on the energy metabolism of oocytes.
Shikonin; Oocyte; Animal; Experiment; Mice
10.3969/j.issn.1002-2619.2017.05.024
※ 项目来源:北京中医药大学自主选题资助项目(编号:2016-JYB-XS029)
滕菲(1989—),女,硕士研究生在读,学士。研究方向:受精生殖学。
R285.5;R714.13
A
1002-2619(2017)05-0739-05
2017-01-16)
1 北京中医药大学基础医学院糖尿病研究中心,北京 100029

