老年分水岭脑梗死患者脑动脉狭窄的分布特点
周志可 张惠敏 李 颖 沈雪莉 张荣伟 赵传胜
(中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
老年分水岭脑梗死患者脑动脉狭窄的分布特点
周志可 张惠敏 李 颖 沈雪莉 张荣伟 赵传胜
(中国医科大学附属第一医院神经内科,辽宁 沈阳 110001)
目的 探讨老年分水岭脑梗死(CWI)患者脑动脉狭窄的分布特点。方法 选52例老年CWI住院患者,男38例,女14例,平均年龄(75.6±5.0)岁。所有患者行头磁共振成像(MRI)、弥散加权成像(DWI)及CT血管造影(CTA)检查,将CWI分为皮质型、皮质下型和混合型。采用北美症状性动脉内膜切除术研究协助组(NASCET)狭窄测量标准,根据狭窄程度分为:轻度(狭窄率<50%),中度(狭窄率50%~70%),重度、闭塞(狭窄率>70%)。结果 CTA共检测出104条,颈内动脉37条(37/104,35.6%),大脑中动脉26条(26/104,25%),大脑前动脉9条(9/104,8.6%),大脑后动脉11条(11/104,10.6%),椎动脉(21/104,20.2%)。皮质型CWI血管轻-中度狭窄10例(10/13,76.9%),皮质下型重-闭塞25例(25/29,86.2%)。单支血管病变12例(12/52,23.1%),多支血管病变40例(40/52,76.9%)。结论 颈内动脉、大脑中动脉、椎动脉狭窄与老年CWI关系密切,皮质型CWI血管病变主要以轻-中度狭窄为主,皮质下型主要以重-闭塞为主。
分水岭脑梗死;CT血管造影;磁共振成像
分水岭脑梗死(CWI)又称边缘带梗死,是指脑内相邻动脉供血区交界处脑组织的缺血坏死,多见于中老年患者,约占全部脑梗死的10%〔1〕。各种原因引起的休克、降压药使用不当、大量脱水等导致体循环低血压或有效循环血量减少,最先出现边缘带受累发生缺血梗死〔2〕。本文对52例老年CWI患者的神经影像学及临床资料进行分析,观察不同类型CWI患者的脑动脉狭窄的分布特点。
1 资料与方法
1.1 一般资料 2010年7月至2015年2月中国医科大学附属第一医院神经内科住院的老年CWI患者52例,男38例,女14例;年龄61~84〔平均(75.6±5.0)〕岁。诊断符合第四届全国脑血管病会议制定的标准,经头磁共振成像(MRI)和弥散加权成像(DWI)证实为急性分水岭脑梗死,排除心源性脑栓塞、瘤卒中、血液成分异常、感染、自身免疫性疾病等引起的脑梗死。
1.2 方法
1.2.1 MRI检查 MRI采用美国生产的GE1.5T超导型MR机及标准头线圈对所有患者进行颅脑扫描。扫描参数为:TR 2 100 ms,TE 24 ms,视野(FOV):24 cm×24 cm,层厚5 mm,间隔1.5 mm,矩阵:256×256,反转时间750 ms。DWI采用SE平面回波成像(EPI),采集参数TR/TE:500/108 ms,层厚5 mm,FOV:24 cm×24 cm。矩阵128×128,弥散敏感系数(b值)采用b=1 000 s/m2,一次激励成像。弥散敏感梯度分别施加在X、Y、Z方向上得到三组DWI,自动生成平均弥散图像。MRI显示分水岭脑梗死的形状、大小及分布位置,DWI显示弥散受限高信号,表观扩散系数(ADC)显示低信号提示近期梗死灶。
1.2.2 CWI分型 根据梗死灶部位将CWI分为皮质型、皮质下型和混合型〔3〕。①皮质型:梗死灶位于大脑中与大脑前或大脑后动脉皮质支的供血区,表现为额、顶、枕叶楔形病灶,包括皮质前型和皮质后型。临床症状主要表现为偏瘫、失语、皮层性感觉障碍及情感淡漠等。②皮质下型:梗死灶位于大脑前、大脑中、大脑后动脉深穿支与Heubner动脉、豆纹动脉、脉络膜前动脉的供血区,表现为侧脑室旁、半卵圆中心、放射冠区的串珠样或条索状病灶。临床症状主要表现为轻偏瘫、偏身感觉障碍及轻度构音障碍等。③混合型:以上两种类型并存。
1.3 头颈CT血管造影(CTA) CTA采用美国GE公司的Light Speed 64排螺旋CT,Nemoto双筒CT专用高压注射器,使用峰值法进行容积扫描,扫描范围从主动脉弓下缘至颅顶。扫描结束后在GE公司的ADW4.4工作站上进行容积重建、血管拉直、曲面重建及管腔分析等后处理。经三维重建图像处理,显示从主动脉弓出发,到颈动脉分叉处、Willis环及其远端分支等血管。采用北美症状性动脉内膜切除术研究协助组(NASCET)狭窄测量标准〔4〕,狭窄程度=(颈内动脉管径-最小残存管径)/颈内动脉管径×100%,根据狭窄程度分为:轻度(狭窄率<50%),中度(50%<狭窄率<70%),重度-闭塞(狭窄率>70%)。
1.4 统计学方法 应用SPSS20.0统计软件进行χ2检验。
2 结 果
2.1 MRI和DWI结果 52例患者经MRI和DWI证实为急性CWI,其中皮质型13例(25%),皮质下型29例(55.8%),混合型10例(19.2%)。
2.2 CTA检测出病变血管数量、狭窄程度及分布 CTA共检测出病变血管104条,单支血管病变12例(12/52,23.1%),多支血管病变40例(40/52,76.9%)。颈内动脉狭窄37条(37/104,35.6%),其次大脑中动脉26条(26/104,25%),椎动脉21条(21/104,20.2%),大脑前动脉9条(9/104,8.6%),大脑后动脉11条(11/104,10.6%)。见表1。皮质型好发轻-中度狭窄(10/13,76.9%),皮质下型好发重-闭塞(25/29,86.2%)。见表2。
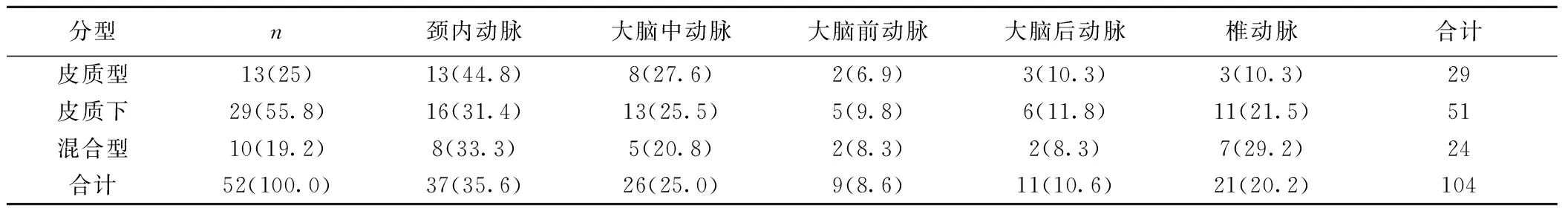
表1 分水岭脑梗死与病变血管的分布〔n(%)〕

表2 分水岭脑梗死与血管狭窄程度〔n(%)〕
3 讨 论
CWI发病前常有黑矇、体位性低血压或晕厥〔5〕,提示脑血流低灌注的存在,随着经颅多普勒(TCD)的普及,通过检测血管内微栓子信号来预测梗死灶数目及分布,提示微栓塞的存在;分水岭区处于低灌注时,血流动力学发生障碍,微栓子不易被冲刷走,造成终末血管堵塞,血流瘀滞进一步加重该部位低灌注,最终导致CWI〔6〕。因此,目前普遍认为CWI与低灌注和微栓塞有关〔7〕,两者具有协同作用。
CTA检查52例患者均有不同程度的脑血管狭窄,多支血管病变40例(40/52,76.9%),提示血管狭窄是引起CWI的病变基础〔8〕。方瑞乐等〔9〕报道约67%的 CWI患者存在脑血管狭窄或闭塞,特别是老年人内皮功能受损,血流速度缓慢,促使平滑肌细胞增生和血小板黏附聚集形成斑块,随着动脉粥样硬化性狭窄或闭塞、不稳定斑块溃疡破裂等〔10〕最终导致CWI的形成。本研究结果提示CWI可能与颈内动脉和大脑中动脉狭窄关系密切〔11〕,椎动脉先天发育异常所致纤细或缺如多见,使后循环向前循环代偿减少,脑血流灌注不足导致CWI的发生。
本组资料显示皮质型CWI主要以轻-中度狭窄为主,皮质下型主要以重-闭塞为主,两者分别具有统计学差异。皮质型CWI血管狭窄不重,血流动力学影响较小,加上Willis环的代偿作用,不易引起脑组织缺血梗死,Jorgensen等〔12〕最早报道从皮质型CWI患者观察到微栓子的存在,而不是继于脑血流量的下降,提示其原因可能与易损斑块破裂、微栓子脱落导致远端栓塞有关。皮质下分水岭区的血流供应主要来自深穿支,这些动脉直接从主干血管近乎以直角逆行发出,微栓子难以随血流到达该区域,Moustaa等〔13〕报道皮质下分水岭区的血流灌注与颈内动脉的狭窄程度显著相关,提示其原因可能与低灌注有关〔7〕,颈内动脉重度狭窄或闭塞时,Willis环及次级侧支循环代偿有限,皮质下分水岭区灌注不足,血流动力学发生障碍,代谢储备耗尽最终导致该区域缺血梗死。混合型CWI包括皮质型和皮质下型,考虑其原因为低灌注和微栓塞的协同作用有关。
与数字减影血管造影(DSA)相比,CTA能清晰显示斑块类型、溃疡形状、纤维帽是否存在裂隙等〔14〕,安全无创,操作简便,价格低廉,假阳性率和假阴性率与DSA相当〔15〕,并优于MRA,临床普及率高。本组资料提示分水岭脑梗死与颈内动脉、大脑中动脉和椎动脉狭窄关系密切,不同类型的CWI发病机制有所不同,皮质型CWI主要与微栓塞有关,皮质下型主要与低灌注有关,混合型可能与两者协同作用有关,观察血管病变程度及分布情况对分水岭脑梗死的个体化治疗具有重要指导作用。
1 Rovira A,Grive E.Distribution territories and causative mechanisms of ischemic stroke〔J〕.Eur Radiol,2005;15(3):416-26.
2 Oaesman IF,Sherman PM,Grega MA,etal.Watershed strokes after cardiac surgery:diagnosis,etiology and outcome〔J〕.Stroke,2006;37(5):2306-11.
3 Momjian-Mayor I,Baron JC.The pathophysiology of watershed infarction in internal carotid artery disease:review of cerebral perfusion studies〔J〕.Stroke,2005;36(2):567-77.
4 North America symptomatic carotid endarterectomy trial collaboratots.Beneficial effects of carotid endarterectomy in symptomatic patients with high grade stenosis〔J〕.N Engl J Med,1991;325(7):445-53.
5 Förster A,Szabo K,Hennerici MG.Mechanisms of disease:pathophysiological concepts of stroke in hemodynamic risk zones-do hypoperfusion and embolism interact〔J〕.Nat Clin Pract Neurol,2008;4(4):216-25.
6 Caplan LR,Wong KS,Gao S.Is hypoperfusion an important cause of strokes? If So,How〔J〕?Cerebrovasc Dis,2006;21(3):145-53.
7 Mangla R,Kolar B,Almast J,etal.Border zone infarcts:pathophysiologic and imaging characteristics〔J〕.Radiographics,2011;31(5):1201-14.
8 Yamauchi H,Nishii R,Higashi T,etal.Hemodynamic compromise as a cause of internal border-zone infarction and cortical neuronal damage in at herosclerotic middle cerebral artery disease〔J〕.Stroke,2009;40(12):3730-5.
9 方瑞乐,王拥军.脑分水岭梗死的临床特点及其发病机制研究〔J〕.中国卒中杂志,2006;1(4):246-51.
10 Rush JW,Aultman CD.Vascular biology of angiotensin and the impact of physical activity〔J〕.Appl Physiol Nutr Metab,2008;339(1):162-72.
11 Yong SW,Bang OY,Lee PH,etal.Internal and cortical border-zone infarction:clinical and diffusion-weighted imaging feartures〔J〕.Stroke,2006;37(3):841-6.
12 Jorgensen L,Torvik A.Ischaemic cerebrovascular diseases in an autopsy series.2.Prevalence,location,pathogenesis and clinical course of cerebral infarcts〔J〕.J Neurol Sci,1969;9(2):285.
13 Moustaa RR,Izquierdo-Garcia D,Jones PS,etal.Watershed infarcts in transient ischemic attack/minor stroke with>or=50% carotid stenosis:hemodynamic or embolic〔J〕? Stroke,2010;41(7):1410-6.
14 Seemann MD,Englmeier K,Schuhmann DR,etal.Evaluation of the carotid and vertebral arteries:comparison of 3D SCTA and IA-DSA-work in Progress〔J〕.Eur Radiol,1999;9(1):105-12.
15 Nonent M,Ben Salem D,Serfaty JM,etal.Overestimation of moderate carotid stenosis assessed by both doppler US and contrast enhanced 3D-MR angiography in the CARMEDAS study〔J〕.J Neuroradiol,2011;38(3):148-55.
〔2016-01-27修回〕
(编辑 苑云杰/曹梦园)
赵传胜(1973-),男,医学博士,主任医师,博士生导师,主要从事脑血管病、缺血后的神经修复研究。
周志可(1985-),男,主治医师,医学博士,主要从事老年神经病学研究。
R74
A
1005-9202(2017)11-2694-03;
10.3969/j.issn.1005-9202.2017.11.041

