纳氏试剂测定水中氨氮影响因素的探讨
王玉功 拉毛吉 张 榕
(国土资源部 兰州矿产资源监督检测中心,兰州 730050)
纳氏试剂测定水中氨氮影响因素的探讨
王玉功 拉毛吉 张 榕
(国土资源部 兰州矿产资源监督检测中心,兰州 730050)
对国家生活饮用水标准检验方法“GB/T5750—2006”中涉及到的水中氨氮的检测条件进行了探讨,讨论了样品的采集与保存,影响显色、空白值的各项因素,并提出相应的解决办法。对国家标准物质以及实际样品的验证表明,方法的相对误差为0.03%~1.5%,相对标准偏差RSD为0.55%~5.3%,准确度也能满足分析要求,对国家标准方法进行了补充与细化,在实际工作中有参考价值。
纳氏试剂;氨氮;水样;影响因素
前言
氨氮含量是水质评价中的一个重要指标,水中氨氮的来源主要为生活污水中含氮有机物受微生物作用的分解产物,工业废水,如焦化废水、合成氨化肥厂废水等,以及农田排水[1]。此外,在无氧环境中,水中存在的亚硝酸盐亦可受微生物作用,还原为氨。测定水中氨氮,有助于评价水体被污染和“自净”状况。测定氨氮的常用方法有纳氏试剂分光光度法、水杨酸盐分光光度法、酚盐分光光度法[2]、对污染严重的水或工业废水,则以蒸馏法使之消除干扰。这些方法各有特点,纳氏试剂分光光度法灵敏度高、操作相对简单,成为水质分析氨氮普遍使用的方法。然而在实际的样品分析中,结果的精密度和准确度都不令人满意。针对这一问题,本文讨论了影响显色的各项因素、影响空白值的各项因素。优化了实验条件,提出注意事项,在实际水质检测中取得满意效果,是对国家标准方法的补充和细化。对实际工作有一定参考价值。
1 实验部分
1.1 仪器和试剂
Tu-1800SPC紫外可见分光光度计(北京谱析公司);pHS-3C型酸度计(上海雷磁仪器厂)。
所用试剂均为分析纯,实验室用水为无氨蒸馏水。
试剂同文献[2]
氨氮标准储备溶液(NH3-N,1.00 mg/L):将氯化铵于l05 ℃下烘干冷却后称取3.819 0 g,然后用水溶解并定容于1 L,摇匀。用时稀释成10 μg/mL的标准溶液。
1.2 水样的采集与保存
水样采集在聚乙烯瓶或玻璃瓶内,并应尽快送实验室分析,若采样当天不能送达实验室检测,可加硫酸将水样酸化至pH<2,每升水样加0.8 mL硫酸,于2~5 ℃下存放。24 h内分析。
1.3 实验方法
同国家标准方法纳氏试剂法测定氨氮[2]。
2 结果与讨论
2.1 水样pH值的影响
一般水样的采集、送样、检测不可能一天完成,为保证检测结果的可靠性,必须将样品酸化至pH<2,并应尽快送实验室分析。检测时先将样品的pH值调节至中性,再取样按实验方法分析。测定氨氮的反应式可表示为:
NH4++OH-= NH3+ H2O
NH3+OH-= NH2-+ H2O
2K2HgI4+ NH2-+ 2OH-= NH2Hg2OI+4K++7I-+ H2O
(1)
由反应式(1)可知,体系碱度变化影响纳氏反应平衡,水样是否调节到中性,是产生测定误差的主要原因。为了验证水样pH值变化与氨氮测定值的关系,配制氨氮含量为2.5 mg/L的水样分为4份,分别调节pH值为:5、7、9、11,按实验方法加入纳氏试剂显色后测定,结果见表1。由表1实验结果表明:水样pH值变化对氨氮的测定值有较大影响,水样呈中性和碱性,得出的结论符合平行样测定质量控制要求[3],而呈酸性的水样测定氨氮无实际意义。同时水样的碱度调节过大,加入纳氏试剂显色后体系pH值过大,溶液易浑浊,得到的结果明显偏高。本法显色后体系的pH值在11~12,这与杨树成[4]pH值控制在11.8~12.4是一致的。所以将样品的pH值调节为中性是获得好的精密度、准确度的关键(pH值的调节:将酸化至pH<2的水样1 000 mL加入30 mL NaOH溶液(200 g/L)后,再以NaOH溶液(50 g/L)微调至中性。)。

表1 pH值变化与氨氮测定值关系
2.2 显色体系的稳定时间
显色体系的稳定性是影响氨氮测定的重要因素,本反应在常温下即可顺利进行,且反应温度在15~30 ℃范围内对体系无影响。选择氨氮含量高、中、低三个级别的水样,测其吸光度,结果如图1所示,加入纳氏试剂10 min后,体系的吸光度达最大,放置10~30 min内溶液稳定,故选择显色10 min后进行尽快测定。

图1 显色体系稳定的时间Figure 1 Stable times of the coloring system.
2.3 实验室用水的影响
实验室环境空气中常常含有氨,所用纯水也容易被氨盐试剂交叉污染,导致氨氮空白值偏高,所以实验室自制的蒸馏水、超纯水应以氨氮专用的水桶密封保存。
2.4 滤纸的影响
一些地下水、地表水常常有少量悬浮物,需过滤后测定,水样有颜色或浑浊需用絮凝沉淀法处理,要用到滤纸,一般的滤纸都含有少量的氨氮,会影响氨氮测定的精密度,所以使用前用无氨水反复洗涤可除去滤纸中可溶性氨。
2.5 化学试剂影响
市售的分析纯碘化汞试剂质量参差不齐,碘化汞见光易分解,变质的碘化汞试剂肉眼很难分辨,使得配制的纳氏试剂空白值明显偏高,所以购得碘化汞需进行空白验证,空白值满足分析要求的试剂才可使用,并且使用后碘化汞应避光密封保存,以获得较低的空白值。
2.6 纳氏试剂的配制
文献[2]纳氏试剂配制过程中往往易出现浑浊,配制方法较难控制。 参考沈燕飞等人的文献[5],利用KI、HgCl2和NaOH配制的纳氏试剂空白值较国家标准方法中,用KI、HgI2和NaOH配制的空白值低。该方法关键在于把握HgCl2的加入量,这决定着获得显色基团含量的多少,进而影响方法的灵敏度。但文献[5]未给出HgCl2的确切用量,本文经大量实验总结的配制方法试剂空白值低、不易浑浊、显色灵敏。配制方法如下:称取20 g碘化钾溶于约50 mL水中,边搅拌边逐步加入9 g二氯化汞(HgCl2)结晶粉末后,改为滴加饱和二氯化汞溶液,并充分搅拌,当出现微量朱红色沉淀溶解时,停止滴加二氯化汞溶液。另称取60 g氢氧化钠溶于300 mL水中,充分冷却至室温后,将纳氏试剂溶液在边搅拌下,徐徐注入氢氧化钠溶液中,用水稀释至500 mL,摇匀。储存于聚乙烯瓶中,于2~5 ℃下避光保存,可使用6个月不失效。
2.7 酒石酸钾钠保存期影响
按照国家标准[2]实验常常发现,氨氮标准曲线的截距往往很大,这是因为50%的酒石酸钾钠溶液的空白值与其保存的环境、时间有关。如图2所示,系列1为酒石酸钾钠室温保存一个月内的曲线,空白值大,呈线性;系列2为保存2个月内曲线,空白值增大且不成线性;系列3为在4 ℃保存5个月的曲线,空白值小且线性良好。所以实际工作中酒石酸钾钠应现用现配或配制后2~5 ℃储存6个月内用完。

图2 酒石酸钾钠溶液的保存时间Figure 2 The preservation time of the potassium sodium tartrate solution.
2.8 样品稀释
氨氮测定过程中,样品显色后,常常发现其吸光度值高于曲线范围。对于大批量样品重新取样分析费时、费力、又浪费试剂。王文雷等[6-7]采用将显色后的样品稀释测定,经验证与原始样稀释后测定的结果无显著性差异。所以本法对于超曲线范围的样品显色后稀释测定。
2.9 准确度实验
为了考核验证方法的准确性,以国家标准物质GBW(E)081785(由国家标准物质中心购得)按实验方法对其中的氨氮含量进行测定,结果见表2,测定值与标准值相符,方法的准确度良好。
表2 标准物质中氨氮的测定结果

Table 2 Analysis results of ammonia nitrogen in National standard Reference materials /(mg·L-1)
2.10 精密度及加标回收实验
对实际样品:地表水、地下水按实验方法进行精密度及加标回收实验,见表3。表3结果表明,方法的相对标准偏差(RSD,n=5)为0.55%~5.25%,加标回收率为93.8%~102%,符合水质检验质量控制[3],说明本方法实验条件更适合氨氮的准确测定。
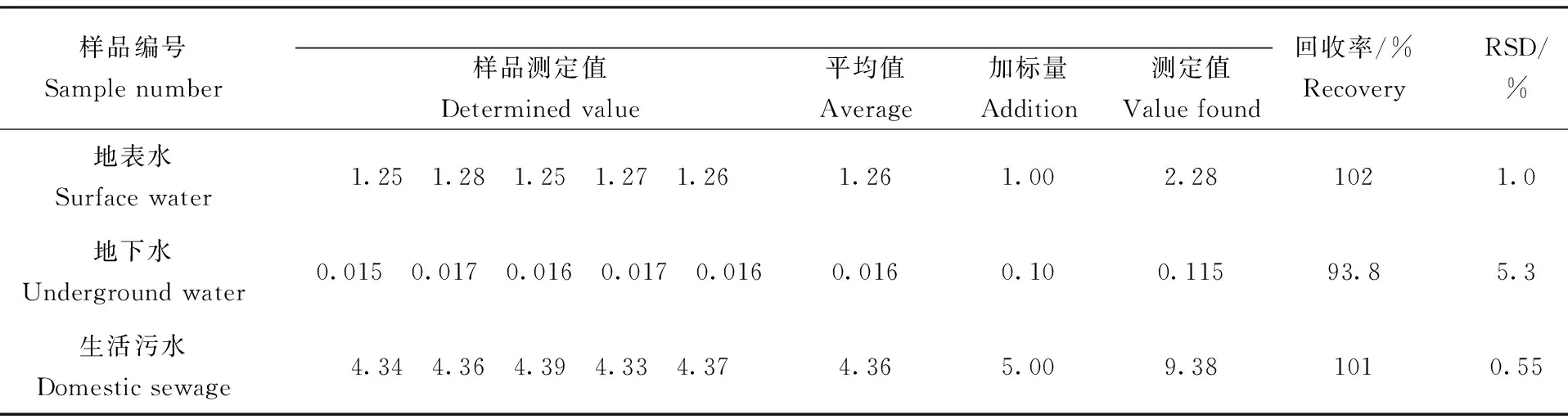
表3 实际样品分析结果和加标回收实验
3 结语
本文主要讨论饮用水、水源水、较洁净水质氨氮的测定,对于有颜色或浑浊的样品需进行絮凝沉淀后测定、对于严重污染水或含有硫化物、Ca、Mg 、Fe 浓度较高的样品,均应蒸馏后比色或容量法测定。
按照国家标准方法测定水中氨氮,本文严格了样品的采集与保存,讨论了样品pH值的调节,试剂的配制与保存,显色体系的稳定时间,通过国家标准物质以及实际样品的验证,准确度、精密度都有较大提高,是对国家标准方法的补充与细化,在实际工作中有参考价值。
[1] 尹洧.现代分析技术在水质氨氮监测中的应用[J].中国无机分析化学(ChineseJournalofInorganicAnalyticalChemistry),2013,3(2):1-5.
[2] 中国国家标准化管理委员会.GB/T5750—2006 生活饮用水标准检验方法[S].北京:中国标准出版社,2006.
[3] 中国环境监测总站.水质监测实验室质量控制指标[S].北京:中国环境科学出版社,1990.
[4] 杨树成.环境样品稀释方法探讨[J].中国环境监测(EnvironmentalMonitoringofChina),1997,13(4):55-57.
[5] 沈燕飞,历以强. 氨氮测定中有关问题的探讨[J].环保科技(EnvironmentalProtectionandTechnology),2008,3(14):17-19.
[6] 王文雷.纳氏试剂比色法测定水体中氨氮影响因素的探讨[J].中国环境监测(EnvironmentalMonitoringofChina),2009,25(2):29-32.
[7] 王婷,曹磊,薛明霞.纳氏试剂分光光度法测定氨氮中常见问题与解决办法[J].分析试验室(ChineseJournalofAnalysisLaboratory),2008,27(12):346-349.
Investigation on Influencing Factors for Determination of Ammonia Nitrogen in Water with Nessler Reagent
WANG Yugong, LA Maoji, ZHANG Rong
(LanzhouTestingandQualitySupervisionCenterforGeologicalandMineralProducts,TheMinistryofLandandResources,Lanzhou,Gansu730050,China)
The testing conditions for the determination of ammonia nitrogen in water, which are described in the national drinking water standard test method (GB/T5750—2006), were studied. The testing conditions included the collection and preservation of samples, the various factors that could influence the coloring and the blank value. Some appropriate solutions to resolve the problems caused by above factors were recommended. Verification experiments were conducted on national standard materials as well as real samples, and the results showed that the relative error of the method was between 0.03%-1.5% and the relative standard deviation of the method was between 0.55% and 5.3%. The accuracy can meet the analysis requirement. This method can supplement national standard method and provide reference to practical works.
nessler reagent; ammonia nitrogen; samples of water ;influence factor
10.3969/j.issn.2095-1035.2017.02.007
2016-08-29
2016-12-10
甘肃矿产资源勘查与综合利用工程技术研究项目(1306FTGA011)资助
王玉功,男,高级工程师,主要从事水质检测、岩石矿物分析研究。E-mail: wangyugong586@sohu.com
O657.32;TH744.12
A
2095-1035(2017)02-0027-04
本文引用格式:王玉功,拉毛吉,张榕. 纳氏试剂测定水中氨氮影响因素的探讨[J].中国无机分析化学,2017,7(2):27-30. WANG Yugong,LA Maoji,ZHANG Rong. Investigation on Influencing Factors for Determination of Ammonia Nitrogen in Water with Nessler Reagent[J].Chinese Journal of Inorganic Analytical Chemistry,2017,7(2):27-30.

