术中快速预测乳腺癌非前哨淋巴结转移模型的建立与验证研究
张 燕,孙 晓,赵 桐,刘雁冰,邱鹏飞,李盼盼,田崇麟,王永胜,3
1.济南大学山东省医学科学院医学与生命科学学院,山东 济南 250200;2.山东大学附属山东省肿瘤医院乳腺病中心,山东 济南 250117;3.山东省医学科学院,山东 济南 250062
术中快速预测乳腺癌非前哨淋巴结转移模型的建立与验证研究
张 燕1,2,孙 晓2,赵 桐2,刘雁冰2,邱鹏飞2,李盼盼1,2,田崇麟1,2,王永胜2,3
1.济南大学山东省医学科学院医学与生命科学学院,山东 济南 250200;2.山东大学附属山东省肿瘤医院乳腺病中心,山东 济南 250117;3.山东省医学科学院,山东 济南 250062
背景与目的:大部分前哨淋巴结(sentinel lymph node,SLN)阳性而接受腋窝淋巴结清扫术(axillary lymph node dissection,ALND)的患者,腋窝非前哨淋巴结(non-sentinel lymph node,nSLN)并没有发生转移,因此准确预测nSLN转移至关重要。该研究将建立基于分子诊断一步核酸扩增法(onestep nucleic acid amplification,OSNA)的术中快速预测乳腺癌nSLN转移的模型,以期有效指导乳腺癌后续治疗。方法:利用2010年OSNA临床试验入组的552例患者中SLN阳性、并接受ALND的103例患者数据,建立基于分子诊断的乳腺癌NSLN转移的预测模型,并利用2015年OSNA临床试验入组的327例患者中61例符合相同条件的患者数据进行验证。结果:原发肿瘤大小、SLN总肿瘤负荷、SLN阳性数及阴性数是NSLN转移的四个独立相关因素,利用这四个因素建立预测列线图,得出建模组患者的受试者工作特征(receiver operating characteristic curve,ROC)曲线的曲线下面积(area under the ROC curve,AUC)为0.814,验证组患者的AUC为0.842。利用验证组61例患者影像学评估的肿瘤大小替代病理大小对本模型进行了验证,得出AUC为0.838,与模型验证性AUC相比差异无统计学意义(P=0.740 6)。结论:基于分子诊断的乳腺癌预测nSLN转移的模型既可以术中快速预测腋窝淋巴结转移风险,也可以术后常规预测,明显优于其他预测模型,对后续腋窝的处理及放疗靶区勾画具有更好的指导价值。
乳腺肿瘤;前哨淋巴结活组织检查;分子诊断技术
前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)已迅速替代腋窝淋巴结清扫术(axillary lymph node dissection,ALND),成为临床腋淋巴结阴性早期乳腺癌的标准处理模式[1-2]。前哨淋巴结(sentinel lymph node,SLN)阳性而接受ALND的患者中,大部分患者腋窝非前哨淋巴结(non-sentinel lymph node,nSLN)并没有发生转移,因此,准确预测nSLN转移风险至关重要。当SLN 1~2枚转移时,ACOSOG Z0011试验证实接受保乳手术及全乳房放疗的患者可以避免ALND,AMAROS试验则显示,腋窝放疗与ALND具有相似的区域控制和生存率及更低的上肢水肿发生率[3-4]。临床实践中,采取高切线野或者腋窝单独设野照射主要依据nSLN转移的概率[5],因此,对于SLN低肿瘤负荷转移患者,预测nSLN转移的风险及其概率对指导后续放疗靶区的勾画同样极为重要。传统基于临床病理指标的nSLN预测模型的预测效能较低,不能满足临床的需要。
近年来,敏感性更高的分子诊断优势逐渐显现。一步核酸扩增法(one-step nucleic acid amplification,OSNA)采用反转录-环状介导等温扩增(reverse-transcription loop-mediated isothermal amplification,RT-LAMP)技术进行特定基因细胞角蛋白19(cytokeratin19,CK19)的扩增检测判定淋巴结是否转移。本研究将分析OSNA检测法对nSLN转移的预测能力,建立乳腺癌术中快速预测NSLN转移的预测模型,以期有效指导乳腺癌后续治疗。
1 资料和方法
1.1 受试者入选条件
已经确诊为乳腺癌的女性患者,符合SLNB适应证。本研究已得到医院伦理委员会的批准和患者的知情同意。
1.2 SLN的处理
本研究采用联合99mTc标记的硫胶体和亚甲蓝的方法进SLNB。若SLN质量为100~ 1 200 mg,则垂直于短轴进行切分:短轴长度小于等于4.0 mm时,切分为2枚组织块,1枚组织块术中行OSNA检测,另l枚术后行病理检测;短轴长度大于4.0 mm时,切分为4枚组织块,奇数组织块术中行OSNA检测,偶数组织块术后行病理检测。
1.3 OSNA检测
对同一淋巴结的送检组织块进行匀浆,应用样本处理液(Lynorhag)从组织匀浆液中进行RNA提取,应用CK19核酸检测试剂盒(Lynoamp BC)在基因扩增分析仪RD-100i(购自日本Sysmex公司)中进行检测,且每次检测均包括严格的质控。检测结果++、+均判定为SLN阳性(分别代表CK19 mRNA扩增量大于等于5 000个/μL,拷贝数为250~5 000个/μL。CK19 mRNA扩增量小于250个/μL则被判定为SLN阴性。每例患者的总肿瘤负荷(total tumor load,TTL)为所有阳性淋巴结的CK19 mRNA拷贝值之和。
1.4 病理检测
采用间隔为200 μm逐层切片H-E染色,切片的厚度为4~6 μm,每个组织块取3张切片。采用的标准为第7版美国癌症联合委员会(American Joint of Cancer Conference,AJCC)肿瘤分期[6]的诊断标准,大于等于2.0 mm的转移灶定义为宏转移,0.2~2.0 mm的转移灶定义为微转移,以上转移灶定义为SLN阳性。
1.5 预测NSLN转移模型的指标选择
综合传统模型[7-13],选取年龄、原发肿瘤大小、脉管浸润、组织学分类、肿瘤分级、SLN阳性数/SLN总数、最大转移灶大小、SLN阳性数、SLN阴性数、ER、PR及HER-2等因素,并将本研究中的SLN TTL作为指标之一,建立后续预测模型。
1.6 统计学处理
应用SPSS 17.0进行统计分析。通过单因素相关分析及Logistic多因素回归分析得出与nSLN转移相关的独立因素(为避免统计过程中数据非线性因素的影响,TTL数据取Log形式进行分析),α=0.05,P<0.05为差异有统计学意义。参照纪念斯隆-凯特琳癌症中心 (Memorial Sloan-Kettering Cancer Center,MSKCC)模型建立方法[7],建立预测nSLN转移的列线图,利用ROC曲线评估该列线图预测nSLN转移的灵敏度与特异度,并应用MedCalc 15.8软件进行ROC曲线分析。其中,依据Logistic多因素回归分析结果,建立预测nSLN转移发生风险概率的Logistic回归模型,Logistic回归方程为Logit(P)=1/1+exp[-(-4.89+0.48X1+0.567X2+1.081 X3-0.661X4)](其中P表示nSLN转移发生风险的预测值,X1表示Log(TTL),X2表示肿瘤大小(cm),X3表示SLN阳性数目,X4表示SLN阴性数目),依据回归方程公式应用Rstat 3.3.3软件,建立列线图模型。
2 结 果
2.1 临床病理特征
本研究入组患者的临床病理学特征见表1。2010年OSNA临床试验(注册号:NCT01136369)共入组患者552例,103例患者SLN阳性并接受ALND纳入本次研究的建模数据组。因国家食品药品监督管理总局要求该临床试验入组患者需足1 000例,于2015年准予再次开展OSNA临床试验,目前本中心共入组患者327例,61例患者SLN阳性并接受ALND纳入本次研究的验证数据组。本研究中术中快速冰冻病理及印片细胞学检查,二者或任一阳性即作为SLN阳性并行ALND。入组患者均为OSNA结果阳性,且术中冰冻或印片结果阳性的患者。
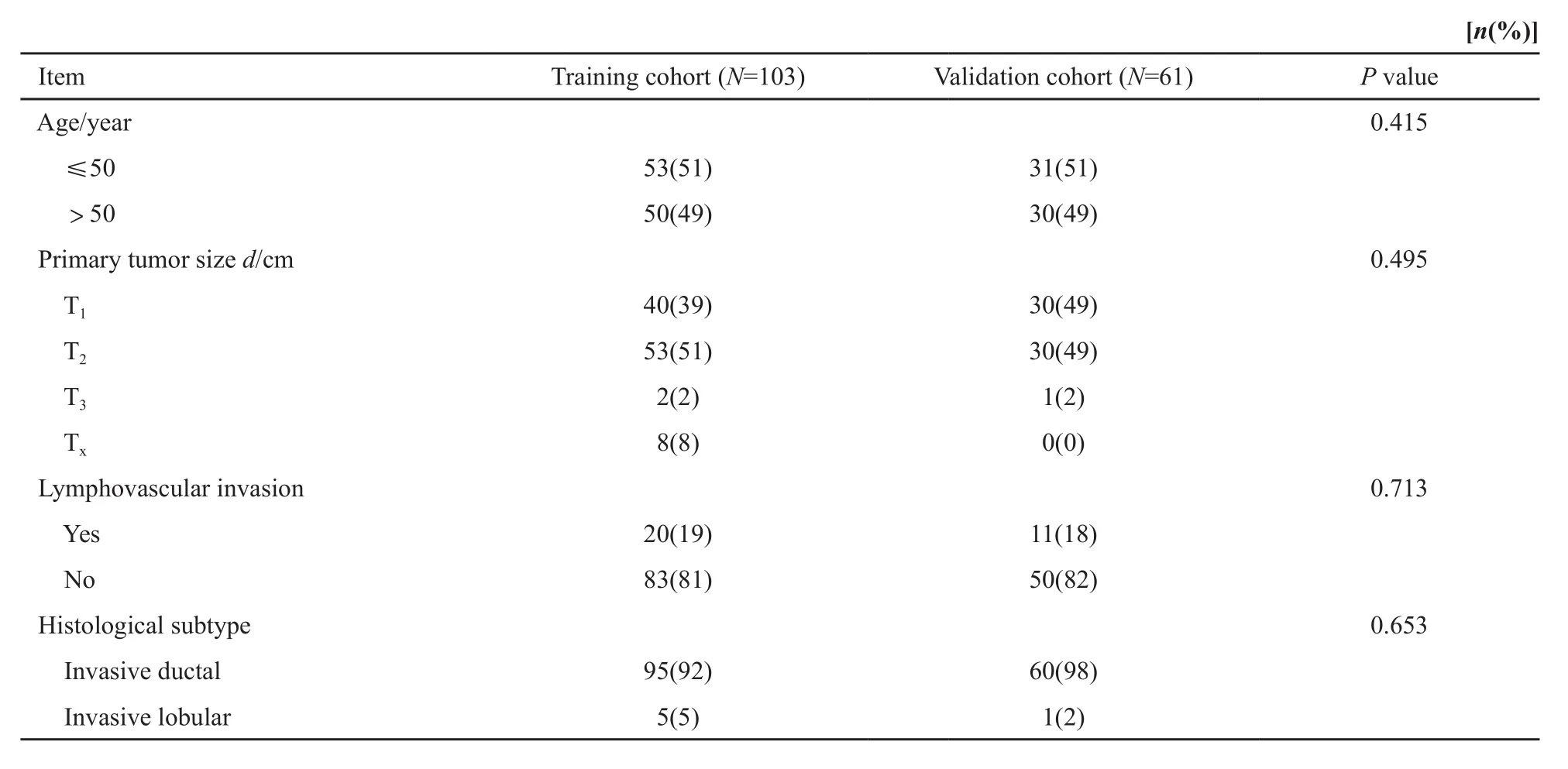
表1 入组患者临床及病理特征Tab. 1 Clinicopathologic characteristics of the enrolled patient

续表
2.2 建立基于分子诊断预测nSLN转移的列线图模型
按照本预测模型选取的指标,对建模组103例患者进行单因素分析,发现原发肿瘤大小(P=0.001)、脉管浸润(P=0.007)、TTL(P=0.000)、最大转移灶大小(P=0.000)、SLN阳性数(P=0.000)、SLN阴性数(P=0.000)及SLN阳性数/SLN总数(P=0.000)均与nSLN转移相关,而年龄(P=0.940)、组织学分类(P=0.993)、肿瘤分级(P=0.300)、ER(P=0.074)、PR(P=0.073)及HER-2(P=0.695)均与nSLN转移无关。对有统计学意义的因素进一步行Logistic多因素回归分析,发现TTL(P=0.002)、原发肿瘤大小(P=0.013)、SLN阳性数(P=0.000)及SLN阴性数(P=0.001)是nSLN转移的独立相关因素,依据MSKCC列线图建立方法,利用TTL、原发肿瘤大小、SLN阳性数及SLN阴性数建立预测乳腺癌nSLN转移的列线图模型(图1)。并利用所建模型得出建模组患者NSLN转移预测值的ROC曲线的AUC为0.814(图2)。
2.3 本模型的预测性验证研究
为了进一步验证本模型的准确性,我们利用验证组61例符合本研究条件的患者对建立的预测模型进行了验证,得出ROC曲线的AUC为0.842(图2)。

图1 基于术中分子诊断预测NSLN转移列线图Fig.1 Nomogram to predict likelihood of NSLN metastases based on intraoperative molecular diagnosis

图2 本模型建模组及验证组患者NSLN转移预测值的ROC曲线Fig.2 ROC curve of the prediction model for the training cohort and the validation cohort
2.4 影像学评估的肿瘤大小与原发肿瘤大小对模型预测性差异的比较
本模型的四个建模因素除原发肿瘤大小外其余数据均可在术中获取,为实现术中快速预测nSLN转移风险,本研究利用验证组61例患者影像学(超声、钼靶、乳腺磁共振)评估的肿瘤大小数据替代术后病理评估的原发肿瘤大小数据,对模型进行了验证,得出ROC曲线的AUC为0.838,与前述验证性ROC曲线的AUC相比差异并无统计学意义(P=0.740 6)。
2.5 本模型对腋窝淋巴结分期为pN1、pN2及以上患者的预测性研究
本研究共入组164例患者,其中121例患者腋窝淋巴结分期pN1,43例患者腋窝淋巴结分期大于等于pN2,为探究本模型对患者腋窝淋巴结1~3枚转移及大于等于4枚淋巴结转移的预测能力,利用本模型得出患者pN1及大于等于pN2的预测风险临界值为45.4%,ROC曲线的AUC为0.861(P<0.000 1)。另外,为探究术中利用影像学肿瘤大小快速预测腋窝淋巴结分期情况,利用本模型得出验证组61例患者中pN1及大于等于pN2的预测风险临界值为33.5%,AUC为0.839(P<0.000 1)。
2.6 本模型与传统预测模型的验证性比较
我们将本模型与传统的预测模型进行了比较,传统模型以MDA及Tenon模型为代表,利用建模组及验证组的164例患者分别对其进行了验证,得出AUC分别为0.745及0.623(图3)。

图3 本模型及传统模型的验证性ROC曲线Fig. 3 ROC curve of our model and the traditional models
3 讨 论
以往认为,SLN阴性时,不必行ALND,SLN阳性时,ALND仍是标准处理模式。近期发表的两项前瞻性研究的结果在一定程度上改变了这一观点,目前认为,临床腋淋巴结阳性患者或者SLN转移超过2枚时,无论接受保乳手术还是乳房切除手术,仍应进行ALND。而对于腋窝低肿瘤负荷转移的接受保乳手术的乳腺癌患者,不需要进一步的腋窝处理,对于接受乳房切除术患者,腋窝放疗是ALND可以接受的优选替代。因此,ALND是上述两项研究标准(Z0011+AMAROS)之外的SLN转移患者的标准治疗方案,对于SLN转移(更重要的是Z0011+AMAROS研究标准之外SLN转移)患者,预测nSLN是否转移,从而避免ALND的预测模型具有十分重要的临床意义。然而,有20%~60%的患者腋窝nSLN并没有发生转移,这部分患者接受了过度治疗,并没有从ALND中获益[14-18]。因此,外科医师对nSLN转移预测模型的需求较大,需要通过模型的预测情况指导后续腋窝手术治疗。
放疗科医师也越来越看重nSLN预测模型的应用价值。2016年乳腺癌NCCN指南指出[19],接受乳房切除术和保乳手术的乳腺癌患者,腋窝淋巴结1~3枚转移时推荐行胸壁+锁骨上下区域放疗,强烈建议内乳区淋巴结放疗(ⅡA类证据),腋窝淋巴结4枚以上转移时推荐行胸壁+锁骨上下区域+内乳区淋巴结放疗(Ⅰ类证据)。因此,腋窝淋巴结分期pN1及大于等于pN2患者的局部区域治疗是不同的,nSLN预测模型的应用可以指导放疗医师更精确的勾画放疗靶区。因此,对于SLN低肿瘤负荷转移患者,预测NSLN转移的风险对指导后续放疗靶区的勾画同样极为重要。
世界各地的研究者均在不断探索预测nSLN转移的风险的模型,已经建立的模型包括MSKCC、Tenon、MD Anderson(MDA)、Mayo、Cambridge、Stanford、Helsinki等,各模型特征见表2。其中一些模型已应用于临床[20]。一项荟萃分析结果显示,Tenon及Stanford模型的预测准确性受SLN肿瘤负荷的影响较大,而MSKCC及Cambridge模型预测nSLN转移的稳定性较好[21]。2015年圣安东尼奥乳腺癌大会上,Jay Harris教授指出虽然MA20和EORTC22922/10925研究结果都证实了区域淋巴结放疗对中等复发风险者可显著改善无病生存,但考虑到区域淋巴结放疗带来包括放射性肺炎和上肢淋巴水肿的损伤显著增加,对低负荷SLN阳性者,推荐采用MDA列线图来评估nSLN阳性概率,若不超过25%~30%,推荐采用高位切线野,若高于此概率,则考虑采用腋窝放疗[22]。但传统预测模型存在以下缺陷:① 均采用SLN病理诊断方法,但不同机构SLN病理诊断的方法存在很大差异,缺乏统一标准。② 术中快速冰冻病理检测只取淋巴结的单层或有限几个层面进行检测,存在严重取样误差。术后对复杂的三维肿瘤进行二维切片常规病理检测也很难获得SLN最大转移灶大小的准确诊断。③ 传统模型的建立基于术后病理信息,包括原发肿瘤大小、多灶性和脉管浸润等因素,因此无法做到术中应用传统模型指导后续的腋窝手术方式,只能依据术后病理情况再评估腋窝淋巴结状况。这些缺陷大大限制了传统腋窝nSLN转移预测模型的临床应用。

表2 各传统预测模型的特征Tab. 2 Characteristics of different traditional models
OSNA技术是基于RT-LAMP原理检测CK19在SLN中的表达。CK19是上皮性细胞的标志基因,可作为乳腺癌在淋巴结、外周血等间叶组织转移的标志物,此法利用半定量结果检测并区分淋巴结的微转移灶及宏转移灶。传统的病理诊断只能评估小于5%的淋巴结组织,而OSNA可对100%的淋巴结组织进行检测,显著降低了取样误差,并且普通实验室人员可以在40 min内完成检测[23]。OSNA作为一种客观标准化技术,可以术中快速、准确的诊断SLN,显著降低了病理医师的主观性和工作负担。建立基于术中分子诊断预测nSLN转移的模型,可弥补传统预测模型的不足。
综上所述,基于术中分子诊断技术的nSLN转移预测模型既可以术中进行快速预测,及时指导后续腋窝手术方式,也可以依据术后病理结果进行预测,有助于临床中明确患者放疗靶区勾画,加强区域控制。
[1] VERONEsiU, PAGANELLI G, VIALE G, et al. Sentinel lymph node biopsy and axillary dissection in breast cancer: results in a large series[J]. J Natl Cancer Inst, 1999, 91(4):368-373.
[2] POSTHER K E, WILKE L G, GIULIANO A E. Sentinel lymph node dissection and the current status of American trials on breast lymphatic mapping[J]. Semin Oncol, 2004, 31(3): 426-436.
[3] GIULIANO A E, HUNT K K, BALLMAN K V, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial[J]. JAMA, 2011, 305(6): 569-575.
[4] DONKER M, VAN TIENHOVEN G, STRAVER M E, et al. Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial[J]. Lancet Oncol, 2014, 15(12): 1303-1310.
[5] BUDACH W, BÖLKE E, KAMMERS K, et al. Adjuvant radiation therapy of regional lymph nodes in breast cancer-a meta analysis of randomized trials-an update[J]. Radiat Oncol, 2015, 10: 258.
[6] EDGE SBBD, COMPTON C C, FRITZ A G, et al. AJCC cancer staging manual, 7thedition[M]. Springer, New York, 2010.
[7] VAN ZEE K J, MANASSEH D M, BEVILACQUA J L, et al. A nomogram for predicting the likelihood of additional nodal metastasis in breast cancer patients with a positive sentinel node biopsy[J]. Ann Surg Oncol, 2003, 10(10): 1140-1151.
[8] HWANG R F, KRISHNAMURTHY S, HUNT K K, et al. Clinicopathologic factors predicting involvement of nonsentinel axillary nodes in women with breast cancer[J]. Ann Surg Oncol, 2003, 10(3): 248-254.
[9] DEGNIM A C, REYNOLDS C, PANTVAIDYA G, et al. Nonsentinel node metastasis in breast cancer patients: assessment of an existing and a new predictive nomogram[J]. Am J Surg, 2005, 190(4): 543-550.
[10] BARRANGER E, COUTANT C, FLAHAULT A, et al. An axilla scoring system to predict non-sentinel lymph node status in breast cancer patients with sentinel lymph node involvement[J]. Breast Cancer Res Treat, 2005, 91(2): 113-119.
[11] PAL A, PROVENZANO E, DUFFY S W, et al. A model for predicting non-sentinel lymph node metastatic disease when the sentinel lymph node is positive[J]. Br J Surg, 2008, 95(3): 302-309.
[12] KOHRT H E, OLSHEN R A, BERMAS H R, et al. New models and online calculator for predicting non-sentinel lymph node status in sentinel lymph node positive breast cancer patients[J]. BMC Cancer, 2008, 8: 66.
[13] MERETOJA T J, LEIDENIUS M H K, HEIKKILÄ P S, et al. International multicenter tool to predict the risk of nonsentinel node metastases in breast cancer[J]. J Natl Cancer Inst, 2012, 104(24): 1888-1896.
[14] GIULIANO A E, HUNT K K, BALLMAN K V, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis: a randomized clinical trial[J]. J Am Med Assoc, 2011, 305(6): 569-575.
[15] CHEN K, ZHU L, JIA W, et al. Validation and comparison of models to predict non-sentinel lymph node metastasis in breast cancer patients[J]. Cancer Sci, 2012, 103(2): 274-281.
[16] PAL A, PROVENZANO E, DUFFY S W, et al. A model for predicting non-sentinel lymph node metastatic disease when the sentinel lymph node is positive[J]. Br J Surg, 2008, 95(3): 302-309.
[17] CHAGPAR A B, SCOGGINS C R, MARTIN R C, et al. Prediction of sentinel lymph node-only disease in women with invasive breast cancer[J]. Am J Surg, 2006, 192(6): 882-887.
[18] ZEE K J, MANASSEH D M, BEVILACQUA J L, et al. A nomogram for predicting the likelihood of additional nodal metastases in breast cancer patients with a positive sentinel node biopsy[J]. Ann Surg Oncol, 2003, 10(10): 1140-1151.
[19] NCCN National Comprehensive Cancer Network. Breast cancer[EB/OL]. V1.2016. Available at: http://www.nccn. org/professionals/physician_gls/PDF/breast.pdf.
[20] HESSMAN C J, NAIK A M, KEAMEY N M, et al. Comparative validation of online nomograms for predicting nonsentinel lymph node status in sentinel lymph node-positive breast cancer[J]. Arch Surg, 2011, 146(9): 1035-1040.
[21] ZHU L, JIN L, LI S, et al. Which nomogram is best for predicting non-sentinel lymph node metastasis in breast cancer patients? A meta-analysis[J]. Breast Cancer Res Treat, 2013, 137(3): 783-795.
[22] HARRIS J R. Critical decision making in radiation therapy for breast cancer in 2015[C]. 2015 San Antonio Breast Cancer Symposium. PL1-01.
[23] 王永胜, 欧阳涛, 吴 炅, 等. 一步核酸扩增仪术中诊断乳腺癌前哨淋巴结转移的前瞻性、多中心临床观察[J].中华医学杂志, 2013, 93(16): 1251-1254.
A nomogram for the intraoperative prediction of non-sentinel lymph node metastasis in breast cancer patients
ZHANG Yan1,2, SUN Xiao2, ZHAO Tong2, LIU Yanbing2, QIU Pengfei2, LI Panpan1,2,TIAN Chonglin1,2, WANG Yongsheng2,3
(1. School of Medicine and Life Sciences, University of Jinan and Shandong Academy of Medical Sciences, Jinan 250200, Shandong Province, China; 2. Breast Cancer Center, Shandong Cancer Hospital Affiliated to Shandong University, Jinan 250117, Shandong Province, China; 3. Shandong Academy of Medical Sciences, Jinan 250062, Shandong Province, China)
WANG Yongsheng E-mail: wangysh2008@ aliyun.com
Background and purpose: When patients have positive sentinel lymph node (SLN), axillary lymph node dissection (ALND) is usually performed, but most of them have no metastasis in the non-sentinel lymph node (nSLN). It is of great significance to predict metastasis of nSLN precisely. The aim of the study was to establish a nomogram for the intraoperative prediction of nSLN metastasis in breast cancer patients using one-step nucleic acid amplification (OSNA) techniques and to direct the subsequent therapy for breast cancer effectively. Methods: Of 552 breast cancer patients who underwent SLN biopsy in the 2010 OSNA clinical trial, 103 with SLN metastasis treated with ALND were assessed to establish a nomogram for intraoperative prediction of nSLN based on the moleculardiagnosis. A validation cohort of 61 patients who met the similar criteria in the 2015 OSNA clinical trial subsequently validated it. Results: Primary tumor size, total tumor load, the number of positive SLNs and negative SLNs were associated with the presence of nSLN metastasis based on the multivariable logistic regression results, and a nomogram was established with these variables. Its area under the ROC curve was 0.814 for the predictive model and it was 0.842 in the re-validation cohort. The tumor size assessed by the postoperative histological examination was replaced by the size evaluated by the imaging examination, and the area under the ROC curve was 0.838. There was no statistically significant difference in the accuracy compared with the former validation data (P=0.740 6). Conclusion: The predictive nomogram based on the molecular diagnosis can predict the nSLN metastases intra/post-operatively. It appears to be obviously superior to other predictive models and may help to guide the axillary management and to make decisions about radiation target region.
Breast cancer; Sentinel lymph node; Molecular diagnostic techniques
10.19401/j.cnki.1007-3639.2017.05.008
R737.9
A
1007-3639(2017)05-0368-08
2017-01-10
2017-03-30)
国家自然科学基金(81502314);国家自然科学基金(81672638)。
王永胜 E-mail:wangysh2008@ aliyun.com

