LRRC3B对食管癌细胞Eca109迁移、侵袭及PI3K/Akt信号通路的影响
曹燕飞,任 睿,杨 晔,罗向晖,王水利
1.陕西省人民医院胸外科,陕西 西安 710068;2.陕西省新安中心医院妇产科,陕西 西安 710048;3.陕西省人民医院呼吸内科,陕西 西安 710068
LRRC3B对食管癌细胞Eca109迁移、侵袭及PI3K/Akt信号通路的影响
曹燕飞1,任 睿2,杨 晔1,罗向晖1,王水利3
1.陕西省人民医院胸外科,陕西 西安 710068;2.陕西省新安中心医院妇产科,陕西 西安 710048;3.陕西省人民医院呼吸内科,陕西 西安 710068
背景与目的:先前的研究已经证实富含亮氨酸重复序列3B蛋白(leucine-rich repeatcontaining 3B,LRRC3B)在多种癌症中低表达,并且与癌细胞的迁移侵袭密切相关。该研究旨在探讨LRRC3B在食管癌发展中的作用机制。方法:免疫组织化学染色检测LRRC3B在60例食管癌组织及60例癌旁组织中的表达情况,采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)和蛋白[质]印迹法(Western blot)分别检测食管癌细胞Eca109和食管正常上皮细胞系HEEC中LRRC3B的mRNA和蛋白表达。处理食管癌细胞Eca109并分3组:正常对照组、阴性对照组(转染对照空pCMV6质粒)和过表达LRRC3B组(转染pCMV6-LRRC3B过表达质粒)。采用Transwell法检测各组Eca109细胞迁移和侵袭的变化。采用Western blot检测各组细胞中上皮间质转化(epithelial-mesenchymal transition,EMT)相关蛋白E-cadherin、N-cadherin和Vimentin表达以及p-Akt蛋白水平。结果:LRRC3B在食管癌组织和细胞中的表达明显低于癌旁组织和食管正常上皮细胞。过表达LRRC3B明显抑制Eca109细胞的迁移和侵袭能力,上调上皮因子E-cadherin表达,抑制间质标志物N-cadherin和Vimentin表达,同时降低细胞内p-Akt水平。结论:LRRC3B在食管癌中低表达,上调LRRC3B能够抑制食管癌细胞的EMT过程,可能与抑制PI3K/Akt信号通路有关。
富含亮氨酸重复序列3B蛋白;食管癌;上皮间质转化;PI3K/Akt
食管癌是世界上高发恶性肿瘤之一。在我国,食管癌发病率位居第5位,死亡率位居第4位,且呈不断上升趋势[1]。分子靶向治疗是继手术治疗、放疗和化疗之后肿瘤患者的又一选择,增强肿瘤抑制基因的表达,抑制肿瘤细胞增殖和转移,目前已经成为国内外肿瘤研究领域的热点。富含亮氨酸重复序列3B蛋白(leucine rich repeat-containing 3B,LRRC3B)是具有保守亮氨酸序列的跨膜蛋白,该蛋白参与动植物细胞黏附、信号转导、基因表达调控及细胞凋亡等过程[2]。已有研究证实LRRC3B基因在非小细胞肺癌[3]、乳腺癌[4]、肾细胞癌[5]和胃癌[6]中低表达,作为肿瘤抑制基因,上调其表达能够显著抑制肿瘤细胞增殖。但是目前LRRC3B在食管癌中的表达以及生物学作用尚不明确。本研究探索了LRRC3B在食管癌组织和食管癌细胞中的表达变化,分析其在食管癌发展中的作用机制,从而为食管癌的靶向治疗提供实验依据。
1 材料和方法
1.1 组织标本来源及处理
收集2014年10月—2015年5月期间本院消化科经手术治疗的食管癌患者60例,其中女性25例、男性35例,平均年龄为(49.5+4.6)岁。所有患者均已知情同意,且术前均未行放、化疗或分子靶向治疗。取材部分为癌灶组织和远端正常食管黏膜组织,癌旁组织取材于肿瘤边缘肉眼观察为正常黏膜组织,制备组织石蜡切片,备用。
1.2 细胞和主要试剂
人食管癌细胞系Eca109和正常食管上皮细胞系HEEC均购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库。免疫组织化学染色试剂盒和DAB显色试剂盒均购自北京中杉金桥生物技术有限公司,免疫组织化学LRRC3B抗体购自北京博奥森生物技术有限公司,胎牛血清、青霉素、链霉素、胰酶及DMEM培养液均购自美国Gibaco公司,RPMI-1640培养液购自美国Hyclone公司,实时荧光定量聚合酶链反应(real-time f l uorescent quantitative polymerase chain reaction,RTFQ-PCR)有关试剂均购自宝生物工程(大连)有限公司,LipofectamineTM2000购自美国Invitrogen公司,Matrigel基质胶购自购自美国Omega公司。LRRC3B、E-cadherin、N-cadherin和Vimentin单克隆抗体均购自美国Sigma公司,p-Akt和Akt单克隆抗体均购自美国Cell Signaling公司,pCMV6-LRRC3B质粒和对照空pCMV6质粒购自美国Origene公司,兔抗大鼠β-actin抗体和HRP标记的山羊抗兔IgG购自武汉博士德生物工程有限公司。
1.3 免疫组织化学染色检测组织切片中LRRC3B表达
分别随机选取3张食管癌组织和癌旁组织石蜡切片,依次经过脱蜡、水化、抗原修复、封闭内源性过氧化物酶,滴加一抗,4 ℃温育过夜,滴加山羊抗鼠的二抗,37 ℃温育30 min,DBA显色、苏木精复染、盐酸分化、脱水封片,每张切片随机选取5个以上高倍镜视野,观察LRRC3B阳性表达的情况。LRRC3B在食管癌细胞的阳性表达为细胞质中出现棕黄色颗粒,因此按阳性细胞占细胞总数的百分比对组织进行染色分级:0~10%的细胞质染色为阴性(-),10%~50%的细胞质染色为阳性(+),大于50%的细胞质染色为强阳性(++)。以上所有切片染色均与正常食管组织阳性对照样品相对比。
1.4 采用RTFQ-PCR检测Eca109和HEEC细胞中LRRC3B的mRNA表达
分别提取正常培养的食管癌细胞Eca109和正常试管上皮细胞HEEC中的总RNA,严格按照Prime ScriptRTreagent kit反转录试剂盒合成cDNA,采用cDNA的第1链作为模板进行PCR扩增。使用ABI7500快速RTFQ-PCR系统,用2-ΔΔCt法分析待测基因的相对表达水平。目的基因LRRC3B的mRNA表达量检测是以β-actin为内参基因。上海英骏生物技术有限公司合成扩增目的基因LRRC3B,其上游引物为:5’-TCCAATCATGAGACAGCCCAC-3’,下游引物为:5’-TCTGCCAGCATGTTCATCCAA-3’;内参基因β-actin上游引物为:5’-ATAGCACAGCCTGGATAGCAACGTAC-3’,下游引物为:5’-CACCTTCTACAATGAGCTGCGTGTG-3’。
1.5 食管癌细胞Eca109转染与分组
将Eca109细胞接种于含有10%的胎牛血清及青霉素100 U/mL和链霉素100 g/mL的RPMI-1640培养液中,置于37 ℃,CO2体积分数为5%培养箱常规培养。当细胞处于对数期时根据LipofectamineTM2000试剂盒说明书转染不同质粒。根据不同处理,细胞分为3组:正常对照组(不作任何处理,正常培养)、阴性对照组(转染对照空质粒pCMV6)和过表达LRRC5B组(转染过表达质粒pCMV6-LRRC3B)。转染48 h后收集细胞用于后续试验。
1.6 采用Transwell迁移实验检测各组Eca109细胞的迁移能力
用无血清DMEM培养液调整各组细胞浓度为1×105个/mL,在Transwell下室加入1 mL含有5%FBS的DMEM培养基,上室加入0.5 mL浓度为1×105个/mL的待测细胞。培养24 h,去除上室的细胞,用4%多聚甲醛溶液固定黏附在Transwell小室膜下表面细胞15 min,再用0.05%结晶紫染色40 min,然后使用Leica DC 300F正置显微镜随机选取10个视野计数细胞个数,求其平均值。
1.7 采用Transwell侵袭实验检测各组Eca109细胞的侵袭能力
与迁移实验不同的是,Transwell侵袭实验需要在接种细胞之前,用100 μL 浓度为1 mg/mL的Matrigel包埋小室1 h,其余步骤同Transwell迁移实验。
1.8 采用蛋白[质]印迹法(Western blot)检测细胞中LRRC3B、EMT相关蛋白及PI3K/Akt相关蛋白的表达
消化、离心收集各组细胞,加入裂解液重悬细胞,离心,收集含有总蛋白的上清液,采用Bradford蛋白浓度测定试剂盒进行蛋白定量(离心速率15 000×g,r=3 cm)。调整加样量25 μg,10% SDS-PAGE后转移蛋白至PVDF膜,新鲜配制的含5%BSA的TBST液室温封闭1 h,加入一抗(LRRC3B 1∶1 000,E-cadherin 1∶ 1 500,N-cadherin 1∶2 000,Vimentin 1∶1 500,p-Akt 1∶1 000,Akt 1∶1 500)过夜,TBST液洗膜3次,每次5 min,加入HRP标记的山羊抗兔IgG二抗温育1 h,ECL显影,Band Scan 5.0凝胶电泳图像分析软件进行条带灰度扫描,β-actin为内参对目的蛋白进行灰度值半定量分析。每个样本重复3次,取均值。
1.9 统计学处理
采用SPSS 17.0统计软件对数据进行统计学分析,计量资料用表示,多个样本均数的比较采用单因素方差分析,组间数据两两比较采用 LSD-t法,P<0.05为差异有统计学意义。
2 结 果
2.1 癌灶组织和癌旁组织中LRRC3B免疫组织化学染色比较
免疫组织化学染色结果显示,60例食管癌的癌组织中,LRRC3B在细胞质中的表达不明显,45例(90%)呈现阴性表达;60例食管癌的癌旁组织中,LRCC3B在细胞质中弥漫表达,40例(66.7%)呈现阳性表达,20例(33.3%)呈现强阳性表达(图1)。

图1 食管癌组织和癌旁组织中LRRC3B免疫组织化学染色Fig. 1 The immunohistochemistry of LRRC3B in cancer tissues and adjacent non-neoplastic tissues
2.2 LRRC3B在食管癌组织中的表达与患者临床病理参数的关系
随着临床分期的增加,食管癌组织中LRRC3B表达降低,Ⅱ、Ⅲ期的阳性表达程度低于Ⅰ期(P<0.05);无淋巴结转移的组织中LRRC3B表达高于有淋巴结转移的组织(P<0.05)。LRRC3B在不同年龄、性别患者食管癌组织中的表达差异无统计学意义(P>0.05,表1)。
2.3 食管癌细胞Eca109和正常细胞HEEC中LRRC3B表达量比较
与正常食管癌上皮细胞HEEC相比,食管癌细胞Eca109中LRRC3B的mRNA相对表达和蛋白相对表达分别为(0.35+0.04)和(0.31+0.05),分别明显小于HEEC细胞中LRRC38的mRNA相对表达()和蛋白相对表达量(),差异有统计学意义(P<0.05,图2)。
2.4 转染pCMV6-LRRC3B质粒对食管癌细胞Eca109迁移能力的影响
与正常对照组相比,过表达LRRC3B组Transwell小室膜下附着的细胞数为,明显小于正常对照组细胞的迁移数,差异有统计学意义(P<0.05,图3)。
2.5 转染pCMV6-LRRC3B质粒对食管癌细胞Eca109侵袭能力的影响
与正常对照组相比,过表达LRRC3B组细胞侵袭穿过Transwell小室底膜的数量为,明显小于正常对照组的98.7+5.3,差异有统计学意义(P<0.05,图4)。
2.6 转染pCMV6-LRRC3B质粒对食管癌细胞Eca109中LRRC3B以及EMT相关蛋白表达的影响
正常对照组Eca109细胞中LRRC3B、E-cadherin、N-cadherin和Vimentin蛋白相对表达量依次为、、和,过表达LRRC3B组细胞中LRRC3B、E-cadherin、N-cadherin和Vimentin蛋白相对表达量依次为、、和,与正常组相比,过表达LRRC3B组细胞中LRRC3B和E-cadherin表达量显著增加,N-cadherin和Vimentin表达量显著减少,差异有统计学意义(P<0.05,图5)。

表1 患者临床病理参数与LRRC3B表达的关系Tab. 1 The relationship between patient characteristics and LRRC3B expression
2.7 转染pCMV6-LRRC3B质粒对食管癌细胞Eca109中PI3K/Akt信号通路的影响
正常对照组Eca109细胞中p-Akt和Akt蛋白水平分别为和,过表达LRRC3B组细胞中p-Akt和Akt蛋白相对水平分别为和,与正常对照组相比,过表达LRRC3B组细胞中p-Akt蛋白相对水平显著降低,差异有统计学意义(P<0.05),而Akt总蛋白无明显变化(图6)。

图2 Western blot检测HEEC细胞和Eca109细胞中LRRC3B表达Fig. 2 The expression of LRRC3B in HEEC cells and Eca109 cells were measured by Western blot

图3 各组细胞迁移能力比较Fig. 3 The comparison of cell migration in di ff erent groups
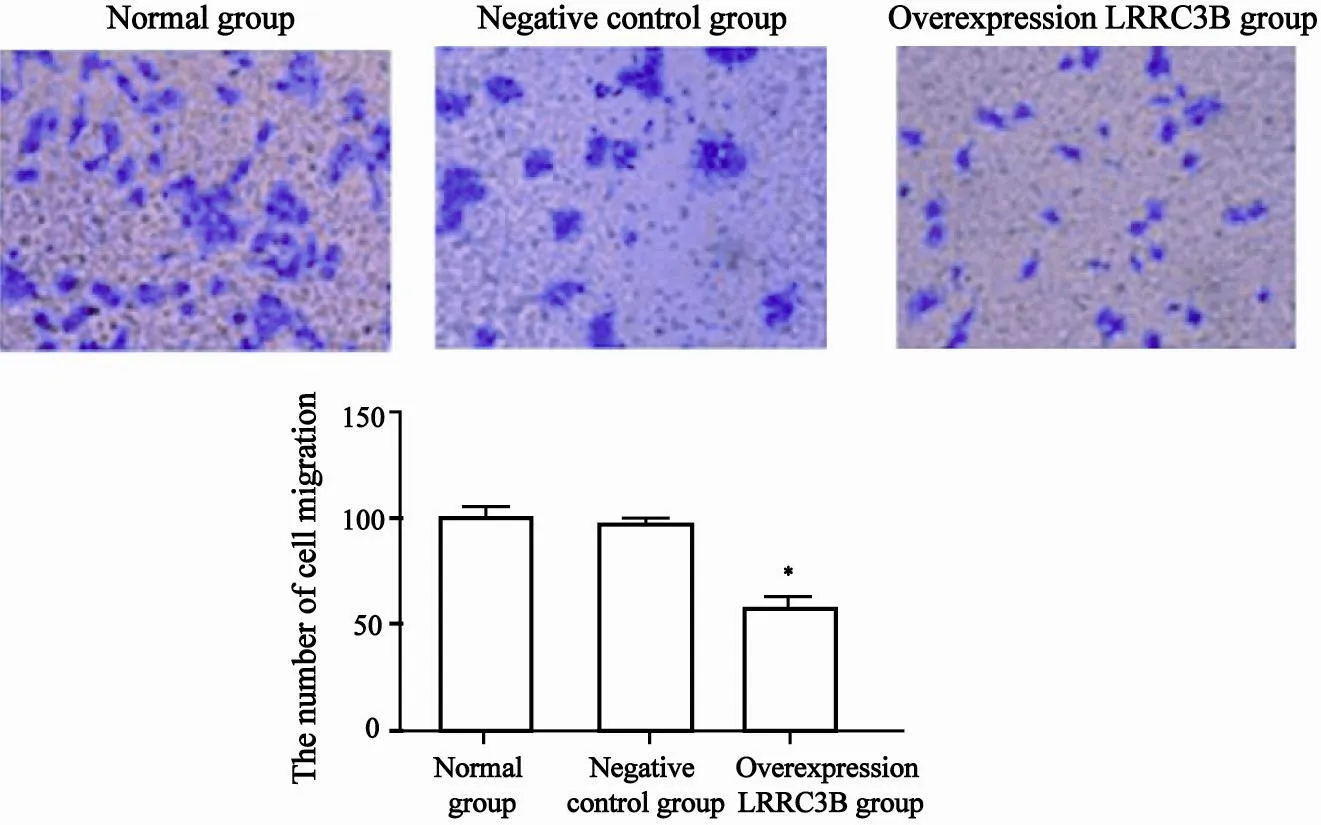
图4 各组细胞侵袭能力比较Fig. 4 The comparison of invasion in di ff erent groups

图5 Western blot检测各组细胞LRRC3B以及EMT相关蛋白表达Fig. 5 The expression of LRRC3B and EMT related proteins in groups were measured by Western blot
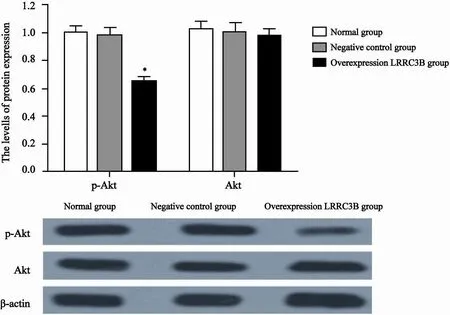
图6 Western blot检测各组细胞PI3K/Akt相关蛋白表达Fig. 6 The related proteins of PI3K/Akt in groups were measured by Western blot
3 讨 论
LRRC3B是一种具有分泌和跨膜功能并包含亮氨酸重复序列的分泌性蛋白[6]。富含亮氨酸重复序列蛋白参与动植物体内许多重要的过程,包含免疫调节、受体间相互作用、细胞黏附、信号转导、基因表达和细胞凋亡等等[5,7]。先前研究已经在胃癌、结肠癌、乳腺癌、前列腺癌及透明细胞肾细胞癌中发现LRRC3B基因由于启动子区域DNA甲基化和组蛋白去乙酰化导致的失活和表达下调,表明LRRC3B参与了癌症的发生、发展过程[8-10]。本研究发现,LRRC3B在食管癌患者癌变组织部位的表达明显低于癌旁组织,同时与正常食管上皮细胞相比,食管癌细胞Eca109中LRRC3B显著减少。这表明LRRC3B也可能参与了食管癌的发生过程,进一步将食管癌细胞Eca109转染过表达LRRC3B质粒,研究LRRC3B在食管癌生物学行为中的作用机制。
已有研究证实,LRRC3B能够抑制非小细胞肺癌细胞的增殖和侵袭[11],在胃癌细胞中转染LRRC3B能够抑制集落形成[6],同时LRRC3B能够有效抑制卵巢癌细胞活性[12]。本研究通过Transwell实验得知,过表达LRRC3B明显抑制食管癌细胞Eca109的迁移和侵袭。EMT被认为是癌细胞迁移和侵袭过程中最关键的步骤[13],一般来说,钙黏蛋白表达的减少或缺失及间质标志物的诱导上调是EMT发生的主要标志[14]。因此,本研究采用Western blot分析转染LRRC3B后细胞中EMT相关蛋白E-cadherin、N-cadherin和Vimentin表达量变化。Western blot结果显示过表达LRRC3B明显抑制N-cadherin和Vimentin表达,同时上调E-cadherin表达。因此,LRRC3B能够通过抑制EMT过程,从而能抑制细胞的迁移和侵袭能力。
癌细胞中调控EMT的信号通路有多种,包含有Notch信号通路、Ras/EMK信号通路、Hedgehog信号通路、Wnt信号通路及PI3K/Akt信号通路[15-17]。PI3k/Akt被认为是食管癌起始和发展过程中至关重要的一条信号通路,并且也被认为与EMT密切相关。据报道,上皮细胞中激活的Akt水平导致细胞间黏附力缺失,细胞极性的缺失并且诱导细胞运动,改变上皮细胞和间质细胞标志物的表达和分布[16,18]。本研究发现,LRRC3B明显抑制细胞中Akt的磷酸化水平,表明LRRC3B可能通过抑制PI3K/Akt信号通路而抑制食管癌细胞的迁移和EMT转化。
综上可知,我们推断LRRC3B基因在食管癌中是非常重要的肿瘤抑制基因,上调LRRC3B表达能够有效抑制食管癌细胞的EMT发生过程,这可能与抑制PI3K/Akt信号通路有关。因此,LRRC3B可能成为食管癌预防和治疗的一个新靶点。
[1] GENG T T, XUN X J, LI S, et al. Association of colorectal cancer susceptibility variants with esophageal cancer in a Chinese population [J]. World J Gastroenterol, 2015, 21(22): 6898-6904.
[2] ZUNIGA-PFLUCHER J C. New role identified for LRR-containing proteins in T cell development [J]. J Exp Med, 2014, 211(5): 746-747.
[3] KAN L, LI H, ZHANG Y, et al. LRRC3B is downregulated in non-small cell lung cancer and inhibits cancer cell proliferation and invasion [J]. Tumour Biol, 2016, 37(1): 1113-1120.
[4] WANG Y, PENG Y, ZHOU Y, et al. The clinical value of LRRC3B gene expression and promoter hypermethylation in breast carcinomas [J]. Cell Biochem Biophys, 2014, 70(2): 1035-1041.
[5] KONDRATOV A G, STOLIAR L A, KVASHA S M, et al. Methylation pattern of the putative tumor-suppressor gene LRRC3B promoter in clear cell renal cell carcinomas [J]. Mol Med Rep, 2012, 5(2): 509-512.
[6] KIM M, KIM J H, JANG H R, et al. LRRC3B, encoding a leucine-rich repeat-containing protein, is a putative tumor suppressor gene in gastric cancer [J]. Cancer Res, 2008, 68(17): 7147-7155.
[7] TIAN X Q, ZHANG Y, SUN D, et al. Epigenetic silencing of LRRC3B in colorectal cancer [J]. Scand J Gastroenterol, 2009, 44(1): 79-84.
[8] CHEN X, LEUNG S Y, YUEN S T, et al. Variation in gene expression patterns in human gastric cancers [J]. Mol Biol Cell, 2003, 14(8): 3208-3215.
[9] RICHARDSO A L, WANG Z C, DE NICOLO A, et al. X chromosomal abnormalities in basal-like human breast cancer[J]. Cancer Cell, 2006, 9(2): 121-132.
[10] KORKOLA J E, HOULDSWORTH J, CHADALAVADA R S, et al. Down-regulation of stem cell genes, including those in a 200-kb gene cluster at 12p13.31, is associated with in vivo differentiation of human male germ cell tumors [J]. Cancer Res, 2006, 66(2): 820-827.
[11] 阚 亮, 张 萌, 何 平. LRRC3B在非小细胞肺癌中下调并与肺癌细胞增殖和侵袭能力相关[J]. 中国肺癌杂志, 2016, 19(4): 177-183.
[12] KASHUBA V, DMITRIEV A A, KRASNOV G S, et al. NotI microarrays: novel epigenetic markers for early detection and prognosis of high grade serous ovarian cancer [J]. Int J Mol Sci, 2012, 13(10): 13352-13377.
[13] CHEN Q Y, JIAO D M, WANG J, et al. miR-206 regulates cisplatin resistance and EMT in human lung adenocarcinomacells partly by targeting MET [J]. Oncotarget, 2016, 7(17): 24510-24526.
[14] LIU Z, LONG J, DU R, et al. miR-204 regulates the EMT by targeting snai1 to suppress the invasion and migration of gastric cancer [J]. Tumour Biol, 2016, 37(6): 8327-8335.
[15] GUO L, PENG W, TAO J, et al. Hydrogen sulfide inhibits transforming growth factor-beta1-induced EMT via Wnt/ Catenin pathway [J]. PLoS One, 2016, 11(1): e0147018.
[16] YANG J, QIN G, LUO M, et al. Reciprocal positive regulation between Cx26 and PI3K/Akt pathway confers acquired gefitinib resistance in NSCLC cells via GJIC-independent induction of EMT [J]. Cell Death Dis, 2015, 6: e1829.
[17] ISLAM S S, MOKHTAriR B, NOMAN A S, et al. Sonic hedgehog (Shh) signaling promotes tumorigenicity and stemness via activation of epithelial-to-mesenchymal transition (EMT) in bladder cancer [J]. Mol Carcinog, 2016, 55(5): 537-551.
[18] KAUSHIK N K, KAUSHIK N, YOO K C, et al. Low doses of PEG-coated gold nanoparticles sensitize solid tumors to cold plasma by blocking the PI3K/AKT-driven signaling axis to suppress cellular transformation by inhibiting growth and EMT[J]. Biomaterials, 2016, 87: 118-130.
The influence of LRRC3B on esophageal cancer cell Eca109 migration, invasion and PI3K/Akt signaling pathway
CAO Yanfei1, REN Rui2, YANG Ye1, LUO Xianghui1, WANG Shuili3
(1. Department of Thoracic Surgery, Shaanxi Provincial People’s Hospital, Xi’an 710068, Shaanxi Province, China; 2 Department of Obstetrics and Gynecology, Shaanxi Xin’an Central Hospital, Xi’an 710048, Shaanxi Province, China; 3. Department of respiratory internal, Shaanxi Provincial People’s Hospital, Xi’an 710068, Shaanxi Province, China)
REN Rui E-mail: huiqingguohn@163.com
Background and purpose: Previous studies have confirmed that the expression of leucine-rich repeat-containing 3B (CLRRC3B) was significantly decreased in different human cancers, which was also associated with the migration and invasion of cancer cells. The aim of this study was to explore the potential mechanism of LRRC3B in the development of esophageal cancer. Methods: The LRRC3B expression was detected in 60 cancer tissues and 60 adjacent non-neoplastic tissues by immunohistochemistry. The mRNA and protein expression of LRRC3B in Eca109 and HEECs were detected using real-time fluorescence quantitative polymerase chain reaction (RTFQ-PCR) and Western blot, respectively. Eca109 cells with different treatments were divided into three groups: normal group, negative control group (transfected with pCMV6 plasmid), overexpression LRRC3B group (transfected with pCMV6-LRRC3B plasmid). Transwell assay was used to measure the migration and invasion of Eca109 cells in different groups. The protein levels of E-cadherin, N-cadherin, Vimentin and p-Akt were determined by Westernblot. Results: The expression of LRRC3B in esophageal cancer tissues was lower than that of non-cancerous tissues, as well as the expression of LRRC3B in Eca109 was decreased compared with that of normal esophageal epithelial cell line HEEC. Overexpression of LRRC3B significantly inhibited Eca109 cells migration and invasion, upregulated the expression of E-cadherin and decreased the expression of N-cadherin and Vimentin. Moreover, overexpression of LRRC3B significantly inhibited the phosphorylation of Akt in Eca109 cells. Conclusion: The expression of LRRC3B was decreased in esophageal cancer. Overexpression of LRRC3B can efficiently inhibit the EMT progression in esophageal cancer cells by suppressing PI3K/Akt signaling pathway.
Leucine-rich repeat-containing 3B; Esophageal cancer; Epithelial-mesenchymal transition; PI3K/ Akt
10.19401/j.cnki.1007-3639.2017.05.005
R735.1
A
1007-3639(2017)05-0345-08
2016-11-05
2016-12-20)
陕西省自然科学基金面上项目(2014JM2-8166)。
任 睿 E-mail:huiqingguohn@163.com

