手术完全切除的ⅢA(N2)期非小细胞肺癌失败表型分析
张 琴, 傅小龙,蔡旭伟,冯 雯,余 雯
上海交通大学附属胸科医院放疗科,上海200030
手术完全切除的ⅢA(N2)期非小细胞肺癌失败表型分析
张 琴, 傅小龙,蔡旭伟,冯 雯,余 雯
上海交通大学附属胸科医院放疗科,上海200030
背景与目的:ⅢA(N2)期非小细胞肺癌(non-small cell lung cancer,NSCLC)总体生存不佳,5年生存率为15%~30%。该研究旨在探讨ⅢA(N2)期NSCLC患者肿瘤完全切除术后患者的首次失败表型,明确各部位远处转移发生的风险,为术后治疗的选择提供临床依据。方法:对2005年1月—2012年7月收治的经手术完全切除的ⅢA(N2)期NSCLC患者进行回顾性分析。观察患者无进展生存期(progression-free survival,PFS)、总生存期(overall survival,OS)、首次失败表型以及首次失败表型的发生率和发生时间。生存分析和首次失败发生率采用Kaplan-Meier法计算。结果:入组患者共357例。全组患者的中位PFS为20.0个月,OS为43.1个月,5年总生存率为36.9%。病程中284例(77.6%)患者出现进展,首次失败表型:61例局部区域复发,197例远处转移,26例进展时既有局部区域复发又有远处转移。首次失败表型是远处转移中最主要的转移部位是脑、骨、肺,其中脑最常见,共67例患者。首次失败表型是局部区域复发的中位时间是13.6个月,而首次失败表型是远处转移的中位时间是15.1个月。首次失败表型是脑转移发生时间均较早,92.5%的患者均在3年内发生。结论:手术完全切除的ⅢA(N2)期NSCLC的首次失败表型中,远处转移显著高于局部区域复发;脑是远处转移作为首次失败表型最常见的部位。本研究为该类患者化疗时间的选择、术后放疗价值以及是否需要行全脑预防性放疗提供了一定的理论依据。
非小细胞肺癌;ⅢA(N2)期;失败表型;远处转移;脑转移
2016年中国癌症统计数据显示,肺癌的发病率最高,并且死亡率也位居各个肿瘤之首[1]。在经确诊的肺癌患者中约85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。因缺乏有效的早期诊断措施,大部分NSCLC患者确诊时就已经是局部晚期或者有远处转移。ⅢA(N2)期NSCLC是其中的一组异质人群,指病理诊断为NSCLC伴有同侧纵隔和(或)隆突下淋巴结转移,包含分期为T1-3N2M0的所有患者,约占NSCLC的25%,手术是其主要的治疗手段,完全切除术后的ⅢA(N2)期NSCLC的5年生存率为15%~ 30%[3-6]。
虽然手术和放疗技术的进步以及含铂两药化疗等综合治疗延长了ⅢA(N2)期NSCLC完全切除术后患者的生存时间,但总体疗效不理性,其局部区域复发率为20%~40%,远处转移在50%以上[3-4,7-11]。术后失败表型的研究对指导术后采取什么辅助治疗方案和预防治疗措施来改善患者生存是非常有必要的。无论是在前瞻性还是回顾性的研究中,为了方便记录和分析,主要是分析患者的首次失败表型。本研究筛选出上海市胸科医院收治的具有完整术后病理和随访资料的ⅢA(N2)期NSCLC完全切除术后的患者进行回顾性分析,观察该组患者总体疗效,并在此基础上重点探讨其术后首次失败的表型,为该组患者个体化预防性治疗方案的选择提供客观参考依据。
1 资料和方法
1.1 入组及排除标准
回顾性分析了2005年1月—2012年7月在上海市胸科医院行NSCLC根治性切除术的连续患者的病历资料。入组条件:采取一侧全肺切除或者肺叶切除;纵隔淋巴结清扫术,要求至少清扫三站纵隔淋巴结(必须包括隆突下淋巴结);切缘阴性:所有切缘无术中肉眼残留,巨检及微检均无肿瘤残留;术后病理分期为ⅢA(N2)期(包括pT1-3N2M0)NSCLC(根据UICC第7版TNM分期标准);术前无新辅助化疗及术前胸部放疗;术后进展前未接受EGFR-TKIs治疗;非围手术期(术后7~12 d)和非手术并发症致死亡患者,生存期大于等于3个月。
1.2 临床及病理资料收集
本研究通过PubMed等数据库查阅国内外相关文献并结合临床经验,确定可能影响ⅢA(N2)期NSCLC失败表型的因素设计调查表。所有入组患者的病理诊断结果须经两位以上病理科主治及以上医师将所有入组患者的病理H-E染色片复核确认。① 临床因素包括:性别、年龄、吸烟史、原发灶位置、手术方式、有无术后化疗和术后放疗;② 病理因素包括病理类型、分化程度、原发灶病理T分期、脉管侵犯、淋巴结(lymph nodes,LN)转移的状态。
1.3 观察指标
观察指标包括无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)。局部区域内淋巴结复发是指在胸部增强CT上新发现的或者较前片有明显增大的纵隔、肺门及锁骨上区域淋巴结,最短径要大于等于1 cm或者是PET/CT上有明显高代谢的淋巴结。远处转移是指除局部区域外的部位复发(M1,2)。首次失败表型定义为手术当日开始至出现首次治疗失败的部位。计算失败表型发生风险时,只要首次失败表型是这些部位转移(不论其他部位转移情况)都认为是事件发生。影像学结果需要和临床随访结果一致。
1.4 统计学处理
数据分析采用SPSS 20.0统计软件包,连续变量如年龄、淋巴结转移的总数和淋巴结转移的度均采用中位数值转为二分类变量。生存分析和首次失败表型的发生风险采用Kaplan-Meier法,检验为log-rank检验,P<0.05为差异有统计学意义。
2 结 果
2.1 入组患者的一般临床资料
2005年1月—2012年7月之间总共有357例ⅢA(N2)期患者接受根治性肺癌切除术,并完全满足入组条件并且随访资料完全。随访时间到2016年2月,中位随访时间40.4个月(4.4~132.0个月)。在357例的入组患者中,男性219例,女性138例,男、女性比例为1.59∶1;平均年龄59岁(35~83岁),中位年龄60岁。所有入组患者均接受了系统的淋巴结清扫术,至少需清扫三站淋巴结,隆突下淋巴结必须清扫;清扫的淋巴结数目范围为5~68个,中位数为22个。患者的具体临床病理资料见表1。
2.2 入组患者的生存情况及失败模式
至随访截至时间,全组357例患者中227例死亡。入组患者中位PFS为20.0个月(95%CI:17.3~22.7个月),1、3和5年无进展生存率分别为69.6%、30.2%和19.2%;中位OS为43.1个月(95%CI:35.9~50.3个月),1、3和5年总生存率分别为91.6%、55.2%和36.9%。病程中284例(77.6%)患者出现进展,61例(17.1%)出现局部区域复发,197例(55.2%)患者出现远处转移,26例(7.3%)患者进展时既有局部区域复发又有远处转移(图1)。1、3、5年局部区域复发率及远处转移率分别为11.5%、27.7%、33.3%和24.0%、62.0%、74.0%。无论是首次失败表型还是病程中总的失败表型:远处转移发生率均显著高于局部区域复发,且差异有统计学意义(P=0.000) (图2)。在223例(62.5%)首次失败表型是远处转移(包括26例局部和远处同时进展)的患者中,脑、骨和肺是最常见的转移部位,其中脑转移患者67例,占首次失败表型是远处转移患者的29.2%%,各部位转移的发生风险和发生数目详见图3。首次失败表型是局部区域复发的中位时间是13.6个月,而远处转移作为首次失败表型的中位时间是15.1个月。首次失败表型是脑转移的中位时间是14.4个月,而颅外远处转移作为首次失败表型的中位时间是15.2个月。脑转移无论是作为首次失败表型还是病程中出现的转移发生时间均较早,92.5%患者的均在3年内发生。
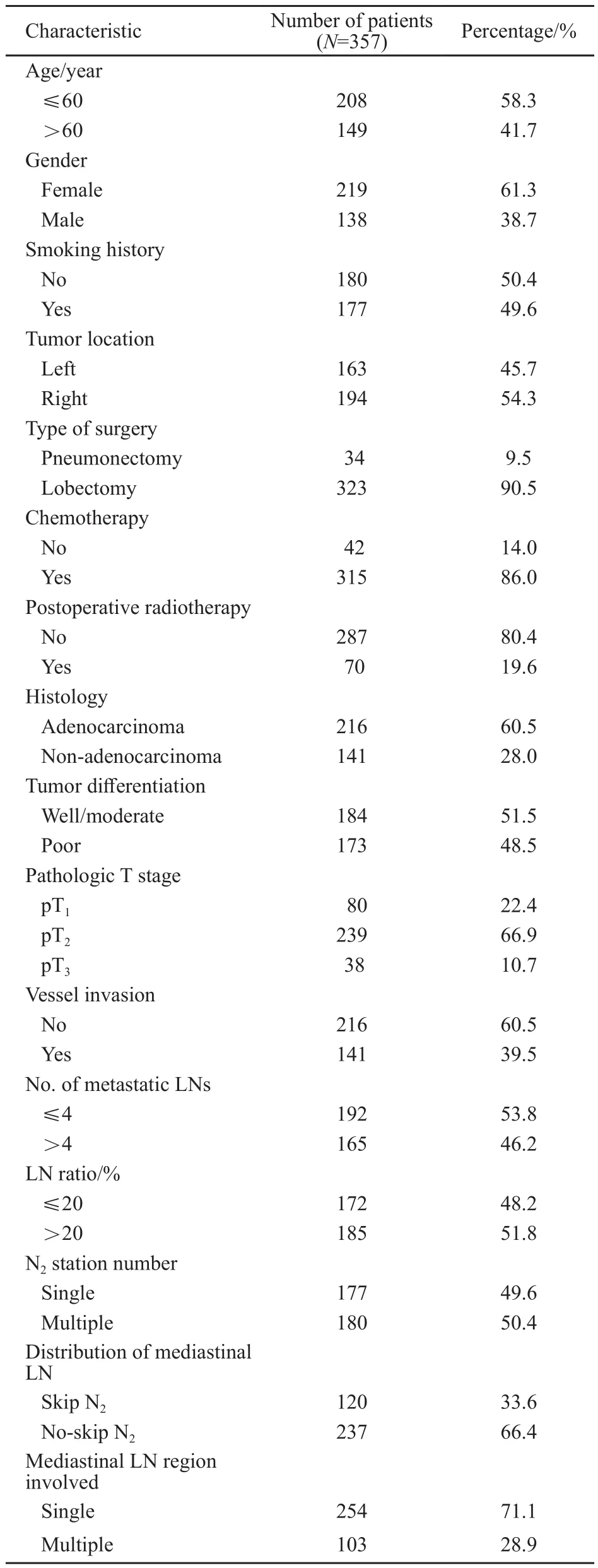
表1 患者的临床病理资料Tab. 1 The clinical and pathological characteristics of patients
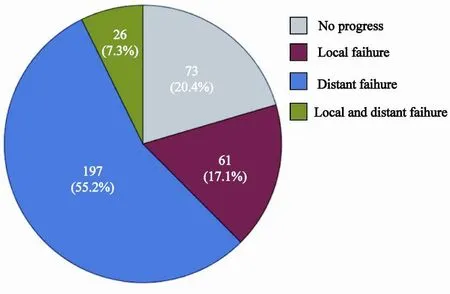
图1 357例患者首次失败表型图Fig. 1 Pattens of first failures were shown in 173 patients

图2 失败表型风险曲线图Fig. 2 The actuarial risk of recurrence
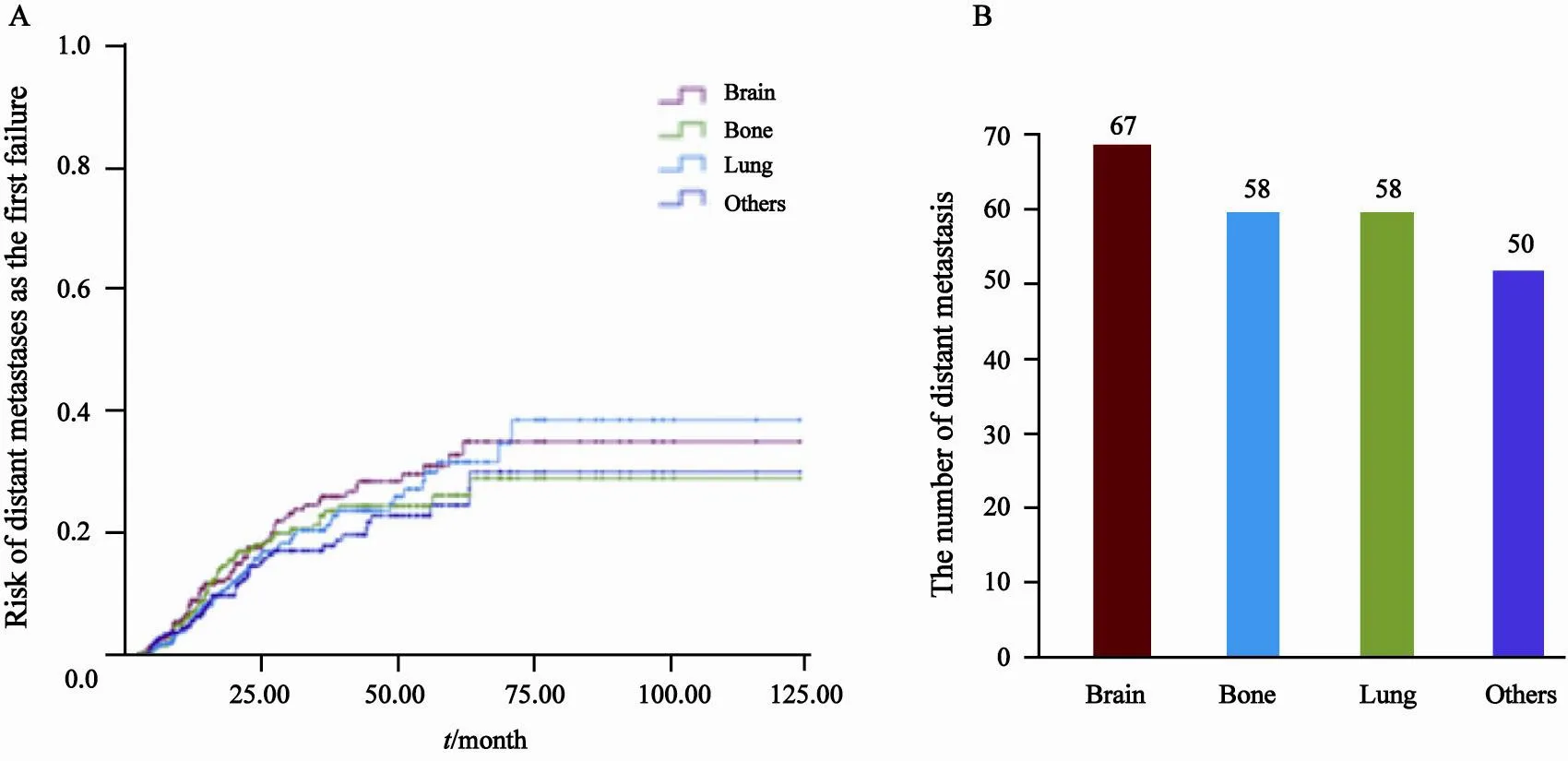
图3 首次失败表型是远处转移各部位的发生风险图和数目图Fig. 3 The risk and numbers of distant metastases as the first failure in di ff erent sites
3 讨 论
既往报道的关于术后病理诊断为ⅢA(N2)期NSCLC的前瞻性和回顾性分析研究发现,该类患者的5年生存率在15%~30%之间,从这些患者的失败表型来看主要是局部区域复发和远处转移,局部区域复发率为20%~40%,远处转移率均在50%左右。本组患者的5年生存率为36.9%,首次失败表型主要是局部区域复发和远处转移,其局部区域复发率为24.4%,远处转移率为62.5%,预后与既往文献报道类似[3-5]。
本研究是患者数最多,手术方式和病理结果都比较统一的关于ⅢA(N2)期NSCLC完全切除术后首次失败表型的单中心研究。从既往研究结果以及本组的研究结果可以发现ⅢA(N2)期NSCLC完全切除术后患者的主要失败表型是局部区域复发和远处转移。目前辅助化疗价值比较明确,对于高远处转移率目前主要是采用术后含铂两药联合辅助化疗的治疗措施,但术后辅助化疗带来的生存获益有限,5年生存率仅提高5%。手术方式和术后放疗技术的进步,特别是术后放疗的运用,则能在提高局部控制率的基础上进一步提高患者的总体生存率。2010年起国内外的学者开展了多项回顾性研究,均发现术后放疗在完全切除术后的ⅢA(N2)期NSCLC患者中的重要性[12]。Billiet等[13]进行了Meta分析也发现在ⅢA(N2)期NSCLC患者中,即使进行了术前的新辅助化疗,术后放疗仍有降低局部复发同时提高OS的价值。2015年基于美国国家癌症数据库的两个大样本研究再次肯定术后放疗的价值,并认为辅助化疗后的再行放疗带来的生存获益超过单纯术后辅助化疗的价值[14-15]。但ⅢA(N2)期NSCLC术后辅助放疗的范围、时机、与辅助化疗如何联合以及哪些高危人群需要行术后放疗,目前仍不清楚,需要开展临床试验来验证[16]。
尽管术后辅助放化疗降低了局部复发率和远处转移率,提高了生存率,但患者的远处转移仍是失败的主要原因,成为影响生存的主要难题。其中脑是最常见的远处转移部位,主要是因为化疗药物无法通过血脑屏障,患者总的脑远处转移率并未得到明显控制。本研究也发现脑转移是最主要的转移部位,脑转移的中位时间是14.4个月,92.5%的患者均在3年内发生,发生时间较早。这提示我们在完全切除术后的ⅢA(N2)期NSCLC中有脑转移的高危人群,可能需要行全脑预防性放疗[17],从而降低脑转移发生风险来提高总体生存。
因此了解患者的首次失败表型,尤其是远处转移中不同部位首次失败表型的发生率,有利于我们采取不同的预防治疗策略,降低患者远处转移率从而提高生存率。根据本组完全切除术后ⅢA(N2)期NSCLC患者的首次失败表型,基于该组患者详细的临床因素、病理结果等信息,有利于筛选局部区域复发以及远处转移如脑转移高危人群,为患者个体化治疗的选择提供了更全面客观的参考依据。
[1] CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
[2] MORGENSZTERN D, NG S H, GAO F, et al. Trends in stage distribution for patients with non-small cell lung cancer: a national cancer database survey[J]. J Thorac Oncol, 2010, 5(1): 29-33.
[3] KIM D W, YUN J S, SONG S Y, et al. The prognosis according to patterns of mediastinal lymph node metastasis in pathologic stage ⅢA(N2) non-small cell lung cancer[J]. Korean J Thorac Cardiovasc Surg, 2014, 47(1): 13-19.
[4] DARLING G E, LI F, PATSIOS D, et al. Neoadjuvant chemoradiation and surgery improves survival outcomes compared with definitive chemoradiation in the treatment of stage ⅢA(N2) non-small cell lung cancer[J]. Eur J Cardiothorac Surg, 2015, 48(5): 684-690, 690.
[5] TAMURA M, MATSUMOTO I, SAITO D, et al. Lymph node ratio as a prognostic factor in patients with pathological N2non-small cell lung cancer[J]. World J Surg Oncol, 2016, 14(1): 295.
[6] BILLIET C, DE RUYSSCHER D, PEETERS S, et al. Patterns of locoregional relapses in patients with contemporarily staged stage Ⅲ-N2NSCLC treated with induction chemotherapy and resection: implications for postoperative radiotherapy target volumes[J]. J Thorac Oncol, 2016, 11(9): 1538-1549.
[7] FENG W, FU X L, CAI X W, et al. Patterns of local-regional failure in completely resected stage ⅢA(N2) non-small celllung cancer cases: implications for postoperative radiation therapy clinical target volume design[J]. Int J Radiat Oncol Biol Phys, 2014, 88(5): 1100-1107.
[8] REYMEN B, VAN BAARDWIJK A, WANDERS R, et al. Long-term survival of stage T4N0-1and single station ⅢA(N2) NSCLC patients treated with definitive chemo-radiotherapy using individualised isotoxic accelerated radiotherapy (INDAR)[J]. Radiother Oncol, 2014, 110(3): 482-487.
[9] KOSHY M, FEDEWA S A, MALIK R, et al. Improved survival associated with neoadjuvant chemoradiation in patients with clinical stage ⅢA(N2) non-small cell lung cancer[J]. J Thorac Oncol, 2013, 8(7): 915-922.
[10] AMINI A, LOU F, CORREA A M, et al. Predictors for locoregional recurrence for clinical stage Ⅲ-N2non-small cell lung cancer with nodal downstaging after induction chemotherapy and surgery[J]. Ann Surg Oncol, 2013, 20(6): 1934-1940.
[11] LIAO W Y, CHEN J H, WU M, et al. Neoadjuvant chemotherapy with docetaxel-cisplatin in patients with stageⅢ-N2non-small cell lung cancer[J]. Clin Lung Cancer, 2013, 14(4): 418-424.
[12] BILLIET C, PEETERS S, DECALUWE H, et al. Outcome after PORT in ypN2or R1/R2 versus no PORT in ypN0stageⅢ-N2NSCLC after induction chemotherapy and resection[J]. J Thorac Oncol, 2016, 11(11): 1940-1953.
[13] BILLIET C, DECALUWE H, PEETERS S, et al. Modern postoperative radiotherapy for stage Ⅲ non-small cell lung cancer may improve local control and survival: a meta-analysis[J]. Radiother Oncol, 2014, 110(1): 3-8.
[14] ROBINSON C G, PATEL A P, BRADLEY J D, et al. Postoperative radiotherapy for pathologic N2non-small cell lung cancer treated with adjuvant chemotherapy: a review of the national cancer data base[J]. J Clin Oncol, 2015, 33(8): 870-876.
[15] CORSO C D, RUTTER C E, WILSON L D, et al. Reevaluation of the role of postoperative radiotherapy and the impact of radiation dose for non-small cell lung cancer using the national cancer database[J]. J Thorac Oncol, 2015, 10(1): 148-155.
[16] BILLIET C, PEETERS S, DECALUWE H, et al. Postoperative radiotherapy for lung cancer: is it worth the controversy?[J]. Cancer Treat Rev, 2016, 51: 10-18.
[17] LI N, ZENG Z F, WANG S Y, et al. Randomized phase Ⅲtrial of prophylactic cranial irradiation versus observation in patients with fully resected stage ⅢA(N2) non-small cell lung cancer and high risk of cerebral metastases after adjuvant chemotherapydagger[J]. Ann Oncol, 2015, 26(3): 504-509.
Patterns of the first failure in completely resected stage ⅢA(N2) non-small cell lung cancer
ZHANG Qin, FU Xiaolong, CAI Xuwei, FENG Wen, YU Wen
(Department of Radiation Oncology, Shanghai Chest Hospital, Shanghai Jiao Tong University, Shanghai 200030, China)
FU Xiaolong E-mail: xlfu1964@hotmail.com
Background and purpose: The prognosis of completely resected stage ⅢA(N2) non-small cell lung cancer (NSCLC) remains a signi ficant concern. The 5-year overall survival (OS) rates range from 10% to 30%. This study aimed to analyze the patterns of first failure in completely resected stage ⅢA(N2) NSCLC and to assess the actuarial risk of developing metastasis at di ff erent sites and to guild standard clinical practice. Methods: Patients withⅢA(N2) NSCLC who had undergone radical surgery in our hospital from Jan. 2005 to Jul. 2012 were retrospectively reviewed. The progression-free survival (PFS), the OS, patterns of first failure, the actuarial risk were analyzed. The cumulative incidence of first failure was determined using the Kaplan-Meier analysis. Results: Among 357 patients who met the eligibility criteria with completely resected stage ⅢA(N2) NSCLC, 5-year OS was 36.9%. There were 284 (77.6%) patients experiencing disease failure: 61 with local failure, 197 with local and distant failures, and 26 patients with local recurrence as the first failure. Brain, bone and lung were the main sites of distant failure as the first failure, while brain was the most common site. There were 67 patients developing brain metastases (BM) as the first site of failure. The median time of local failure as the first site of failure was 13.6 months, and the time to develop distant recurrence was 15.1 months. 92.5% BM developed in 3 years after the complete resection. Conclusion: As the first failure, the rate of distant failure was much higher than that of local failure in completely resected stage ⅢA(N2) NSCLC. Brain was the most common site of distant failure as the first failure. These results can be helpful in guidingstandard clinical practice and evaluating the outcome of comprehensive treatment.
Non-small cell lung cancer; Stage ⅢA(N2); Patterns of first failure; Distant failure; Brain metastases
10.19401/j.cnki.1007-3639.2017.05.010
R734.2
A
1007-3639(2017)05-0383-06
2016-12-01
2017-02-20)
傅小龙 E-mail:xlfu1964@hotmail.com

