罕见的伴EWSR1易位的6例肺原发性黏液样肉瘤的临床病理分析
金 燕,沈旭霞,沈 磊,孙艺华,陈海泉,王 坚,李 媛
1.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海200032;2.复旦大学附属肿瘤医院胸外科,复旦大学上海医学院肿瘤学系,上海 200032
罕见的伴EWSR1易位的6例肺原发性黏液样肉瘤的临床病理分析
金 燕1,沈旭霞1,沈 磊1,孙艺华2,陈海泉2,王 坚1,李 媛1
1.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海200032;2.复旦大学附属肿瘤医院胸外科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:肺原发性黏液样肉瘤是一种非常罕见的软组织肿瘤。最近有学者发现该肿瘤具有特异性的EWSR1基因易位。该研究旨在探讨伴EWSR1基因易位的肺原发性黏液样肉瘤的临床病理学特征及其鉴别诊断。方法:回顾性分析复旦大学附属肿瘤医院病理科诊断的6例伴EWSR1基因易位的肺原发性黏液样肉瘤,收集临床及影像学资料及组织病理学形态,采用免疫组织化学法分析免疫学表型,采用荧光原位杂交(f l uorescence in situ hybridization,FISH)检测EWSR1基因融合状态,并复习相关文献。结果:患者均为成年人,其中男性4例,女性2例,发病年龄23~64岁,中位年龄44岁。大体上,肿瘤大小2.0~5.5 cm,肿瘤境界较清楚,切面质韧,灰白灰黄色,胶冻样。镜下观察,所有病例均与支气管关系紧密,肿瘤细胞主要由梭形细胞或多边形细胞组成,排列呈条索状、梁状或网状结构,背景为多少不等的黏液样基质。该肿瘤缺乏特异性标志物,但肿瘤细胞可不同程度表达上皮膜抗原(epithelial membrane antigen,EMA)。FISH检测结果显示EWSR1基因重排阳性。随访4~29个月,其中5例无瘤生存,1例出现胸膜及骨转移。结论:伴有EWSR1基因重排的肺原发性黏液样肉瘤是一种极为罕见的低度恶性的肉瘤。组织学上有一定的特征性改变,熟悉其瘤谱及基因学特征有助于诊断和鉴别诊断。
EWSR1基因;肺原发性黏液样肉瘤,荧光原位杂交
发生于肺的肉瘤常为转移性肉瘤,原发性肺的肉瘤非常罕见,常见的肺原发性肉瘤包括肺血管肉瘤、上皮样血管内皮瘤及炎性肌纤维母细胞肉瘤。肺原发性黏液样肉瘤是一种非常罕见的软组织肿瘤,该肿瘤常发生在支气管内呈多结节样生长,镜下瘤细胞主要由梭形细胞或多边形细胞组成,排列呈条索状、梁状或网状结构,背景常出现多少不等的黏液样基质[1-2]。最近有学者指出原发性黏液样肉瘤具有尤文肉瘤断裂点区域1(ewing sarcoma beakpoint region 1,EWSR1)基因易位[2],并且首次将该肿瘤纳入2015年新版世界卫生组织(World Health Organization,WHO)肺肿瘤组织学分类[3],命名为伴EWSR1易位的肺原发性黏液样肉瘤(primary pulmonary myxoid sarcoma with EWSR1 fusion,简称PPMS)。PPMS尽管具有特征性的组织学结构及EWSR1基因易位,但该肿瘤的组织学起源及生物学行为仍不清楚。本研究总结了复旦大学附属肿瘤医院病理科2010年1月—2016年9月间诊断的伴有EWSR1易位的肺原发性黏液样肉瘤,结合文献复习分析和探讨了伴有EWSR1易位的肺原发性黏液样肉瘤的临床病理特征、组织学起源、生物学行为、鉴别诊断及治疗与预后。
1 资料和方法
1.1 临床资料
收集6例复旦大学附属肿瘤医院病理科2010年1月—2016年9月间诊断的伴EWSR1易位的肺原发性黏液性肉瘤,1例为本院病例,5例为会诊病例。所有病例均经作者复核确认。影像学资料翻拍患者所携带的CT或由本院影像诊断中心提供,随访信息通过预留电话直接咨询获取。6例患者中,男性4例,女性2例。患者年龄23~64岁(中位年龄44岁)。1例表现为支气管腔内生长,其余病例紧邻支气管生长。临床上,6例患者临床症状均有咳嗽,但无咳痰,偶有咯血及发热等全身症状。CT检查结果显示,3例位于右下肺叶,2例位于右上肺叶,1例位于左下肺叶。CT影像表现为肺内软组织结节影伴或不伴支气管狭窄阻塞(图1)。所有患者均行手术治疗,其中1例进行了术后化疗。随访4~29个月,无死亡病例,其中1例于术后10个月出现胸膜转移,术后14个月出现骨转移(病例1)。
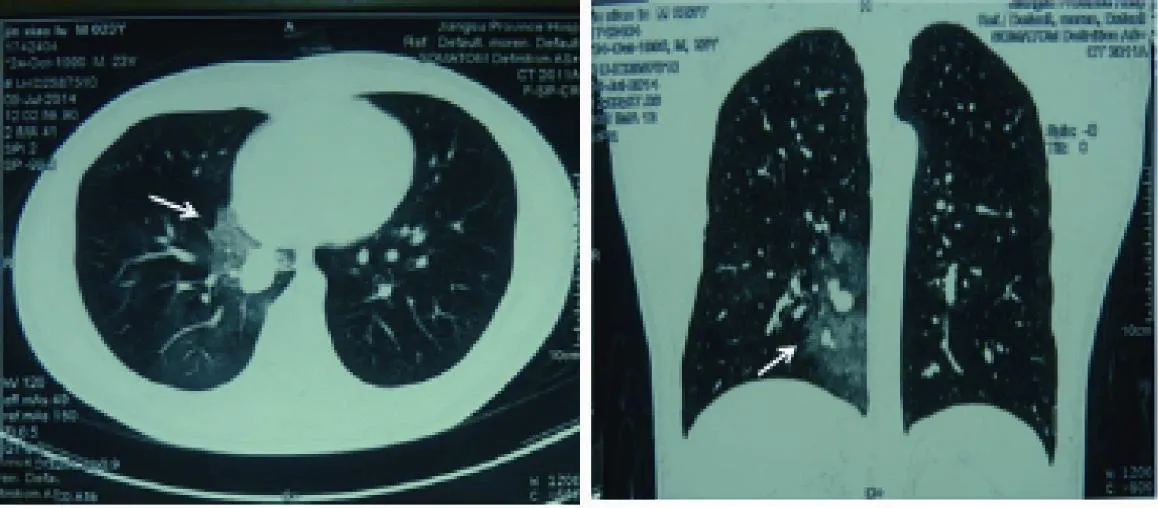
图1 胸部CT扫描结果显示右肺下叶软组织结节影,伴支气管狭窄阻塞(白色箭头)Fig. 1 Chest CT scan showed a soft tissue nodule with bronchial obstruction at the right lower lobe of the lung (white arrow)
1.2 方法
1.2.1 常规H-E染色、免疫组织化学染色
标本经10%中性甲醛溶液固定,常规脱水,石蜡包埋,切片厚4 μm,并采用H-E和免疫组织化学法进行染色。免疫组织化学法采用EnVision两步法,DAB显色。所用一抗分别为波形蛋白(Vimentin)、细胞角蛋白(AEl/ AE3)、上皮膜抗原(EMA)、结蛋白(Desmin)、平滑肌肌动蛋白(SMA)、突触素(Syn)、CD34、CD68(KP-1)、CD99、S-100和Ki-67,均购自丹麦Dako公司。
1.2.2 荧光原位杂交(fluorescence in situ hybridization,FISH)检测
采用EWSR1基因易位检测使用特异性的EWSR双色易位分离探针(购自美国Vysis公司)试剂盒,检测6例石蜡包埋组织中的EWSR1基因易位情况;具体操作步骤按试剂盒说明书进行。判读标准:细胞核有易位信号小于等于10%为阴性,细胞核有易位信号大于10%为阳性。
2 结 果
2.1 病理学检查
大体上,肿瘤大小为2.0~5.5 cm的境界清楚的肿块,表面包膜不明显,切面质中-韧,颜色灰白、灰黄、胶冻样。所有肿瘤均与支气管关系密切,1例位于支气管内,其余病例均紧邻支气管,肿块或可浸润到周围的肺实质内。4例呈多结节样生长,镜下可见纤维性假包膜将肿瘤分隔成多结节状结构。瘤细胞主要由梭形细胞或多边形细胞组成,偶可见圆形或卵圆形肿瘤细胞,排列呈条索状、梁状或网状结构。所有病例均可见不同比例的网状结构的存在,甚至在以实体生长方式为主的病例中也可见明显的网状结构,这种网状结构的背景中可见显著的嗜碱性黏液样间质(表2,图2)。瘤细胞异型性程度不等,5例从无到轻度不典型性,1例从中度到局灶明显(病例1)。核分裂象为(0~7)个/10 HPF,1例可见核分裂象大于5个/10HPF(表2)。肿瘤内出血或坏死不常见。大部分病例(5/6)可见片状至少轻度慢性炎细胞浸润,主要为淋巴细胞及浆细胞,少量的嗜酸性粒细胞和泡沫样组织细胞,少数病例(1/6)肿瘤周围可见伴有生发中心的淋巴组织增生。1例见支气管旁淋巴结转移。
2.2 免疫组织化学检测及FISH检测结果
PPMS缺乏特异性的分子标志物,但肿瘤细胞表达Vimentin,可不同程度表达EMA (图2)。肿瘤细胞不表达AE1/AE3、S-100、CD99、Desmin、SMA、CD34和Syn,大部分病例核细胞增值指数Ki-67偏低(表3)。
FISH检测结果显示,所有病例均表现为EWSR1基因重排阳性,阳性细胞占10%~50% (图2)。
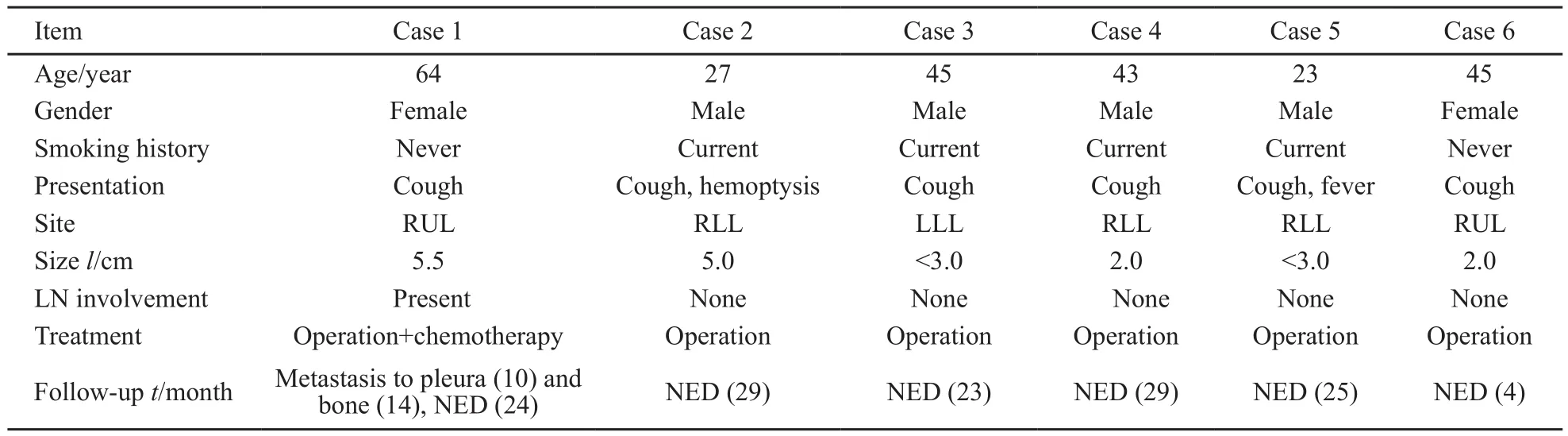
表1 PPMS临床病理学资料Tab. 1 Clinicopathological features of PPMS

表2 PPMS的病理学特征Tab. 2 Pathological features of PPMS

图2 PPMS的主要病理学特征Fig. 2 The main pathological features of PPMS

表3 EWSR1基因重排及免疫组织化学检测结果Tab. 3 Results of EWSR1 gene rearrangement and immunohistochemistry
3 讨 论
肺原发性黏液样肉瘤是罕见的发生在肺实质内的软组织肿瘤。1999年Nicholson等[1]首次报道了2例,目前国内外报道仅5篇(18例)[1-2,4-6],国内仅1例个案报道[7]。综合文献复习和本组病例显示,PPMS多发生在中年人,年龄24~68岁(中位年龄46岁),女患者14例,略多于男性。临床上,大部分以咳嗽为主诉就诊,少数患者还可出现咯血、发热、体重减轻、近期肺内结节明显增大的症状。CT影像表现为肺内软组织结节影伴或不伴支气管狭窄阻塞。大部分病例病情进展缓慢,少数术后发生远处转移(脑、肾或骨转移)。
大体上,肿瘤大小为1.5~13.0 cm(中位3.5 cm),呈境界清楚的结节状肿块。切面呈灰白、灰黄色、胶冻样。组织学上,肿瘤均与支气管相关,可位于支气管内。低倍镜下肿瘤呈分叶状,瘤细胞为多角形、梭形或卵圆形,位于黏液样基质中呈网状或条索状排列,形态类似于骨外黏液软骨肉瘤。细胞的异型性从轻度至明显异型程度不等。核分裂象为(0~32)个/10 HPF,大多数不超5个/10 HPF。特征性的形态学改变是可见程度不等的间质黏液样变性。大部分病例可见慢性炎细胞浸润,主要为淋巴细胞及浆细胞。免疫组织化学染色结果显示,几乎所有病例均表达Vimentin,部分病例局灶性弱表达EMA,而其他的标志物如AE1/AE3、S-100、Desmin、SMA、Syn、CD34和CD68等均阴性表达,且大部分病例Ki-67增值指数偏低。所有病例应用逆转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RTPCR)或FISH检测证实有EWSR1-CREB1基因融合[2,5]。既往文献中关于PPMS组织学起源研究较少,有学者通过超微结构观察到肿瘤细胞内可见有丰富的粗面内质网,细胞表面形成扇形的指状突起[1]。另有学者观察到肿瘤细胞内有中间丝及致密斑的存在,认为PPMS来自原始的间叶细胞具有纤维母细胞或肌纤维母细胞分化方向[6]。
形态学上,需与骨外黏液样软骨肉瘤(extraskeletal myxoid chondrosarcoma,EMC)、血管瘤样纤维组织细胞瘤(angiomatoid fibrous histiocytoma,AFH)、肌上皮肿瘤(myoepithelial neoplasm)和炎性肌纤维母细胞瘤(inflammatory myofibroblastic tumor,IMT)鉴别。EMC常发生于肢体近端和肢带深部软组织,少有发生在上呼吸道、纵隔、胸膜。近期有报道原发于肺内EMC[8]。EMC细胞质疏松、强嗜伊红或含有大小不等的空泡,形似软骨母细胞。常伴有出血或纤维化。PPMS和EMC基质的黏液在低PH环境下可呈阿辛蓝染色阳性,而PPMS,黏液样间质经透明质酸酶预处理后这种敏感性将被破坏,阿辛蓝染色呈阴性。免疫组织化学检测结果示,20%~50%EMC表达S-100。在分子遗传学上,EMC不具备EWSR1-CREB1易位,而具有特征性的NR4A3-EWSR1基因易位(占75%),及NR4A3-TAF15基因易位(占15%)。发生在肺内的AFH由温和的卵圆形至梭形的肿瘤细胞组成,呈多结节样结构,但大部分病例可见血管瘤样结构及瘤周明显的淋巴浆细胞袖套样结构。大部分AFH伴有EWSR1-ATF1基因易位,但也有发现在支气管内发生的伴有EWSR1-CREB1基因易位的个案报告[9],免疫组织化学检测Desmin阳性结果有助于鉴别PPMS。肺原发性肌上皮肿瘤形态学上主要由肌上皮细胞构成,免疫组织化学检测常表达S-100,细胞角蛋白阳性,大多数情况下Desmin、EMA也可呈阳性表达,并且通过电镜分析可见肌丝。分子遗传学分析显示肌上皮瘤可有EWSR1与ZNF444、PBX1和POU5F1基因易位,但至今未见与CREB1基因融合。肺内IMT的肿瘤细胞由梭形细胞组成,呈束状或漩涡状排列,间质内伴有大量的炎症细胞浸润,免疫组织化学检测表达SMA和(或)Desmin,分子遗传学显示具有ALK基因易位。
EWSR1是一个典型的“随意基因”,倾向在5’端与不同基因融合。该基因编码转录因子TET蛋白家族成员之一的EWSR1蛋白,它的重排可发生在多种肿瘤,除PPMS外,还可发生在尤文氏家族肿瘤(Ewing family tumors,EFTs)[10]、AFH[9]、软组织透明细胞肉瘤(clear cell sarcoma,CCS)[11]、EMC[12]、胃肠道透明细胞肉瘤样肿瘤(clear cell sarcoma-like tumor of the gastrointestinal tract,CCSLGT)[13]、促结缔组织增生性小圆细胞肿瘤等[14]。除PPMS外,具有EWSR1-CREB1基因易位的肿瘤还包括CCSLGT、CCS和AFH[2],因此,EWSR1-CREB1基因易位不是某一类肿瘤特异性的基因学改变,而是需要以组织形态学为基础,才能做出准确的诊断。CCSLGT好发于儿童或年轻人的胃肠道,由细胞质透明细胞或嗜酸性的圆形或卵圆形细胞组成,间质内混有表达CD68的破骨细胞样巨细胞。肿瘤细胞恒定表达S-100及sox10。CCS好发于青中年四肢近肌腱和筋膜处,尤其是脚踝部。纤维间隔将多角形或梭形的肿瘤细胞分隔成巢状或束状,细胞质嗜酸性或透明,核明显空泡化,核仁明显。肿瘤细胞表达S-100、HMB-45。如上鉴别诊断中所述,在形态学上,AFH和PPMS非常相似,且基因遗传学上也有重叠,因此两者需行免疫组织化学检测加以鉴别。
目前大多认为PPMS是一种低度恶性的间叶源性肿瘤。大部分病例无瘤生存,少数亦可发生远处转移及死亡。部分病例可出现核异型、核增值指数增高,病理性核分裂象增多等组织学改变,但有学者认为这种高级别组织学改变对疾病的预后无任何提示作用[2]。本研究中发现,发生转移病例中可见较明显的细胞异型性,核分裂象大于5/10 HPF,且Ki-67增值指数明显高于其他病例,为60%,提示形态学对疾病的预后有一定的提示作用。目前为止,PPMS仍以手术切除作为首选治疗方法,常规化疗或放疗效果不佳,是一种极为罕见低度恶性的肉瘤,建议定期随访,密切观察病情变化。由于病例数有限,PPMS的预后仍有待于大量研究资料证明。
[1] NICHOLSON A G, BAANDRUP U, FLORIO R, et al. Malignant myxoid endobronchial tumour: a report of two cases with a unique histological pattern[J]. Histopathology, 1999, 35(4): 313-318.
[2] THWAY K, NICHOLSON A G, LAWSON K, et al. Primary pulmonary myxoid sarcoma with EWSR1-CREB1 fusion: a new tumor entity[J]. Am J Surg Pathol, 2011, 35(11): 1722-1732.
[3] TRAVIS WD B E, BURKE A P, MARX A, et al. WHO classification of tumours of the lung, pleura, thymus and heart[M]. Lyon; IARC Press, 2015.
[4] INAYAMA Y, HAYASHI H, OGAWA N, et al. Low-grade pulmonary myxoid sarcoma of uncertain histogenesis[J]. Pathol Int, 2001, 51(3): 204-210.
[5] MATSUKUMA S, HISAOKA M, OBARA K, et al. Primary pulmonary myxoid sarcoma with EWSR1-CREB1 fusion, resembling extraskeletal myxoid chondrosarcoma: Case report with a review of literature[J]. Pathol Int, 2012, 62(12): 817-822.
[6] JEON Y K, MOON K C, PARK S H, et al. Primary pulmonary myxoid sarcomas with EWSR1-CREB1 translocation might originate from primitive peribronchial mesenchymal cells undergoing (myo)fibroblastic differentiation[J]. Virchows Arch, 2014, 465(4): 453-461.
[7] 李 杨, 宣兰兰, 张二春, 等. 肺原发性黏液样肉瘤病理学诊断1例并文献复习[J]. 蚌埠医学院学报, 2016, 41(6): 765-768.
[8] BALANZA R, ARRANGOIZ R, CORDERA F, et al. Pulmonary extraskeletal myxoid chondrosarcoma: A case report and literature review[J]. Int J Surg Case Rep, 2016, 27: 96-101.
[9] THWAY K, NICHOLSON A G, WALLACE W A, et al. Endobronchial pulmonary angiomatoid fibrous histiocytoma: two cases with EWSR1-CREB1 and EWSR1-ATF1 fusions[J]. Am J Surg Pathol, 2012, 36(6): 883-888.
[10] ARVAND A, DENNY C T. Biology of EWS/ETS fusions in Ewing’s family tumors[J]. Oncogene, 2001, 20(40): 5747-5754.
[11] WANG W L, MAYORDOMO E, Zhang W, et al. Detection and characterization of EWSR1/ATF1 and EWSR1-CREB1 chimeric transcripts in clear cell sarcoma (melanoma of soft parts)[J]. Mod Pathol, 2009, 22(9): 1201-1209.
[12] SCIOT R, DAL CIN P, FLETCHER C, et al. t(9;22)(q22-31;q11-12) is a consistent marker of extraskeletal myxoid chondrosarcoma: evaluation of three cases[J]. Mod Pathol, 1995, 8(7): 765-768.
[13] WANG J, THWAY K. Clear cell sarcoma-like tumor of the gastrointestinal tract: an evolving entity[J]. Arch Pathol Lab Med, 2015, 139(3): 407-412.
[14] DUFRESNE A, CASSIER P, COURAUD L, et al. Desmoplastic small round cell tumor: current management and recent findings[J]. Sarcoma, 2012; 2012: 714986. DOI: 10.1155/2012/714986. Epub 2012 Mar 29.
Clinicopathologic analysis of primary pulmonary myxoid sarcoma with EWSR1 translocation
JIN Yan1, SHEN Xuxia1, SHEN Lei1, SUN Yihua2, CHEN Haiquan2, WANG Jian1, LI Yuan1
(1. Department of Pathology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai, 200032 China; 2. Department of Thoracic Surgery, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
LI Yuan E-mail: whliyuan@hotmail.com
Background and purpose: Primary pulmonary myxoid sarcoma (PPMS) is a very rare lung tumor that has recently been shown to harbor EWSR1-CREB1 translocation. This study aimed to investigate the clinicopathological characteristics and differential diagnosis of PPMS. Methods: The clinical and pathological features of 6 cases of PPMS with EWSR1 gene rearrangement were reviewed. Immunohistochemistry and f l uorescence in situ hybridization (FISH) study were performed. Results: Six patients were enrolled in this study, including 4 male patients and 2 female patients with an age range of 23 to 64 years (median age, 44 years). All tumors involved pulmonary parenchyma, with a predominant endobronchial component in 1 and adjacent to bronchus in 5 patients. Microscopically, the tumor was lobulated and composed of cords of polygonal, spindle cells within myxoid stroma. Tumors were immunoreactive for only Vimentin and weakly focal for epithelial membrane antigen (EMA). All tumors were shown to harbor EWSR1 gene rearrangement by FISH. Follow-up of all patients showed that 1 patient developed a pleura and bone metastasis but was still alive and 5 were disease-free after 4-29 months. Conclusion: PPMS is an extremely rare sarcoma with low-grade malignant potential. This is characterized by distinct histological features and EWSR1 gene rearrangement. It is important that understanding tumor spectrum and genetic feature can contribute to diagnosis and differential diagnosis of PPMS.
EWSR1 gene;Primary pulmonary myxoid sarcoma; Fluorescence in situ hybridization
10.19401/j.cnki.1007-3639.2017.05.003
R734.2
A
1007-3639(2017)05-0334-06
2016-11-30
2017-02-15)
国家自然科学基金面上项目(81472173)。
李 媛 E-mail:whliyuan@hotmail.com

