中药组学前沿技术发展与应用*
陈士林
(中国中医科学院中药研究所北京100700)
中药组学前沿技术发展与应用*
陈士林**
(中国中医科学院中药研究所北京100700)
近年来,中药领域取得很多研究成果和成就,受到国际社会广泛关注,同时也推动了中医药的国际化进程。但是,对中药成分产生的遗传背景、摄入后对人体环境内基因的影响等问题还不清楚,以本草基因组学(Herbgenomics)为代表的中药组学前沿技术为中药成分的生物合成、中药新品种选育、中药材鉴定等方面的研究提供了新的方法,也将促进中药领域取得更多的成果。本文就中药组学前沿技术的研究进展进行综述,为中药领域相关研究提供参考。
本草基因组学药用模式生物基因组学转录组学合成生物学DNA条形码标准汤剂
近年来,中药领域取得了举世瞩目的研究成果和成就,其主要的技术背景是化学成分研究,中药的现代研究多是针对中药的有效成分及其药理活性。药物成分的合成途径、积累机制、遗传生物学背景以及药物在摄入后如何影响人体环境内基因等,这些中药现代化进程中的关键问题尚未得到深入研究。
2008年,本课题组提出“本草基因组学”概念。本草基因组学(Herbgenomics)是利用组学技术研究中药基原物种的遗传信息及其调控网络,阐明中药防治人类疾病分子机制的学科,从基因组水平研究中药及其对人体作用的前沿科学。主要涉及中草药结构基因组、转录组、功能基因组、蛋白质组、代谢组、表观基因组、宏基因组、基因组辅助分子育种、中药合成生物学、中药基因组学、生物信息学及数据库等理论与实验技术。本草基因组学的主要研究内容是生物遗传背景、遗传信息,将基因组学和多种组学技术相结合,研究中药的模式物种体系、合成生物学、药用植物选种和育种、培育优良品种、基因鉴定、代谢途径等[1,2]。本文主要对“本草基因组学”的最新研究成果进行综述。
1 创立药用模式生物研究体系
在近代的医学领域,医学家常用斑马鱼、线虫等模式动物进行验证实验,植物学领域有拟南芥等模式物种,农业有水稻、烟草等模式物种进行科学研究。这些学科的研究成果都有基因组背景清楚的模式生物体系来支撑,各项研究成果在实验室中可以被重复、验证和证实,容易得到国际主流科学家的认可,比如仅线虫的相关研究就产生过3个诺贝尔奖得主。一直以来,中药缺少一个模式物种体系,相关研究成果在其他国家、研究机构不能被有效的验证,因而较难在国际顶级学术期刊上发表,研究成果的认可度也会受到影响。为此,本课题组进入基因组学领域进行研究,为中药模式物种体系的建立奠定基础。
1.1 灵芝基因组学研究——灵芝药用模式真菌研究体系
2012年,本课题组提出灵芝成为首个药用模式真菌,通过基因组解析技术研究真菌次生代谢产物发现,灵芝是一种非常好的模式生物。这项工作对后续功能基因发掘、有效成分合成途径、品种选育以及指导生产都起到了很好的推动作用。目前,本课题组朱英杰博士等完成的基因组学揭示灵芝的生物活性机制[3]相关研究已经发表了许多高水平的论文,可见有一个模式物种体系可以促进研究者取得很好的研究成果(图1)。
1.2 丹参基因组学研究揭示活性成分合成途径
本课题组前期从事药用植物研究,相关研究成果难以在植物学顶级期刊上发表。2016年,我们在丹参基因组基础研究的基础上进行了丹参基因组学研究,与广药集团开展中药资源研究战略合作,共同解析丹参基因组。随着高杂合度、高复杂度丹参基因组的测序和组装完成,为其他药用植物基因组解析提供了可行的研究策略,该项成果[4]发表于Molecular Plant。通过第三代转录组研究,揭示了丹参活性成分合成的分子机理[5]。丹参二萜合酶功能多样性研究,揭示丹参酮骨架合成机制[6]。采用基因组数据发掘,发现多个与萜类和酚酸类合成相关基因[7]。发掘鉴定在小RNA沉默通路中发挥关键作用的丹参DCL、RDR和AGO家族。通过分析bHLH、WRKY、MYB等转录因子,发现其对丹参活性成分的调控作用[8]。另外,通过丹参基因组揭示生长素调控生长发育的机理等。
通过选育丹参雄性不育系,突破中药材杂种优势育种技术难题,“中丹1号”、“中丹2号”通过新品种鉴定。由此可见,得到一个大的基因组学研究背景的支撑对中药研究水平会有很大提升,且对品种选育研究也有很好的促进作用。
2 转录组学研究—有效候选基因和发掘分子育种标记
转录组学信息是基因组研究的基础信息和核心数据,中药比较转录组研究为中药功能基因组研究提供有效候选基因,基于转录组数据发掘的SSR是分子育种研究中的有效分子标记。
2.1 三七组学研究加快品种选育,推动克服连作障碍
为解决三七原植物的连作障碍问题,本课题组通过前期大量转录组学研究。从三七根茎转录组获得30.852条单一序列,其中70.2%为注释序列挖掘11条参与三萜皂苷生物合成途径的基因[9]。克隆并确定三七皂苷合成途径关键基因[10]。克隆三七中编码鲨烯环氧酶的基因(PnSE1、PnSE2),并检测其在三七不同组织部位表达模式[11]。获得编码三七甲羟戊酸途径限速酶MVK1(PnMVK1)基因的全长cDNA序列,完成蛋白结构及表达谱分析[12]。土壤宏基因组揭示三七连作障碍是由于真菌多样性下降、微生物群落失衡、病原菌增加。从而,建立了克服三七连作障碍的综合策略——“土壤复合处理+绿肥回田+生物菌剂+抗病品种”。
特别是宏基因组学的研究,通过和三七研究院和云南苗乡三七公司合作,在自然病圃中获得母本,经人工病圃纯化后,建立抗病群体并采用Restriction-site Associated DNA Sequencing(RAD-Seq)测序技术筛选抗病株的特异SNP位点辅助系统选育。
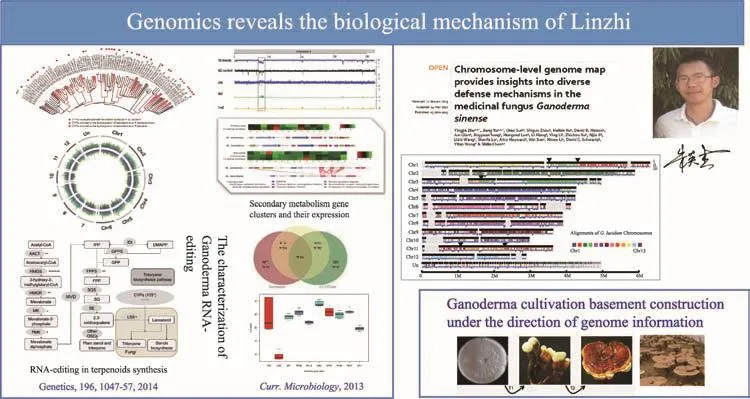
图1 基因组学揭示灵芝的生物活性机制

图2 人参全球产地生态区划研究
通过传统的单株选育及集团选育并结合现在分子生物学技术,有效缩短了三七的选育年限,加快育种进程。通过选育使三七根腐病的发病率下降了62.9%,有显著的抗病性。抗病群体包含12个特异的SNP位点,具有特异的基因型。通过以上工作,最终筛选出三七抗性新品种“抗七1号”。通过上万株三七的标记、筛选,该项目实际工作量非常大,基因组学研究技术大大地加快了筛选工作、品种选育过程。2016年9月,通过植物新品种登记专家田间鉴定、评审,命名为“苗乡抗七1号”。这些基础研究工作与行业实际需求及大田生产结合,产生了很好的经济和社会效益。
2.2 基因组学研究助力人参现代化栽培体系建立
对同属植物人参和三七可以采用相似的研究方法和技术,不过人参的生长周期更长,所以一般需要做3-4代才能确定一个优选品种。目前,农田栽参已经有了大的突破,这项工作已进行多年,现在已经开始大田推广。为避免人参“与粮争地”,本课题组进行了人参全球产地生态区划研究(图2),并建立了中药材产地生态适宜性分析地理信息系统(Traditional Chinese Medicine Geographic Informatin Systems,TCMGIS),在全世界范围内寻找适合种植人参的国家和地区,该系统每1平方公里可以采到3个数据点,数据精准、可靠、覆盖面全,已获得广泛认可。利用该系统可以发现原产地以外的适宜生长区,在生态适宜区人工种植稀缺、贵重药材,满足日益增长的药材需求量。例如,中国不是西洋参的分布区,但中国是西洋参的生态适宜区,通过多年的研究和时间探索,2012年中国西洋参的产量已经高于西洋参原产国美国,总产量仅次于加拿大,位列世界第二,产生了很高的社会效益和经济效益。
2.3 中药体内代谢基因组研究和中药合成生物学
中药体内代谢基因组研究是促进精准医疗的一个非常重要环节(图3)。中药体内代谢及药效发挥的基本环节是药物分子与机体生物分子之间直接或间接的相互作用,引起从遗传信息到整体功能实现过程中多个层面的结构与功能状态的改变,而决定这些层面的结构与功能的基础是基因。因此,以基因表达、调控及修饰为研究方向,进行中药多组分、多环节、多靶点的体内研究,可能有助于阐明中药体内代谢过程和分子作用机制。同时,人个体也是一个生物环境,除了人自身的遗传物质,还有来自于分布人体各部位的微生物基因,其中肠道是微生物种类数目最高的器官。近年来,基于基因组学的技术在中药体内代谢领域进行了有益的探索。因此,有必要探讨中药体内代谢基因组相关研究,包括中药对人自身基因的影响和对人体微生物基因组的影响。
有些中药是以其单体成分为目标进行新药研制研究,如人参皂苷等。另外,还有一些药物是以药物化学全合成、结构修饰的方式研发出来。根据相关领域的研究总结,本课题组在本草基因组研究基础上提出“中药合成生物学”[13]。中药合成生物学是基于基因组信息对中药有效成分生物合成相关元器件进行发掘和表征,借助工程学原理对其进行设计和标准化,通过在底盘细胞中装配与集成,重建生物合成途径和代谢网络,实现药用活性成分的定向、高效的异源合成。因此,中药合成生物学也是很重要的一个环节(图3)。

图3 从本草基因组学到中药合成生物学
3 中药材鉴定研究
众所周知,目前市场上的中药材比较混乱,药材粉末更是“神仙难辨”,针对药材某些药用部位进行造假的技术手段更是层出不穷。2015年,沃尔玛等美国4大零售商涉嫌草药补充剂造假,被纽约州当局要求下架,这个中药国际化发展进程中的大事件,直接导致2015-2016年我国提取物和中草药的出口量显著下降。该事件的原因是,美国药监部门检测到有草药补充剂造假现象,被检药材中没有原物种的DNA,部分草药补充剂商品系人工造假产物。另外,国际上还出现过“银杏叶造假事件”,当时我国境内也查出有不良商家用槐米造假来充当银杏叶的现象。这些现象导致中医对中药的不认可,并有人提出“方灵药不灵”的说法。更严重的是,香港“洋金花与凌霄花混用中毒事件”、菊三七误当三七导致严重肝毒性,以及全球最大草药医疗事件——马兜铃肾病,将关木通与木通误用,广防己与防己误用等,这些误用严重威胁国民健康和人身安全。
3.1 经典鉴定方法不能满足安全用药需求
如果仅仅通过检测药材的一个部位,根据其性状鉴定、基原鉴定、显微鉴定和理化鉴定,要鉴定到物种水平是非常困难的。比如根类药材就不具备分类的核心特征,植物分类主要是以花和果实进行鉴定。加之现在世界贸易带来的药材广泛流通,对药材鉴定造成更大的困难,因此需要寻找更有普适性的鉴定方法(表1)。世界上有20多种甘草,一个药材经药检所鉴定,结果不会显示具体的物种名称,只能确定是否与药典描述的药材相符。如果药材来源都不清楚,后期再做含量测定等精确计算就很难保证准确性。为此,我们要寻求一种基因鉴定的方法。
3.2 DNA条形码鉴定方法
DNA条形码鉴定法是在所有正品药材中找到相同的一段DNA片段进行测序,保存在数据库中作为对照品用来鉴定未知样品或易混淆样品。国际条形码协会植物工作组提出的两个叶绿体片段——rbcL和matK,两者加在一起使用鉴定效率为72%。本课题组有基因组的研究优势,通过大样品量的实验确定了条形码序列的筛选范围,从而找到约220 bp的核基因组片段ITS2作为通用条形码,突破了当时对DNA条形码序列长度范围500-800 bp的定义,通过大样本量验证发现ITS2序列有很好的扩增效率和鉴定能力,数千份的样品中达到92.7%的样品都能鉴定准确。该研究发表的第一篇文章被引用820多次,在随后的研究中,本课题组在国际上首次明确ITS2多拷贝有利于物种鉴定。

表1 中药材经典鉴定技术发展历程
在以上研究工作中,本课题组一共检测4.8万份中药样品,涉及217科1 251属的1.1万个物种。所有样本均采用原植物,从全国4大药用植物园里找到所有正品药材的原物种;对于部分植物园采不到的物种,到野外采集样品后,与英国皇家植物园核对,经国内权威专家鉴定无误后才会使用。本课题组在中检院购买了所有的对照药材,这些鉴定工作是由各大药检所来复核样本。在核对机制方面,应用BLAST分析、Barcoding Gap分析和系统发育树分析等分析技术。
为了证实ITS2能高效鉴定近缘科属种药材(中草药及其混伪品),本课题组专门就中草药近缘物种(易混品)进行了评估验证研究。另外,还对《中国药典》收载的根茎类药材及其混伪品5 860份、花类药材602份、全草类药材及其混伪品2 431个物种、皮类药材312份、果实类药材1 352份进行了研究,发现ITS2能准确稳定鉴定生药及其混伪品。
另外,对于部分药材还能做种下的道地药材鉴定,比如川麦冬和浙麦冬的鉴别、不同地区肉苁蓉的区分及野外考察及生态型分布,ITS2是很好的一种鉴定方法。
3.3 超级条形码
作为传统鉴定方法的有效补充,DNA条形码分子鉴定方法近年来发展迅猛,但对于某些近缘物种,尤其是种下等级的准确鉴定,DNA条形码序列也存在一定的局限性。随着测序技术的发展以及测序成本的下降,第二代和第三代高通量测序技术越来越多的应用于药用植物的研究中,应用高通量测序技术获取药用植物叶绿体全基因组的方法已经很成熟。将叶绿体全基因组作为超级条形码来进行物种鉴定,或应用叶绿体全基因组筛选种属特异的DNA条形码序列是某些近缘物种或种下等级准确鉴定的一个方向。本课题组基于SMRT PacBio技术获取了三种贝母属物种的叶绿体全基因组序列,并对叶绿体全基因组进行全局分析,查找基因区域和基因间区的高变异区域,筛选出7个基因间区作为潜在的贝母属物种鉴定的特异性DNA条形码序列,为难鉴定科属筛选DNA条形码序列提供了参考。
综上所述,本课题组由此创建了全新中草药DNA条形码物种鉴定体系:鉴定方法的标准操作流程有:①供试品处理;②DNA提取;③PCR扩增;④条形码序列的获取;⑤结果判断;中草药鉴定平台包括标准化中草药DNA条形码数据库和网络鉴定操作平台;鉴定软件系统有DNA拼接软件和中药DNA条形码鉴定软件。该体系的组织构成以ITS2为主体序列,以psbA-trnH为辅助序列,适用于中药材(包括药材、药材粉末及部分药材饮片)及基原物种的鉴定。国际期刊Biotechnology Advances以“草药鉴定从形态到基因的文艺复兴”刊发了该研究成果。
3.4 DNA条形码的应用与交流合作
目前,2010版和2015版《中国药典》已经纳入DNA条形码分子鉴定法指导原则,课题组编著了《中国药典中药材DNA条形码标准序列》;2015年5月,英国药典委员会专门派两名专家到国家药典委员会申请学习DNA条形码技术,《英国药典》在2016年引进了草药DNA鉴定技术;美国药典委员会多次与本课题组联系,希望将ITS2应用到西洋参等草药的鉴定研究中,邀请本课题组协助建立草药鉴定标准。
现在,我们又将DNA条形码鉴定技术应用在中成药鉴定领域。比如当归成药鉴定方面,通过当归及近缘种265份ITS2序列分析,找到当归独有的SNP,开发了一段37 bp的分子身份证,GenBank中当归属72个种429条ITS2序列,仅当归具有此分子身份证。应用该分子身份证对28份中成药进行鉴定,7份样品检测结果为独活、羌活、藁本、紫花前胡等非标签成份。这一研究拓宽了DNA条形码技术在降解严重样品中的应用。
为了让企业进行快速鉴定,我们专门研究应用比色法来判断物种的快速鉴别技术。如对西红花及其混伪品应用环介导等温扩增技术(LAMP)进行快速鉴定,通过对西红花及其混伪品设计LAMP特异性扩增引物,西红花样本经LAMP扩增后,呈绿色荧光,而混伪品样本为橙色,目测即可进行快速鉴别,为企业节省了宝贵的时间。本课题组对以上技术进行了产权保护,国内外首创中草药DNA条形码物种鉴定体系独家专利。在论文成果方面,本课题组在BiotechnolAdv、Nature Commun、PNAS、Biol Rev、中国科学等发表论文165篇,被PNAS、Science、MBE等国际著名期刊引用;国内发表的论文中3篇DNA条形码研究论文入选中国百篇最具影响优秀国内学术论文。
在应用方面,国际上大量的研究机构、检验机构和企业都在用我们的技术,种子、种苗的鉴定也可以用这种技术,我们培训了很多技术人员,国内最大的中医院广东省中医院、湖北省中医院都在用这个技术,其中广东省中医院每天要用12吨的中药材饮片,他们非常重视药材的基原物种问题;许多知名药企也是非常重视药材原物种的鉴定,以确保所用品种是法定来源,保证产品的安全性和疗效;日本最大汉方企业津村安排专人提供的药材防风样品来我们课题组进行检测,结果显示样品为华山前胡,为企业成功避免遭受损失;贵重药材、草药饮料、侦破案件等领域也在使用这个技术。在国际合作方面,日本国津村株式会社、美国Unigen、安利等都就DNA条形码鉴定技术与我们开展了广泛的合作。
另外,中草药DNA条形码物种鉴定体系研究获得了国家科技进步二等奖、教育部科技进步一等奖、中华中医药学会自然科学一等奖,入选“2014年度世界中医药十大新闻”。项目负责人在国际生命条形码大会应邀做主题报告,担任药用植物分会主席。中草药DNA条形码物种鉴定体系已经成为国际国内的亮点。在这个过程中我们有一个体会,中医药作为一个应用学科,还是要先把其中的原理、背景研究清楚,才能有更长久、更好的发展。
3.5 中药鉴定进入通用和标准化基因鉴定时代
课题组基于开源代码PHP QR Code编码方式将DNA条形码序列转换为二维码,应用移动终端的二维码扫描软件识别可获得物种拉丁名及序列信息,通过移动终端的浏览器可在中药材DNA条形码鉴定系统中进行物种鉴定。二维DNA条形码可应用于中药材流通监管领域,DNA条形码序列获得及DNA条形码信息跨平台转换,能够有效实现对中药材流通的数字化监管,推动中药材流通监管现代化、国际化进程。另外,我们和澳门大学课题组合作进行了道地药材品质溯源研究(图4)。
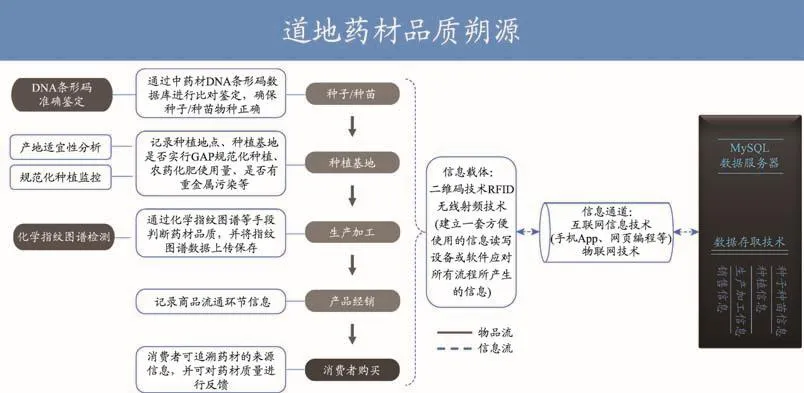
图4 溯源系统架构图
4 中药饮品标准汤剂内涵
中药饮片标准汤剂是以中医理论为指导、临床应用为基础,参考现代提取方法,经标准化工艺制备而成的单味中药饮片水煎剂。在定位方面,中药饮片标准汤剂可以用于标化临床用药,保障用药的准确性和剂量的一致性,它的作用包括:①有利于临床用药的准确和剂量的统一;②有利于保障疗效的一致性;③有利于促进用药质量提高,改变目前监管困局;④为中药研究标准化提供了基础;⑤有利于促进制造工艺和管理的改善和提升。
中药绝大部分是复方,目前新药审批方法、管理办法有一些不太科学的规定,比如现有成药生产管理要求固定的(如100 kg)药材原料要生产固定的(如10 000粒)胶囊数,但是原料药材有效成分的含量不是固定的,这种原料的有效成分含量、出膏率等指标都不一样,生产的产品差别就很大,很难做到均一稳定。在和日本津村合作过程中发现他们几十年生产的成药样品含量都非常的稳定,他们核心的方法就是中间设置标准汤剂,简单来讲就是“中间提取物”,相当于西医的“原料药”,目前我们中成药新药生产工艺里是没有这个概念的,这个想法在药典委和各位专家讨论过,讨论中反对这一做法的原因就是中间提取物造假更容易,以后监管起来更难。但是,如果我们现在最基本的均一稳定都做不到,稳定可控的“精准”之路更是难上加难。
前不久,药监局针对中药配方颗粒引入了标准汤剂概念(《中药配方颗粒管理办法(征求意见稿)》,2015年第283号),每种药材标准煎剂作为最原始的标准,通过这种“中间提取物”的方式来监管、控制。比如金银花标准汤剂,把有代表性GAP产地的金银花饮片按照传统的标准煎煮规范(容器大小、水量、温度、时间)确定出膏率、有效成分得率,在这些步骤的基础上确立标准,基于此后面生产颗粒剂时就有了一个基本可控的范围,有了标准汤剂这个中间参照物,颗粒剂就有相对均一、稳定的产品。值得思考的是,中药新药是不是也可以引入标准汤剂的概念,对后面的成药稳定性是很重要的因素。
5 总结与展望
1986年,国家食品药品监督管理总局药物审评中心将第一个新药证书(86卫药证字X-01号)(92卫药证字X-66、67号)颁发给中国中医科学院中药研究所屠呦呦教授开发的青蒿素。当时,该项新药研究项目能够获批新药证书,既反映了新药审批机构明确的判断力和高度的前瞻性,也为2015年屠呦呦教授获得诺贝尔生理学或医学奖的奠定了基础。
2015年,与张伯礼院长一起陪同屠教授赴瑞典领奖时,我们与许多国际知名医药专家进行了对话和交流,各位专家普遍认为,中国的中医药,特别是数千年的中医临床经验,是中国最具有原始创新性的、最具有竞争力的一个资源和领域,如果把中国数千年的临床经验总结好、挖掘好,可能还会产生很多类似于青蒿素的重大新药。另外,国际医药专家还讨论了一些中医药的新成果,比如三氧化二砷治疗白血病等,说明国际社会对中医药日益重视。2015年诺奖颁奖现场,安德森教授在屠教授整整半小时的讲话过程中一直半跪着为屠教授扶话筒,他的敬业精神值得称颂。这不仅表示了安德森教授对屠教授的尊重,更反映出国际主流科学家对中国传统医学的尊重。
目前,我们已有7个中药品种在美国进行II期、III期临床试验,说明中国在中医药国际化发展方面前景良好。另外,美国药典、欧洲药典中许多中药标准也是以中国科学家为主体建立的,中国药学家在欧洲、美国的话语权也越来越大。
中药基因资源是一种珍贵的国家战略资源,国际竞争严峻,韩国、美国、日本等国家已启动许多中药基原物种全基因组研究,对我国传统中药研究领域造成极大挑战。目前,我们对中药的生物学本质研究还非常薄弱,这制约了对中药的深入研究。在获取中草药基因组和基因遗传信息的基础上,通过本草基因组学相关研究来解决中药研究中面临的一系列难题,包括建立用于次生代谢产物生物合成及其调控研究的药用模式生物体系,通过合成生物学生产重要的天然药物或中药新药原料,利用基因组辅助育种培育中草药优良品种,开发用于鉴别中药材混伪品的分子标记,揭示药材道地性的生物学本质,建立本草数据库保护珍贵的药用植物基因资源,以及研究人类基因组遗传多态性和肠道微生物的多样性对中药体内代谢和药效的影响等。
1Chen S L,Pang X H,Song J Y,et al.A renaissance in herbal medicine identification:from morphology to DNA.Biotechnology Advances,2014, 32(7):1237-1244.
2Chen S L,Song S Y,Sun C.Herbal genomics:Examining the biology of traditional medicines.Science,2015,347(6219 Suppl):S27-S29.
3Chen S L,Xu J,Liu C,et al.Genome sequence of the model medicinalmushroom Ganoderma lucidum.Nature Communications,2012,3(2):913.
4Xu H B,Song J Y,Luo HM,et al.Analysis of the Genome Sequence of the Medicinal Plant Salvia miltiorrhiza.Molecular Plant,2016,9(6):949-952.
5Xu Z,Peters R J,Weirather J,et al.Full-length transcriptome sequences and splice variants obtained by a combination of sequencing platforms applied to different root tissues of Salvia miltiorrhiza and tanshinone biosynthesis.Plant J,2015,82:951-961.
6 Lowder L G,Zhang D,Baltes N J,et al.A CRISPR/Cas9 Toolbox for Multiplexed Plant Genome Editing and Transcriptional Regulation.Plant Physiol,2015,169(2):971-985.
7 Yimian Ma,Lichai Yuan,Bin Wu,et al.Genome-wide identification and characterization of novel genes involved in terpenoid biosynthesis in Salvia miltiorrhiza.J Exp Bot,2012,63(7):2809-2823.
8 Xin Zhang,Hongmei Luo,Zhichao Xu,et al.Genome-wide characterisation and analysis of bHLH transcription factors related to tanshinone biosynthesis in Salvia miltiorrhiza.Sci Rep,2015;5:11244.
9Kim M,Shin H,Su Chung T,et al.Extracting regulatory modules from gene expression data by sequential pattern mining.BMC Genomics, 2011,12 Suppl 3:S5.
10 Niu Y,Luo H,Sun C,et al.Expression profiling of the triterpene saponin biosynthesis genes FPS,SS,SE,and DS in the medicinal plant Panax notoginseng.Gene,2014,533(1):295-303.
11牛云云,朱孝轩,罗红梅,等.三萜皂苷合成生物学元件的初步开发:三七鲨烯环氧酶编码基因克隆及表达模式分析.药学学报,2013, 48(2):211-218.
12郭溆,罗红梅,陈士林.三七甲羟戊酸激酶PnMVK1基因的克隆和生物信息学分析.2012,47(8):1092-1097.
13 Li Q S,Li Y,Song J Y,et al.High-accuracy de novo assembly and SNP detection of chloroplast genomes using a SMRT circular consensus sequencing strategy.New Phytologist,2014,204(4):1041-1049.
14 Dong L L,Xu J,Feng G Q,et al.Soil bacterial and fungal community dynamics in relation to Panaxnotoginseng death rate in a continuous cropping system.Sci Rep,2016,6:31802.
15 Zhu Y J,Xu J,Sun C,et al.Chromosome-level genome map provides insights into diverse defense mechanisms in the medicinal fungus Ganodermasinense.Sci Rep,2015,5:11087.
16 Xu ZC,Peters R J,Weirather J,et al.Full-length transcriptome sequences and splice variants obtained by a combination of sequencing platforms applied to different root tissues of Salvia miltiorrhiza and tanshinone biosynthesis.Plant Journal,2015,82(6):951-961.
17 Zhao MM,Shi YH,Wu L,et al.Rapid authentication of the precious herb saffron by loop-mediated isothermal amplification(LAMP)based on internal transcribed spacer 2(ITS2)sequence.Sci Rep,2016,6:25370.
18董林林,陈中坚,王勇,等.药用植物DNA标记辅助育种(一):三七抗病品种选育研究.中国中药杂志,2017,42(1):202-208.
19陈士林,宋经元.本草基因组学.中国中药杂志,2016,41(21):3881-3889.
20陈士林,孙永珍,徐江,等.本草基因组计划研究策略.药学学报, 2010(7):807-812.
21陈士林,朱孝轩,李春芳,等.中药基因组学与合成生物学.药学学报,2012(8):1070-1078.
22陈士林,刘安,李琦,等.中药饮片标准汤剂研究策略.中国中药杂志,2016,41(8):1367-1375.
23黄林芳,郑司浩,武拉斌,等.基于化学成分及分子特征中药材肉苁蓉生态型研究.中国科学:生命科学,2014,44(3):318-328.
24 Wang X Y,Liu Y,Wang L L,et al.A Nucleotide Signature for the Identification of Angelicae Sinensis Radix(Danggui)and Its Products.Sci-Rep,2016,6:34940.
Advances andApplications of Frontier Omics Technology of Chinese Materia Medica
Chen Shilin
(Institute of Chinese Materia Medica,China Academy of Chinese Medical Sciences,Beijing 100700,China)
A lot of research achievements have been obtained in the field of Chinese materia medica(CMM)in recent years,which have been paid close attention to by the international community.It also promotes the internationalization of traditional Chinese medicine(TCM).However,the genetic background of CMM bioactive compounds and the effect on human genes of CMM composition after ingestion are not clear.As a frontier technology,herbgenomics provides a new method for the study of biosynthesis,breeding of new varieties and the identification of CMM.It will also promote more achievements in this field.This paper reviewed the research progress of study on the frontier omics technology of CMM in order to provide references for CMM research.
Herbgenomics,medicinal model organism,genomics,transcriptomics,synthetic biology,DNA barcoding, standard decoction
10.11842/wst.2017.03.007
R282.5
A
(责任编辑:马雅静,责任译审:王晶)
2017-04-15
修回日期:2017-04-30
*本文为编者根据陈士林研究员在2016年国家食品药品监督管理总局新药审评中心举办的“思与行”讲坛上的演讲稿整理而成。
**通讯作者:陈士林,本刊执行主编,研究员,博士生导师,主要研究方向:中药资源学。

