探究金属镁与铵盐反应的原理
石锦惠


有一定的化学基础者都知道金属镁能够与酸反应产生氢气,进入高中后学生也明确了镁条可以与热水反应产生氢气。实验表明,常温下金属镁不仅能在水溶液中呈酸性铵盐(强酸弱碱盐,即(NH4)2SO4、NH4Cl、NH4NO3)溶液里反应。而金属镁能否在中性铵盐(如CH3COONH4)的溶液、碱性铵盐(如NH4HCO3、(NH4)2CO3)的溶液里发生反应呢?
1.实验探究为铵盐的水溶液与金属镁反应提供真实的来源
实验:用滴定管向试管中加入10滴 0.1mol·L-1NH4Cl溶液,用砂纸除去镁条表面氧化膜,将镁条投入溶液,开始镁条表面产生大量的气体,收集气体发现气体具有可燃性(经检验其中含H2)。一段时间后,用蘸有浓盐酸的玻璃棒靠近试管口产生白烟的气体。将上述实验中的NH4Cl溶液换成(NH4)2 SO4溶液,实验的现象完全相同。
结论:开始镁条表面产生大量的气体,收集气体发现气体具有可燃性,说明是H2。一段时间后,用蘸有浓盐酸的玻璃棒靠近试管口产生白烟的气体,产生的是NH3。
反思:一方面,本实验采用0.1mol·L-1NH4Cl溶液或(NH4)2SO4溶液是防止NH4NO3的酸性溶液中NO3-具有氧化性;另一方面,上述实验反应产生H2的原因可以从下列两个方面考虑:
(1)Mg直接与NH4+反应:Mg+2NH4+=Mg2++2NH3↑+H2↑;
(2)NH4+水解出来的H+与Mg反应:NH4++H2O NH3·H2O+H+;Mg+2H+=Mg2++H2↑。
2.理论分析为铵盐的水溶液与金属镁反应作出正确的指导
通过铵盐的水溶液与金属镁反应产生氢气和氨气,学生更多地倾向(2)中NH4+水解出来的H+与Mg反应。为了证明Mg直接与NH4+反应成立,学生查阅了资料,已知NH3·H2O的Kb=1.8×10-5,几种弱酸常温下的电离平衡常数表1所示:
从表中数据进行分析,对NH4HSO3或(NH4)2SO3溶液來讲,Ka大于与Kb,因为NH3·H2O比SO32-或HSO3-的电离常数小,说明SO32-或HSO3-比NH4+水解程度小,所以溶液呈酸性;类似的,Ka小于Kb,溶液成碱性,故NH4HCO3或(NH4)2CO3溶液碱酸性;若Ka等于与Kb,溶液呈中性,如CH3COONH4溶液呈中性,这是因为NH3·H2O和CH3COOH的电离常数相同,说明CH3COO-和NH4+水解程度相同,所以CH3COONH4溶液呈中性。当实验选择与Mg反应的铵盐为CH3COONH4,若实验过程中也产生H2和NH3,则就可以充分说明是NH4+与直接Mg反应的结果。
学生进行实验验证是必然的。用滴定管向试管中加入10滴 0.1mol·L-1 CH3COONH4溶液,用砂纸除去镁条表面氧化膜,将镁条投入溶液,镁条表面产生大量的气泡。用湿润的红色石蕊试纸接触生成气体变红,说明产生了NH3;再用小试管采取排水法收集反应生成的气体,发现气体可以燃烧(方法是:将集满氢气的小试管用大拇指堵住管口,管口朝下,立即移近酒精灯火焰,试管里的气体能点燃)。
3.深入探究为铵盐的水溶液与金属镁反应构建完整的知识体系
在前面我们分析了具有酸性的NH4NO3溶液中NO3-可能具有氧化性,将金属镁投入NH4NO3溶液中,是否是NO3-氧化金属镁呢?
实验:用滴定管向试管中加入10滴 0.1mol·L-1NH4NO3溶液,用砂纸除去镁条表面氧化膜,将镁条投入溶液,镁条表面产生大量的无色气体。收集气体进行可燃性实验,其气体不可燃,并使带火星的木条复燃;进行NH3检验实验,其气体不含NH3;气体接触空气不变棕红色。
结论:金属镁投入NH4NO3溶液中不再产生氢气和氨气,气体也不是一氧化氮或二氧化氮,而是另有其他。
通过资料查阅发现,在微弱的酸性环境下NO3-被Mg还原生成N2O、N2等物质。其发生反应的离子方程式可以表示为:4Mg+10H++2NO3-=4Mg2++N2O↑+5H2O或5Mg+12H++2NO3-=5Mg2++N2↑+6H2O。因为实验比较复杂,这里就不再狗尾续貂了。
另外,在碱性条件下的铵盐与金属镁的反应又是何种结果呢?
实验:在试管中加入2ml pH=8.2的 NH4HCO3溶液,将除去表面氧化膜的镁条投入溶液,开始镁条表面产生大量的气体,同时有白色固体析出。对产生的气体进行实验分析发现,该气体能够使澄清的石灰水变浑浊,除去这种气体之后,还有另一种可以燃烧的气体,燃烧后生成水。
结论:NH4HCO3溶液与金属镁反应生成二氧化碳和氢气。
反思:NH4HCO3溶液与金属镁反应生成二氧化碳和氢气一定与HCO3-有关。怎样才能验证产生二氧化碳和氢气原因与HCO3-有关呢?可以补充这样的实验:
(1)在试管中加入2ml pH=8.2的 NaHCO3溶液,将除去表面氧化膜的镁条投入溶液,开始镁条表面产生大量的气体,同时有白色固体析出。这种实验现象与pH=8.2的 NH4HCO3溶液的实验现象完全一样,说明与NH4+无关。
(2)将pH=8.2的 NaOH溶液中加入除去表面氧化膜的镁条,没有气体产生。说明产生的H2与OH-没有关系。
学生查阅资料发现,析出的白色固体为Mg2(OH)2CO3。这完全可以用高中化学知识作以解释:因为NH4HCO3溶液中存在HCO3- H++CO32-平衡,Mg与H+反应生成了Mg2+,降低了H+的浓度,使平衡正向移动;同时溶液中存在HCO3-+H2O H2CO3+OH-,溶液中的Mg2+、OH-、CO32-结合就产生了难溶的Mg2(OH)2CO3。
为了确定NH4HCO3溶液与金属镁反应析出的白色固体是Mg2(OH)2CO3,学生又补充了下列实验:
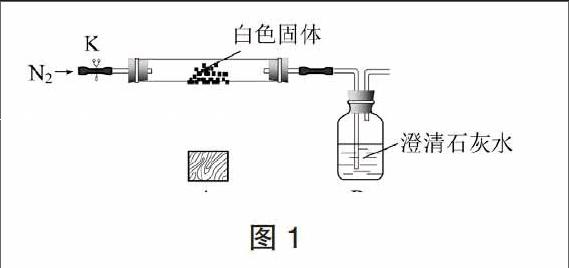
某学生设计了图1所示装置来探究白色固体的热分解情况(夹持仪器省略)。打开K,先通入一段时间氮气,然后,用酒精灯在A处加热玻璃管,观察B瓶溶液变浑浊,说明白色体分解产生CO2。待实验完毕后,继续通入氮气至玻璃管冷却,在硬质玻璃管的右侧的内壁发现了液滴。
图1实验说明该析出的白色固体分解产生了水和二氧化碳,但不能说明就一定是Mg2(OH)2CO3,因为MgHCO3分解也会产生相同的现象。
该小组对上述装置又进行简单改进后(如图2),作了白色固体的定量探究。连接仪器、装药品,打开止水夹K,通入氮气,加热玻璃管。当C中硬质玻璃管的右侧的内壁不再有液滴时,停止加热,继续通入氮气至玻璃管冷却。
为了确定其固体组成,在实验设计中,学生注意了应先吸收水蒸气,再吸收CO2,实验D不能选用碱石灰,因为它同时吸收水蒸气和CO2。在装置D中应盛放氯化钙固体,E中盛放碱石灰固体。在这一实验中学生得出了一组数据如表2所示:
还有更多的实验正等待着我们去探究、去开发,这里就不一一列举了。
总之,铵盐溶液与金属镁常见的反应是Mg直接与NH4+反应:Mg+2NH4+=Mg2++2NH3↑+H2↑。然而,在不同的条件下也会有不同的结果,如金属镁在与NH4NO3或NHHCO3溶液的反应,就是特例,但是,其反应原理还是有据可循的。我们唯有不断地反思、不断地探究,真理就一定会掌握在自己的手中。
参考文献:
[1]周晓宏,张冬临,刘晓渝.镁与铵盐溶液反应的教学分析[J]. 化学教育, 2007, 28(8):55.
[2]罗华荣,彭晓玲.探究镁与氯化铵溶液的反应[J].中学化学教学参考, 2009(8):50-51.
(作者单位:福建省长乐华侨中学)

