抗肿瘤化合物告达亭的早期毒性机制研究
唐红艳, 胡思扬,3, 张家雯, 施佳玉, 吴小雨, 张 闪, 张晓涵, 彭颗红, 周 畅
(1.湖南师范大学生命科学学院,动物多肽药物创制国家地方联合工程实验室,中国 长沙 410081;2.湖南省肿瘤医院妇科肿瘤科, 中国 长沙 410013;3.湖南师大附中梅溪湖中学,中国 长沙 410205)
抗肿瘤化合物告达亭的早期毒性机制研究
唐红艳1, 胡思扬1,3, 张家雯1, 施佳玉1, 吴小雨1, 张 闪1, 张晓涵1, 彭颗红2*, 周 畅1
(1.湖南师范大学生命科学学院,动物多肽药物创制国家地方联合工程实验室,中国 长沙 410081;2.湖南省肿瘤医院妇科肿瘤科, 中国 长沙 410013;3.湖南师大附中梅溪湖中学,中国 长沙 410205)
为探究告达亭(Caudatin)对雄性昆明小鼠的毒性影响,按照告达亭质量比为5和10 mg/kg以及溶剂对照组对SPF级昆明鼠通过腹腔注射的方法,进行为期14 d的毒理学研究.实验动物总共30只昆明鼠,随机分为6组,分2批进行实验,两次实验结果一致:实验昆明鼠在不同浓度告达亭处理14 d后体质量无明显变化,血液学指标检测正常,心、肝、肺、肾以及睾丸均无组织畸变.
告达亭;慢性毒理实验;血液成分生化分析

图1 告达亭的分子结构Fig.1 The molecular structure of Caudatin
近年来,中药新品种逐年增加,其应用的范围越来越广.关于中药毒副作用给人体造成严重损害的报道时有发生,中药的安全性成为其走向国际市场必须突破的瓶颈.C21甾体苷类化合物主要存在于萝藦科中,告达亭(Caudatin)是从白首乌中分离得到的一种C21甾体苷元,分子式为C28H42O7,其结构式如图1[1-2].前期研究发现告达亭可以体外阻滞包括AGS细胞和HeLa细胞在内的多种肿瘤细胞周期,起到抑制细胞增殖的作用;通过克隆形成和Tunel等实验证明告达亭可以诱导肿瘤细胞发生凋亡; 划痕实验验证告达亭对多种肿瘤细胞的迁移速率有显著的抑制作用[3-5].告达亭在抗肿瘤、免疫调节、化疗药物增效减毒等方面具有重要的生物活性[6].但是到目前为止,未见有关告达亭药物毒性的报道.中药有效成分在开发成新药前对其有效性及安全性做出初步评价必不可少,早期毒性指标的发现对于药物毒性的早期预警尤为重要.本论文采用模式生物小鼠做为研究对象,首次对告达亭是否影响小鼠血清生化指标以及脏器毒理关系进行了研究,为临床合理用药提供理论依据.
1 材料与方法
1.1 药品与仪器
告达亭购于深圳美荷生物公司,戊巴比妥纳、苦味酸、乙二胺四乙酸(K2-EDTA)等为上海生工的进口分装试剂.所用仪器有五分类血液细胞分析仪BC-5500(Mindray 公司),倒置显微镜CX-41(Zeiss公司)等.
1.2 实验动物
SPF级6周龄雄性昆明鼠30只,健康状况良好,体质量为35~40 g,购自斯莱克景达实验动物中心.
1.3 动物分组及告达亭剂量
将30只雄性昆明鼠随机分为6组,每组5只,用全价颗粒饲料喂养,自由饮水,培养环境为SPF级动物房,室温:22~24 ℃,湿度:50%~64%.实验重复两次,每次15只小鼠,分3组.于每日上午8~9时分别以5和10 mg/kg及等容量溶剂腹腔注射,对照组所注射的溶剂为丙二醇和PEG400按照体积比1∶9 配制,再用水稀释至总体积占比20%,过滤灭菌.
1.4 观察指标
1.4.1 行为观察及体重检测 每天进行一般观察的项目,包括小鼠精神状态、行为活动、粪便性状、腺体分泌、皮肤被毛等.隔日称取体质量,进行监测.
1.4.2 血清生化指标的检测 末次给药24 h后,对小鼠腹腔注射1%戊巴比妥纳进行麻醉,所有小鼠均用眼眶下采血法收取血液,先取1.5 mL血液样本按照1∶100 的比例加入10% K2-EDTA 抗凝剂.取2 mL血液样本,自然凝固后,检测肌酐(CREA)、胆固醇(CHOL)、总蛋白(TP)、甘油三酯(TG)、尿酸(UA)等血清生化指标.检测血液学指标包括红细胞(RBC)、血红蛋白含量(HGB)、红细胞容积(HCT)、红细胞平均血红蛋白浓度(MCHC)、平均红细胞血红蛋白含量(MCH)、平均红细胞体积(MCV)、红细胞分布宽度标准差(RDW-SD)、红细胞分布宽度变异系数(RDW-CV)、白细胞数(WBC)、血小板压积(PCT)、血小板数(PLT)、血小板平均体积(MPV)、血小板分布宽度(PDW).
1.5 病理学检查
用颈椎拉断法处死小鼠后尸解,取出心、肝、肺、肾和睾丸5个脏器组织,首先经 Bouin氏液固定24 h,在自来水下流水冲洗10 min.用70%,80%,90%,95%,100%各级酒精梯度脱水,每级10~30 min.用二甲苯将材料进行透明,每次20~30 min,进行2次.浸蜡,包埋后保存.经切片、展片与贴片,脱蜡,染色,脱水,透明,封片,镜下观察并拍照[7-8].
2 结果
2.1 告达亭对雄性小鼠的影响
雄性昆明小鼠在给药前经SPF级动物房适应性饲养7 d,经为期14 d告达亭给药处理,每次给药后未见小鼠口、鼻、眼有异常分泌物.14 d 后所有小鼠行为活动正常,精神状态良好、毛发光润,未见粪便异常,无一例死亡.
2.2 告达亭对雄性小鼠体质量增长的影响
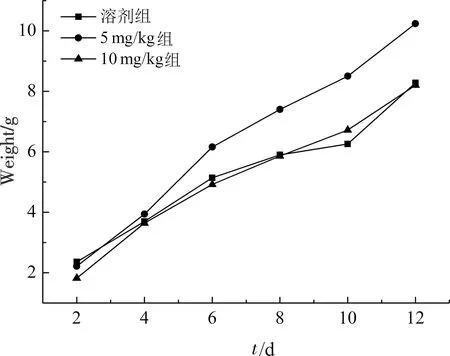
图2 告达亭对小鼠体质量增长变化图 Fig.2 Changes of body weight growth of mice under treatment of Caudatin
体质量增长的幅度可以反映动物机体发育是否正常,通常通过检测实验组和对照组动物的体质量变化,来观察是否存在药物毒性[9].正常情况下,6周龄小鼠的体质量会逐日增长,若小鼠患有某些疾病,则体质量增长会受到影响.每隔一天的相同时间为实验鼠称体质量,计算平均值.统计结果见图2,与溶剂对照组比较,5 mg/kg告达亭处理组体质量增长较快,10 mg/kg 告达亭剂量处理组的体质量增长速率基本一致,结果表明告达亭对小鼠的体质量无明显抑制作用.
2.3 告达亭对雄性小鼠血液学指标的影响
对雄性昆明小鼠连续腹腔注射给药14 d,末次给药24 h后,眼球取血检测各项血液学指标.血液中各种指标的增高或降低都与机体的健康状态息息相关,主要血液指标见表1.结果显示,低剂量组白细胞(WBC)计数与同期溶剂对照组比较略有降低,高剂量组WBC计数与对照组比较下降明显.白细胞的多少与身体免疫能力息息相关,可见告达亭在一定程度上降低了身体的免疫能力.其他组各项指标与同期溶剂对照组比较,中剂量组和高剂量组都没有显著性差异.统计结果如图3.

表1 雄性小鼠腹腔注射告达亭14 d后血液学指标的检测结果(x±s)
2.4 告达亭对雄性小鼠血清生化指标的影响
各组动物血清生化指标见表2,告达亭处理组与溶剂对照组比较,CREA(肌酐)、TP(总蛋白)和UA(尿酸)的检测结果均无明显影响.TG(甘油三酯)和CHOL(胆固醇)在告达亭低浓度组略有升高,在高浓度组又下降.统计结果见图4.

表2 雄性小鼠腹腔注射告达亭14 d后血清生化指标的检测结果(x±s)
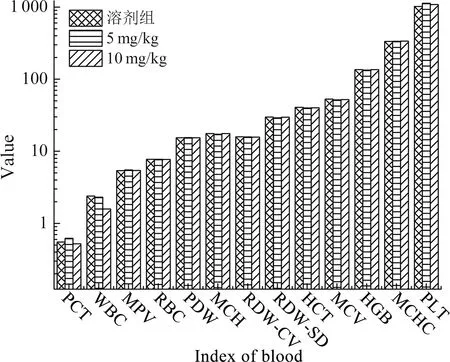
图3 告达亭对雄性小鼠血液生化指标的影响Fig.3 Effect of Caudatin on blood biochemical indexes of male mice
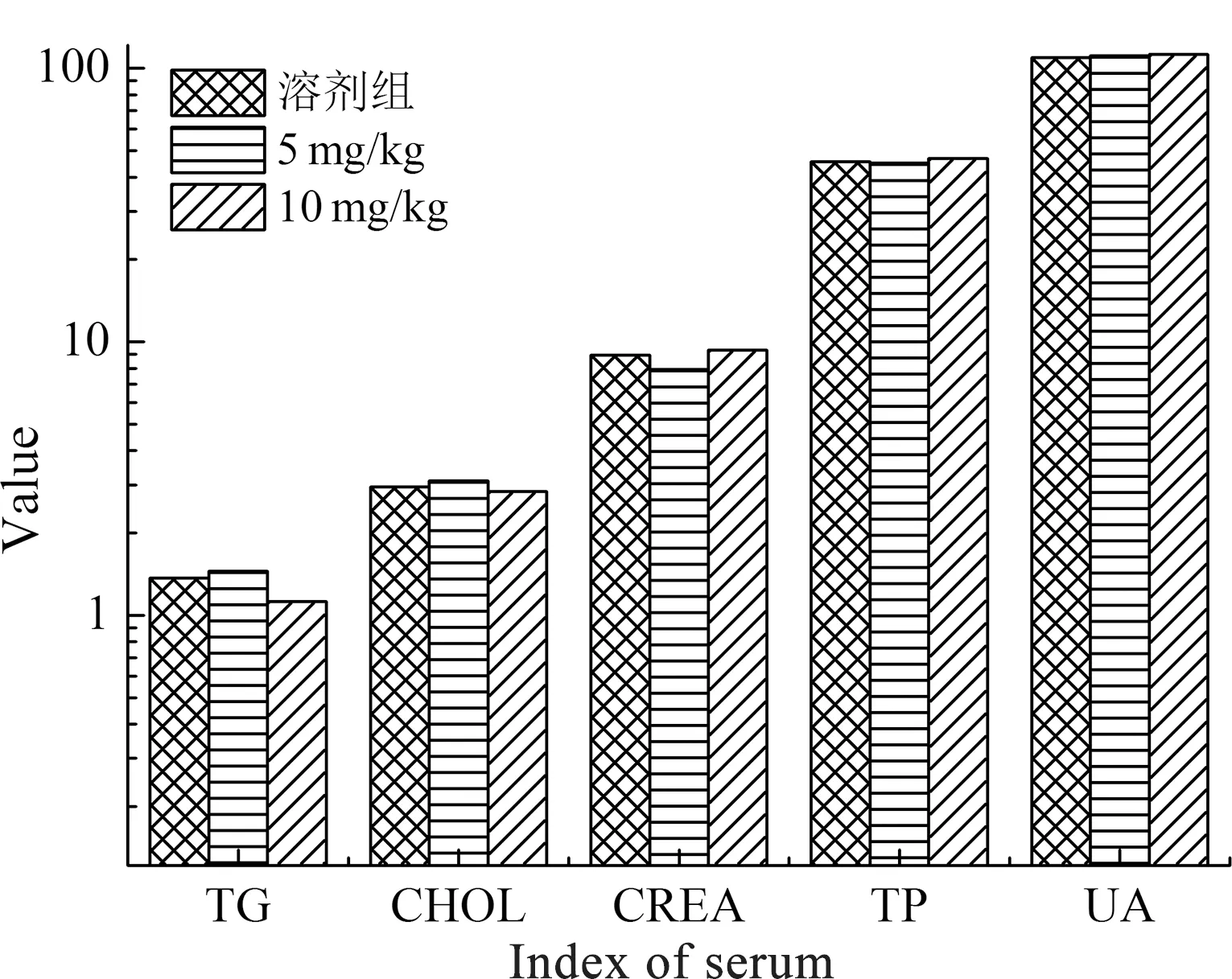
图4 告达亭对小鼠血清生化指标的影响Fig.4 Effect of Caudatin on serum biochemical indexes in mice

图5 雄性小鼠腹腔注射14 d后组织HE染色结果(200×)Fig.5 The results of HE staining after intraperitoneal injection of Caudatin for 14 days in male mice(200×)
2.5 告达亭不影响雄性小鼠组织器官的发育
采取常规脱颈椎法处死实验鼠,解剖并仔细观察各主要脏器,未见脏器萎缩、坏死等异常现象.采用常规石蜡切片,然后对各组织伊红染色,苏木精复染,树胶封片,镜检.结果如图5所示.肺、睾丸、肾脏、心脏和肝脏组织中均未发现病灶情况.各组肺部结构清晰,细胞核质分布明显;睾丸是机体的生殖和内分泌器官,对照组以及5和10 mg/kg告达亭剂量处理组中小鼠睾丸的结构正常.曲细精管管腔内细胞层数未见减少,各级生精细胞排列规则、层数多,曲细精管管腔内充满较多精子,间质细胞成群分布;与对照组比较,5和10 mg/kg告达亭剂量处理组肾脏组织结构完整,肾小球和肾小管轮廓清晰,未见异常现象;心脏为循环系统中一个主要的器官,心内膜切片结果显示,与对照组比较,内皮下层的结缔组织较为致密,无结构异常.告达亭剂量组与溶剂对照组相比,肝组织结构完好,可见肝小叶和汇管区,无异常变化.
3 讨论
药物研发环节中需要进行毒理学研究,淘汰因毒性问题不适宜进一步研发的中药或合成化合物,有助于降低投资风险、提高研发成功率.耳叶牛皮消分布广泛,药用块根具有养阴清热、止咳、抗炎等功效.但它因为含耳叶牛皮消根萝蘑毒素(cynanchotoxin),食用后出现的中毒症状有流涎、呕吐、痉挛、呼吸困难、心跳缓慢等.告达亭是从耳叶牛皮消中提取出的一种C21甾体化合物,初步药效学证实它可以抑制肿瘤细胞增殖,诱导凋亡,具有良好的应用前景[10].告达亭作为耳叶牛皮消的一种衍生物,其一般毒性、毒性作用靶器官、毒性作用机制均未开展系统研究.
六周龄雄性小鼠购买后,经适应性饲养7 d,称取体质量,发现差别不大.随机将小鼠分成3组, 14 d连续小鼠尾静脉注射告达亭,注射剂量分别按0,5和10 mg/kg.14天后观察,3组动物全部存活,精神和运动未见异常;对照组与高剂量告达亭实验组小鼠平均体质量增长无明显差异,表明此浓度范围内的告达亭对体质量增长无抑制作用;低剂量告达亭实验组与对照组比较平均体质量有小幅增加,说明低剂量告达亭可以促进消化和吸收食物,有利于体质量增长.血液学检查RBC,HGB,HCT和RDW等发现,与同期溶剂对照组比较,低剂量组和高剂量组都没有显著性差异,变化在正常参考值范围内.低剂量组WBC计数与对照组比较略有降低,但在正常参考值范围内,而告达亭高剂量组WBC计数与同期溶剂对照组比较有显著性降低.白细胞减少与感染、毒素或药物引发有关.告达亭是否会引起白细胞持续下降,是否引起动物乏力、食欲减退,毒性程度是否严重,将通过延长给药时间、增加给药剂量等实验来证明.血浆生化指标检查发现,和肝功能代谢能力相关的TP,与肾功能相关的CREA和UA,以及血脂分析的常规项目TG和CHOL均未见明显改变.进一步观察HE染色的组织切片发现各组器官均正常.高剂量组和低剂量组告达亭处理后的小鼠肝小叶结构清晰,肝细胞索和肝血窦均没有变形,大小比例正常.告达亭处理组的肾小球剖面界限清晰,肾小管和间质未见明显异常.近年来研究发现,生殖细胞对药物更敏感,抗肿瘤药物有效杀死肿瘤细胞的同时,往往引起生精细胞的大量凋亡,甚至男性生精功能急剧下降,从而导致不育.两组告达亭处理组的睾丸曲细精管形状正常,每一个曲细精管内均见多层细胞,生精细胞与支持细胞数目丰富,管腔从外向内有各级生精细胞排列规则,最内层精子形态和数量正常.药物组未见小鼠心肌萎缩、心肌断裂、心肌出血,心肌细胞核完整.两组告达亭处理组的肺组织是正常网状结构,苏木精复染后,细胞核清晰可见,胞核与胞浆对比鲜明,从组织形态未看出病变.综上实验结果说明,一定浓度的告达亭对小鼠血液系统以及肝、肾、睾丸、心和肺等重要器官的毒性作用很小.
在药物的毒性反应中还须考虑神经毒性.药物产生的神经毒性会引起神经系统的不良反应,有可能造成包括药物成瘾在内的诸多不良后果.据统计,大约有10%的新药因为神经系统不良反应而不能面市[11-13].因此下一步将着重研究告达亭是否会产生神经毒性,并研究告达亭对雌性小鼠有无生殖毒性.另外,遗传毒理学也是目前新兴的一项毒理实验研究学,笔者想从中药抗诱变性的角度研究告达亭是否起中药抗诱变性作用,能否与其他成熟的化疗药物配合使用,降低化疗药物的剂量,达到更好的治疗效果.
[1] 费洪荣, 王桂玲, 赵 莹, 等. 告达亭增强TRAIL诱导的HepG2细胞凋亡[J]. 中国病理生理杂志, 2015,31(2):279-283.
[2] 赵 鑫,陈 梅,彭蕴茹,等.多指标正交试验优化白首乌C21甾总苷的醋酸水解条件[J]. 中国中药杂志, 2011,36(5):569-572.
[3] FEI H R, CUI L Y, ZHANG Z R,etal. Caudatin inhibits carcinomic human alveolar basal epithelial cell growth and angiogenesis through modulating GSK3β/β-catenin pathway[J]. J Cell Biochem, 2012,113(11):3403-3410.
[4] FEI H R, CHEN H L, XIAO T,etal. Caudatin induces cell cycle arrest and caspase-dependent apoptosis in HepG2 cell [J]. Mol Biol Rep, 2012,39(1):131-138.
[5] 费洪荣, 肖 婷, 陈 庚, 等. 告达亭对人胃癌细胞株SGC-7901细胞增殖和凋亡的调节作用[J]. 中国药理学通报, 2010,26(10):1330-1333.
[6] LI X F, ZHANG X T, LIU X Z,etal. Caudatin induces cell apoptosis in gastric cancer cells through modulation of Wnt/β-catenin signaling[J]. Oncolog Rep, 2013,30(10):677-684.
[7] 王 巧. HE染色方法在临床病理诊断中的应用[J]. 临床合理用药, 2014,11(7):118-119.
[8] 何书海, 陈宏智. 一种快捷安全的动物病理组织石蜡切片制作技术[J]. 中国兽医杂志, 2012,48(1):15-16.
[9] 孙宇立, 董 铖, 洪新宇, 等. 4种急性经口毒性试验方法的比较研究[J]. 环境与职业医学, 2015,32(6):539-543.
[10] TAN Z W, XIE S, HU S Y,etal. Caudatin targets TNFAIP1/NF-κB and cytochrome c/caspase signaling to suppress tumor progression in human uterine cancer[J]. Int J Oncolog, 2016,49(4):1638-165.
[11] REDFERN W S, STANG I, STOREY S,etal. ICHS7A requirements for core battery studies on nervous system function:a critical view[J]. Acta Pharmacol Sin, 2006,27(1):450.
[12] 赵军宁, 鄢良春, 宋 军.建立以“功效”为核心的新型中药质量评价模式[J].中药药理与临床, 2010,26(5):158-161.
[13] 肖小河, 金 城, 鄢 丹, 等. 中药大质量观及实践[J]. 中草药, 2010,41(4):505-508.
(编辑 WJ)
Study on the Early Toxicity and Mechanism for Antitumor Compound Caudatin
TANGHong-yan1,HUSi-yang1,3,ZHANGJia-wen1,SHIJia-yu1,WUXiao-yu1,ZHANGShan1,ZHANGXiao-han1,PENGKe-hong2*,ZHOUChang1*
(1.The National and Local Joint Engineering Laboratory of Animal Peptide Drug Development,College of Life Science, Hunan Normal University, Changsha 410081, China;2.Department of Gynecological Oncology, Hunan Cancer Hospital, Changsha 410013, China;3.The High School Attached to HNU-Meixihu High School, Changsha 410205, China)
To examine the toxic effect of Caudatin on male Kunming mice, using Caudatin concentrations of 5 mg/kg, 10 mg/kg and the vehicle control group of SPF grade Kunming mice by intraperitoneal injection method, we conducted the toxicological study for a period of 14 days. These 30 Kunming mice were randomly divided into six groups, within two sub-experiments. We found that the results from these two sub-experiments are consistent with each other. There was no significant change in body weight and hematological parameters. We observed no markedly pathological change in the tissue of heart, liver, lung, kidney and testis of 30 Kunming mice after the treatment of different concentrations of Caudatin for 14 days.
Caudatin; chronic toxicity test; biochemical analysis of blood components
2016-08-07
湖南省科技计划资助项目(2013FJ3147);湖南省研究生科研创新资助项目(CX2017B232);湖南师范大学本科生创新性实验资助项目(2016086);湖南师范大学教学改革研究资助项目(201467)
10.7612/j.issn.1000-2537.2017.03.006
R99
A
1000-2537(2017)03-0032-05
*通讯作者,E-mail:zhouchang1972@126.com;pengkehong@hnszlyy.com

