抗体类药物在非小细胞肺癌中的临床评价进展
郭青松,李纲,沈毅珺
抗体类药物在非小细胞肺癌中的临床评价进展
郭青松,李纲,沈毅珺
肺癌在我国恶性肿瘤发病率及死亡率均位于第 1 位[1],其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)占肺癌总数的 80% ~ 85%[2]。NSCLC 包括腺癌、鳞癌、大细胞癌三类,与其他恶性肿瘤相比,大部分肺癌患者确诊时已经失去了手术的机会,以药物治疗为主的全身姑息治疗是目前肺癌治疗的重要手段。近 10 年来,随着靶向治疗特别是免疫治疗的兴起,抗体类药物在治疗 NSCLC 上取得巨大成功,贝伐单抗和派姆单抗更是获得 FDA 批准用于一线治疗非小细胞肺癌。作为一名从事生物大分子药物开发的专业研究人员,作者就已上市的相关抗体类药物(表 1)在NSCLC 中的临床研究作简要概述。
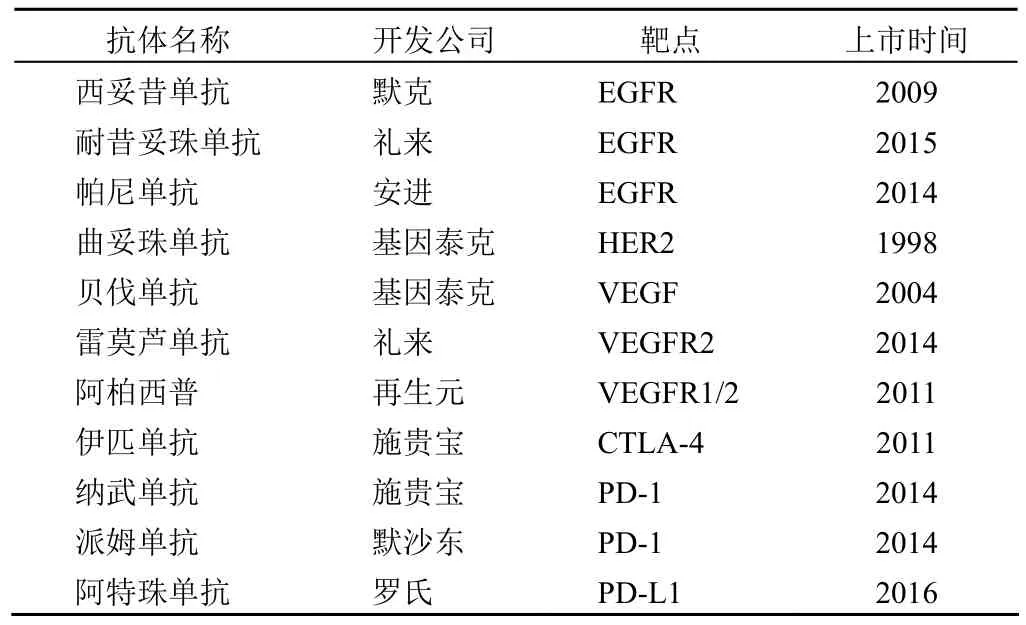
表 1 在 NSCLC 中开展临床研究的上市抗体类药物或融合蛋白
1 阻断 EGFR 家族的抗体
EGFR 属于 ErbB 受体家族成员,该家族包括 EGFR(HER1)、HER2、HER3 以及 HER4,有 45% ~ 70% 的肺癌患者高表达 EGFR,高表达的 EGFR 对 NSCLC 靶向治疗具有指导性,已有相关靶向 EGFR 家族的抗体应用在NSCLC 的临床中。
1.1 西妥昔单抗
西妥昔单抗(cetuximab)是由默克公司开发的 IgG1 型人/鼠嵌合抗体,是 FDA 批准的第一个 EGFR抗体药物。西妥昔单抗在 NSCLC 治疗中一般与化疗同时使用或化疗后作为单药继续使用,初始剂量为 400 mg/m2,后每周静脉输注 250 mg/m2,直至疾病进展。随机对照 II 期临床试验针对 EGFR 阳性表达的 NSCLC 观察顺铂和长春瑞滨(NP 方案)联合西妥昔单抗一线治疗的效果,与 NP 方案单纯化疗相比,联合治疗其客观缓解率(objective response rate,ORR)高(35% vs 28%),中位无进展生存期(progression-free-survival,PFS)长(5.0 个月 vs 4.6 个月),两年生存率较高(16% vs 0%),且耐受较好[3]。非小细胞肺癌 III 期临床试验结果显示,NP 方案联合西妥昔单抗可显著延长总生存期(overall survival,OS)1.2 个月,死亡风险下降 13%,且安全性较好,其主要不良事件(adverse event,AE)为痤疮样皮疹[4]。在我国开展的西妥昔单抗联合吉西他滨和顺铂(GP 方案)治疗晚期 NSCLC 的临床研究中,联合组 PFS 较对照组显著延长(5.5 个月 vs 4.1 个月,P < 0.01)[5]。Pujol 等[6]通过 Meta 分析四项关于西妥昔单抗联合含铂化疗一线治疗 NSCLC 的临床试验,结果表明不管采用哪种含铂双药化疗方案,也不论何种病理亚型的 NSCLC,西妥昔单抗加入一线化疗后在 OS、PFS、ORR方面均优于单纯化疗。另外,西妥昔单抗在 NSCLC 二线治疗中也获得了不少研究进展,阿法替尼联合西妥昔单抗对EGFR-T790M 突变所致继发性耐药的 NSCLC 的临床结果显示,联合使用可使患者的生存显著获益,其 ORR 为32%,PFS 可达 4.7 个月,且 AE 较少[7]。
1.2 其他 EGFR 抗体
耐昔妥珠单抗(necitumumab)是由礼来公司开发的全人源抗 EGFR 的 IgG1 型抗体。对耐昔妥珠单抗治疗NSCLC 目前开展了两项 III 期临床试验,其中一项SQUIRE 试验在鳞状 NSCLC 患者中开展,另一项INSPIRE 试验在非鳞状 NSCLC 患者中开展。在 SQUIRE试验中,耐昔妥珠单抗与吉西他滨和顺铂联合用于晚期鳞状NSCLC 的治疗,并与单一化疗进行对比,在 EGFR 阳性患者中,联合治疗可显著延长患者 OS(11.7 个月 vs 10 个月,P = 0.002)[8]。而在 INSPIRE 非鳞状 NSCLC 试验中,由于耐昔妥珠单抗治疗组中有一些患者出现了血栓栓塞[9],已于 2011 年初被迫中止。基于此,FDA 于 2015 年批准耐昔妥珠单抗用于治疗鳞状 NSCLC。
帕尼单抗(panitumumab)是由安进公司开发的靶向EGFR 的全人源 IgG2 型抗体,2014 年 FDA 批准其一线治疗野生型 KRAS 转移性结直肠癌。临床选择既往未治疗过的 IIIB 或 IV 期 NSCLC 患者,比较卡铂(AUC = 6,每 3 周)+ 紫杉醇(200 mg/m2,3 周一次)联合或不联合帕尼单抗(2.5 mg/m2,每周一次)化疗的疗效及其安全性。研究结果显示,单纯化疗组与帕尼单抗联合组之间在 PFS(5.3 个月 vs 4.2个月,P = 0.55)和 OS(8.0 个月 vs 8.5个月,P = 0.81)上均无显著差异,提示帕尼单抗联合一线化疗方案可能对晚期 NSCLC 无明显疗效[10]。
1.3 曲妥珠单抗
曲妥珠单抗(trastuzumab)是由基因泰克公司开发的一种人源化抗 HER2 的 IgG1 型抗体。HER2 属于 EGFR家族成员,并在多种恶性肿瘤中过表达,虽然曲妥珠单抗在乳腺癌中对于 HER2 阳性的患者有效,但是这并不适用于肺癌。曲妥珠单抗联合一线化疗方案用以治疗 IIB/III 期HER2 阳性的 NSCLC 患者的两项随机 II 期临床试验,其结果均显示,联合曲妥珠单抗并不能提高化疗的疗效,也不加重化疗的不良反应。但在试验中,HER2 强表达(+++)的患者对曲妥珠单抗治疗的反应较好,提示曲妥珠单抗对这一较少见类型的 NSCLC 有效[11]。
2 抑制血管生成的抗体或融合蛋白
肿瘤的生长与存活依赖于生成的血管为其提供氧气和营养物质,内皮血管生长因子(vascular endothelial growth factor,VEGF)是迄今被认为最重要的血管生成因子,具有促进血管内皮细胞增殖和体内新生血管的形成,通过与受体VEGFR 结合从而实现其生物学功能[12],因此阻断VEGF/VEGFR 通路,成为 NSCLC 的热门治疗靶点。
2.1 贝伐单抗
贝伐单抗(bevacizumab)是由基因泰克公司开发的一种人源化抗 VEGF 的 IgG1 型抗体,是第一个获得 FDA批准的抗新生血管生成的抗体药物,可显著抑制 VEGF 促进血管生成的活性[13],主要用于一线治疗转移性结直肠癌、转移性肾细胞癌、二线治疗脑胶质瘤、晚期子宫颈癌、铂耐药复发性卵巢癌、转移性 HER2 阴性乳腺癌以及一线治疗 NSCLC。2010 年 2 月,贝伐单抗获得国家食品药品监督管理总局(CFDA)批准,用于转移性结直肠癌的治疗,2015 年 7 月获得批准用于治疗 NSCLC。
E4599 是一项开放、随机、阳性对照的多中心临床试验,评价贝伐单抗一线治疗局部晚期、转移性或复发性非鳞状 NSCLC 患者的有效性和安全性[14]。878 例患者随机接受以铂类为基础的化疗(紫杉醇和卡铂,CP 方案),或CP 方案与贝伐单抗 15 mg/kg 剂量联合,主要终点指标为OS,结果显示联合组的 OS与 CP 方案相比延长了 2 个月,大幅提高了传统 NSCLC 一线化疗的疗效,是治疗NSCLC 的重要里程碑。AVAIL 是一项随机、双盲的 III 期临床研究,比较了两个不同剂量的贝伐单抗(7.5 mg/kg 和15 mg/kg)联合吉西他滨/顺铂(GC 方案)与单纯 GC 化疗治疗既往未接受化疗的局部晚期、转移性或复发性非鳞状NSCLC 患者[15]。主要终点指标是 PFS,次要终点指标包括ORR 和 OS,研究结果显示联合贝伐单抗能明显延长 PFS,但在改善 ORR 和 OS 方面并没有获得显著差异,因此许多国家并未批准该药在 NSCLC 的一线应用。
2.2 雷莫芦单抗
雷莫芦单抗(ramucirumab)是由礼来公司开发的一种全人源抗 VEGFR2 的 IgG1 型抗体,可特异性地与VEGFR2 结合阻断受体活化。基于一项大型的国际多中心的 III 期临床 NCT01168973 研究结果,2014 年 12 月雷莫芦单抗被批准用于治疗转移性 NSCLC。该项研究纳入了26 个国家共 1253 例 NSCLC 患者,对比雷莫芦单抗联合多西他赛和安慰剂用于治疗经铂类化疗后发生疾病局部进展或远处转移的 NSCLC 患者的疗效[16]。结果显示,雷莫芦单抗组中位 OS 和 PFS 均显著优于安慰剂组,中位 OS分别为 10.5 个月和 9.1 个月(P = 0.0235),中位 PFS 分别为 4.5 个月和 3.0 个月(P < 0.0001),且雷莫芦单抗组的治疗总体反应率较高(23% vs 14%,P < 0.0001)。安全性方面,雷莫芦单抗组较安慰剂组最常见的 3 级以上 AE 主要包括中性粒细胞下降(48.8% vs 39.8%)、粒缺性发热(15.9% vs 10.0%)、乏力(14.0% vs 10.5%)、白细胞下降(13.7% vs 12.5%)和高血压(5.6% vs 2.1%),5 级 AE 事件相似(5.4% vs 5.8%)。雷莫芦单抗组的患者较安慰剂组出现更多流血/出血事件(28.9% vs 15.2%),但 3 级以上此类事件的发生率类似(2.4% vs 2.3%)。
2.3 阿柏西普
阿柏西普(aflibercept)是由再生元公司开发的 VEGFR融合蛋白,是将 VEGFR1 的第 2 个 IgG 结构域与VEGFR2 的第 3 个 IgG 结构域融合后再与人 IgG1 的Fc 段融合而成,目前已被批准治疗湿性黄斑(AMD)和结直肠癌。在一项阿柏西普联合顺铂和培美曲塞治疗晚期NSCLC 的 II 期临床研究中,由于出现 5 例可逆性后部脑白质脑病综合征而被停止继续试验[17]。在另一项阿柏西普联合多西他赛治疗经铂类治疗产生耐药的晚期 NSCLC的 III 期临床研究 NCT00532155 中,结果显示与安慰剂相比,虽然 PFS 和 ORR 有显著提高,但 OS 并没有改善(10.1 个月 vs 10.4 个月),且联合阿柏西普后的毒性增加,因此目前阿柏西普未被批准用于 NSCLC 的治疗[18]。
3 免疫治疗抗体药物
癌症免疫治疗是指通过活化 T 细胞功能综合提升人体固有的免疫力,增强对癌细胞杀灭的治疗方法,其中抑制免疫检查点通路被认为是最有前景的治疗方式之一。目前FDA 批准了阻断 CTLA-4 通路以及阻断 PD-1 通路共4 个免疫检查点抗体药物上市,以下简要介绍这 4 个抗体在 NSCLC 治疗中的临床评价进展。
3.1 伊匹单抗
CTLA-4 是一种跨膜蛋白,其配体为 CD80 和 CD86,CTLA-4 通过与其配体结合可抑制 T 细胞功能发挥肿瘤免疫抑制作用[19]。由施贵宝公司开发的全人源化抗 CTLA-4抗体伊匹单抗(ipilimumab)作为首个治疗恶性黑色素瘤免疫药物于 2011 年被批准上市。在 NSCLC、小细胞肺癌中伊匹单抗也有相关临床开展,一项随机 II 期临床研究在NSCLC 患者中将伊匹单抗与 PC 方案化疗联合,其首要终点为免疫相关 PFS(ir-PFS),用特异性的免疫相关反应评价标准(ir-RC 和 RECIST 标准或 WHO 疗效标准)评估疗效[20]。治疗方式包括伊匹单抗与化疗同步(同步治疗组)和化疗后伊匹单抗治疗(分阶段组)两种,与单纯化疗加安慰剂作对照相比,在分阶段治疗组,伊匹单抗显著提高ir-PFS(5.7 个月 vs 4.6 个月)和 PFS(5.1 个月 vs 4.2 个月),值得注意的是,鳞癌患者更易受益(HR:0.55,95% CI:0.27 ~ 1.12),但其临床 3/4 AE 事件发生率也较高(15% vs 6%),并有两例患者死亡[21]。
3.2 纳武单抗
PD-1 属于免疫球蛋白超家族成员,其配体 PD-L1 广泛表达于多种肿瘤细胞上,当 PD-1 受体与配体结合可抑制 T 细胞功能,因此阻断 PD-1/PD-L1 信号通路可以恢复T 细胞功能,介导肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)对肿瘤的杀伤[22]。由施贵宝公司开发的纳武单抗(nivolumab)是全球第一个上市的抗 PD-1 抗体,目前已有黑色素瘤、非小细胞肺癌、肾细胞癌、头颈部癌和淋巴瘤等多个适应证获得 FDA 批准。其中纳武单抗联合伊匹单抗已获批一线治疗黑色素瘤,但在 NSCLC 中目前只批准其二线治疗。基于前期临床研究在治疗 NSCLC 中选择每两周给药 3 mg/kg 作为标准剂量,两项 III 期临床CheckMate 017[23]和 CheckMate 057[24]分别评估纳武单抗在晚期鳞状和非鳞状 NSCLC 的疗效和安全性并与多西他赛作对照。在鳞状和非鳞状 NSCLC 中,其 OS 分别为 9.2 个月和 12.2 个月,一年生存率分别为 42% 和 51%,其 ORR分别为 20% 和 19%,均优于多西他赛治疗组。纳武单抗治疗 NSCLC 其安全性较好,主要 AE 事件包括:皮炎、胃肠道反应、肺炎。药物相关的肺炎发生率为 6%,3/4 级肺炎发生率为 2%,试验早期有 2 例患者因肺炎死亡,因此临床试验早期干预值得研究者重视。
2016 年 ESMO 会议上,施贵宝公布了纳武单抗单药一线治疗 NSCLC 的 III 期临床 CheckMate 026 试验结果,该项临床以 PD-L1 阳性(PD-L1 > 1%)表达的 NSCLC患者为研究对象,主要终点为 PFS。与铂类标准疗法相比其中位 PFS 分别为 4.2 个月和 5.9 个月,OS 分别为14.4 个月和 13.2 个月,结果并未延长 PFS,表明纳武单抗冲击一线治疗 NSCLC 失败。而纳武单抗联合铂类双药化疗一线治疗晚期 NSCLC 疗效显著,尤其是 5 mg/kg 的纳武单抗联合紫杉醇-卡铂治疗组,其两年 OS 率为 62%,24 周无进展生存率达到 51%[25];在另一项纳武单抗联合伊匹单抗一线治疗 NSCLC 的 I 期临床 CheckMate-012 结果显示,每两周 3 mg/kg 的纳武单抗联合每 12 周 1 mg/kg的伊匹单抗与联合每 6 周 1 mg/kg 的伊匹单抗相比,中位随访时间分别为 12.8 个月和 11.8 个月,其 ORR 分别为47% 和 39%,治疗相关的 3/4 级 AE 发生率分别为 37%和 33%,显示出较好的耐受[26]。目前针对处于先前接受治疗发生疾病进展处于 IIIB/IV 期的 NSCLC 的临床NCT02066636 正在进行中,预计 2019 年完成;另外针对NSCLC 患者 EGFR-T790M 阴性突变的 II 期临床NCT02864251 也正在开展中。
3.3 派姆单抗
派姆单抗(pembrolizumab)是由默沙东公司开发的抗PD-1 的 IgG4 型抗体,基于该药对 EGFR 阴性、ALK 阴性和应用铂类化疗后发生疾病进展的 NSCLC 患者有效,2015 年被 FDA 授予“突破性治疗”称号。派姆单抗在与纳武单抗竞争冲击一线治疗 NSCLC 的 III 期临床试验KEYNOTE-024 大获成功,该项临床旨在比较派姆单抗单一治疗与铂类双药化疗作为一线治疗 PD-L1 阳性转移性NSCLC 患者的疗效,其首要终点为 PFS,次要终点为 OS、ORR 和安全性,与纳武单抗不同的是派姆单抗的 PD-L1阳性标准为 PD-L1 > 50%。临床结果显示派姆单抗相比铂类双药化疗显著延长 PFS(10.3 个月 vs 6.0 个月,P <0.001),次要终点 OS 同样明显提升,派姆单抗组患者第6 个月时的生存率达到 80.2%,而化疗组为 72.4%。此外,与化疗相比,派姆单抗治疗组拥有更高的 ORR(44.8% vs 27.8%),更长的持续缓解时间,且 3 级或 3 级以上的 AE发生率更低(26.6% vs 53.3%)[27]。基于此,2016 年派姆单抗已获批一线治疗具有 PD-L1 高表达(> 50%)、无EGFR 以及 ALK 突变的转移性 NSCLC 的患者。另外,派姆单抗联合化疗(培美曲赛 + 卡铂)一线治疗转移性或晚期非鳞状 NSCLC 患者的 II 期临床试验 KEYNOTE-021结果表明,联合组相比化疗组其 ORR 较高(55% vs 29%),可显著延长 PFS(13 个月 vs 8.9 个月),6 个月 PFS 的患者比例更大(77% vs 63%);安全性方面,派姆单抗组 3 级以上 AE 较高(39% vs 26%),但因为不良事件停药和相关死亡的比例并没有增加[28]。
3.4 阿特珠单抗
阿特珠单抗(atezolizumab)是由罗氏公司开发的第一个靶向 PD-L1 的抗体,2016 年 5 月获批治疗晚期或转移性上皮膀胱癌,2016 年 10 月获批治疗经铂化疗后发生疾病进展的 NSCLC。2016 年 3 月治疗 NSCLC 的 II 期POPLAR 临床结果公布[29],与纳武单抗和派姆单抗不同的是:阿特珠单抗不仅分析肿瘤 PD-L1 的表达水平,同时也分析 TIL 的 PD-L1 表达水平,并根据 PD-L1 在肿瘤组织和 TIL 的水平将肿瘤患者分为高、中、低以及不表达四种类型。临床结果显示与多西他赛相比,每三周给药 1200 mg的阿特珠单抗可显著增加 NSCLC 患者的 OS(12.6 个月vs 9.7 个月),且生存的改善与肿瘤组织中 PD-L1 表达水平以及 TIL 的 PD-L1 表达水平有关,PD-L1 高表达的患者从阿特珠单抗中获益更多;在安全性方面,阿特珠单抗相比多西他赛发生 3/4 级 AE 比例更低(11% vs 39%),显示出较好的耐受。
4 小结
随着贝伐单抗和派姆单抗获批一线治疗 NSCLC,单纯化疗已不再是一线治疗的唯一选择,抗体药物与传统化疗或者靶向治疗的联合使用将更加丰富 NSCLC 的治疗策略,特别是抗体药物免疫治疗的兴起,为 NSCLC 的治疗打开新的思路。但同时抗体药物也面临着单药治疗反应率低、联合治疗 AE 发生率较高等诸多临床问题,如何选择合适的标志物进一步提高疗效,如何联合用药提高疗效的同时降低AE 的发生,如何选择优势群体以及扩宽治疗人群等都需要更深一步的前瞻性研究。
[1] Chen WQ, Zhang SW, Zeng HM, et al. Report of cancer incidence and mortality in China, 2010. China Cancer, 2014, 23(1):1-10. (in Chinese)陈万青, 张思维, 曾红梅, 等. 中国 2010年恶性肿瘤发病与死亡.中国肿瘤, 2014, 23(1):1-10.
[2] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int J Cancer, 2010, 127(12):2893-2917.
[3] Rosell R, Robinet G, Szczesna A, et al. Randomized phase II study of cetuximab plus cisplatin/vinorelbine compared with cisplatin/vinorelbine alone as first-line therapy in EGFR-expressing advanced non-small-cell lung cancer. Ann Oncol, 2008, 19(2):362-369.
[4] Pirker R, Pereira JR, Szczesna A, et al. Cetuximab plus chemotherapy in patients with advanced non-small-cell lung cancer (FLEX): an open-label randomised phase III trial. Lancet, 2009, 373(9674):1525-1531.
[5] Miao JH, Zhong J, Guo XD, et al. Clinical observation of cetuximab combined with gemcitabine and cisplatin for advanced non-small-cell lung cancer. J Clin Med in Pract, 2012, 16(3):90-92. (in Chinese)缪建华, 钟皎, 过雪丹, 等. 西妥昔单抗联合 GP方案治疗晚期非小细胞肺癌临床观察. 实用临床医药杂志, 2012, 16(3):90-92.
[6] Pujol JL, Pirker R, Lynch TJ, et al. Meta-analysis of individual patient data from randomized trials of chemotherapy plus cetuximab as first-line treatment for advanced non-small cell lung cancer. Lung Cancer, 2014, 83(2):211-218.
[7] Janjigian YY, Smit EF, Groen HJM, et al. Dual inhibition of EGFR with afatinib and cetuximab in kinase inhibitor-resistant EGFR-mutant lung cancer with and without T790M mutations. Cancer Discov, 2014, 4(9):1036-1045.
[8] Paz-Ares L, Socinski MA, Shahidi J, et al. Correlation of EGFR-expression with safety and efficacy outcomes in SQUIRE: a randomized, multicenter, open-label, phase III study of gemcitabine-cisplatin plus necitumumab versus gemcitabine-cisplatin alone in the first-line treatment of patients with stage IV squamous non-small-cell lung cancer. Ann Oncol, 2016, 27(8):1573-1579.
[9] Paz-Ares L, Mezger J, Ciuleanu TE, et al. Necitumumab plus pemetrexed and cisplatin as first-line therapy in patients with stage IV non-squamous non-small-cell lung cancer (INSPIRE): an open-label, randomised, controlled phase 3 study. Lancet Oncol, 2015, 16(3):328-337.
[10] Socinski MA. Antibodies to the epidermal growth factor receptor in non small cell lung cancer: current status of matuzumab and panitumumab. Clin Cancer Res, 2007, 13(15 Pt 2):s4597-s4601.
[11] Spicer J, Harper P. Targeted therapies for non-small cell lung cancer. Int J Clin Pract, 2005, 29(9):1055-1062.
[12] Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med, 2003, 9(6):669-676.
[13] Wang Y, Fei D, Vanderlaan M, et al. Biological activity of bevacizumab, a humanized anti-VEGF antibody in vitro. Angiogenesis, 2004, 7(4):335-345.
[14] Sandler A, Gray R, Perry MC, et al. Paclitaxel-carboplatin alone or with bevacizumab for non-small-cell lung cancer. N Engl J Med, 2006, 355(24):2542-2550.
[15] Reck M, von Pawel J, Zatloukal P, et al. Overall survival with cisplatin-gemcitabine and bevacizumab or placebo as first-line therapy for nonsquamous non-small-cell lung cancer: results from a randomised phase III trial (AVAiL). Ann Oncol, 2010, 21(9):1804-1809.
[16] Garon EB, Ciuleanu TE, Arrieta O, et al. Ramucirumab plus docetaxel versus placebo plus docetaxel for second-line treatment of stage IV non-small-cell lung cancer after disease progression on platinum-based therapy (REVEL): a multicentre, double-blind, randomised phase 3 trial. Lancet, 2014, 384(9944):665-673.
[17] Chen H, Modiano MR, Neal JW, et al. A phase II multicentre study of ziv-aflibercept in combination with cisplatin and pemetrexed in patients with previously untreated advanced/metastatic non-squamous non-small cell lung cancer. Br J Cancer, 2014, 110(3):602-608.
[18] Ramlau R, Gorbunova V, Ciuleanu TE, et al. Aflibercept and docetaxel versus docetaxel alone after platinum failure in patients with advanced or metastatic non-small-cell lung cancer: a randomized, controlled phase III trial. J Clin Oncol, 2012, 30(29):3640-3647.
[19] Srivastava N, McDermott D. Update on benefit of immunotherapy and targeted therapy in melanoma: the changing landscape. Cancer Manag Res, 2014, 6:279-289.
[20] Genova C, Rijavec E, Barletta G, et al. Ipilimumab (MDX-010) in the treatment of non-small cell lung cancer. Expert Opin Biol Ther, 2012, 12(7):939-948.
[21] Lynch TJ, Bondarenko I, Luft A, et al. Ipilimumab in combination with paclitaxel and carboplatin as first-line treatment in stage IIIB/IV non-small-cell lung cancer: results from a randomized, double-blind, multicenter phase II study. J Clin Oncol, 2012, 30(17):2046-2054.
[22] Chen DS, Irving BA, Hodi FS. Molecular pathways: next-generation immunotherapy--inhibiting programmed death-ligand 1 and programmed death-1. Clin Cancer Res, 2012, 18(24):6580-6587.
[23] Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer. N Engl J Med, 2015, 373(2):123-135.
[24] Borghaei H, Paz-Ares L, Horn L, et al. Nivolumab versus docetaxel in advanced nonsquamous non-small-cell lung cancer. N Engl J Med, 2015, 373(17):1627-1639.
[25] Rizvi NA, Hellmann MD, Brahmer JR, et al. Nivolumab in combination with platinum-based doublet chemotherapy for first-line treatment of advanced non-small-cell lung cancer. J Clin Oncol, 2016, 34(25):2969-2979.
[26] Hellmann MD, Rizvi NA, Goldman JW, et al. Nivolumab plus ipilimumab as first-line treatment for advanced non-small-cell lung cancer (CheckMate 012): results of an open-label, phase 1, multicohort study. Lancet Oncol, 2017, 18(1):31-41.
[27] Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med, 2016, 375(19):1823-1833.
[28] Langer CJ, Gadgeel SM, Borghaei H, et al. Carboplatin and pemetrexed with or without pembrolizumab for advanced, non-squamous non-small-cell lung cancer: a randomised, phase 2温爱萍, 孟繁平, 李芳芳, 等. 单链抗体融合人血白蛋白对重症肌无力患者血清与乙酰胆碱受体结合的抑制. 中国免疫学杂志, 2009, 25(10):940-942.
[216] Duttaroy A, Kanakaraj P, Osborn BL, et al. Development of a long-acting insulin analog using albumin fusion technology. Diabetes, 2005, 54(1):251-258.
[217] Mertins P, Celik I, Kisker O, et al. Albumin-fused anti-angiogenesis peptides: CN, 03807641.1. 2010-12-01. (in Chinese)默廷斯 P, 西利克 I, 基斯克 O, 等. 与白蛋白融合的抗-血管生成肽: 中国, 03807641.1. 2010-12-01.
[218] Santagostino E, Martinowitz U, Lissitchkov T, et al. Long-acting recombinant coagulation factor IX albumin fusion protein (rIX-FP) in hemophilia B: results of a phase 3 trial. Blood, 2016, 127(14):1761-1769.
[219] Schulte S. Innovative coagulation factors: albumin fusion technology and recombinant single-chain factor VIII. Thromb Res, 2013, 131 Suppl 2:S2-S6.
[220] Josephson CD, Abshire T. The new albumin-free recombinant factor VIII concentrates for treatment of hemophilia: do they represent an actual incremental improvement? Clin Adv Hematol Oncol, 2004, 2(7):441-446.
[221] Shapiro AD. Long-lasting recombinant factor VIII proteins for hemophilia A. Hematology Am Soc Hematol Educ Program, 2013, 2013:37-43.
[222] Weimer T, Wormsbächer W, Kronthaler U, et al. Prolonged in-vivo half-life of factor VIIa by fusion to albumin. Thromb Haemost, 2008, 99(4):659-667.
[223] Herzog E, Harris S, McEwen A, et al. Recombinant fusion protein linking factor VIIa with albumin (rVIIa-FP): Tissue distribution in rats. Thromb Res, 2014, 134(2):495-502.
[224] Zollner S, Schuermann D, Raquet E, et al. Pharmacological characteristics of a novel, recombinant fusion protein linking coagulation factor VIIa with albumin (rVIIa-FP). J Thromb Haemost, 2014, 12(2):220-228. cohort of the open-label KEYNOTE-021 study. Lancet Oncol, 2016, 17(11):1497-1508.
[29] Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet, 2016, 387(10030):1837-1846.
10.3969/j.issn.1673-713X.2017.03.012
上海市科技成果转化和产业化项目(15431905800)
201210,上海复旦张江生物医药股份有限公司
沈毅珺,Email:yjshen@fd-zj.com
2017-01-17
——中国居民收入分配中的逆向调节机制

