新颖糖基转移酶对抗菌药物金霉素的糖基化修饰
戴舒远,赵锡澍,解可波,王霞,戴均贵
新颖糖基转移酶对抗菌药物金霉素的糖基化修饰
戴舒远,赵锡澍,解可波,王霞,戴均贵
目的发掘新颖糖基转移酶并对金霉素进行糖基化修饰。
方法对来源于木立芦荟的重组糖基转移酶进行金霉素糖基化功能筛选,发现重组 AaGT1 能催化金霉素与葡萄糖糖基供体进行反应。放大反应液经乙酸乙酯萃取去除未反应底物,剩余含糖基化产物的水相部分采用反相半制备 HPLC技术进行分离纯化。通过质谱和核磁共振波谱等技术对产物结构进行鉴定;对底物与糖基化产物的水溶性进行测定,并评价两者抑菌活性。
结果糖基转移酶 AaGT1 催化金霉素获得两个金霉素异构体的糖基化产物,异金霉素 10-O-β-D-葡萄糖苷和 4-差向异金霉素 10-O-β-D-葡萄糖苷。异金霉素 10-O-β-D-葡萄糖苷的水溶性是盐酸金霉素水溶性的 3.3 倍;糖基化产物对金黄色葡萄球菌没有明显的抑制活性。
结论糖基转移酶 AaGT1 对金霉素能够进行糖基化,产物异金霉素 10-O-β-D-葡萄糖苷和 4-差向异金霉素10-O-β-D-葡萄糖苷均为新化合物,对底物进行糖基化修饰能提高其水溶性。
金霉素; 糖基化; 糖基转移酶; 木立芦荟
糖基化(glycosylation)是自然界广泛存在的重要化学修饰反应,很多活性天然产物或药物均具有糖基。糖基的存在对其水溶性、毒副作用和药理活性往往会产生重要影响[1]。在天然或非天然苷元上引入糖基,进而提高化合物的成药性,为新颖糖苷类药物的发现带来了希望[2]。因此,糖基化修饰已作为合成活性糖苷类化合物的有效策略而被广泛应用在药物研究领域。天然糖苷类化合物的糖基是由糖基转移酶(glycosyltransferase)催化引入的。糖基转移酶能够将多种单糖由供体分子转移到受体分子上,形成相应的糖苷类化合物。糖基转移酶催化的酶法糖基化具有反应条件温和、环境友好、步骤简洁、具有位置和立体选择性及效率高等优点[3]。因此,糖基转移酶在活性化合物的糖基化修饰中具有广阔的应用前景。
金霉素(chlortetracycline)是一种四环素类抗生素,抗菌谱与其他四环素类抗生素相似,目前药物剂型主要是软膏。临床上用于治疗沙眼、细菌性结膜炎、麦粒肿及细菌性眼睑炎等疾病的治疗。但金霉素水溶性较差且毒副作用大,用药后可引起诸多不良反应[4],所以金霉素在临床上应用存在诸多限制。正因如此,我们尝试对金霉素进行糖基化结构修饰以克服上述缺陷,改善其临床使用效果。
本文通过对木立芦荟(Aloe arborescens)转录组注释的 6 个候选糖基转移酶基因(AaGT1 ~AaGT6)的外源表达及催化活性筛选,发现其中糖基转移酶 AaGT1 可对金霉素进行糖基化反应。通过放大酶促反应分离制备得到 2 个糖基化产物,并对糖基化产物进行了水溶性及抑菌活性测试。这些结果为后续金霉素的糖基化修饰研究提供了实验依据。
1 材料与方法
1.1 材料
1.1.1 载体 pET-28a 购自美国 Invitrogen 公司;宿主细胞 Transetta 购自北京全式金生物技术有限公司。
1.1.2 仪器 1-14、3K15、3K18 和 8K 高速离心机为德国 Sigma 公司产品;培英 HYG-A 恒温摇床为江苏太仓仪器厂产品;ZX-TJS 无菌工作台为上海整新电子设备公司产品;SHH-W21-420 三用电热恒温水箱为北京长风仪器产品;MLS-3750 S Labo-Autoclave 型全自动蒸汽消毒锅、MDF-382E型超低温冰箱为日本 Sanyo 公司产品;Bencbtop K冷冻干燥机为美国 Vir Tis 公司产品;1200 分析型高效液相系统为美国 Agilent 公司产品;Dionex Ultimate 3000 型高效液相色谱仪、LCQ Fleet 离子阱质谱仪为美国 Thermo 公司产品;分析型色谱柱Shiseido spolar C18(250 mm × 4.6 mm,5 μm)为日本 Shiseido 公司产品;反相半制备色谱柱 YMC Triart C18(250 mm × 10 mm,5 μm)为日本 YMC公司产品;VNS-400、VNS-600 型核磁共振波谱仪为美国 Varian 公司产品。
1.1.3 试剂 HPLC 检测用色谱级甲醇、甲酸及供体化合物尿苷二磷酸葡萄糖(UDP-Glc)购自美国 Sigma 公司;其他试剂均为市售分析纯。
1.1.4 培养基 LB 培养基:胰蛋白胨 10 g、酵母提取物 5 g、氯化钠 10 g,蒸馏水定容至 1 L,使用前 121 ℃ 灭菌 20 min。
1.2 方法
1.2.1 糖基转移酶表达系统的构建及诱导表达 来源于芦荟的糖基转移酶基因 AaGT1 ~AaGT6 连接表达载体 pET-28a,经测序验证后转化表达宿主 Transetta 获得含目的基因的重组工程菌。将重组工程菌转接于含卡那霉素和氯霉素(终浓度分别为 50 和 34 μg/ml)的 50 ml LB 培养基中,37 ℃,200 r/min 条件下培养过夜作为种子液。
将 AaGT1 重组菌的种子液以 1∶100 的比例转接至含卡那霉素和氯霉素(终浓度分别为 50 和34 μg/ml)的 5 L LB 培养基中,于 37 ℃、200 r/min条件下培养至 OD600= 0.6。向培养液中加入诱导剂IPTG 至终浓度为 0.15 mmol/L。在 18 ℃,200 r/min摇床中继续培养诱导 16 h。随后将菌液于 4 ℃、6000 × g 离心 10 min 后弃上清培养基,并用蒸馏水洗涤菌体 3 次。
1.2.2 重组糖基转移酶 AaGT1 的分离纯化 按照 Hi Trap Chelating HP 操作手册进行,为尽可能保持蛋白活力,整个纯化过程在 4 ℃ 蛋白层析柜中进行,主要步骤如下:
⑴每克 AaGT1 重组菌体用 5 ml 的 binding buffer(含 0.5 mol/L NaCl、20 mmol/L 咪唑的50 mmol/L 磷酸盐缓冲液,pH 7.2)重悬,加入苯甲基磺酰氟(PMSF,终浓度为 1 mmol/L)和溶菌酶(终浓度为 1 mg/ml),混匀后超声破碎菌体。
⑵菌体破碎后,于 4 ℃、10 000 × g 条件下离心 60 min,取上清(粗酶液)用 0.45 μm 滤膜过滤后上样于 binding buffer 平衡后的镍柱(Ni-NTA)进行亲和层析纯化。流速为 1 ml/min,分别用含100、250、500 mmol/L 浓度咪唑的 elution buffer(除咪唑浓度不同外,其他成分与 binding buffer相同)进行梯度洗脱。洗脱液经脱盐后,利用SDS-PAGE 检测目的蛋白。
1.2.3 糖基转移酶催化活性筛选 糖基转移酶活性初筛反应体系:重组 AaGT1 ~ AaGT6 粗酶液198 μl、50 mmol/L 盐酸金霉素1 μl、100 mmol/L UDP-Glc 1 μl。在 30 ℃ 水浴条件下,反应 12 h 后,加入 400 μl 的甲醇终止反应,振荡混匀,15 000 × g离心 30 min。利用 HPLC-UV/MS 对糖基转移酶的催化活性进行初步判断。
HPLC-MS 分析由 Agilent 1200 液相系统串联 Thermo LCQ Fleet 离子阱质谱仪完成,柱后分流比为 2∶1。流动相 A 为甲醇,流动相 B 为 0.1%甲酸水溶液,梯度洗脱。梯度条件:A∶B(v/v)1∶9→ 9∶11,30 min;流速 1 ml/ min;柱温 30 ℃;进样量 20 μl;在 254 nm 波长下检测。
ESI 源优化参数:鞘气流速 20(任意单位);辅助气流速 5(任意单位);喷雾电压 5000 V;毛细管温度 350 ℃;碰撞诱导解离电压 35 V。
1.2.4 金霉素糖基化产物的制备及结构鉴定 分别称取 28 mg 盐酸金霉素(溶解于 200 μl DMSO)、64 mg UDP-Glc(溶解于 1 ml 蒸馏水)。将纯化的酶液与上述两者混合均匀,用 pH7.4 的 Tris-HCl将反应体系定容至 50 ml,混匀后放入 30 ℃ 水浴锅中,反应 16 h 后以两倍体积的乙酸乙酯萃取5 次,有机相减压蒸干(经 HPLC-UV 检测仅有微量的转化产物)。将残余水相减压蒸干后,加入 5 ml甲醇超声提取 15 min,离心后将上清液进一步浓缩至 2 ml,0.22 μm 滤膜过滤后,使用甲醇/0.1% 甲酸水溶液为流动相通过反相半制备系统对糖基化产物及底物进行分离纯化,梯度洗脱条件为甲醇∶0.1% 甲酸水溶液(1∶9 → 1∶1,v/v,30 min);254 nm 下检测,流速 3 ml/min。将糖基化产物及底物流份经减压蒸馏及冷冻干燥后,得到化合物4-差向异金霉素 10-O-β-D-葡萄糖苷(7.2 mg,tR= 14.4 min)、异金霉素 10-O-β-D-葡萄糖苷(8.0 mg,tR= 17.7 min)、差向异金霉素(4.0 mg,tR= 22.2 min)和异金霉素(4.2 mg,tR= 26.0 min)。
1.2.5 水溶性实验
1.2.5.1 盐酸金霉素的标准曲线的绘制 将盐酸金霉素分别配成 512、256、128、64、32、16 μg/ml浓度,用于 HPLC 分析,进样体积为 10 μl,每个浓度重复 3 次,在 370 nm 波长下,测定吸收峰的面积。然后根据峰面积与进样质量得出回归方程:y = 0.0191x – 1.5328(r = 99.93%),y 为峰面积,x 为进样质量(ng)。
1.2.5.2 异金霉素 10-O-β-D-葡萄糖苷标准曲线的绘制 将该化合物分别配成 900、600、400、200、100 μg/ml 浓度,用于 HPLC 分析,进样体积为 10 μl,每个浓度重复 3 次,在 254 nm 波长下,测定吸收峰的面积。然后根据峰面积与进样质量得出回归方程:y = 0.0011x + 0.41(r = 99.89%),y 为峰面积,x 为进样质量(ng)。
1.2.5.3 待测化合物的溶解度测定 将 200 μl蒸馏水加入到过量的盐酸金霉素、异金霉素10-O-β-D-葡萄糖苷中形成悬浊液,室温下超声 1 h。9000 × g 离心 10 min,取 100 μl 上清液,分别用甲醇稀释至 1、2 ml,用于 HPLC 分析,进样量为10 μl,重复 3 次,在 370 与 254 nm 波长下测定吸收峰的面积。根据回归方程得出溶解质量,然后计算得出溶解度。
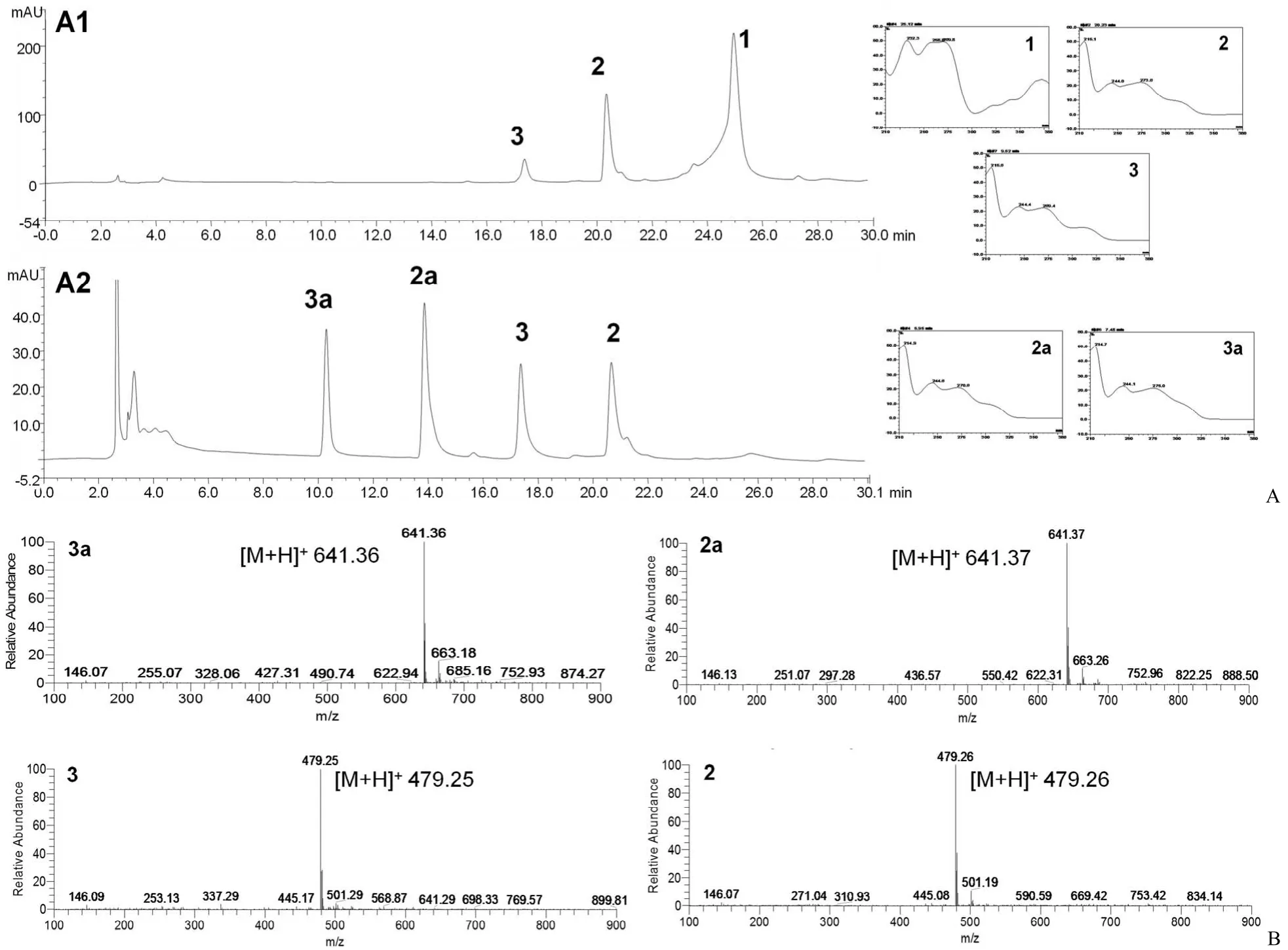
图 1 AaGT1 催化金霉素糖基化反应[A:HPLC-UV 分析空白对照组(A1)、催化反应体组(A2);B:糖基化产物峰 3a 与2a 以及非酶促反应底物峰 3 与 2 对应的 ESI-MS谱图]Figure 1 Glycosylated chlortetracycline by AaGT1 [A: HPLC-UV analysis of blank control (A1), catalytic reaction (A2); B: ESI-MS spectra of glycosylated products 3a, 2a and non-enzymatic reaction substrates 3, 2]
2 结果
2.1 芦荟糖基转移酶对金霉素糖基化的活性筛选
为获得能够对金霉素进行糖基化修饰的糖基转移酶,以 UDP-Glc 为供体,金霉素为受体,对6 个重组酶的粗酶液进行催化活性的筛选。经HPLC-UV/MS 检测发现,6 个重组糖基转移酶中只有 AaGT1(Genbank 序列号 KY293674)对金霉素表现出较高的糖基化活性(图 1)。比较底物与转化产物一级质谱,发现转化产物的分子量较底物的分子量增加 162,因此推测转化产物为底物金霉素引入一个葡萄糖基团。
从图 1 的 HPLC-UV/ESI-MS 图可以看出,金霉素(1)在糖基转移酶 AaGT1 的催化下,出现两个分子量增加 162 的糖基化产物峰(2a、3a)和两个非酶促反应底物峰(2、3),并且底物峰的保留时间以及紫外吸收光谱均与盐酸金霉素(1)有差异。非酶促反应底物(2、3)的分子量与金霉素一致,说明底物可能为金霉素的同分异构体。两个糖基化产物的紫外吸收光谱与底物的紫外吸收光谱一致,因此推测两个糖基化产物为金霉素同分异构体(2、3)的糖基化产物。
2.2 糖基化产物的制备及结构鉴定
为进一步确定糖基化产物的结构,通过反相半制备 HPLC 分离纯化得到 4 个化合物,依据紫外吸收光谱和核磁数据[5–7],4 个化合物分别鉴定为异金霉素(2)、异金霉素 10-O-β-D-葡萄糖苷(2a)、4-差向异金霉素(3)、4-差向异金霉素 10-O-β-D-葡萄糖苷(3a)。其中,化合物 2a、3a 为新化合物。
根据高分辨质谱,化合物 2a 的分子式被确定为 C28H33ClN2O13,分子量为 640(m/z 641.1720 [M + H]+,计算值为 641.1713),相比底物异金霉素的分子量(478)增加了 162;与其底物的1H-NMR 谱图相比,2a 的1H-NMR 谱图(表 1)多了 1 个端基氢 δH5.22、6 个连氧氢 δH3.17-3.65 的一组葡萄糖质子信号;2a 的13C-NMR谱图(表 1)比底物多了化学位移值在 δC60.5、69.4、73.1、76.6、77.2、99.3 的 6 个连氧碳,由于 δC99.3 是葡萄糖端基碳的典型信号,因此可判断化合物 2a 是在异金霉素苷元上引入了一分子葡萄糖的糖基化产物。HMBC 谱可观察到 H-1'(δH5.22)与 C-10(δC155.0)相关,表明该葡萄糖基团连在苷元的 10-OH上。端基质子的偶合常数 J = 7.2 Hz,表明形成的糖苷键为 β 构型。因此,化合物 2a 的结构被确定为异金霉素 10-O-β-D-葡萄糖苷。
与化合物 2a 相似的结构解析过程,化合物 3a被确定为 4-差向异金霉素 10-O-β-D-葡萄糖苷。
2.3 金霉素及其糖基化产物可能的转化过程
根据 HPLC-UV 分析结果,推测金霉素在AaGT1 酶反应液的作用下可能的转化途径(图 2)。由于 C7位含氯原子时,金霉素在弱碱性条件下,快速水解为异金霉素。异金霉素在水溶液中产生可逆的差向异构作用,生成差向异金霉素[8]。两者在AaGT1 酶的催化作用下,生成糖苷类化合物 2a、3a。我们还观察到化合物 2a、3a 在含水溶剂中可相互转化。
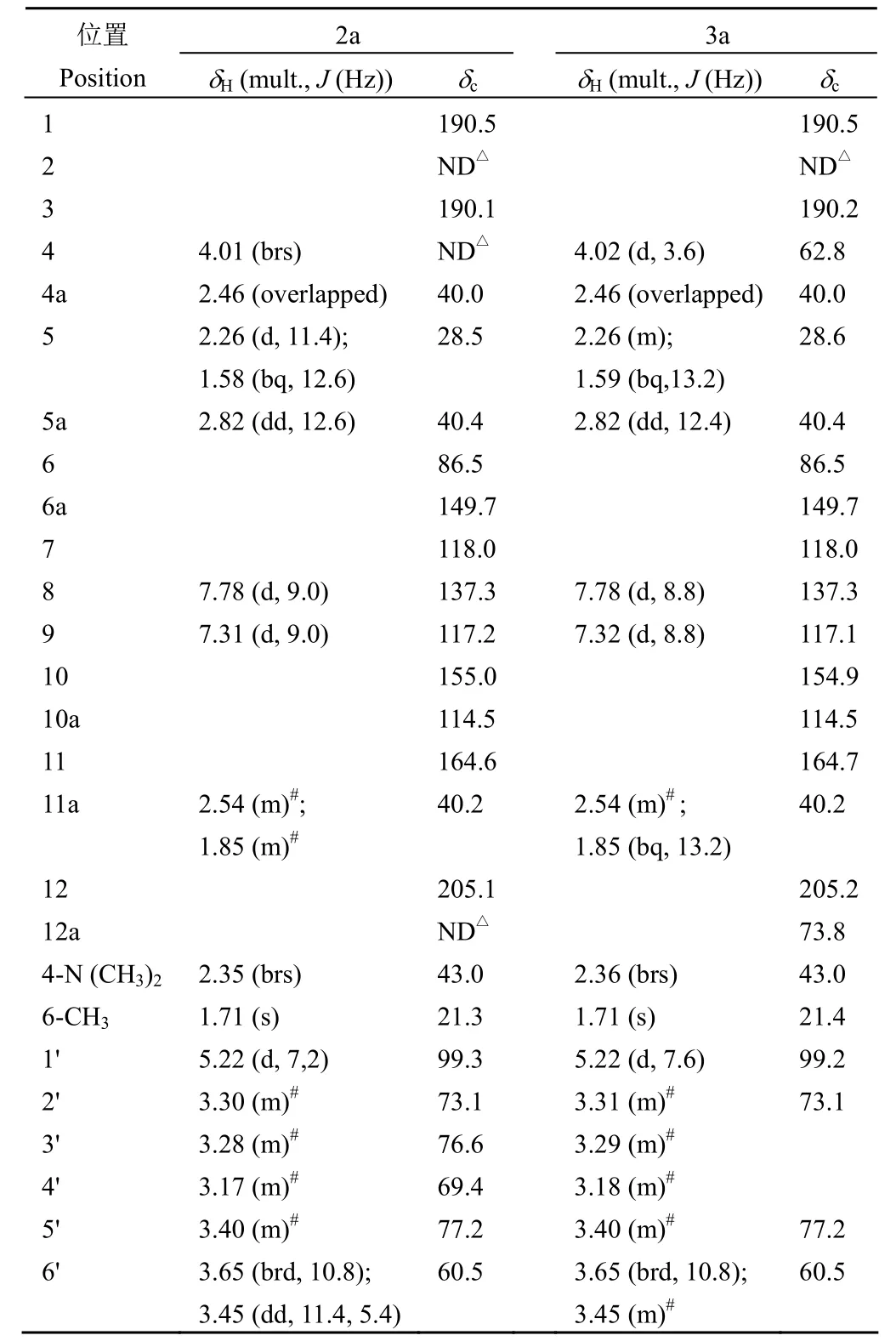
表 1 化合物 2a 与 3a 核磁共振波谱数据Table 1 1H-NMR and13C-NMR data of compounds 2a and 3a
2.4 金霉素与糖基化产物 2a 的水溶性比较
由于葡萄糖分子具有较大极性,苷元上引入葡萄糖基会增加其水溶性[9]。水溶性测试结果表明,糖基化的产物异金霉素 10-O-β-D-葡萄糖苷(2a)的水溶性为盐酸金霉素的 3.3 倍(表 2),显示糖基的引入有增加苷元水溶性的作用。
2.5 抑菌生物活性评价
将盐酸金霉素以及化合物 2、3、2a、3a 进行抑制金黄色葡萄球菌的活性筛选,遗憾的是,除盐酸金霉素外,化合物 2、3、2a、3a 均无明显的抑菌活性。

图 2 金霉素转化成化合物 2a 与 3a 的可能过程Figure 2 Possible transformation process of chlortetracycline to compounds 2a and 3a

表 2 盐酸金霉素(1)、异金霉素 10-O-β-D-葡萄糖苷(2a)的水溶性Table 2 Water solubility of chlortetracycline hydrochloride (1) and iso-chlortetracycline 10-O-β-D-glucoside (2a)
3 讨论
本研究首次利用糖基转移酶对金霉素进行糖基化研究,并获得了两个糖基化产物,异金霉素10-O-β-D-葡萄糖苷与 4-差向异金霉素 10-O-β-D-葡萄糖苷,表明酶法糖基化四环素类是一条可行路线。由于金霉素在酶反应液中稳定性较差,如何在保持金霉素的稳定性和酶的活性基础上完成金霉素糖基化反应,是下一步实验需要解决的关键问题。金霉素异构体的糖基化产物有无除抑菌外的其他药理活性,需我们进一步研究。
[1] Song MC, Kim E, Ban YH, et al. Achievements and impacts of glycosylation reactions involved in natural produst biosynthesis in prokaryotes. Appl Microbiol Biotechnol, 2013, 97(13):5691-5704.
[2] De Bruyn F, Maertens J, Beauprez J, et al. Biotechnological advances in UDP-sugar based glycosylation of small molecules. Biotechnol Adv, 2015, 33(2):288-302.
[3] Xiao J, Muzashvili TS, Georgiev MI. Advances in the biotechnological glycosylation of valuable flavonoids. Biotechnol Adv, 2014, 32(6): 1145-1156.
[4] Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China. Volume 2, 2005. Beijing: Chemical Industry Press, 2005:541. (in Chinese)国家药典委员会. 中华人民共和国药典. 2005年版二部. 北京: 化学工业出版社, 2005:541.
[5] Ding HX, Huang YC, Ding WY, et al. Studies on the chemistry of aureomycin II. Isoaureomycin and its analogues. Acta Chimica Sinica, 1955, 22(2):142-150. (in Chinese)丁宏勋, 黄耀曾, 丁维钰, 等. 金微素的化学 II. 异金微素及其同型物. 化学学报, 1955, 22(2):142-150.
[6] Casy AF, Yasin A. Stereochemical studies of tetracycline antibiotics and their common impurities by 400 MHz 1H NMR Spectroscopy. Magn Reson Chem, 1985, 23(9):767-770.
[7] Shang Z, Salim AA, Khalil Z, et al. Fungal biotransformation of tetracycline antibiotics. J Org Chem, 2016, 81(15):6186-6194.
[8] Wen YL. The stability of tetracycline antibiotics. Chin Pharm J, 1966, 12(1):35-39. (in Chinese)温玉麟. 四环素类抗菌素的稳定性. 中国药学杂志, 1966, 12(1):35-39.
[9] Sun LL, Chen DW, Chen RD, et al. Exploring the aglycon promiscuity of a new glycosyltransferase from Pueraria lobata. Tetrahedron Lett, 2016, 57(13):1518-1521.
Enzymatic glycosylation of antibiotics chlortetracycline by a new glycosyltransferase
DAI Shu-yuan, ZHAO Xi-shu, XIE Ke-bo, WANG Xia, DAI Jun-gui
ObjectiveTo mine novel glycosyltransferase with the ability to glycosylate antibiotics chlortetracycline.
MethodsAfter preliminarly sreening, glycosyltransferase AaGT1 from A. arborescens was found to be capable of glycosylating chlortetracycline. AaGT1 was utilized to catalyze the glycosylation of chlortetracycline with uridine diphosphate glucose. To remove the unreacted chlortetracycline, the reaction solution was extracted with EtOAc for five times. And the rest aqueous phase was dried by removal of water under reduced pressure, then purified by semi-preparative reversed-phase HPLC. The structures of glycosylated products were determined by HRMS and NMR spectroscopic data analysis. In addition, water solubility of glycosylated product and substrate were measured, and their antibacterial activities were evaluated.
ResultsTwo glycosylated products were obtained and identified as iso-chlortetracycline 10-O-β-D-glucoside and 4-epi-iso-chlortetracycline 10-O-β-D-glucoside. The solubility of iso-chlortetracycline 10-O-β-D-glucoside in water was increased by 3.3 times compared with that of chlortetracycline hydrochloride. However, the glycosylated products showed no significant antibacterial activity against Staphylococcus aureus.
ConclusionIso-chlortetracycline 10-O-β-D-glucoside, 4-epi-iso-chlortetracycline 10-O-β-D-glucoside are novel compounds, and glycosylation of drugs may increase their water solubility.
Chlortetracycline; Glycosylation; Glycosyltransferase; Aloe arborescens
DAI Jun-gui, Email: jgdai@imm.ac.cn
10.3969/j.issn.1673-713X.2017.03.005
国家自然科学基金(81602999)
100034 北京市第三十五中学(戴舒远、赵锡澍、王霞);100050 北京,中国医学科学院北京协和医学院药物研究所(解可波、戴均贵)
戴均贵,Email:jgdai@imm.ac.cn
2016-12-09
www.cmbp.net.cn 中国医药生物技术, 2017, 12(3):221-226
Author Affiliations: Beijing No. 35 High School, Beijing 100034, China (DAI Shu-yuan, ZHAO Xi-shu, WANG Xia); Institute of Materia Medica, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100050, China (XIE Ke-bo, DAI Jun-gui)
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(3):221-226

