壳聚糖流体敷料膜的制备及其促伤口愈合的研究
易喻,徐云霞,梅建凤,陈建澍,张彦璐,应国清
壳聚糖流体敷料膜的制备及其促伤口愈合的研究
易喻,徐云霞,梅建凤,陈建澍,张彦璐,应国清
目的探讨壳聚糖流体敷料膜的透气性、阻菌性、促伤口愈合等效果。
方法制备壳聚糖流体敷料膜,对其透气、阻菌、皮肤刺激、细胞毒性等性能进行考察,建立家兔伤口模型,以创面愈合时间、创面愈合率为指标,评价其促伤口愈合能力。
结果壳聚糖流体敷料膜能在 9 min 内成膜,透气率为(2431 ± 63)g/(m2·d),具有阻菌性,良好的细胞相容性、无皮肤刺激性,在促伤口愈合方面,实验组、阳性组和阴性组创面愈合时间分别为(12.88 ± 0.71)、(15.67 ± 0.41)、(17.17 ± 0.61)d(P < 0.05)。与对照组相比,实验组在伤后各时间点的创面愈合率明显提高(P < 0.05)。
结论壳聚糖流体敷料膜具有良好透气性、阻菌性,无皮肤刺激性及具有促伤口愈合的能力,在医用敷料领域具有一定应用价值。
壳聚糖; 流体敷料膜; 伤口愈合
壳聚糖是一种天然高分子材料,具有低毒性、生物相容性,抑菌活性及可生物降解等性质[1]。相关研究表明,壳聚糖及其衍生物还能够促进皮肤成纤维细胞的生长[2],加速伤口愈合过程,抑制瘢痕成纤维细胞的增殖[3],防止疤痕形成。因此,壳聚糖及其衍生物被认为是医用敷料的理想原料。壳聚糖流体敷料膜是以壳聚糖及其衍生物为主要原料,添加成膜材料、药用辅料成分和易挥发的溶剂,研制得到的一种半流体敷料[4]。该敷料涂抹至伤口处,可形成一层柔软、具黏附性的膜。流体敷料膜除可在某些皮肤病及各种外伤康复等的治疗中发挥显著作用,尤其适合人体腔道等难以包扎部位以及烧烫伤造成的特殊形状伤口的治疗[5]。近年来,国内外对这种流体敷料膜的关注不在少数,一种理想的敷料,应同时具备透气性、保湿性、阻菌性及促伤口愈合等作用,流体敷料膜恰好具备这些条件。
本文利用 N-糖基化壳聚糖的促伤口愈合作用和聚乙烯醇良好的成膜性,添加其他药用辅料,制备出一种新型壳聚糖流体敷料膜,并建立家兔伤口模型,对这种流体敷料膜的性能进行评价,为其实际应用奠定良好的基础。
1 材料与方法
1.1 材料
1.1.1 试剂 N-糖基化壳聚糖(DD = 67%)为实验室自制;薄荷脑购自上海生物化工有限公司;聚乙烯醇购自国药集团化学试剂有限公司;乳酸购自天津市东丽区天大化工试剂厂;双氧水购自上海凌峰化学试剂有限公司;乙醇购自安徽安特食品股份有限公司。
1.1.2 实验动物 家兔 6 只,体重 2.5 ~ 2.75 kg,雌雄各半,由浙江中医药大学动物实验中心提供。自由摄食饮水,室温条件下饲养 1 周后进入实验。
1.2 方法
1.2.1 壳聚糖流体敷料膜的制备 称取适量 N-糖基化壳聚糖于烧杯中,加入定量生理盐水和乳酸,搅拌至溶解得到 20 mg/ml 的壳聚糖溶液;称取适量聚乙烯醇(PVA)加水溶胀后,在 95 ℃ 下加热搅拌至完全溶解,得 10% PVA 膜液;将 N-糖基化壳聚糖溶液和 PVA 溶液按 1∶2 体积比混合,依次添加橄榄油 0.35 ml、薄荷脑 0.1 g、双氧水 0.9 ml和乙醇 8 ml,搅拌 15 min 混合均匀,即得壳聚糖流体敷料膜。
为进一步研究壳聚糖流体敷料的理化性能,采用流延法铺膜,将适量流体均匀涂布于载玻片上,37 ℃ 干燥制得流体敷料膜。
1.2.2 成膜时间测定 精密移取 0.1 ml 流体敷料,均匀涂抹于人体手背,记下时间 t1,待流体敷料挥发成膜后记下时间为 t2,(t2– t1)即为皮肤成膜时间。
1.2.3 透气性试验 按照国家医药行业标准《接触性创面敷料试验方法第 2 部分:透气膜敷料水蒸气透过率》(YY/T 0471.2-2004)进行透气性测试,具体步骤如下:将流体敷料膜(厚度约为 0.05 mm)固定在瓶口面积为 10 cm2的容器口,确保完全封闭,容器内放满水,称量并记录容器、水、敷料膜的总质量 W1,在恒温为(37 ± 1)℃、相对湿度 <20% 的空间里放置 24 h 后,再称量记录质量 W2,通过下式计算水蒸气透过率(WVTR):
WVTR =(W1– W2)× 1000 × 24/t;t 为测定时间;WVTR 的单位为 g/(m2·d)。
1.2.4 阻菌性试验 按照国家医药行业标准《接触性创面敷料试验方法第 5 部分:阻菌性》(YY/T 0471.5-2004),对流体敷料膜的阻菌性能进行测试。具体步骤如下:将一个圆形流体敷料膜(r = 1 cm)移至装有无菌营养琼脂培养基的培养皿上,用滴管吸取一滴黏质沙雷菌(CGCC LL-413)的混悬液接种于敷料膜中央,20 ~ 25 ℃ 下培养 24 h。培养结束后取下敷料膜,继续于 20 ~ 25 ℃ 下培养 24 h,最终观察被样品覆盖的表面积内是否有黏质沙雷菌红色菌落生长。同理,以相同大小的医用纱布作为对照组,重复上面操作,观察是否有黏质沙雷菌生长。整个操作过程为无菌操作。
1.2.5 皮肤刺激性试验 根据文献[6]的方法,取家兔 2 只,雌雄各半,试验前 24 h 背部脊柱两侧脱毛,左、右各 3 cm × 3 cm,取流体敷料直接涂抹于一侧,另一侧不作处理,作为自身对照。持续24 h 后除去药物,以肉眼观察用药皮肤局部有无红斑及水肿等情况为评价指标,进行皮肤刺激性评分。无红斑为 0 分,轻度(勉强可见)、中度(明显可见)、重度红斑及紫红色红斑并伴有焦痂形成依次评价为 1、2、3、4 分;轻度、中度、重度(皮肤隆起 1 mm,轮廓清楚)和严重性水肿(皮肤隆起 1 mm 以上并有扩大)评价为 1 ~ 4 分。将这两项的评分综合起来,位于 0 ~ 0.49 为无刺激性,0.5~ 2.99 为轻度刺激性,3.0 ~ 5.99 为中度刺激性,6.0 ~ 8.0 为强刺激性。
1.2.6 细胞毒性试验[7]取流体敷料膜样品,以0.1 g/ml 比例用 DMEM 细胞培养基于 37 ℃ 下浸提 24 h,制得浸提液;取培养至对数期的 L929细胞种于 96 孔板,每孔接种 100 μl 细胞浓度为5 × 104个/ml 的细胞液,于 37 ℃、5% CO2的细胞培养箱内培养 24 h,然后将 96 孔板中的培养液吸去,加入 100 μl 制备好的浸提液,对照组加入100 μl DMEM 培养基,每组设置 5 组平行,于37 ℃、5% CO2的培养箱内分别培养 24、48 h。培养到相应时间后,在 96 孔板中加入 20 μl 浓度为 5 mg/ml 的 MTT 溶液,继续培养 4 h 后,吸净孔内液体,加入 100 μl 二甲基亚砜,于培养箱中振荡 10 min 后,在 490 nm 波长下测定吸光值(OD),计算细胞相对增殖率(%)= OD实验组/ OD对照组× 100%。
1.2.7 建立全层皮肤切除伤模型[8]取家兔 6 只,雌雄各半,称重后取俯卧位,剪去其背部局部毛发,用硫化钠脱毛,10% 水合氯醛麻醉(3 ml/kg),用碘伏及乙醇常规消毒皮肤后,于兔子距脊柱两侧割长 1.5 cm,宽 1.0 cm 的伤口 4 个,伤口的厚度为0.15 cm,造成一个全层皮肤切除开放创面。对 4 个伤口进行编号,分别为 1 ~ 4号,1 号予以不添加壳聚糖的流体敷料膜 0.1 ml(阴性对照组),2 号予以日本小林液体创可贴 0.1 ml(阳性对照组),3、4 号予以壳聚糖流体敷料膜 0.1 ml(实验组),敷药时涂抹均匀至完全覆盖创口,处理后的创口用无菌纱布包扎好,每 12 小时更换一次。
1.2.8 创面观察[9-10]给药记作第一天,每天观察创面形态和有无渗出液情况,创面收缩的面积大小,创面周围肉芽组织和上皮组织的生长情况,创面愈合时间。创面面积测量:伤后第 3、7、10 和15 天,用计算机图像分析软件计算创面面积。创面愈合率(%)=(原始创面面积 – 未愈合创面面积)/原始创面面积 × 100%。
1.3 统计学处理
以上所有数据均用 SPSS 18.0 软件进行分析,以 P < 0.05 为有统计学意义,数据以表示。
2 结果
2.1 壳聚糖流体敷料膜的性能参数
2.1.1 性状和气味 使用前为乳白色的半流动性液体,质地均匀,带有薄荷脑清香味。使用后呈形态光滑平整且透明的膜,见图 1。
2.1.2 pH pH 值为 5.5,而引起创面感染的大多数病原菌生长增殖的适宜 pH 值为 7.2 ~ 7.4。
2.1.3 成膜时间 涂于皮肤表面 9 min 内成膜,说明此壳聚糖流体敷料膜具有良好的可塑性。
2.2 透气性
WVTR 是评价创伤敷料的一个重要指标,正常皮肤的透气性是 204 g/(m2·d),受伤皮肤是 279 ~5138 g/(m2·d)[11],优良的医用敷料的透气率理想值应高于 1000 g/(m2·d)[12],该敷料透气率为(2431 ± 63)g/(m2·d)。因此,该壳聚糖流体敷料膜的透气性良好。
2.3 阻菌性
在阻菌性试验中,可观察到对照组(纱布)有黏质沙雷菌的生长(图 2A),而实验组(流体敷料膜)没有产生黏质沙雷菌(图 2B),说明纱布不能起到阻挡黏质沙雷菌的作用,在包扎伤口过程中容易使伤口受到外界细菌的感染,而流体敷料膜具有良好的阻菌性,能够阻挡外界细菌对创面的污染。

图 1 壳聚糖流体敷料膜的形态Figure 1 The morphology of chitosan fluid dressing membrane
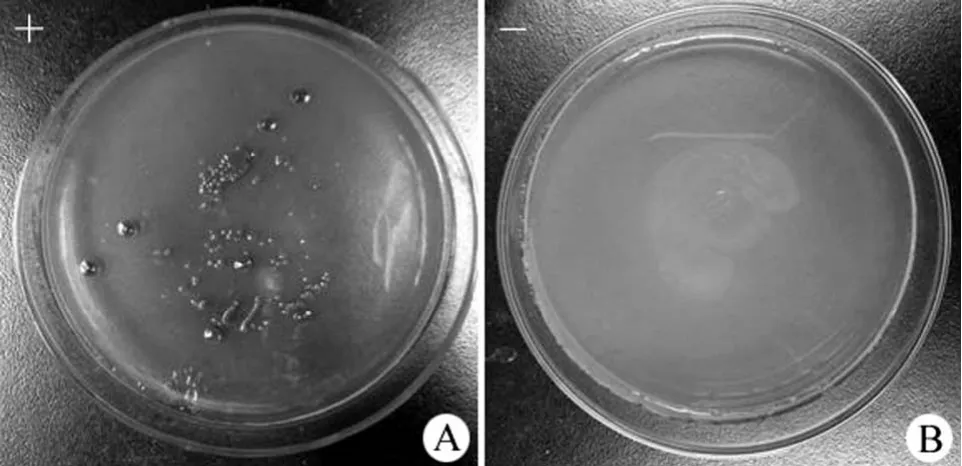
图 2 壳聚糖流体敷料膜的阻菌性结果(A:对照组;B:实验组)Figure 2 The result of bacterial resistance for the chitosan fluid dressing membrane (A: Control group; B: Experimental group)

表 1 细胞相对增殖率与细胞毒性分级的关系Table 1 The relative cell growth rate and cell toxicity

表 2 流体敷料膜的细胞增殖率与毒性评价(P < 0.05)Table 2 The relative cell growth rate and cell toxicity of fluid dressing membrane (P < 0.05)
2.4 皮肤刺激性
家兔裸露皮肤涂抹了壳聚糖流体敷料膜后,未出现红斑、水肿等过敏现象,皮肤状况和对照组皮肤基本一致,故皮肤刺激反应评分为 0,因此可见壳聚糖流体敷料膜对家兔皮肤无刺激性。
2.5 细胞毒性
细胞毒性评价标准见表 1,本实验采用 MTT法测定的细胞毒性,结果见表 2。
在 24 h 和 48 h 时,实验组的细胞增殖率分别为 91.44% 和 95.56%,说明该流体敷料膜的细胞毒性仅为 1 级,符合生物医用材料的细胞毒性要求。
2.6 创面愈合观察
造模的家兔麻醉清醒后,精神沉郁,活动少,少食少水。第 2 天家兔精神状态良好,活动逐渐恢复正常,伤口处湿润,无出血红肿情况。第 3 天各组伤口均开始结痂,两组对照的创面较实验组不平整,实验组肉芽组织生长明显。给药第 7 天,对照组和实验组创面均有不同程度缩小,实验组创面缩小较明显,同时,实验组和阳性组伤口痂皮脱落,有大量肉芽组织增生以修补伤口。第 10 天,阴性组的痂皮自然脱落,实验组的新上皮组织分布均匀,基本愈合;阳性组创面中央仍有血痂。第15 天时,实验组创面全部愈合,阳性组基本愈合,阴性组仍有 1/10 创面未收口(图 3)。
各组创面全部愈合后形成的疤痕也有较大差别:阴性组形成疤痕凸出皮肤明显,用手触摸可感受到硬结块;阳性组形成明显疤痕,原创面中间皮肤略凹凸不平整;实验组形成疤痕凸出皮肤不明显,用手触摸无硬结,恢复情况良好。说明壳聚糖流体敷料膜还可以抑制伤口组织疤痕的异常增生,具有抑制瘫痕形成的作用。
2.7 创面愈合情况结果
实验组、阳性组和阴性组创面愈合时间分别为(12.88 ± 0.71)、(15.67 ± 0.41)、(17.17 ± 0.61)d,和阴性组相比,实验组和阳性组伤口愈合时间均提前,实验组的愈合时间明显缩短,差异均有统计学意义(P = 0.018,P = 0.025)。通过计算机图像分析软件得到创面面积,进一步计算得出创面愈合率,结果如表 3 所示。

图 3 肉眼观察家兔皮肤创面愈合Figure 3 Macroscopic observation of rabbit skin wound healing process
表 3 阴性组、阳性组与实验组创面愈合率比较(±s,%,n = 6)Table 3 Comparison of the wound healing rate among the negative group, the positive group and the experimental group (±s, %, n = 6)

表 3 阴性组、阳性组与实验组创面愈合率比较(±s,%,n = 6)Table 3 Comparison of the wound healing rate among the negative group, the positive group and the experimental group (±s, %, n = 6)
注:与阴性对照组比较,*P < 0.05。Note: Compared with negative group,*P < 0.05.
组别 Group 3 d 7 d 10 d 15 d阴性组 Negative group 20.41 ± 1.76 32.91 ± 2.79 46.67 ± 3.67 76.67 ± 4.26阳性组 Positive group 17.33 ± 2.05* 40.50 ± 3.44* 70.32 ± 1.96* 93.33 ± 3.85*实验组 Experimental group 21.67 ± 1.92* 63.67 ± 3.12* 86.67 ± 4.24 100*
3 讨论
壳聚糖流体敷料能紧密覆盖皮肤创面形成一层透明薄膜,可方便观察创面情况,是一类非常理想的新型医用材料[13-14]。同时,这类流体敷料与 1962 年 George Winter 提出的“湿性愈合”理论[15]也相符。本实验采用 N-糖基化壳聚糖和聚乙烯醇为主要原料,添加其他辅料成分,制备得到一种新型的壳聚糖流体敷料膜。聚乙烯醇的添加增强了该敷料的成膜性能,且聚乙烯醇具有良好的生物相容性和可生物降解性;橄榄油对伤口具有保湿作用,能减轻伤口疼痛,促进愈合,愈后不留疤痕,美国、德国等西方国家早已把橄榄油载入药典;薄荷脑具有清凉感,添加在敷料中可消炎镇痛止痒;双氧水常用于医用消毒杀菌,又可作为致孔剂,双氧水歧化释放氧气而使薄膜致孔透气,此外歧化反应放热能加速成膜;乙醇在此主要作为挥发性溶剂,使流体敷料快速成膜。该敷料膜无肝首过作用,毒副作用较小,涂抹覆盖创面,可以有效保护创面组织。该敷料的 pH 值为 5.5,给创面营造一个微酸的环境。微酸环境能抑制创面细菌的生长,同时促进成纤维细胞的合成以及刺激血管增生,有利于创面的愈合[16]。此外,实验得到的敷料膜透气率为(2431 ± 63)g/(m2·d),相关研究指出[17],当创伤敷料的透气率在 2000 ~ 2500 g/(m2·d) 之间,既有优良的透气性,又能维持创面的湿润环境,起到防止创面过度脱水和渗出液过量累积的作用。因此本实验制备的流体敷料膜,除具有良好的透气性能外,还能够有效阻止水分的蒸发,给创面提供一个湿润环境,促进创面愈合。从阻菌性实验看出,该流体敷料膜具有良好的阻菌性,能够良好阻挡外界细菌对创面的污染。从动物实验中可知,该流体敷料膜能够加速创面的愈合,且抑制瘢痕形成。
综上所述,本实验制得的流体敷料膜具有良好的理化特性及促伤口愈合的能力。随着医用敷料的迅速发展,湿性敷料有望占据整个敷料市场中的优势位置,因而这种新型的壳聚糖流体敷料膜具有广阔的发展空间,有望进一步研究并应用于皮肤浅表创伤、皮肤溃疡及烧烫伤等的修复护理。
[1] Kean T, Thanou M. Biodegradation, biodistribution and toxicity of chitosan. Adv Drug Deliv Rev, 2010, 62(1):3-11.
[2] Song SH, Gao CG. Research progress of chitosan. Liaoning Sports Sci Technol, 2004, 26(5):50-51. (in Chinese)宋淑华, 高春刚. 壳聚糖研究进展. 辽宁体育科技, 2004, 26(5): 50-51.
[3] Chen YP, Xia DL, Wang YF, et al. The fabrication of composite liquid dressing and applications in skin wound healing. Chin J Biomed Eng, 2016, 35(4):453-459. (in Chinese)陈燕培, 夏栋林, 王雨飞, 等. 创面复合液体敷料在皮肤创伤中的治疗研究. 中国生物医学工程学报, 2016, 35(4):453-459.
[4] Jiang YY, Bi YQ, Jiang JG. Clinical effects of chitosan biofluice dressing membrane on various wound healing. J Clin Rehabil Tissue Engg Res, 2007, 11(1):164-166. (in Chinese)蒋玉燕, 毕忆群, 蒋建国. 壳聚糖生物流体敷料膜对各类创面愈合的临床效应. 中国组织工程研究, 2007, 11(1):164-166.
[5] Wang M, He YF, Liu D, et al. Formulation optimization and pharmacodynamics research of chitosan wound sprays. J Chengdu Med Coll, 2016, 11(1):21-23. (in Chinese)王茂, 何彦霏, 刘丹, 等. 壳聚糖创面喷雾剂处方筛选及对大鼠创伤愈合作用的研究. 成都医学院学报, 2016, 11(1):21-23.
[6] Deng CM, He LZ, Yang D, et al. Toxicological evaluation of chitosan-gelatin sponge wound dressing. J Toxicol, 2007, 21(1):76-77. (in Chinese)邓春梅, 何兰珍, 杨丹, 等. 壳聚糖-明胶海绵伤口敷料的毒理学评价. 毒理学杂志, 2007, 21(1):76-77.
[7] Xia GX. Study on N-succinyl chitosan fiber as wound dressing. Qingdao: Ocean University of China, 2014. (in Chinese)夏桂雪. N-丁二酰壳聚糖纤维作为伤口敷料的研究. 青岛: 中国海洋大学, 2014.
[8] Yang R, Li YJ. Establishment of animal model on trauma restoration. Chin Nurs Res, 2003, 17(23):1369-1370. (in Chinese)杨瑞, 李亚洁. 创伤修复动物模型的建立. 护理研究, 2003, 17(23):1369-1370.
[9] Nagelschmidt M, Becker D, Bönninghoff N, et al. Effect of fibronectin therapy and fibronectin deficiency on wound healing: a study in rats. J Trauma, 1987, 27(11):1267-1271.
[10] Chen YL, Huang K. Evaluation criterion of wound healing. Chin J Clin Rehabil, 2002, 6(8):1080-1081. (in Chinese)陈玉林, 黄康. 创面愈合的评价指标. 中国组织工程研究, 2002, 6(8):1080-1081.
[11] Chen LM, Wang T. The research and prospect of biological dressing based on chitosan. Newsl Sericultural Sci, 2015(2):15-21. (in Chinese)陈丽嫚, 汪涛. 壳聚糖生物敷料的研究现状及其发展前景. 蚕学通讯, 2015(2):15-21.
[12] Queen D, Gaylor JD, Evans JH, et al. The preclinical evaluation of the water vapour transmission rate through burn wound dressings. Biomaterials, 1987, 8(5):367-371.
[13] Boateng JS, Matthews KH, Stevens HN, et al. Wound healing dressings and drug delivery systems: a review. J Pharm Sci, 2008, 97(8):2892-2923.
[14] Yan CF, Liu L, Yao JM. Preparation and property characterization of chitosan /sericin biological fluid material. Sci Sericulture, 2013, 39(3):593-598. (in Chinese)严晨峰, 刘琳, 姚菊明. 壳聚糖/丝胶蛋白生物流体材料的制备及性能测试. 蚕业科学, 2013, 39(3):593-598.
[15] Winter GD. Formation of the scab and the rate of epithelisation of superficial wounds in the skin of the young domestic pig. 1962. J Wound Care, 1995, 4(8):366-367; discussion 368-371.
[16] Zhao M, Deng CM, Yang D, et al. Experimental study on chitosan-gelatin sponge in wound healing. China J Mod Med, 2006, 16(18):2738-2740, 2743. (in Chinese)赵明, 邓春梅, 杨丹, 等. 壳聚糖-明胶海绵促进伤口愈合的实验研究(四). 中国现代医学杂志, 2006, 16(18):2738-2740, 2743.
[17] Kim IY, Yoo MK, Seo JH, et al. Evaluation of semi-interpenetrating polymer networks composed of chitosan and poloxamer for wound dressing application. Int J Pharm, 2007, 341(1-2):35-43.
www.cmbp.net.cn Chin Med Biotechnol, 2017, 12(3):232-237
我会参加国家两委局干细胞制剂和临床研究质量管理培训班
4 月 21 日,国家卫生计生委科教司会同食品药品监管总局药化注册司在云南省昆明市共同举办了干细胞制剂和临床研究质量管理培训班。培训班针对国内外干细胞临床研究进展、如何开展规范的临床研究、干细胞制剂质量控制及临床前研究的要求、干细胞临床研究质量受权人的职责及审计体系的建立、干细胞制剂质量标准的建立和质量复核、干细胞临床研究项目备案材料准备等内容对 30 家已备案干细胞临床研究机构的干细胞制剂质量受权人和项目负责人以及 16 个省(市)卫生计生委科教处和食品药品监管局药化注册处干细胞临床研究管理业务人员共计一百余人进行了培训。我会吴朝晖秘书长应科教司邀请,在培训班上就“干细胞临床研究项目备案材料申报注意事项”进行了讲解。
干细胞质量管理检查手册在京修订
4 月 20 日,我会在京召开会议修订干细胞质量管理检查手册,吴朝晖秘书长、协会标准工作专家委员会张爱萍委员出席会议。《干细胞质量管理检查手册》起草小组向与会代表介绍手册起草的过程,在起草过程中数次改稿,多次与专家和业内企业进行交流,形成了本次讨论的草稿。
会上,张爱萍结合自身 GMP 检查的经验,对《干细胞质量管理检查手册》的章节架构、制定原则提出了建议。随后,会议逐条对检查手册的具体条款进行讨论,参会代表就实际生产过程中的问题和专家进行交流,并对检查条款的内容进行了修改,保证条款的科学性和适用性。经过讨论,会议基本就《干细胞质量管理检查手册》的内容和修改达成一致。
Studies on preparation of chitosan fluid dressing membrane and its promoting wound healing
YI Yu, XU Yun-xia, MEI Jiang-feng, CHEN Jian-shu, ZHANG Yan-lu, YING Guo-qing
ObjectiveTo investigate the effect of chitosan fluid dressing membrane on the properties of permeability, antibacterial resistance and wound healing.
MethodsA chitosan fluid dressing membrane was prepared and its permeability, antibacterial property, cell toxicity and skin irritation were observed. Then the rabbit wound model was established, the wound healing time was observed, and wound healing rate as indicators was used to evaluate its ability to promote wound healing.
ResultsChitosan fluid dressing formed a membrane in 9 min, and its permeability was (2431 ± 63) g/(m2·d). Fluid dressingmembrane showed antibacterial, good cell compatibility without skin irritation, and the wound healing time was (12.88 ± 0.71) d, (15.67 ± 0.41) d, and (17.17 ± 0.61) d (P < 0.05) in the experimental group, the positive group, and the negative group, respectively. The wound healing rate in the experimental group was significantly higher than that in the control group (P < 0.05).
ConclusionChitosan fluid dressing membrane possesses good permeability, antibacterial, no skin irritation, and has the ability to promote the wound healing. it could have a certain application value in the field of medical dressings.
Chitosan; Fluid dressing membrane; Wound healing
YING Guo-qing, Email: gqying@zjut.edu.cn
10.3969/j.issn.1673-713X.2017.03.007
310014 杭州,浙江工业大学药学院
应国清,Email:gqying@zjut.edu.cn
2017-03-02
www.cmbp.net.cn 中国医药生物技术, 2017, 12(3):232-237
Author Affiliation: College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China

