基于氨基做质子迁移桥梁亮氨酸的手性转变机理及水溶剂化效应*
赵晓波,李晨洁,王佐成,喻小继,闫红彦,杨晓翠,佟华
(1.白城师范学院化学学院,吉林 白城 137000; 2.白城师范学院传媒学院,吉林 白城 137000; 3.白城师范学院物理与电子信息学院,吉林 白城 137000; 4.长春师范大学外语学院,吉林 长春 131000; 5.白城师范学院计算机科学学院,吉林 白城 137000)
基于氨基做质子迁移桥梁亮氨酸的手性转变机理及水溶剂化效应*
赵晓波1,李晨洁2,王佐成3,喻小继4,闫红彦5,杨晓翠3,佟华3
(1.白城师范学院化学学院,吉林 白城 137000; 2.白城师范学院传媒学院,吉林 白城 137000; 3.白城师范学院物理与电子信息学院,吉林 白城 137000; 4.长春师范大学外语学院,吉林 长春 131000; 5.白城师范学院计算机科学学院,吉林 白城 137000)
采用密度泛函理论的B3LYP方法、微扰理论的MP2方法和自洽反应场理论的smd模型方法,对标题反应进行了研究。反应通道研究发现:标题反应有2条通道a和b,分别是质子H只以氨基和以羰基与氨基顺次为桥,从手性碳的一侧迁移到另一侧。结构分析表明:过渡态aTS2·2H2O分子内的7元环结构基本共面,7元环结构的各个氢键角接近平角。势能面计算表明:a是主反应通道,决速步自由能垒为249.5 kJ·mol-1,由质子从手性碳向氨基氮迁移的过渡态产生;2个水分子作H迁移媒介,同时考虑连续介质模型的水溶剂化效应时,决速步自由能垒降到113.2 kJ·mol-1, 反应速率常数为5.85×10-8s-1;水溶剂化效应使氨基异构反应的能垒从裸反应的13.4 kJ·mol-1升高到19.3 kJ·mol-1。结果表明:水溶剂化效应对非质子迁移的异构反应具有阻碍作用;水分子的催化和水溶剂化效应的共同作用,使质子从手性碳向氨基迁移反应的能垒大幅度降低。
手性;亮氨酸;自洽反应场;密度泛函理论;过渡态;微扰论
亮氨酸(Leu)是一种人体必需氨基酸,分为左旋体(S-Leu)和右旋体(R-Leu)。已有文献[1]报道,生命体内除S-Leu外,也同时存在R-Leu。目前,有关R-Leu等氨基酸的来源,多认为其一部分来自S-氨基酸的消旋化[2-3],但具体的反应机制尚不清楚。Leu在生命体内具有重要的作用[4],可以降低血液中的血糖、治疗头晕、促进皮肤伤口及骨头的愈合。如果Leu缺乏,会使机体停止生长。S-Leu及其衍生物可以延缓皮肤衰老,嫩化肌肤。R-Leu主要用于试剂实验测定和生化研究。

文献[8-13]的研究表明:气相的α-丙氨酸、赖氨酸、半胱氨酸和缬氨酸等氨基酸的手性转变均有4个反应通道。手性碳上的质子H可以羰基、氨基、羰基与氨基联合以及羟基为桥迁移,实现手性转变,并且优势反应通道均是手性碳上的质子以氨基为桥迁移。基于上述机理,本文首次研究了单体Leu分子以氨基为桥迁移的手性转变过程。考虑到生命体内的Leu分子处在水环境中,借鉴文献[14]的研究经验,本文进一步研究了水环境对Leu分子手性转变的主反应通道的影响。本工作解释了生命体内R-Leu的存在,对进一步研究Leu在其他环境条件下的手性转变具有重要的指导作用。
1 研究与计算方法
采用密度泛函理论的B3LYP[15-16]方法,选择6-31+G(d, p)基组,全优化S型Leu向R型Leu转变过程中的各个驻点结构。通过对过渡态[17-19]进行内禀反应坐标(IRC)[20-21]计算,对过渡态进行确认。采用微扰理论的MP2方法[22-23],选择6-311++G(2df, pd)基组,计算体系高水平的单点能。利用Gtotal=Esp+Gtc(Gtotal为总自由能,Esp为单点能,Gtc为吉布斯自由能热校正)计算总自由能。对H迁移过程,首先采用微溶剂化模型,把水视为离散介质,水分子直接参与反应。再把水视为连续介质,采用自洽反应场(SCRF)理论的smd模型方法[24]计算溶剂效应。速控步骤的反应速率常数采用公式[25]
计算,式中kB和h分别为玻尔兹曼常数和普朗克常数,ΔG≠为基元反应的活化吉布斯自由能。计算均由Gaussian09[26]程序完成。
2 结果与讨论
2.1S-Leu向R-Leu手性转变的反应通道
在B3LYP/6-31+g(d,p)理论水平,优化得到Leu分子手性对映体结构如图1。
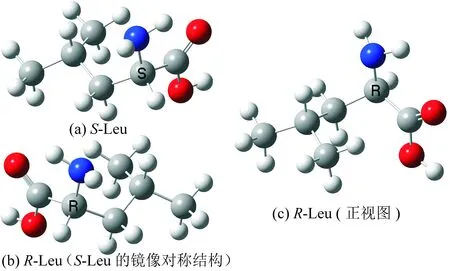
图1 S亮氨酸和R亮氨酸的几何构型Fig.1 The geometries of S and R type Leu molecules
对图1(a)和(c)进行分析发现,S-Leu以氨基氮为质子迁移桥梁的旋光异构可以有2种途径,亦即手性碳上的质子H可以氨基N和羰基氧与氨基氮顺次为桥迁移到纸面里,下面对这2个通道以及主反应通道主要过程的水溶剂效应分别进行讨论。
2.2S-Leu的手性转变机理及水溶剂化效应
2.2.1 单体S-Leu的异构反应S-Leu在a通道的反应历程见图2A。首先,氨基5N上的6H和7H,经它们在纸面里外摆的过渡态a(b)S-TS1(S表示过渡态TS1是S型,a(b)表示此过渡态为a和b通道共有,下同),沿虚频振动的正方向摆到纸面的里侧,形成产物中间体a(b)S-INT1。此基元反应中,二面角6H-5N-1C-7H从121.72°变为-122.42°,基本完成了氨基关于纸面的对称异构,a(b)S-INT1的氨基N朝向读者的一面裸露出来,负电荷的密度大(有孤对电子),氨基N得到质子的能力增强,为手性碳上的质子向其迁移创造了条件。接着是,a(b)S-INT1经过12H向5N迁移的过渡态的aTS2,异构成产物中间体aINT2,aINT2的氨基是质子化的。此基元反应a(b)S-INT1到aTS2的过程中,1C-12H键长从0.109 83 nm增加到0.135 74 nm 断裂,1C-5N键长从0.145 82 nm增加到0.157 61 nm断裂,两个化学键的增长及断裂,需要一定的能量,因此aTS2会产生较高的能垒。然后,aINT2经过渡态aTS3, 实现了7H在纸面里从质子化氨基向手性碳1C的迁移,形成第1产物aP1_R-Leu, 完成手性转变。从aINT2到aTS3的过程中,7H-5N键长从0.102 34 nm增加到0.117 61 nm断裂,1C-5N键长从0.148 36 nm增加到0.157 61 nm断裂,此基元反应也是两个化学键的增长及断裂,因此aTS3也会产生较高的能垒。此过程与a(b)S-INT1到aTS2过程相比较,化学键键长的增幅减小,这预示着aTS3产生的能垒不及aTS2,后面的势能面计算说明了此分析的正确。最后,aP1_R-Leu经过6H和12H在纸面里外摆动的过渡态aR-TS4,沿着虚频振动的正方向翻转到纸面里,异构成产物aP1_R-Leu的异构体aP2_R-Leu。此基元反应过程中氨基构象几何参数的变化与第1个基元反应相似,不再赘述。后面的势能面计算表明,产物可以aP1_R-Leu和aP2_R-Leu两种构象共存。
S-Leu的b通道的主要反应历程见图2B。其第1个基元反应同于a通道,然后,a(b)INT1经质子从手性碳1C向羰基氧9O迁移的过渡态bTS2,异构成第2中间体bINT2。此基元反应的反应物到过渡态过程,1C-12H键长从0.109 83 nm 增加到0.155 30 nm并且断裂。此基元反应过程1C-12H键长改变,远大于前面a通道第2基元反应中1C-12H和1C-5N两个化学键的伸长,因此12H向9O迁移需要更多的能量,亦即bTS2产生的能垒要高于aTS2。接着,bINT2经过渡态bTS3,12H沿着过渡态虚频振动的负方向运动,实现12H从9O向5N的迁移,异构成中间体产物bINT3。从bINT2到bTS3,12H-9O键长从0.098 10nm 增加到0.136 83 nm且断裂,这需要一定的能量。但由于在bTS3分子内形成了基本共面的5元环结构(二面角12H-5N-1C-8C和12H-9O-1C-5N分别为0.710°和0.120°),增加了过渡态的稳定性。因此,bTS3产生的能垒又不会太高。计算表明,bINT3和aINT2的能量和几何参数基本相同,bINT3以后的过程同于aINT2后面的过程,从略。
B3LYP/6-31+g(d,p)水平下得到的驻点结构和过渡态在虚频的振动模式见图2的A和B,各驻点的吉布斯自由能热校正及过渡态的虚频见表1。
在MP2/6-311++G(2df, pd)理论水平计算的单点能见表1。热校正的总自由能见表1,以S-Leu总自由能为自由能零点的相对总自由能亦见表1。
2.2.2S-Leu异构主反应通道主要过程的溶剂化效应 将a通道的第1个基元反应各个物种置于水相,在MP2/6-311++G(2df, pd)∥B3LYP/6-31+g(d,p)双水平下,采用自洽反应场(SCRF)理论的smd模型进行结构优化与单点能计算。各物种的吉布斯自由能热校正、过渡态虚频、单点能、总自由能及相对总自由能列于表2。
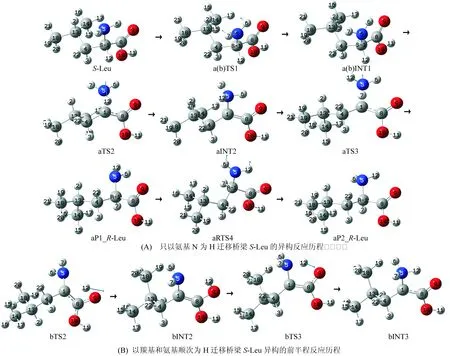
图2 S-Leu向R-Leu旋光异构的反应历程Fig.2 The reaction process of S-Leu to R-Leu optical isomerism
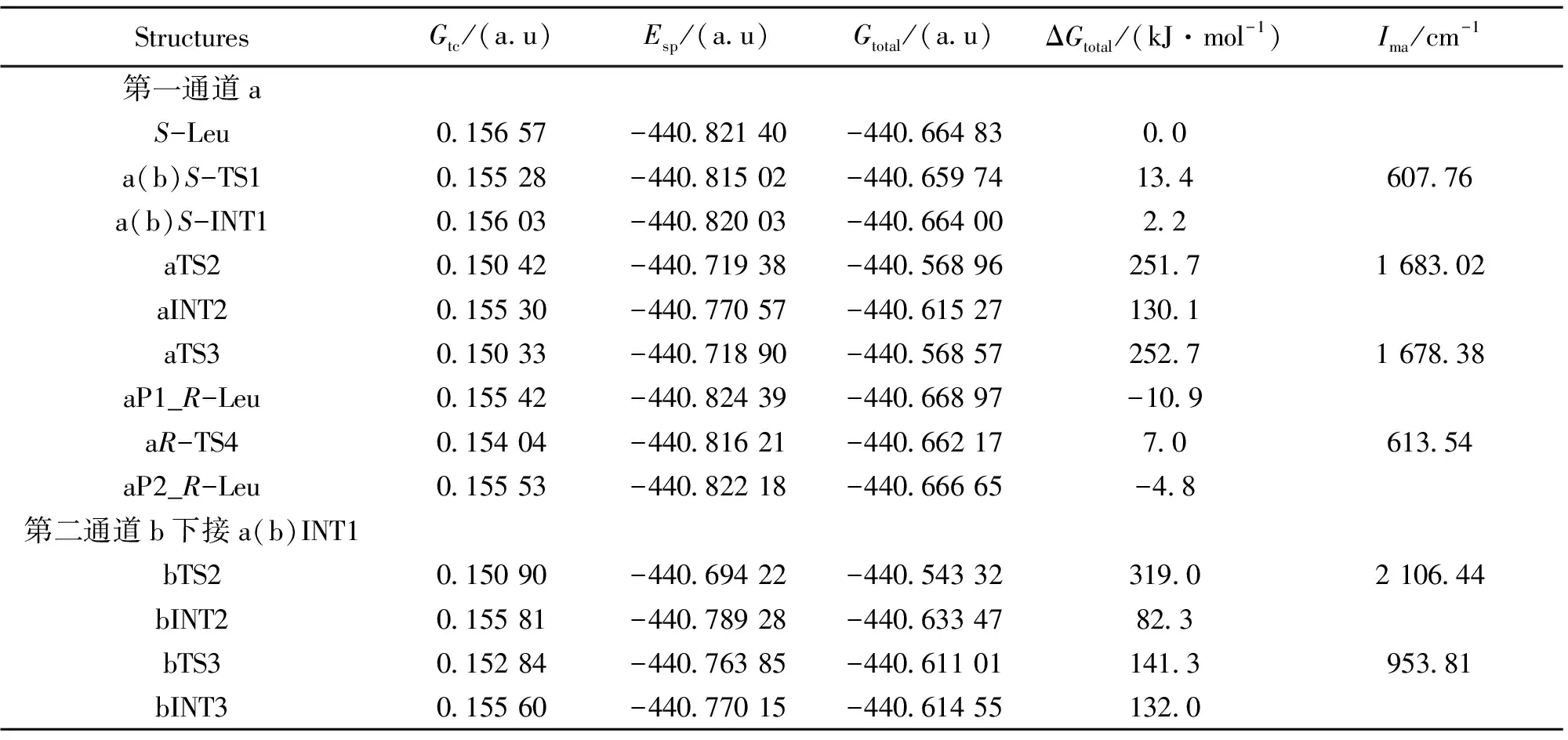
StructuresGtc/(au)Esp/(au)Gtotal/(au)ΔGtotal/(kJ·mol-1)Ima/cm-1第一通道aS-Leu015657-44082140-4406648300a(b)S-TS1015528-44081502-4406597413460776a(b)S-INT1015603-44082003-4406640022aTS2015042-44071938-440568962517168302aINT2015530-44077057-440615271301aTS3015033-44071890-440568572527167838aP1_R-Leu015542-44082439-44066897-109aR-TS4015404-44081621-440662177061354aP2_R-Leu015553-44082218-44066665-48第二通道b下接a(b)INT1bTS2015090-44069422-440543323190210644bINT2015581-44078928-44063347823bTS3015284-44076385-44061101141395381bINT3015560-44077015-440614551320
对第2个基元反应,采用微溶剂化模型,即把水视为离散介质。已有文献研究[12-14]表明,2个水分子构成的链对质子从手性碳向氨基氮的迁移已有很好的催化作用,因此,本工作讨论2个水分子助aINT1向aINT2的异构。2个水分子构成的链作H迁移桥梁的反应历程见图3,2个水分子与aINT1以氢键结合形成水合分子aINT1·2H2O,经过渡态aTS2·2H2O,异构成中间体产物水合分子aINT2·2H2O(m)(m表示水分子在aINT2的前面)。结构分析表明,aTS2·2H2O分子内的7元环结构基本构面(二面角1C-26H-24O-25H、24O-25H-23O-12H和23O-12H-5N-1C分别为6.13°、-0.105°和3.608°),张力很小;7元环结构中的各个氢键接近于180.00°(1C-26H-24O、24O-25H-23O和23O-12H-5N各个氢键角分别为163.63°、160.36°和165.54°),氢键较强。所以,aTS2·2H2O分子构象较稳定,产生的能垒不是很高。对第3个基元反应,水分子是在aINT2的后面通过氢键与aINT2形成的氢键络合物aINT2·2H2O(n),经过渡态aTS3·2H2O,异构成产物络合物aP1_R-Leu·2H2O。aTS3·2H2O和aTS2·2H2O的能量相差无几,但aINT2·2H2O(n)的能量低于aINT1·2H2O的能量,因此,越过aTS3·2H2O需要的能量更低。
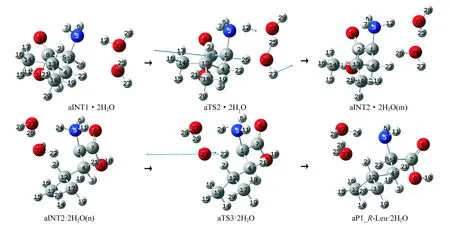
图3 质子以2个水分子构成的链作媒介从手性碳向氨基氮迁移的反应历程Fig.3 The reaction process of the proton transfer from the chiral carbon to amino nitrogen with the chain composed of two water molecules as the medium

StructuresGtc/(au)Esp/(au)Gtotal/(au)ΔGtotal/(kJ·mol-1)Ima/cm-1S-Leu@water015539-44083449-4406791000a(b)S-TS1@water015437-44082611-4406717419368683a(b)S-INT1@water015483-44083512-44068029-31微溶剂模型aINT1·2H2O019754-59348331-5932857700aTS2·2H2O019698-59343168-59323470134189989aINT2·2H2O(m)019965-59344266-593243011123微溶剂与连续介质模型aINT1·2H2O@water019754-59350693-5933093900aTS2·2H2O@water019698-59346327-59326629113289989aINT2·2H2O(m)@water019965-59347388-59327423923微溶剂模型aINT1·2H2O(n)019985-59344160-5932417500aTS2·2H2O019721-59343062-59323341219100984aINT2·2H2O019586-59348448-593288621231微溶剂与连续介质模型aINT1·2H2O(n)@water019985-59347065-5932708000aTS2·2H2O@water019721-59345892-59326171239100984aINT2·2H2O@water019586-59350725-593311391066
在与前面相同的水平计算的各物种的吉布斯自由能热校正、过渡态虚频、单点能、总自由能及相对总自由能,见表2。为计算水相的反应的能垒,将各个物种再置于水相,采用SCRF理论的smd模型,在MP2/6-311++G(2df, pd)理论水平计算单点能,计算值见表2(为简单起见,吉布斯自由能热校正仍用微溶剂化模型的结果)。
2.2.3 标题反应的势能面 根据表1和表2的数据,画出了标题裸反应和水环境下a通道主要反应过程的吉布斯自由能势能面,见图4。
从图4可以看出,a和b两通道相比,a通道具有优势,决速步是第2基元反应,吉布斯自由能垒是249.5 kJ·mol-1,是质子从手性碳向氨基氮迁移的过渡态产生的。以2个水分子作为H迁移媒介时,决速步自由能垒被降到134.1 kJ·mol-1。再考虑到连续介质模型的水溶剂化效应时,决速步自由能垒被降到113.2 kJ·mol-1。生命体内的温度是310.65 K,计算得到决速步反应速率常数为5.85×10-8s-1。因此,水分子的催化和水溶剂化效应的共同作用,使质子迁移的能垒大幅度降低。若再考虑到生命体内温度的涨落以及分子之间不断的碰撞,越过113.2 kJ·mol-1能垒的几率是存在的,这说明S-Leu在生命体内旋光异构可以发生,从一个侧面解释了生命体内R-Leu的存在。从图4还可以看出,溶剂效应对于第1个基元反应,非质子迁移的氨基异构反应具有阻碍作用,使能垒从裸反应的13.4 kJ·mol-1升高到19.3 kJ·mol-1。溶剂效应对于第3个基元反应,质子迁移过程有较小的阻碍作用,使能垒从气相水分子助质子迁移反应的21.9 kJ·mol-1升高到23.9 kJ·mol-1,这说明溶剂效应对质子迁移过程并不总是起助催化作用。
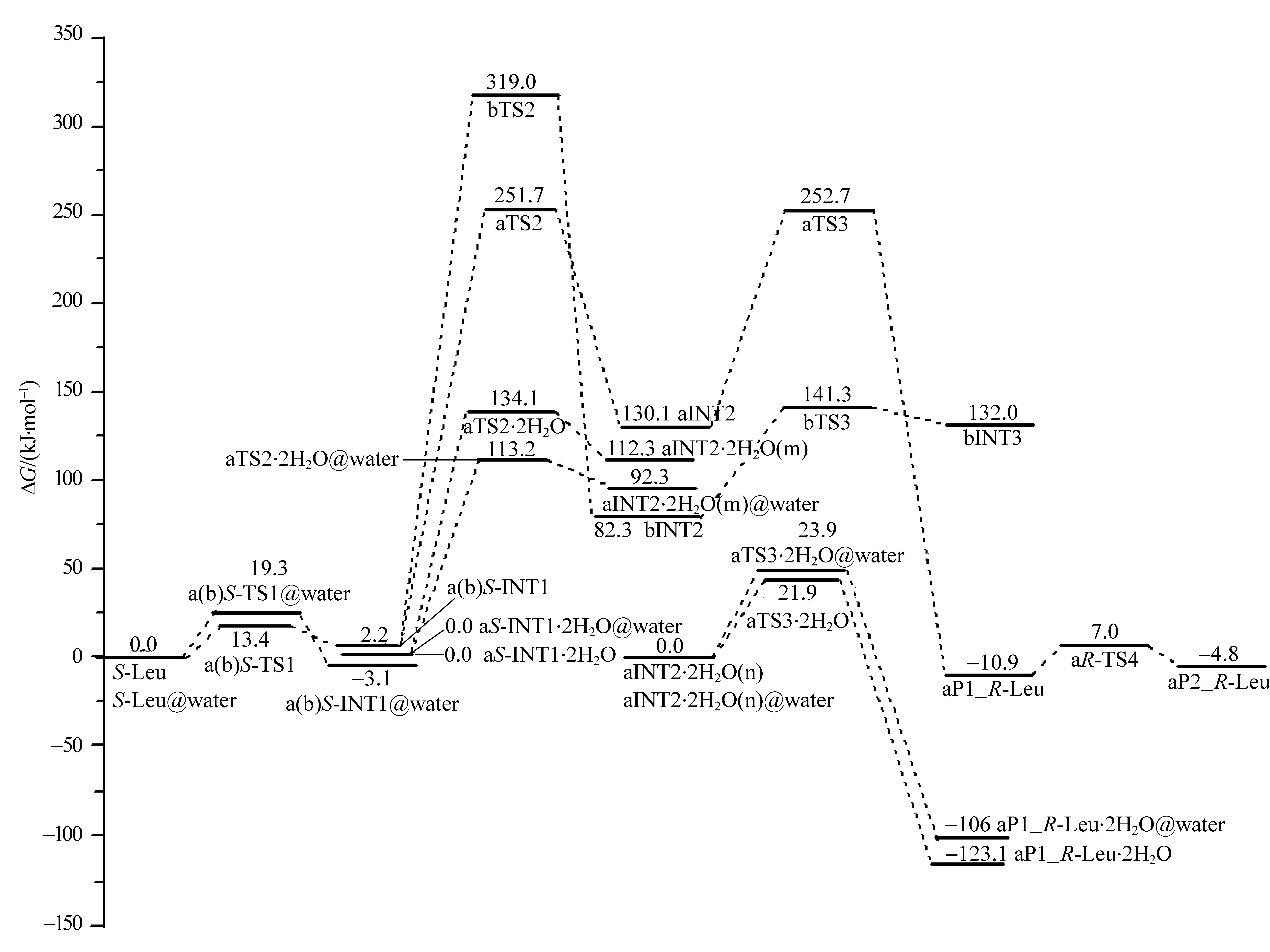
图4 S-Leu向R-Leu旋光异构反应的吉布斯自由能势能面Fig.4 Gibbs free potential energy surfaces diagram of S-Leu to R-Leu optical isomerism reaction
3 结 论
反应通道研究发现:标题反应有2条通道a和b,分别是质子H只以氨基氮和以羰基氧与氨基氮顺次为桥,从手性碳的一侧迁移到另一侧。结构分析表明:过渡态aTS2·2H2O的7元环结构中,各个原子间的二面角均在10°以内,7元环结构趋于共面;各个氢键键角均大于160°,接近平角,氢键较强。说明aTS2·2H2O结构较稳定,不会产生较高的能垒。势能面计算表明:a是主反应通道,决速步自由能垒为249.5 kJ·mol-1,是由质子从手性碳向氨基氮迁移的过渡态产生的;2个水分子作H迁移媒介时,决速步自由能垒降到134.1 kJ·mol-1;若同时考虑连续介质模型的水溶剂化效应时,决速步自由能垒被降到113.2 kJ·mol-1;水溶剂化效应使氨基上的氢从纸面外向纸面里翻转异构的能垒从裸反应的13.4 kJ·mol-1升高到19.3 kJ·mol-1。结果表明:水溶剂化效应对非质子迁移的异构反应具有阻碍作用;水分子的催化和水溶剂化效应的共同作用,使质子从手性碳向氨基氮迁移的能垒大幅降低,是亮氨酸在生命体内旋光异构的一个原因。
[1] 赵华. 苏氨酸、异亮氨酸立体异构体的手性色谱分离及其在哺乳动物体内分布的研究[D]. 重庆:重庆医科大学药学院,2006. ZHAO H. Determination of the four threonine isomers and isoleucine in mammals[D].Chongqing: Chongqing Medical University College of Pharmacy, 2006.
[2] TOHRU Y, NOBUYOSHI E. Amino acid racemases:Functions and mechanisms[J] J Bioscience and Bioengineering, 2003, 96: 103-109.
[3] WOLOSKER H, BLACKSHAW S, SOLOMON H. Snyder, Serine racemase: a glial enzyme synthesizingD-serine to regulate glutamate-N-methyl-D-aspartate neurotransmission[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96: 13409-13414.
[4] 孟仕平,丁玉,黄姗姗.L-亮氨酸的生理功能和分离纯化技术[J].食品工业科技,2011 (4): 441-444. MENG Shiping,DING Yu,HUANG Shanshan. Physiological function and separation & purification technology ofL-leucine[J].Sciedce and Technology of Food Industry, 2011 (4): 441-444.
[5] 罗明道,王辉宪,颜肖慈,等. 亮氨酸、异亮氨酸的结构与热力学性质研究[J]. 武汉大学学报(自然科学版),1995,41(4): 439-443. LUO Mingdao,WANG Huixian,YAN Xiaoci, et al. The Study on molecular structure and thermodynamic properties of Leucine and isoleucine[J]. Journal of Wuhan University(Natural Science Edition), 1995,41(4): 439-443.
[6] 黎新. 亮氨酸热分解机理的DFT研究[J]. 西南师范大学学报(自然科学版),2007, 32(5): 39- 42. LI Xin. DFT studies on thermolysis mechanism of leucine[J]. Journal of Southwest China Normal University(Natural Science),2007, 32(5): 39- 42.
[7] 周光明,虞丹尼,黎司,等. 亮氨酸与异亮氨酸的表面增强拉曼光谱[J]. 化学学报,2007, 65(7): 640- 644. ZHOU Guangming, YU Danni, LI Si, et al. Surface enhanced Raman spectroscopy of leucine and isoleucine[J]. Acta Chimica Sinica, 2007, 65(7): 640- 644.
[8] 王佐成,刘凤阁,吕洋,等.孤立条件下α-丙氨酸分子手性转变机制的DFT研究[J]. 吉林大学学报(理学版), 2014, 52 (4): 825-830. WANG Zuocheng, LIU Fengge, LÜ Y, et al. The DFT research on the chiral transformaition mechanism of alpha alanine under isolated condition[J]. Journal of Jilin University: Science Edition, 2014, 52(4): 825-830 .
[9] 王佐成,佟华,梅泽民,等. α-丙氨酸分子手性转变反应通道及水分子作用的理论研究[J]. 浙江大学学报(理学版),2015, 42 (2):189-197. WANG Zuocheng,TONG Hua, MEI Zemin, et al. Theoretical research on the chiral transformation pathway of α-alanine and effect of water molecules[J]. Journal of Zhejiang University(Science Edition), 2015, 42 (2):189-197 .
[10] 刘凤阁,闫红彦,王佐成,等. 气相赖氨酸分子手性转变机制的理论研究[J]. 武汉大学学报(理学版),2015,61(1): 93-98. LIU Fengge, YAN Hongyan, WANG Zuocheng, et al. Theoretical research on chiral change mechanism of gaseous lysine molecules[J]. Journal of Wuhan University(Natural Science Edition), 2015,61(1): 93-98.
[11] 李忠,佟华,王佐成,等.基于氨基作H转移桥梁单体α-Ala的手性转变机理[J].复旦学报(自然科学版), 2015, 54(5): 102-108. LI Zong, TONG Hua, WANG Zhuocheng , et al. The chiral transition mechanism of monomer α-Alanine based on amino as H transfer bridge[J]. Journal of Fudan University(Natural Science), 2015, 54(5): 102-108 .
[12] 王佐成,范志琳,梅泽民,等. 半胱氨酸分子手性转变及水分子的催化机理[J]. 武汉大学学报(理学版),2016,62(3): 368-37498. WANG Zuocheng, FAN Zhilin, MEI Zemin, et al. Chiral transformation of cysteine molecules and catalytic mechanism of water molecules[J]. Journal of Wuhan University(Natural Science Edition), 2016,62(4): 368-374.
[13] 闫红彦,王佐成,邹晶,等. 缬氨酸分子的手性转变及水分子的催化机理[J]. 中山大学学报(自然科学版), 2016, 55(2): 68-75. YAN Honghong, WANG Zuocheng, ZON Jing, et al. Chiral enantiomers transformation of valine and catalytic mechanism of water molecules[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016,55(2): 68-75.
[14] 王彦全,王佐成, 闫红彦,等. 水环境下基于氨基作氢迁移桥梁α-丙氨酸的手性转变机制[J]. 中山大学学报(自然科学版), 2016, 55(5): 15-23. WANG Yanquan, WANG Zuocheng, Yan Hongyan, et al. Chiral transition mechanism of α-alanine molecule under the water environment based on using anmino as hydrogen transfer bridges[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2016, 55(5): 57- 65.
[15] BECKE A D. Density-functional thermochemistry. Ⅲ. The role of exact exchange [J]. Chem Phys, 1993, 98(7): 5648-5652.
[16] PARR R G, YANG W. Density-functional theory of atoms and molecules[M]. USA:Oxford University Press, 1994.
[17] EYRING H. The activated complex and the absolute rate of chemical reaction [J]. Chemical Reviews, 1935, 17(1): 65-77.
[18] GARRETT B C, TRUHLAR D G. Generalized transition state theory. Classical mechanical theory and applications to collinear reactions of hydrogen molecules [J]. Journal of Physical Chemistry, 1979, 83(8): 1052-1079.
[19] GARRETT B C, TRUHLAR D G. Criterion of minimum state density in the transition state theory of bimolecular reactions [J]. The Journal of Chemical Physics, 1979, 70(4): 1593-1598.
[20] GONZALEZ C, SCHLEGEL H. Reaction path following in mass-weighted internal coordinates [J]. Journal of Physical Chemistry, 1990, 94(14): 5523-5527.
[21] ISHIDA K, MOROKUMA K, KOMORNICKI A. The intrinsic reaction coordinate. Anabinitiocalculation for HNC→HCN and H-+ CH4→CH4+ H-* [J]. The Journal of Chemical Physics, 1977, 66(5): 2153-2156.
[22] 徐光宪,黎乐民,王德民. 量子化学(中册)[M]. 北京:科学技术出版社,1985: 962-986.
[23] BINKLEY J S, POPLE J A. Moeller-Plesset theory for atomic ground state energies[J]. Int J Quantum Chem, 1975,9(2):229-236.
[24] MARENICH A V, CRAMER C J, TRUHLAR D G. Universal slovation model based on solute electron density and on a continuum model of the solvent defined by the bulk dielectric constant and atomic surface tensions[J]. J Phys Chem B, 2009, 113 (18):6378-6396.
[25] 任宏江. 黄嘌呤异构体质子转移异构化反应机理的理论研究[J]. 化学通报,2015, 78(9): 815-819. REN Hongjiang. Theoretical investigation on the proton transfer isomerization of xanthine[J]. Chemistry Bulletin Chem Bul, 2015, 78(9): 815-819.
[26] FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09. Revision E.01 [M]. Pittsburgh, USA:Gaussian, Inc, Wallingford CT, 2013.
Chiral transition mechanism and water solvation effect of leucine molecules based on the amino proton transfer bridge
ZHAOXiaobo1,LIChenjie2,WANGZuocheng3,YUXiaoji4,YANHongyan5,YANGXiaocui3,TONGHua3
(1. College of Chemistry, Baicheng Normal College, Baicheng 137000, China; 2. College of Media, Baicheng Normal College, Baicheng 137000, China; 3. College of Physics and Electronic Information, Baicheng Normal College, Baicheng 137000, China; 4. Foreign Languages School, Changchun Normal University, Changchun 131000, China; 5.College of Computer Science, Baicheng Normal College, Baicheng 137000, China)
The title reaction mechanism was explored by using the B3LYP density functional theory, the MP2 method of perturbation theory and smd model method of self consistent reaction field theory. The study of reaction channels showed that there are two channels a, b in the chiral transition reaction, and in the one the proton is transferred from one side to the other of chiral carbon with only the amino as a bridge, in the other with carbonyl and amino N as the bridge successively. The molecular structure analysis showed that the seven-ring structure in the transition state aTS2·2H2O is almost coplanar and each hydrogen bond angles of the seven-ring structure approach straight angle. Calculations of potential energy surface pointed out that the channel a is the dominant reaction channel and the free energy barrier of the rate-determining step is 249.5 kJ·mol-1, which is caused by the transition state with proton migration from chiral carbon to amino nitrogen. Moreover, with consideration of two water molecules as H transfer media and with inclusion of the water solvation effect of the continuous medium model,, the free energy barrier of the rate-determining step is reduced to 113.2 kJ·mol-1and the reaction rate constant is 5.85×10-8s-1, and the water solvation effect enables the energy barrier of the amino heterogeneous reaction increased from 13.4 kJ·mol-1to 19.3 kJ·mol-1. Therefore, water solvation effect can hinder the heterogeneous reaction of non proton transfer, and the interaction of the catalytic action of water molecules and water solvation effect can cooperatively reduce the proton transfer reaction energy barrier to a large degree.
chiral; leucine; self consistent reaction field; density functional theory; transition state; perturbation theory.
10.13471/j.cnki.acta.snus.2017.03.013
2016-09-03 基金项目:吉林省科技发展计划资助项目自然科学基金(20130101308JC; 20160101308JC)
赵晓波(1972年生),男;研究方向:物理化学;E-mail: zhaoxb0514@126.com
王佐成(1963年生),男;研究方向:单分子反应机理;E-mail:wangzc188@163.com
O641.12
A
0529-6579(2017)03-0085-08

