长江口盐度梯度下有色溶解有机物的分布、来源与季节变化
徐亚宏,姚鹏,苏荣国,赵彬
(1.中国海洋大学 海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100; 2. 中国海洋大学 化学化工学院, 山东 青岛 266100)
长江口盐度梯度下有色溶解有机物的分布、来源与季节变化
徐亚宏1, 2,姚鹏1*,苏荣国2,赵彬1, 2
(1.中国海洋大学 海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100; 2. 中国海洋大学 化学化工学院, 山东 青岛 266100)
通过测定有色溶解有机物(CDOM)的吸收光谱和荧光光谱研究了2015年3月和7月长江口盐度梯度下CDOM的分布、组成、来源及河口混合行为等。利用激发发射矩阵荧光光谱(EEMs)并结合平行因子分析(PARAFAC),研究了CDOM的荧光组分特征,共识别出两类4个荧光组分组成,即类腐殖质荧光组分C1(260,375/490 nm)、C2(365/440 nm)、C3(330/400 nm)及类蛋白质荧光组分C4(295/345 nm)。结果表明,3月和7月,4种荧光组分的分布模式与总荧光强度都基本一致:从口内到口外,先升高后降低,且4种组分都在河口呈现不保守混合行为,在最大浑浊带处存在添加过程,达到峰值,在口外有去除过程。3月腐殖化指数HIX范围在1.12~7.19,而7月HIX的范围在0.87~6.71;生物指数BIX在3月范围在0.76~1.11,7月为0.62~1.15,表明3月CDOM的腐殖化程度较7月高,而自生贡献比例较7月略低。3月吸收系数α(355)的平均值为0.55 m-1, 7月的略高,为0.61 m-1,表明7月长江口CDOM的含量略高。光谱斜率比值SR的季节性变化不大,都是近岸低,远岸高,表明CDOM的平均分子质量从口内到口外在逐渐增加。
长江口;最大浑浊带;有色溶解有机物;三维荧光-平行因子分析;吸收光谱;季节变化
1 引言
有色溶解有机物(colored dissolved organic matter,CDOM),又称黄色物质(yellow substance),是水体中富含腐殖酸、富里酸、氨基酸和芳烃聚合物等的一类溶解性有机物[1]。CDOM是天然水体DOM储库中主要的吸光物质,尤其是对紫外和可见光的吸收,被认为是海洋中最大的溶解有机碳(dissolved organic carbon,DOC)贮库[2]。CDOM通过吸收紫外光,能有效阻止有害紫外线对水体微生物的伤害,从而保护水生生态系统;另外,CDOM吸收紫外光后发生光化学反应,可以产生大量的小分子量的有机物,为浮游植物所利用[3]。但另一方面,CDOM对可见光的吸收会抑制光合作用,降低初级生产力;CDOM也是重金属和有机污染物的重要载体,影响重金属和有机污染物的迁移转化等过程[4]。在河口、近海等区域CDOM的主要来源为陆地径流输入;在远离河流影响的开阔大洋,海洋自生生物活动为其主要来源[1,5]。在河口区域,CDOM的来源、组成和分布等受到河流输入和海洋自生等因素的共同影响,淡咸水混合过程中特有的生物地球化学作用也会对CDOM的归宿产生重要影响。因此,研究CDOM在河口的混合行为,对于深入认识CDOM在海洋中的源汇过程和海洋碳循环等有重要意义。利用平行因子分析(parallel factor analysis,PARAFAC)技术来对三维荧光光谱(excitation-emission matrices,EEMs)进行解谱,鉴别出其中的单一荧光组分和浓度,是近年来研究CDOM的常用分析技术[3, 6—7]。该方法能够根据CDOM各成分的性质、来源、迁移转化途径等的不同,将CDOM各成分“剥离”,较好地解析CDOM组成,是已知的最有效的CDOM分析技术之一,在土壤有机物、河口边缘海、大洋海水的CDOM研究中得到广泛应用[3,6—10]。EEMs-PARAFAC已成为研究水环境中CDOM的组成及其组分之间的动力学特征的重要工具之一。此外,吸收光谱是另一种能提供水体中CDOM相对含量及相对分子量大小等定性定量信息的光谱分析手段,常与荧光光谱分析方法结合使用,为水体的碳循环及水生态系统光化学环境的研究提供有力参考[11—12]。
长江是我国第一大河,世界第三大河,其年均输沙量和输水量分别在世界排名第四和第五[13]。长江径流入海后与海水混合,并向外冲溢而形成东、黄海最显著的水文特征之一,即长江冲淡水[14—15]。长江口混合区域受强烈的潮汐活动、人类活动和陆源径流输入等诸多因素影响,其碳循环的地球化学机制相对复杂。而位于河口段和口外海滨间的拦门沙地区,水体含沙量特别高,发育着最大浑浊带[13],对此处生源要素的生物地球化学过程具有独特的影响,也使得CDOM的迁移转化更加复杂[16]。虽然对长江口及邻近海域CDOM的分布、来源和光学特性已有大量研究,如范冠南等[17]发现长江口外邻近海域CDOM吸收系数的值由近岸向远岸递减,而光谱斜率的分布则相反,两者呈现良好地负相关关系;朱伟健等[18]发现长江口口外区域表层CDOM浓度受潮汐活动影响显著;王翔等[19]获得了长江口冲淡水与外海水团交汇的锋面区域CDOM吸收特性的分布特征与邻海区域类似。之前的研究多集中在河口外区域,且仅讨论CDOM的荧光特性或是吸收特性,很少有研究聚焦在长江口内和最大浑浊带区域,讨论淡咸水混合过程中CDOM荧光特性和吸收特性两者的变化。本文通过对2015年3月和7月在长江口采集的两个航次的CDOM样品进行EEMs-PARAFAC分析,并结合吸收光谱分析,研究了长江口盐度梯度下CDOM的光学性质、河口混合行为的季节变化特点,以期丰富对长江口CDOM生物地球化学过程的认识,为全面了解长江口碳的生物地球化学循环提供基础。
2 材料与方法
2.1 样品的采集与预处理
2015年3月和7月利用“润江1号”科考船在长江口进行了两个航次的调查,西起121°E徐六泾附近,东至124°E,盐度从0至33,共19个站位,具体采样位置如图1所示。3月长江下游大通水文站的水流量为20 822 m3/s,7月为49 560 m3/s(数据来源:http://xxfb.hydroinfo.gov.cn)。每个站位取表层水样(0.5 m深),用孔径0.7 μm的GF/F膜(预先用马弗炉在450℃时灼烧5 h)过滤并收集于100 mL 洁净玻璃瓶(预先用马弗炉在450℃时灼烧4~5 h)中,于-20℃冷冻保存。水样带回实验室后,解冻至室温,用孔径0.22 μm的一次性聚醚砜针头滤器过滤后进行荧光光谱和吸收光谱的测定。盐度使用哈希HQ40d多参数水质分析仪在现场直接测定。
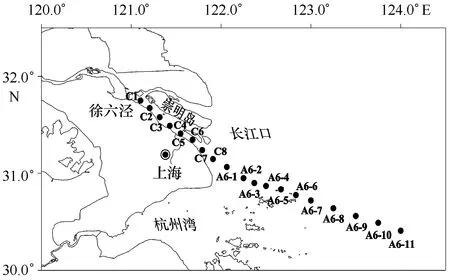
图1 长江口2015年3月和7月采样站位 Fig.1 Sampling sites in the Changjiang Estuary in March and July, 2015
2.2 样品测定
2.2.1 三维荧光光谱测定
用Jobin Yvon Fluorolog-3三维荧光光谱仪进行荧光扫描[3,7]。以Milli-Q水为空白,配1 cm石英比色皿,450 W氙弧灯做光源,光电倍增管电压为700 V;激发波长(Ex)240~480 nm,发射波长(Em)250~580 nm,增量都为5 nm,狭缝宽度都为5 nm,扫描信号积分时间为0.05 s。用QSU单位来表示水样CDOM的相对含量。1 QSU为1 μg/L硫酸奎宁溶于0.05 mol/L 硫酸溶液,在λEx= 350 nm、λEm=450 nm处测得的荧光强度[19]。
2.2.2 吸收光谱测定
吸收光谱采用岛津UV-2550紫外可见分光光度计进行测定,在200~800 nm范围内进行光吸收测定,间隔1 nm,配5 cm石英比色皿,以0.22 μm聚醚砜滤膜过滤后的Milli-Q水为参比进行扫描,得到CDOM的光吸收曲线[3,7,20—21]。为校正海水与参比Milli-Q水之间折射率差异及水样中细小颗粒物、胶体的反射和散射引起的基线漂移,所有吸光度值均扣除700~800 nm波长范围的平均值。本文用355 nm 处的吸收系数α(355)表示CDOM的相对浓度,以下式计算[9]:
α(λ)=2.303A(λ)/L,
(1)
式中,A(λ)为波长λ时的吸光度,本式中λ=355,L为比色皿长度(单位:m)。
光谱斜率S采用非线性拟合的方法计算,计算式如下:
a(λ)=a(λ0)exp[S(λ0-λ)],
(2)
式中,a(λ)是波长λ时的吸收系数,a(λ0)是参照波长λ0时的吸收系数,本文中λ0选择440 nm[22-23]。用275~295 nm 与350~400 nm之间的光谱斜率比值SR表示CDOM的相对分子质量大小。
2.3 EEMs 的平行因子分析
2.3.1 平行因子模型
PARAFAC 是一种利用交互最小二乘法使得数据的残差平方和最小的算法,是一种解析三维荧光光谱常用的方法。PARAFAC 利用模型来确定组分的峰位置,使分析过程简便快捷,并且提高了分析的灵敏度。利用其分析的解的唯一性,可以成功区分化学结构相似的荧光组分[3,9—10]。因此采用PARAFAC模型对CDOM 的三维荧光光谱进行分解,以识别长江口CDOM 的荧光组分特征[3,7]。该分析在 Matlab 7.6中使用DOMFluor工具箱进行,用残差分析得出组分数,再通过折半分析对分离出的组分进行验证[9]。
2.3.2 荧光强度的计算
通过PARAFAC模型可得到每种成分的相对荧光强度(scores),各成分的荧光强度In按下式计算[3]:
In=Scoren×Exn(λmax)×Emn(λmax),
(3)
式中,Scoren代表第n种成分的相对荧光强度,Exn(λmax)代表第n种成分激发负载最大值,Emn(λmax)代表第n种成分发射负载的最大值。总荧光强度和各荧光组分的相对含量Pn计算公式如下[3]:
(4)
Pn=In/TFI.
(5)
2.4 腐殖化指数和生物指数
腐殖化指数(HIX)和生物指数(BIX)由EEMs光谱计算所得。HIX被用来指示 CDOM 的腐殖化程度和来源,其数值是在λEx=255 nm处,发射波长 435~480 nm 的区域积分值与发射波长为300~345 nm的区域积分值的比值,HIX值越高表示CDOM腐殖化程度越高,稳定性也越好,存在的时间较长[24—25]。陆源CDOM具有较高的HIX,而水体自生或排污而来的CDOM则具有较低的HIX。BIX用来指示CDOM中自生贡献比例,即在λEx=10 nm 处,发射波长380 nm 处的荧光强度值与发射波长 430 nm 处的荧光强度的比值[26]。以浮游植物和细菌的有机体降解产物等生物源为主的CDOM,其BIX值较高;以陆源输入为主的CDOM,其BIX较低。
3 结果与讨论
3.1 长江口CDOM的荧光组分特征
将长江口CDOM样品的三维荧光光谱矩阵输入到PARAFAC模型,并对其进行解析,通过残差分析、折半分析等确定长江口CDOM的荧光性组分为4个(图2,表1),与文献对比可知,其中3个为类腐殖质组分:C1[Ex/Em,(265)375/490]、C2(365/440)和C3(330/400),1个为类蛋白质组分:C4(295/345)[3, 9, 27—29]。
4个组分的荧光特征与其他文献利用PARAFAC模型研究不同水体环境(如河流、河口、边缘海、大洋等)所得到CDOM荧光特征非常相似[3,9,27—29]。组分C1代表了具有最大激发和发射波长的荧光组分,反映了长波类腐殖质的荧光特性,被认为是具有高分子量和高芳香度基团的陆源物质[27],也可能在陆源颗粒有机物的生物地球化学循环过程中产生,主要成分是胡敏酸[28]。C2的最大激发波长和最大发射波长分别在365 nm和440 nm,有研究显示其与还原型辅酶(NADH)的氧化形式泛醌极其相似[30]。这种荧光组分曾在受城市和农业影响极其严重的水域DOM中被发现[3,31]。C3的最大激发和发射波长与海洋类腐殖质M峰相似[29],与在南极湖研究中的一个微生物产生的组分C3也相似[30],在Stedmon和Markager[27]对废水的研究中也发现了该组分,可见该组分有多种来源,可以是生物活动、陆源输入或者人类活动。C4是典型的类蛋白质荧光组分(类色氨酸),在不同的水体环境中均有报道,主要来源是海洋生物活动,但在人类活动影响严重的近海区域,陆源输入经常成为类蛋白质组分的主要来源[29,32—33]。
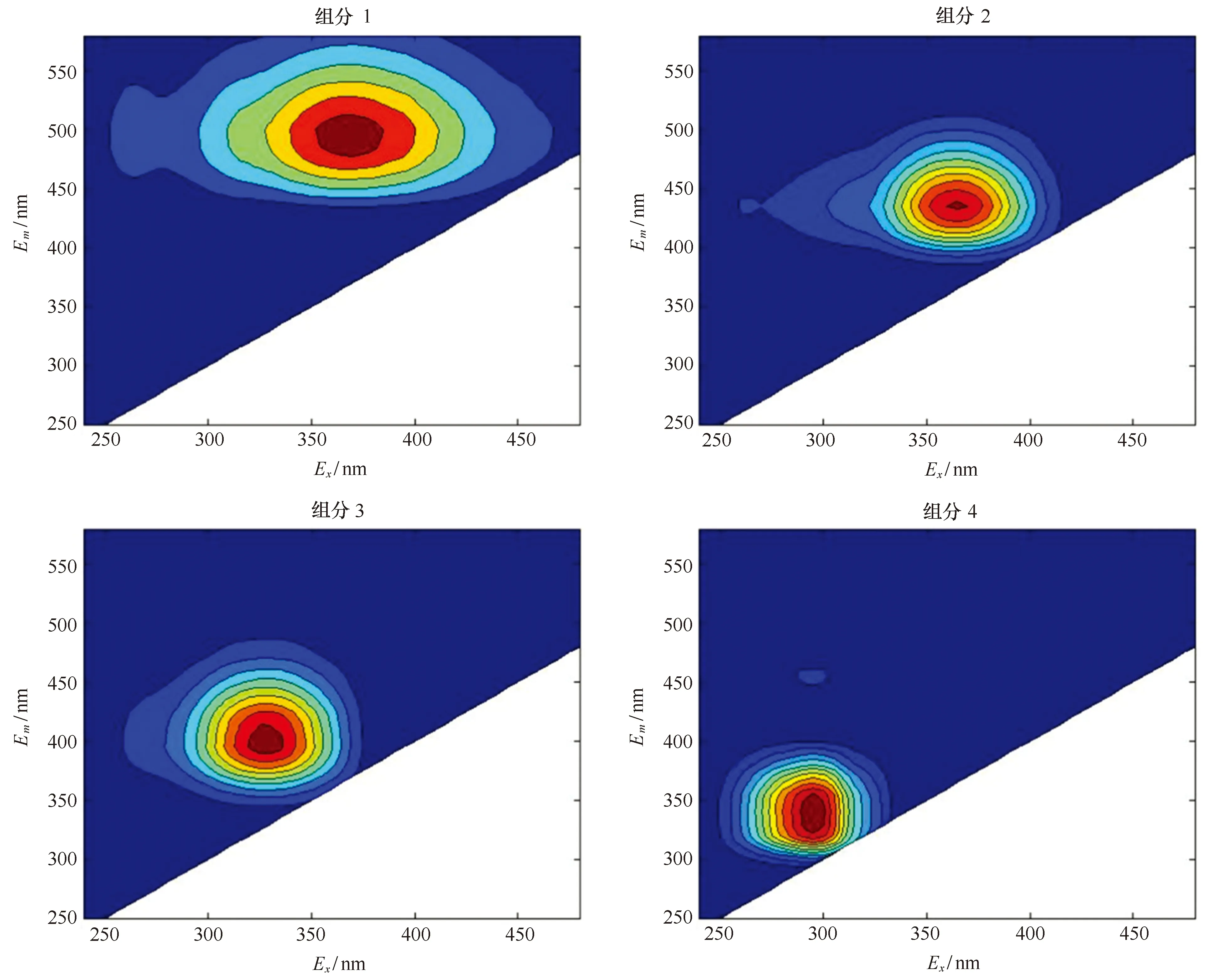
图2 PARAFAC鉴别出的长江口4个CDOM荧光组分Fig.2 Four fluorescent components of CDOM in the Changjiang Estuary by PARAFAC model
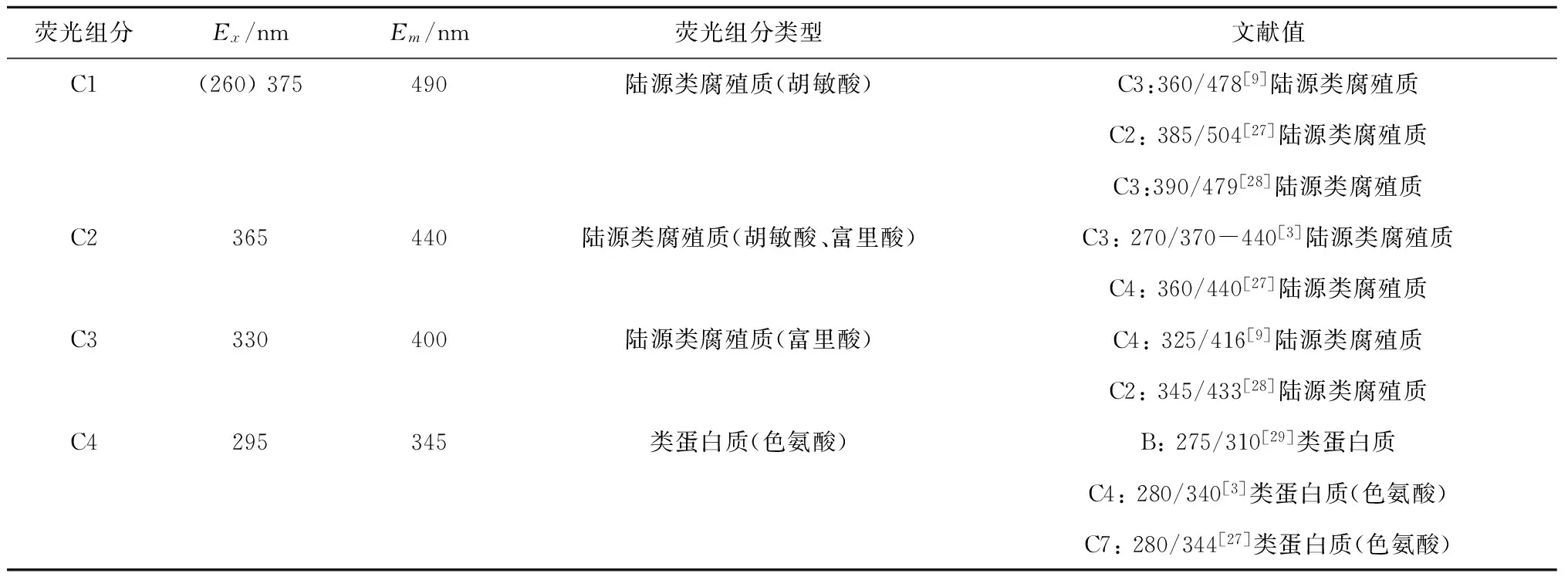
荧光组分Ex/nmEm/nm荧光组分类型文献值C1(260)375490陆源类腐殖质(胡敏酸)C3:360/478[9]陆源类腐殖质C2:385/504[27]陆源类腐殖质C3:390/479[28]陆源类腐殖质C2365440陆源类腐殖质(胡敏酸、富里酸)C3:270/370-440[3]陆源类腐殖质C4:360/440[27]陆源类腐殖质C3330400陆源类腐殖质(富里酸)C4:325/416[9]陆源类腐殖质C2:345/433[28]陆源类腐殖质C4295345类蛋白质(色氨酸)B:275/310[29]类蛋白质C4:280/340[3]类蛋白质(色氨酸)C7:280/344[27]类蛋白质(色氨酸)
3.2 长江口CDOM荧光组分的分布与河口混合行为
两个采样时间的4种组分的荧光强度和对总荧光强度的贡献在长江口的分布均大致相同,7月比3月要复杂一些。3月类腐殖质组分C1、C2和C3的荧光强度的范围分别为0.04~0.73,0.12~1.80和0.12~1.39,7月分别为0.07~1.36,0.10~5.37和0.05~1.00(图3)。这3个荧光组分在河口内都没有减少趋势,在口门附近的最大浑浊带表现出一定的添加行为,之后在河口外混合过程中呈现去除迹象,但它们对总荧光强度的贡献从口内到口外呈下降趋势。7月C6站位的C2组分荧光强度存在异常高值,由图3b可知其值是其他站位C2组分值的数倍,可能与此处离上海市区近,存在排污口且夏季海上活动较多有关,因为该组分曾在污染严重的水域CDOM中被发现[3,27]。组分C4在3月和7月的荧光强度范围分别为0.09~0.94和0.08~0.77,其对总荧光强度的贡献从口内到口外逐渐升高,3月从7.72%到23.09%,7月从4.51%到26.15%。
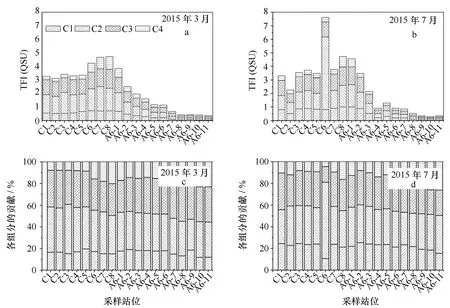
图3 长江口CDOM中各组分荧光强度和对总荧光强度的贡献Fig.3 Fluorescence intensity and contribution to the total fluorescence intensity of four fluorescent components in CDOM of the Changjiang Estuary
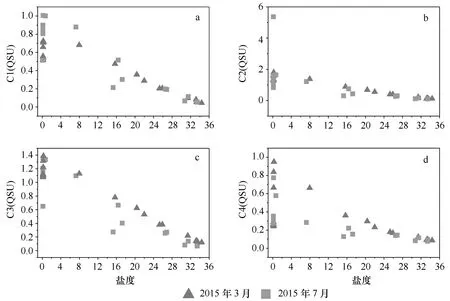
图4 长江口2015年3月7月CDOM中各荧光组分随盐度的变化Fig.4 Variation of four fluorescent components with salinity in CDOM of the Changjiang Estuary in March and July, 2015
由图4可知,各组分在淡水区都相对较高,而图3显示4种荧光组分在口门处有明显添加作用,表明长江口CDOM除陆源输入以外还有其他来源。Guo等[6]对九龙江口的研究和Yamashita[28]对日本Ise湾的研究结果也表明,类腐殖质组分和类蛋白组分在河口最大浑浊带存在添加行为,但原因不尽相同。类腐殖质组分的添加可能是因为在最大混浊带,潮汐作用显著,再悬浮作用强烈,沉积物间隙水中高浓度的类腐殖质荧光组分会释放出来,使其浓度升高[34]。最大浑浊带处微生物作用强烈,浮游植物有机体的降解、细菌的降解和摄取、浮游植物和大型植物的释放和浮游生物细胞渗透都会使类蛋白组分浓度升高[35]。最大浑浊带处高浓度的悬浮颗粒物可以促进CDOM在颗粒物和水体之间的吸附和解吸过程,而这个过程也可能使类蛋白组分浓度升高[34]。图4显示C1组分在最大浑浊带处荧光强度高值7月明显高于3月,而另外两种类腐殖质组分则没有明显季节性变化。类蛋白组分C4荧光强度在3月的峰值要高于7月峰值,这与春季长江口最大浑浊带悬浮颗粒浓度明显高于夏季有关[36]。7月4种组分在盐度大于10的区域都存在一定的去除过程,在3.4节中将结合α(355)一起讨论。
在剔除了7月C6站位的C2组分异常高值后,对长江口不同季节CDOM样品各荧光组分进行了相关性分析,研究了该区域不同季节CDOM的共变性特征。从表2可以看出,不管3月还是7月,类腐殖质组分C1、C2和C3之间均有很好的相关性,r2均大于0.9,说明这三者有相同的源和汇,而这3种组分与类蛋白组分C4相关性较差。C2与C4的相关性略强于其他组分与C4的相关性。C1、C3是传统的陆源类腐殖质组分,主要受陆源输入的影响,C2在多种水生环境中均观测到,同时受到陆源和海源自生的共同影响,而类蛋白质组分C4,主要受到现场生物活动的影响,但在人类活动强烈、污染严重的地区,陆源输入也会成为类蛋白质组分的主要来源[37—38]。另外,从表2还可看出,长江口各组分之间的相关性基本上都强于3月,特别是前3种类腐殖质组分与组分C4的关系在7月要好于3月,尤其是C2和C3,这是因为在夏季,高流量会使长江口陆源输入对于表层水中CDOM的影响大于春季,其中对类蛋白组分的影响较其他组分更为明显,而这种陆源的影响也强于其他因素对CDOM的影响,使得4个组分在来源和去除上的相似性也强于春季。

表2 长江口4种CDOM荧光组分之间的相关性分析
3.3 长江口CDOM荧光组分的腐殖化指数和生物指数
腐殖化指数HIX用于指示有机物中腐殖质含量,陆源输入的CDOM腐殖化程度较高,HIX值也较高,而生物活动产生的CDOM腐殖化程度较弱,HIX值也较低[39]。生物指数(BIX)用来指示CDOM中自生贡献比例,以浮游植物和细菌的有机体降解产物等生物源为主的CDOM,其BIX值较高;而来自陆源输入的CDOM,其BIX值较低[39]。从图5可知,2015年3月长江口CDOM的腐殖化指数HIX范围在1.12~7.19,均值为3.18。而7月HIX的范围在0.87~6.71,均值为4.06。生物指数BIX在3月范围在0.76~1.11,均值为0.89,7月的范围在0.62~1.15,均值为0.89,两个季节相差不大。
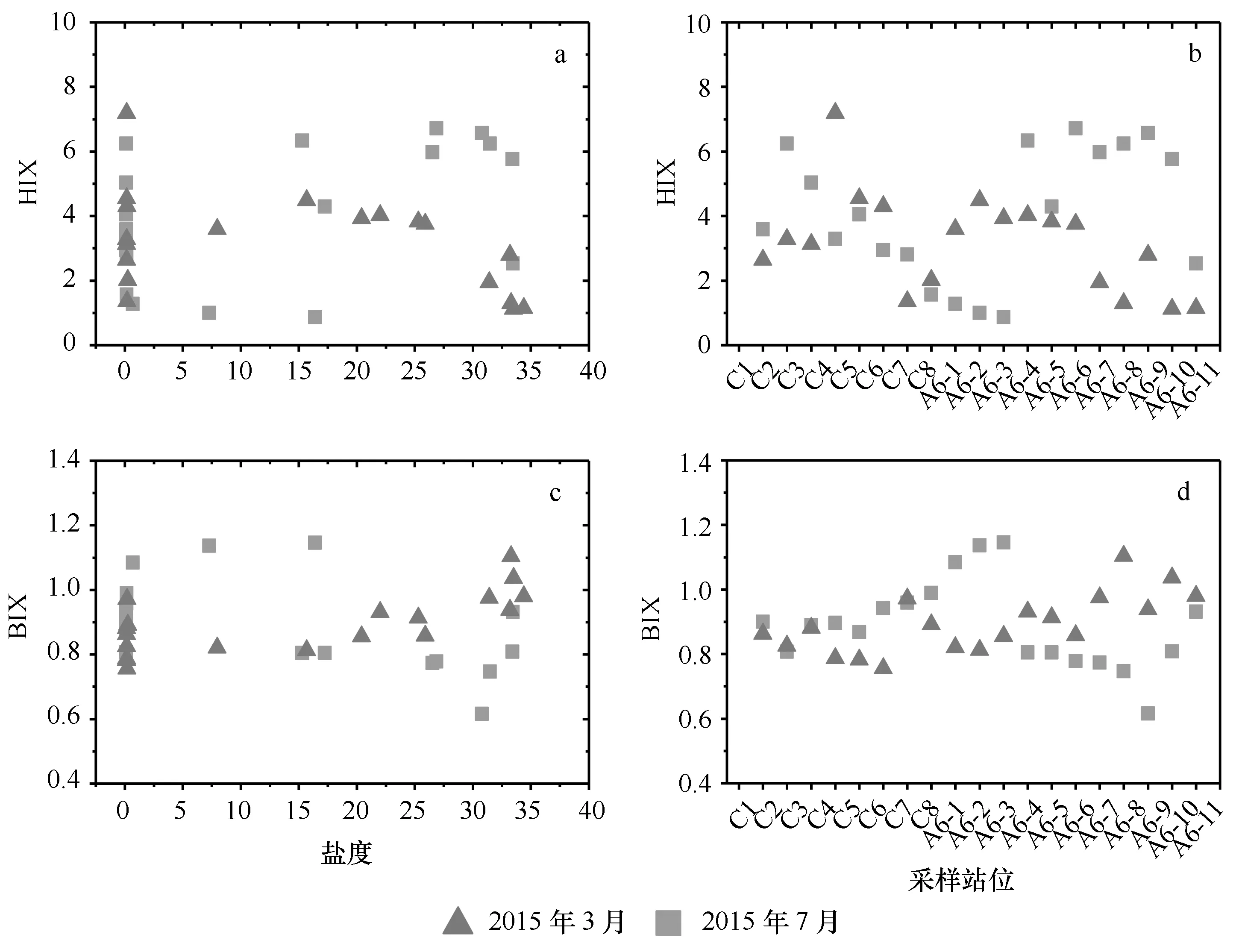
图5 长江口腐殖化指数(HIX)和生物指数(BIX)随盐度和采样站位的变化Fig.5 Variation of HIX and BIX with salinity and sampling site in the Changjiang Estuary
就分布而言,3月HIX从徐六泾开始先升高,然后降低,在口门外的最大浑浊带处(C7站)降低,之后再升高,此时盐度也迅速增加到8左右,后保持平稳,并在盐度超过30之后再逐渐降低(图5a,5b);而7月HIX也是从徐六泾开始先升高,然后逐渐降低,到口门外最大浑浊带边缘(A6-3)降到最低,在此之后,与盐度的升高相对应,从A6-4站位开始,HIX迅速升高,并保持平稳,在盐度较高的外海站位也开始降低(图5a,5b)。上述两个航次的HIX分布变化,虽然波峰波谷所处的站位是不同的,但是其变化规律是一致的。在口门外,HIX降低和升高的站位7月比3月更向外一些,与7月份流量比3月份大是有关的,淡水和陆源物质能够输运到离河口更远的位置,最大浑浊带也向外偏移。由图5b可知,HIX在7月的高值和低值的绝对值都大于3月。其中,7月低值低于3月,是因为夏季最大浑浊带处微生物活动强烈,会使CDOM腐殖化程度降低;而7月高值高于3月,这与7月份流量大也有关,高流量会加强陆源输入对河口表层水的影响,进而使此处CDOM腐殖化程度相对较高。BIX与HIX具有相反的变化规律,无论是3月,还是7月航次,HIX的波峰波谷恰与BIX的波谷和波峰相对应。图6所显示的BIX与HIX的关系也说明了这一点,即随着BIX的升高,HIX逐渐降低。HIX和BIX在口门内外的这种变化特点,说明最大浑浊带附近有比较强的微生物活动(由较高的BIX所显示),会降低陆源输入的CDOM的腐殖化程度(由降低的HIX所揭示)。
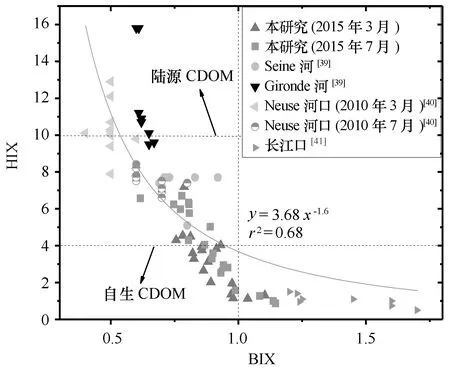
图6 长江口CDOM的BIX与HIX关系图及与世界其他河口的比较Fig.6 Plots of BIX and HIX in the Changjiang Estuary and comparison with other estuaries around the world
图6中的虚线表示不同来源CDOM的分界值。Huguet等研究表明,HIX的值低于4时,CDOM主要来源于自生贡献,而高于10时,说明CDOM腐殖化程度很高,来自陆源输入[26];BIX值低于1时,CDOM自生贡献比例较低,而高于1时,CDOM主要来源于自生贡献[24]。本研究中,3月HIX值绝大多数都低于4,7月有少部分高于4,但低于10;而两个月份的BIX值绝大部分都小于1,据此可知,本研究中,长江口CDOM腐殖化程度相对较低,自生贡献相对较高。从图6还可以看出,长江口CDOM较欧洲的Senie河口[39]和Gironde河口[39]以及美洲的Neuse河口[40]的CDOM腐殖化程度也较弱,自生贡献比例较高,可能与长江口最大浑浊带附近微生物活动较多有关。长江口HIX最高值比黄、渤海秋季(1.1~3.8)和夏季(0.73~2.66)的值要高,但BIX比黄、渤海秋季和夏季的略低(分别为0.96~1.20和0.96~2.25)[42],说明长江口CDOM受陆源输入影响相对边缘海也要大(图6)。Sun等[41]在长江口的研究结果显示其HIX较低,BIX较高,说明CDOM腐殖化程度弱,自生贡献比例较高,可能是由于其采样站位多位于近岸,受到上海等城市工业、农业和生活污水等排放所致[43—44]。
3.4 长江口CDOM的吸收性质
图7给出了吸收系数α(355)在河口区随盐度和站位的变化。从图7a可见,α(355)的河口行为与类腐殖质组分 C1、C2、C3很相似,都是在盐度小于 3之前浓度基本不变,后逐渐降低,在盐度大于10开始,有去除过程,且7月比3月明显。从图7b可见,两个月份α(355)从口内到口外都是先升高后降低,在口门处达到最高值,且7月的最高值高于3月的最高值。3月吸收系数α(355)的平均值为0.55 m-1, 7月的略高为0.61 m-1,张霄宇等[45]在该区域的研究结果也显示丰水期α(355)的值明显高于枯水期,表明地表径流输入量对该区域 CDOM 的含量有显著影响。与国内外其他相关文献[2, 22, 41]报道比较可以看出,本研究区域α(355)的值与国内外的河口海岸带区域相比偏低,其最大值还不足亚马逊河(3.12 m-1)[2]的一半,这可能是由于长江流域植被覆盖程度相对较低从而使得陆源输入的CDOM量相对较低所致[22]。3月和7月,α(355)在口门处都达到最高,有CDOM的添加现象,可能是此处为最大浑浊带,由于表层沉积物再悬浮,造成沉积物中CDOM的释放,或是有色颗粒有机质(CPOM)因微生物活动在此处解吸,使得水体CDOM浓度升高[34]。3月长江口α(355)在口外与盐度呈负相关关系,显示稀释扩散作用是CDOM吸收特征在春季长江口分布的主控因素[23,46—47]。7月口外α(355)和4种荧光组分与盐度的相关性较3月更差一些,在盐度高于10的区域,存在去除的稀释过程,与4种组分在此区域的去除相对应,可能是由于在河口外,海水与淡水混合影响水域盐度和pH,进而影响水体物理化学环境的改变,CDOM在这种环境下,容易吸附、絮凝在颗粒物上而析出[48—49],进而使其浓度下降。
由图8可知,α(355)与3个类腐殖质组分C1、C2和C3之间均存在很显著的线性正相关关系,r2都不小于0.9(P<0.01);而与类蛋白质组分C4之间则相关性很差,CDOM 的吸收性质是由发色团产生,而荧光性质是由荧光团产生,上述关系表明CDOM的类腐殖质荧光团与其发色团之间在结构上有很密切的内在联系,而类蛋白质荧光团则不是 CDOM发色团的主要成分[37]。
SR用于指示CDOM相对分子质量大小,由陆源输入的CDOM 平均分子质量较低,SR值低;而由海洋自生的CDOM 平均分子质量较高,SR值高。图7c和图7d可看出,7月SR的均值为1.15,较3月1.08略高,季节性变化不大。SR在3月和7月长江口从近岸到远岸,逐渐增大,也说明近岸受陆源输入影响较大,远岸陆源输入势力减弱,微生物降解势力增强,陆源带来的腐殖化程度较高的有机质减少,引起SR值增大。也就是说,近岸CDOM组成上小分子量有机物所占比例较高,随着盐度的增加,陆源输入的小分子量有机物减少,而海洋自生来源的大分子量有机物增多[33]。在数值上来讲,SR值大部分都大于1,即S275~295>S350~400,富里酸含量高于腐殖酸,理论上应该是大部分CDOM为海源有机质[45],但在长江口区域,影响因素复杂多变,人类活动非常显著,陆源的有机物也受人类活动扰动的影响,虽来自陆源,大部分为小分子量富里酸。
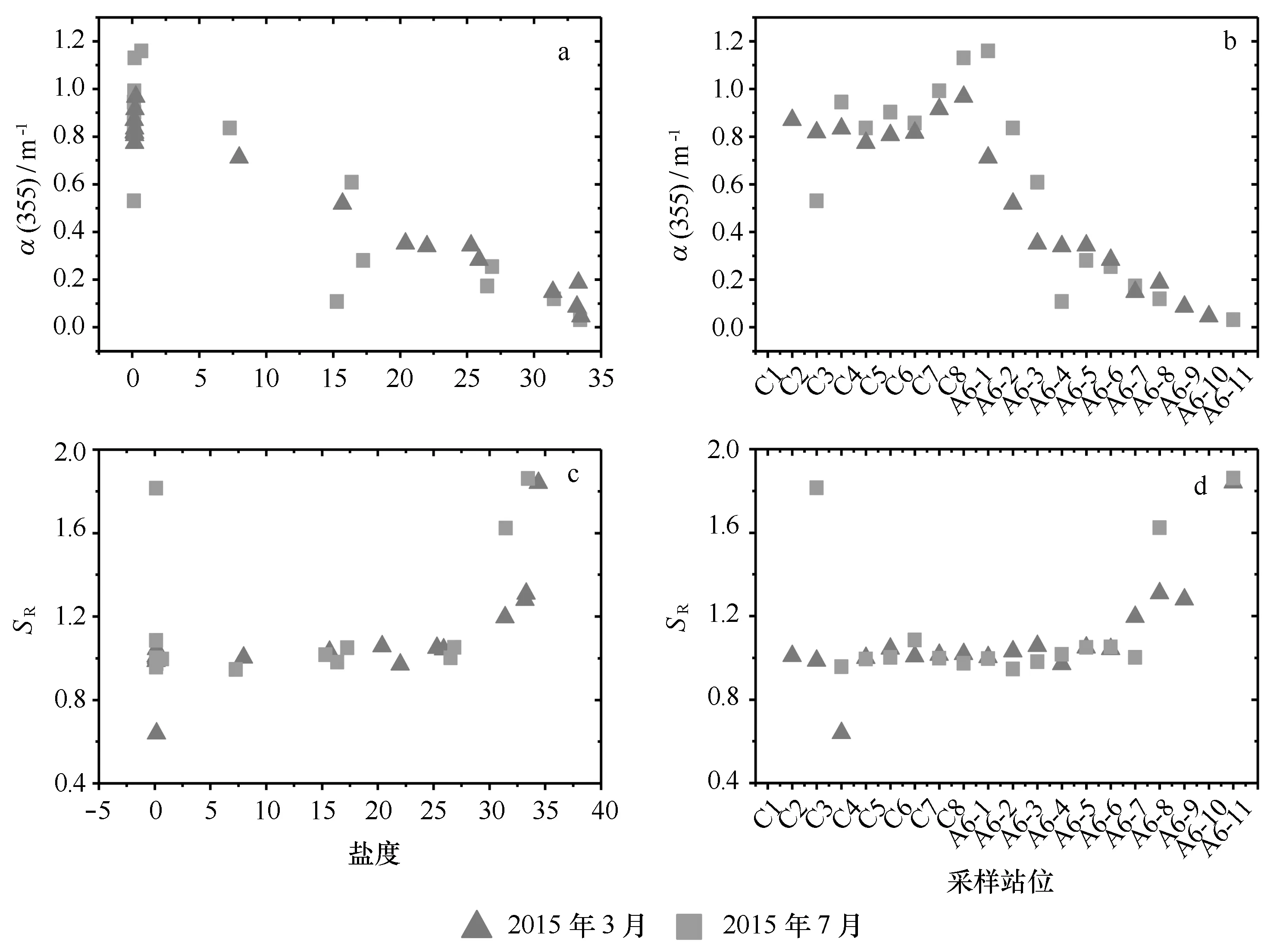
图7 长江口α(355)和SR随盐度和采样站位的变化Fig.7 Variation of α(355) and SR with salinity and sampling site in the Changjiang Estuary
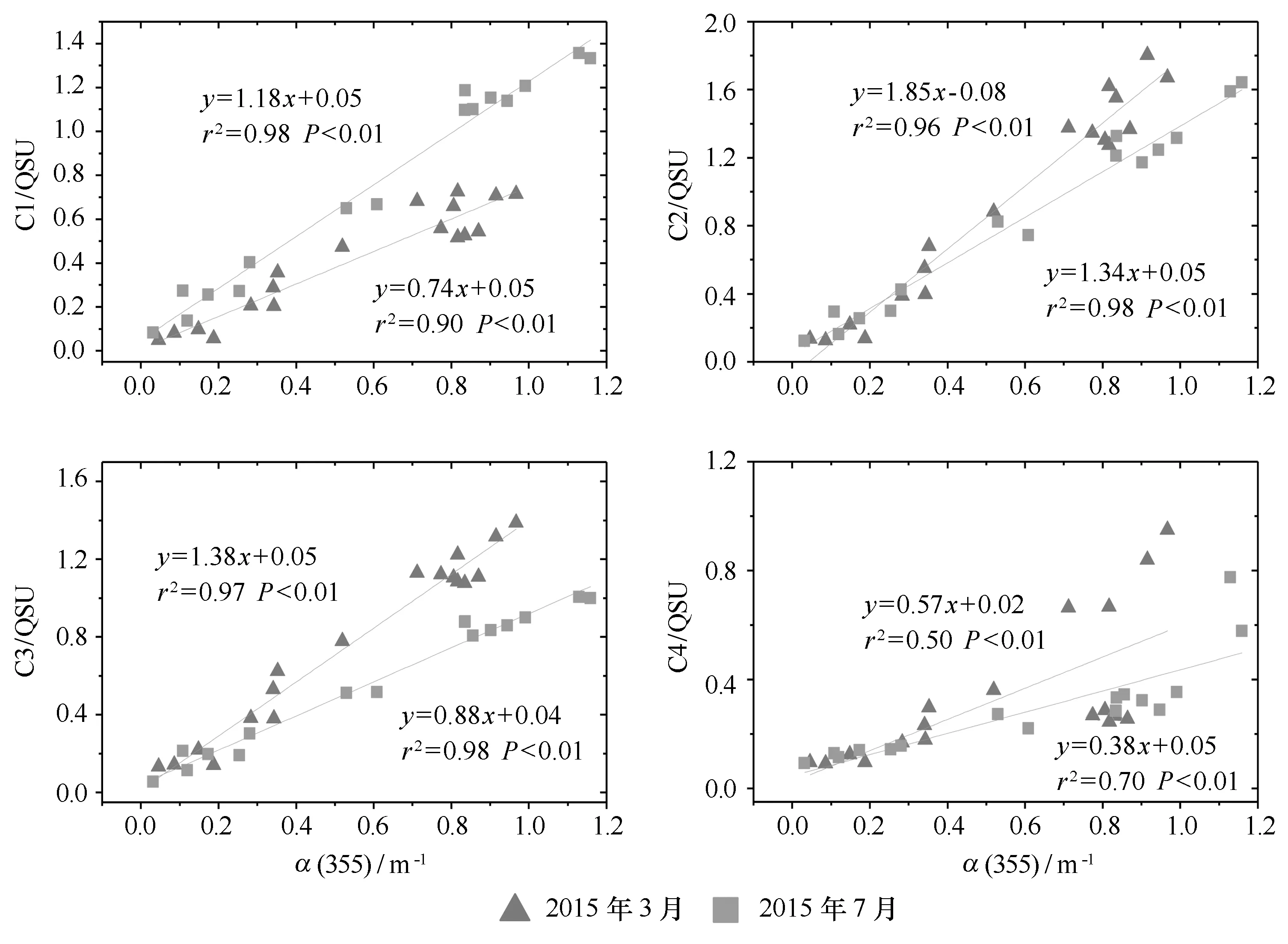
图8 长江口各荧光组分与α(355)的关系Fig.8 Relationship between four fluorescent components and α(355) in the Changjiang Estuary
4 结语
利用三维荧光光谱-平行因子分析法识别出2015年3月和7月长江口CDOM由4个荧光组分组成:即3个类腐殖质荧光组分C1(260, 375/490 nm)、C2(365/440 nm)、C3(330/400 nm)和一个类蛋白质荧光组分C4(295/345 nm)。类腐殖质组分之间较好的相关性表明它们有相似的来源和生物地球化学行为。4种荧光组分在河口的分布与总荧光强度的分布一致,在口门处的最大浑浊带有添加过程,可能是受到表层沉积物再悬浮和微生物作用的影响。夏季在盐度高于10的区域有去除过程,与此处物理化学环境的改变有关。结合HIX、BIX、α(355)、SR等相关参数,可判断长江口CDOM主要来自陆源输入,3月最大浑浊带处表层沉积物再悬浮和生物活动会对CDOM有一定添加效应,人类活动也会对其产生影响;而在7月除以上因素外,变化的物理化学环境、海洋自生贡献等也会对CDOM产生一定影响。
[1] Whitehead R F, De Mora S, Demers S, et al. Interactions of ultraviolet-B radiation, mixing, and biological activity on photobleaching of natural chromophoric dissolved organic matter: A mesocosm study[J]. Limnology and Oceanography, 2000, 45(2): 278-291.
[2] Green S A, Blough N V. Optical absorption and fluorescence properties of chromophoric dissolved organic matter in natural waters[J]. Limnology and Oceanography, 1994, 39(8): 1903-1916.
[3] Bai Ying, Su Rongguo, Shi Xiaoyong. Assessing the dynamics of chromophoric dissolved organic matter in the southern Yellow Sea by excitation-emission matrix fluorescence and parallel factor analysis (EEM-PARAFAC)[J]. Continental Shelf Research, 2014, 88: 103-116.
[4] Yamashita Y, Panton A, Mahaffey C, et al. Assessing the spatial and temporal variability of dissolved organic matter in Liverpool Bay using excitation-emission matrix fluorescence and parallel factor analysis[J]. Ocean Dynamics, 2011, 61(5): 569-579.
[5] Vodacek A, Hogel F E, Swift R N, et al. The use of in situ and airborne fluorescence measurements to determine UV absorption coefficients and DOC concentrations in surface waters[J]. Limnology and Oceanography, 1995, 40(2): 411-415.
[6] Guo Weidong, Yang Liyang, Zhai Weidong, et al. Runoff-mediated seasonal oscillation in the dynamics of dissolved organic matter in different branches of a large bifurcated estuary—The Changjiang Estuary[J]. Journal of Geophysical Research: Biogeosciences, 2014, 119(5): 776-793.
[7] Yan Lihong, Su Rongguo, Zhang Chuansong, et al. Assessing the dynamics of chromophoric dissolved organic matter (CDOM) in the Yellow Sea and the East China Sea in autumn by EEMs-PARAFAC[J]. Science China Chemistry, 2012, 55(12): 2595-2609.
[8] Rochelle-Newall E J, Fisher T R. Chromophoric dissolved organic matter and dissolved organic carbon in Chesapeake Bay[J]. Marine Chemistry, 2002, 77(1): 23-41.
[9] Stedmon C A, Markager S, Bro R. Tracing dissolved organic matter in aquatic environments using a new approach to fluorescence spectroscopy[J]. Marine Chemistry, 2003, 82(3/4): 239-254.
[10] 黄昌春, 李云梅, 王桥, 等. 基于三维荧光和平行因子分析法的太湖水体CDOM组分光学特征[J]. 湖泊科学, 2010, 22(3): 375-382.
Huang Changchun, Li Yunmei, Wang Qiao, et al. Components optical property of CDOM in Lake Taihu based on three-dimensional excitation emission matrix fluorescence[J]. Journal of Lake Sciences, 2010, 22(3): 375-382.
[11] 陈欣, 张霄宇, 雷惠. 长江口CDOM的光谱吸收特征以及DOC物源示踪意义[J]. 海洋环境科学, 2012, 31(5): 3-8.
Chen Xin, Zhang Xiaoyu, Lei Hui. Optical absorption properties of CDOM and tracing implication of DOC in the Changjiang Estuary[J]. Marine Environmental Science, 2012, 31(5): 3-8.
[12] D’Sa E J, Goes J I, Gomes H, et al. Absorption and fluorescence properties of chromophoric dissolved organic matter of the eastern Bering Sea in the summer with special reference to the influence of a Cold Pool[J]. Biogeosciences Discussions, 2013, 10(12): 19109-19154.
[13] Milliman J D, Farnsworth K L. River Discharge to the Coastal ocean: a Global Synthesis[M]. Cambridge: Cambridge University Press, 2011.
[14] 林金祥, 王宗山. 关于长江冲淡水异常变化的分析[J]. 海洋科学进展, 1985, 3(4): 15-23.
Lin Jinxiang, Wang Zongshan. On the analysis of anomalaus change of fresh water tongue of Changjiang river[J]. Advances in Marine Science, 1985, 3(4): 15-23.
[15] 毛汉礼, 甘子钧, 蓝淑芳. 长江冲淡水及其混合问题的初步探讨[J]. 海洋与湖沼, 1963, 5(3): 183-206.
Mao Hanli, Gan Zijun, Lan Shufang. A preliminary study of the Yangtze diluted water and its mixing processes[J]. Oceanologia et Limnologia Sinica, 1963, 5(3): 183-206.
[16] 潘慧慧, 姚鹏, 赵彬, 等. 基于水淘选分级的长江口最大浑浊带附近颗粒有机碳的来源、分布和保存[J]. 海洋学报, 2015, 37(4): 1-15.
Pan Huihui, Yao Peng, Zhao Bin, et al. Sources, distribution and preservation of size-fractionated particulate organic carbon in the turbidity maximum zone of the Changjiang Estuary based on water elutriation[J]. Haiyang Xuebao, 2015, 37(4): 1-15.
[17] 范冠南, 毛志华, 陈鹏, 等. 长江口及其邻近海域CDOM光谱吸收特性分析[J]. 海洋学研究, 2013, 31(1): 53-58.
Fan Guannan, Mao Zhihua, Chen Peng, et al. Optical characteristics of Colored Dissolved Organic Matter (CDOM) in Changjiang River Estuary and its adjacent sea areas[J]. Journal of Marine Sciences, 2013. 31(1): 53-58.
[18] 朱伟健, 沈芳, 洪官林. 长江口及邻近海域有色溶解有机物(CDOM)的光学特性[J]. 环境科学, 2010, 31(10): 2292-2298.
Zhu Weijian, Shen Fang, Hong Guanlin. Optical characteristics of colored dissolved organic material (CDOM) in Yangtze Estuary[J]. 2010, 31(10): 2292-2298.
[19] 王翔, 杨红, 孔德星, 等. 长江口外海水中有色溶解有机物(CDOM)的光吸收特性[J]. 应用海洋学学报, 2010, 29(4): 518-524.
Wang Xiang, Yang Hong, Kong Dexing, et al. Optical absorption properties of chromophoric dissolved organic matter in the seawater of outer Yangtze Estuary[J]. Journal of Oceanography in Taiwan Strait, 2010, 29(4): 518-524.
[20] 李奕洁, 宋贵生, 胡素征, 等. 2014年夏季长江口有色溶解有机物(CDOM)的分布、光学特性及其来源探究[J]. 海洋与湖沼, 2015, 46(3): 670-678.
Li Yijie, Song Guisheng, Hu Suzheng, et al. Optical characterization, distribution and sources of chromophoric dissolved organic material (CDOM) in the Changjiang River estuary in July 2014[J]. Oceanologia et Limnologia Sinica, 2015, 46(3): 670-678.
[21] Wada S, Aoki M N, Tsuchiya Y, et al. Quantitative and qualitative analyses of dissolved organic matter released fromEckloniacava, Kjellman, in Oura Bay, Shimoda, Izu Peninsula, Japan[J]. Journal of Experimental Marine Biology and Ecology, 2007, 349(2): 344-358.
[22] Hong Huasheng, Wu Jingyu, Shang Shaoling, et al. Absorption and fluorescence of chromophoric dissolved organic matter in the Pearl River Estuary, South China[J]. Marine Chemistry, 2005, 97(1/2): 78-89.
[23] Markager S, Vincent W F. Spectral light attenuation and the absorption of UV and blue light in natural waters[J]. Limnology and Oceanography, 2014, 45(3): 642-650.
[24] 肖隆庚, 陈文松, 陈国丰, 等. 中国南海CDOM三维荧光光谱特征研究[J]. 环境科学学报, 2014, 34(1): 160-167.
Xiao Longgeng, Chen Wensong, Chen Guofeng, et al. Fluorescence excitation-emission matrix spectroscopy of chromophoric dissolved organic matter in the South China Sea[J]. Acta Scientiae Circumstantiae, 2014, 34(1): 160-167.
[25] Ohno T. Fluorescence inner-filtering correction for determining the humification index of dissolved organic matter[J]. Environmental Science & Technology, 2002, 36(4): 742-746.
[26] Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2009, 40(6): 706-719.
[27] Stedmon C A, Markager S. Resolving the variability in dissolved organic matter fluorescence in a temperate estuary and its catchment using PARAFAC analysis[J]. Limnology and Oceanography, 2005, 50(2): 686-697.
[28] Yamashita Y, Jaffé R, Maie N, et al. Assessing the dynamics of dissolved organic matter (DOM) in coastal environments by excitation emission matrix fluorescence and parallel factor analysis (EEM-PARAFAC)[J]. Limnology and Oceanography, 2008, 53(5): 1900-1908.
[29] Coble P G. Characterization of marine and terrestrial DOM in seawater using excitation-emission matrix spectroscopy[J]. Marine Chemistry, 1996, 51(4): 325-346.
[30] Li Weihua, Sheng Guoping, Lu Rui, et al. Fluorescence spectral characteristics of the supernatants from an anaerobic hydrogen-producing bioreactor[J]. Applied Microbiology and Biotechnology, 2011, 89(1): 217-224.
[31] Fellman J B, Petrone K C, Grierson P F. Source, biogeochemical cycling, and fluorescence characteristics of dissolved organic matter in an agro-urban estuary[J]. Limnology and Oceanography, 2011, 56(1): 243-256.
[32] Cory R M, McKnight D M. Fluorescence spectroscopy reveals ubiquitous presence of oxidized and reduced quinones in dissolved organic matter[J]. Environmental Science & Technology, 2005, 39(21): 8142-8149.
[33] Mopper K, Schultz C A. Fluorescence as a possible tool for studying the nature and water column distribution of DOC components[J]. Marine Chemistry, 1993, 41(1/3): 229-238.
[34] Yang Liyang, Guo Weidong, Hong Huasheng, et al. Non-conservative behaviors of chromophoric dissolved organic matter in a turbid estuary: roles of multiple biogeochemical processes[J]. Estuarine, Coastal and Shelf Science, 2013, 133: 285-292.
[35] Zhang Yunlin, Van Dijk M A, Liu Mingliang, et al. The contribution of phytoplankton degradation to chromophoric dissolved organic matter (CDOM) in eutrophic shallow lakes: field and experimental evidence[J]. Water Research, 2009, 43(18): 4685-4697.
[36] 潘慧慧. 基于水淘选分级的长江口颗粒有机碳的分布、来源和降解特征[D]. 青岛: 中国海洋大学, 2015.
Pan Huihui. Sources, distribution, and preservation of size-fractionated particulate organic carbon in the Changjiang Estuary based on water elutriation[D]. Qingdao: Ocean University of China, 2015.
[37] 郭卫东, 黄建平, 洪华生, 等. 河口区溶解有机物三维荧光光谱的平行因子分析及其示踪特性[J]. 环境科学, 2010, 31(6): 1419-1427.
Guo Weidong, Huang Jianping, Hong Huasheng, et al. Resolving excitation emission matrix spectroscopy of estuarine CDOM with parallel factor analysis and its application in organic pollution monitoring[J]. Environmental Science, 2010, 31(6): 1419-1427.
[38] 程远月, 郭卫东, 胡明辉. 近岸沉积物再悬浮期间所释放溶解有机物的荧光特征[J]. 地球化学, 2008, 37(1): 51-58.
Cheng Yuanyue, Guo Weidong, Hu Minghui. Fluorescence characteristics of dissolved organic matter released from estuarine sediments during resuspension[J]. Geochimica, 2008, 37(1): 51-58.
[39] Huguet A, Vacher L, Saubusse S, et al. New insights into the size distribution of fluorescent dissolved organic matter in estuarine waters[J]. Organic Geochemistry, 2010, 41(6): 595-610.
[40] Dixon J L, Osburn C L, Paerl H W, et al. Seasonal changes in estuarine dissolved organic matter due to variable flushing time and wind-driven mixing events[J]. Estuarine, Coastal and Shelf Science, 2014, 151: 210-220.
[41] Sun Qiyuan, Wang Chao, Wang Peifang, et al. Absorption and fluorescence characteristics of chromophoric dissolved organic matter in the Yangtze Estuary[J]. Environmental Science and Pollution Research International, 2014, 21(5): 3460-3473.
[42] 周倩倩, 苏荣国, 白莹, 等. 舟山渔场有色溶解有机物(CDOM)的三维荧光-平行因子分析[J]. 环境科学, 2015, 36(1): 163-171.
Zhou Qianiqian, Su Rongguo, Bai Ying, et al. Characterization of Chromophoric dissolved organic matter (CDOM) in Zhoushan fishery using excitation-emission matrix spectroscopy (EEMs) and parallel factor analysis (PARAFAC)[J]. Environmental Science, 2015, 36(1): 163-171.
[43] 白莹. 黄东海春秋季有色溶解有机物(CDOM)的分布特征及季节变化的研究[D]. 青岛: 中国海洋大学, 2014.
Bai Ying. The study on distribution and seasonal changes of chromophoric dissolved organic matter in spring and autumn in the Yellow Sea and the East China Sea[D]. Qingdao: Ocean University of China, 2014.
[44] 周倩倩. 黄渤海夏秋季有色溶解有机物(CDOM)的分布特征及季节变化的研究[D]. 青岛: 中国海洋大学, 2015.
Zhou Qianqian. The study on distribution and seasonal changes of chromophoric dissolved organic matter in summer and autumn in the Bohai Sea and the Yellow Sea[D]. Qingdao: Ocean University of China, 2015.
[45] Zhang Xiaoyu, Wang Lixia, Yu Le, et al. Conservative behavior of CDOM optical properties in Changjiang River Estuary, China[C]//Proceedings of the 2nd International Conference on Earth Observation for Global Changes. Chengdu: International Society for Optics and Photonics, 2009.
[46] Murphy K R, Stedmon C A, Waite T D, et al. Distinguishing between terrestrial and autochthonous organic matter sources in marine environments using fluorescence spectroscopy[J]. Marine Chemistry, 2008, 108(1/2): 40-58.
[47] Stedmon C A, Osburn C L, Kragh T. Tracing water mass mixing in the Baltic-North Sea transition zone using the optical properties of coloured dissolved organic matter[J]. Estuarine, Coastal and Shelf Science, 2010, 87(1): 156-162.
[48] Shank G C, Zepp R G, Whitehead R F, et al. Variations in the spectral properties of freshwater and estuarine CDOM caused by partitioning onto river and estuarine sediments[J]. Estuarine, Coastal and Shelf Science, 2005, 65(1/2): 289-301.
[49] Helms J R, Stubbins A, Ritchie J D, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and Photobleaching of chromophoric dissolved organic matter[J]. Limnology and Oceanography, 2007, 53(3): 955-969.
Distribution, sources, and seasonal variation of colored dissolved organic matter along salinity gradients in the Changjiang Estuary
Xu Yahong1, 2, Yao Peng1, Su Rongguo2, Zhao Bin1, 2
(1.KeyLaboratoryofMarineChemistryTheoryandTechnology,MinistryofEducation,OceanUniversityofChina,Qingdao266100,China; 2.CollegeofChemistryandChemicalEngineering,OceanUniversityofChina,Qingdao266100,China)
Absorption and fluorescence spectroscopies were used to examine the distribution, composition, sources and mixing behavior of colored dissolved organic matter (CDOM) in the Changjiang estuary in March and July 2015. The characteristics of fluorescent components of CDOM in the Changjiang Estuary were determined by fluorescence excitation emission matrix spectroscopy (EEMs) combined with parallel factor analysis (PARAFAC).Three humic-like components, i.e., C1(260,375/490 nm), C2(365/440 nm) and C3(330/400 nm) and one protein-like component C4 (295/345 nm) were identified by EEMs-PARAFAC. The distribution and non-conservative mixing behavior of these four components were consistent with the total fluorescence intensity (TFI) both in March and July 2015, first increasing and then gradually decreasing from the inner estuary to outside the estuary, with the additional behavior and highest value observed at Turbidity Maximum Zone and removal process outside the estuary. Ranging from 1.12 to 7.19 in March and 0.87 to 6.71 in July, the humification index (HIX) values showed that CDOM in March had a higher degree of humification than that in July. The biological index (BIX) values ranged from 0.76 to 1.11 and 0.62 to 1.15 in March and July respectively, suggesting a greater contribution of biological activities to CDOM in July. In March, The average value of α(355) was 0.55 m-1, lower than that in July (0.61 m-1), reflecting higher content of CDOM in summer. The seasonal variation ofSRwas not obvious, increasing along the salinity in both seasons, which indicated that the average molecular weight of CDOM increased from the inside to the outside of the Changjiang Estuary.
Changjiang Estuary; turbidity maximum zone; CDOM; EEMs-PARAFAC; absorption spectroscopy; seasonal variation
10.3969/j.issn.0253-4193.2017.06.003
2016-10-08;
2016-12-15。
国家重点研发计划项目(2016YFA0600902);国家自然科学基金项目(41676063, 41620104001, 41521064)。
徐亚宏(1990—),女,山东省青岛市人,主要研究方向为海洋有机生物地球化学。E-mail:278138861@qq.com
*通信作者:姚鹏(1977—),男,山东省菏泽市人,教授,从事海洋有机生物地球化学研究。E-mail:yaopeng@ouc.edu.cn
P734
A
0253-4193(2017)06-0021-12
徐亚宏,姚鹏,苏荣国,等. 长江口盐度梯度下有色溶解有机物的分布、来源与季节变化[J].海洋学报,2017,39(6):21—32,
Xu Yahong, Yao Peng, Su Rongguo, et al. Distribution, sources, and seasonal variation of colored dissolved organic matter along salinity gradients in the Changjiang Estuary [J]. Haiyang Xuebao,2017,39(6):21—32, doi:10.3969/j.issn.0253-4193.2017.06.003

