我国典型潮间带底栖硅藻群落空间分布特征
徐帅帅,邸宝平,王玉珏,刘东艳, 3*,王小冬
(1. 暨南大学 赤潮与海洋生物学研究中心,广东 广州 510632;2. 中国科学院 烟台海岸带研究所 海岸带环境过程与生态修复重点实验室,山东 烟台 264003; 3. 华东师范大学 河口海岸国家重点实验室,上海 200062)
我国典型潮间带底栖硅藻群落空间分布特征
徐帅帅1,2,邸宝平2,王玉珏2,刘东艳2, 3*,王小冬1
(1. 暨南大学 赤潮与海洋生物学研究中心,广东 广州 510632;2. 中国科学院 烟台海岸带研究所 海岸带环境过程与生态修复重点实验室,山东 烟台 264003; 3. 华东师范大学 河口海岸国家重点实验室,上海 200062)
底栖硅藻是河口、泥质海滩生态系统的重要生物类群,其数量与分布变化直接或间接地影响到多种海洋生物的饵料供给、海鸟的生存与迁徙。通过对我国从南到北14个典型潮间带表层沉积物中底栖硅藻的分析,共鉴定出硅藻153种,其物种多样性(Shannon-Weaver 指数范围:1.61~4.39)与生物量(范围:0.09×103~ 10×103个/g,干质量)在空间上存在显著差异;聚类分析与相似性分析检验(r=0.738,P=0.1%<0.01)表明,14个调查区域的硅藻群落在空间上可分为4个大的组合,分别对应着渤、黄、东、南海4个区域,吻合了我国近海浮游植物的地理分布特征。与环境因素的相关性分析表明,底栖硅藻群落的物种多样性与生物量受沉积物类型与盐度的影响显著,泥质区域更有利于硅藻的保存,而生物多样性在泥砂质低盐区域相对较高。此外,底栖硅藻生物量与表层沉积物中TOC含量表现出显著正相关性;δ13C数值的空间变化范围为-25‰~-20‰,指示了有机质陆海混合的特征,其中,涧河河口、黄河口、大沽河口、苏北浅滩区域,δ13C数值明显偏正,表明底栖硅藻可能是这些区域沉积物中有机碳的重要贡献者。
潮间带;表层沉积物;底栖硅藻;空间分布特征;有机碳
1 引言
河口与滨海潮间带在地理上位于陆、海交界处的狭窄地带,其生境特点复杂多变,却具有较高的生产力,因此成为多种海洋生物的重要栖息地、鸟类迁徙的中转站及海陆物质交换与能量循环的重要场所[1—2]。世界众多河口、泥质海滩的生态调查结果表明,底栖硅藻是河口、泥质海滩生态系统中的重要植物类群,它们包括无运动能力附着在砂砾上的砂质硅藻、靠粘液附着在潮间带其他水生植物体上的附生硅藻、以及具有较弱运动能力的泥质羽纹纲硅藻[3]。底栖硅藻不仅是某些潮间带软体动物的主要饵料、也是很多海洋动物幼虫、幼体的饵料,故其数量变化直接或间接地影响到海洋渔业资源乃至海鸟的食物来源[4—5]。此外,底栖硅藻还可以影响到沉积物中营养盐的通量变化[6—9],它们在运动期间产生胞外多糖与泥沙黏合在一起,甚至影响到沉积物的侵蚀和沉积过程[10—13]。
我国海岸带拥有众多的河口、潮滩和海湾,气候差异大,沉积物类型多样,富产贝类等多种软体动物,是多种鸟类的重要迁徙地[14—15]。相对于潮间带其他大型植物类群(海藻、海草)的研究,底栖硅藻群落生态规律的研究有限。已有的研究包括陈兴群等[16]对厦门潮间滩涂小型底栖硅藻季节与空间分布研究;朱根海等[17]对南麓列岛潮间带微小型底栖藻类的空间垂直分布规律研究;以及吴瑞等[18]对象山港潮间带底栖硅藻的空间分布特征研究。这些研究为了解底栖硅藻的空间分布规律提供了重要信息,然而,由于调查区域的局限性,尚难进行空间上的系统比较与规律查寻。在科技部“我国典型潮间带沉积物本底及质量调查与图集编研”等项目的支持下,2014年期间,调查了我国从南到北14个典型潮间带表层沉积物中底栖硅藻的群落结构组成,比较了底栖硅藻群落结构的空间差异,讨论了温度、盐度、沉积物类型等环境因素对底栖硅藻群落结构的影响作用,并利用表层沉积物中硅藻生物量与有机碳含量的相关性分析,以及有机碳同位素(δ13C)的指示作用,探讨了底栖硅藻对不同类型潮间带沉积物中有机碳含量的贡献。研究结果可增进对我国典型潮间带底栖硅藻生态作用的了解,并为潮间带生态系统的研究提供重要支撑数据。
2 材料与方法
2.1 采样站点与日期
根据潮间带沉积物类型与发育特点,设定14个调查区域(图1),具体包括:辽宁大辽河口、河北北戴河浅滩、天津涧河河口、山东黄河口、烟台四十里湾浅滩、青岛大沽河口、江苏苏北浅滩、上海崇明岛、浙江杭州湾、福建闽江口、厦门九龙江口、广东珠江口、广西英罗湾、海南东寨港。

图1 采样站位图Fig.1 Map showing the sampling sites
分别于2014年9—10月期间在长江口以北的9个潮间带、11—12月期间在长江口以南的5个潮间带,开展了样品采集工作。每个潮间带站位设置3个采样剖面,在每个剖面高、中、低潮区3个位点进行表层沉积物样品的采样。采用直径3 cm的塑料取样器从潮间带泥滩上取0~2 cm的表层沉积物,每个站点取3个平行样,装入事先准备好的干净的封口袋中,避光冷冻保存,回实验室后置于-20℃冷冻保存,分别用于生物、化学等参数分析。取每个站位的1个剖面用于潮间带底栖硅藻实验,结果以高、中、低3个潮区的平均值±标准偏差表示。
2.2 底栖硅藻分析及数据处理
依据 Renberg[19]及Last和Smol 等[20]的沉积物硅藻纯化方法,经过“去碳酸盐—去有机质—重液浮选—制片”的步骤,去除沉积物中的其他组分,将硅藻从沉积物中提取出来。具体提取程序如下:(1)选取冷冻干燥的方法处理所有的沉积物样品,以获取样品的干质量,用于后续计算;(2)用体积比10%的盐酸溶液过夜处理,去除碳酸盐、金属盐以及金属氧化物,反应充分完成后,用蒸馏水冲洗;(3)在反应之后的沉积物中加入30%的过氧化氢溶液去除有机质,充分反应直至上清液澄清,用蒸馏水冲洗;(4)冲洗干净之后,加入比重为2.4的溴化锌重液,2 000 r/min离心10 min,弃去上层水体,转移中间黄褐色的硅藻细胞带,用于后续分析,重液下面的沉积物样品重复此步骤,直到上层无明显漂浮物为止;(5)取稀释后的硅藻液体0.1 mL,滴放于载玻片,自然风干后制成永久装片编号保存。
硅藻壳体的观察和统计均在 Olympus CKX41 生物显微镜下进行。分类鉴定主要参考金德祥[21—23]、郭玉洁[24]、程兆第等[25]、Hasle[26]、Tomas等[27]硅藻系统分类书籍。
硅藻生物量表示为Dabs,按照 Battarbee 等[28]进行计算,即每克干质量的沉积物中所含有的硅质壳数(单位:个/g,干质量),计算公式如下:
Dabs=(N×V)/(V1×W),
(1)
式中,N表示样品中全部硅藻物种丰度之和;V表示硅藻提取液体积;V1表示永久制片所使用硅藻溶液体积;W表示称取样品的干质量。
基于样品中统计的硅藻总数,计算样品中每个种类的相对丰度(P),以各种类的百分比表示,即:
(2)
Ni表示样品中物种i的绝对丰度,N表示样品中全部硅藻物种丰度之和。
利用Shannon-Weaver 指数 (H′)[29]表征了物种的多样性特征,计算公式如下:
(3)
S表示物种数;Pi为第i种物种的相对丰度。
2.3 总有机碳、δ13C及沉积物粒度测定
总有机碳(Total organic carbon: TOC)与有机碳同位素(δ13C)的测定:沉积物样品冷冻干燥研磨粉碎之后,加入0.5 mol/L的盐酸溶液除去碳酸盐,样品酸化干燥24 h之后加入 Milli-Q水冻干,使用稳定同位素质谱仪(MAT253, Thermo Fisher)测定。
沉积物粒度的测定:沉积物样品经10% H2O2溶液去除沉积物中有机质,再用0.05% (NaPO3)6溶液进行分散后,利用 Mastersize 2000 激光粒度仪测定,测定方法按照《海洋调查规范》第8部分“海洋地质地球物理调查”[30],测量范围为0.02~2 000 μm,误差小于1%。根据 Folk 等[31]与我国沉积物粒度分类标准[30],划分沉积物粒径与类型。
2.4 统计分析
根据硅藻生物量与物种多样性,利用 PRIMER 6.0 软件对硅藻群落数据进行聚类分析,并利用相似性分析检验(ANOSIM)对聚类结果进行差异性检验。硅藻物种多样性、硅藻生物量、TOC含量、δ13C 值以及环境因子之间的 Pearson 相关性分析利用软件 SPSS 20.0 分析得到。
3 结果与讨论
3.1 环境因子特征
调查期间,研究区域的海水温度主要受到季节和纬度变化的影响,变动范围为15.9~28.3℃,最高值出现在英罗湾(28.3℃),最低值出现在闽江口(15.9℃)(图2)。海水盐度变化范围较大(1.9~30.9),主要受到淡水输入量的影响,河口的盐度明显低于海湾潮间带区域,在淡水输入量较大的崇明岛(长江口)、闽江口、九龙江口与珠江口,盐度数值较低(图2)。

图2 调查期间海水温度与盐度的空间分布特征Fig.2 The spatial distributions of sea temperature and salinity during the survey
沉积物粒度是影响沉积物中有机质的重要因素,不同调查区域之间沉积物粒度组成存在显著差异(表1)。海湾潮间带的沉积物类型为砂相,包括秦皇岛浅滩、四十里湾浅滩与英罗湾;河口、潮滩区域的沉积物类型大致可分为3种:闽江口、珠江口和东寨港主要为粉砂质砂;大辽河口、黄河口、大沽河口、苏北浅滩和崇明岛为粉砂质淤泥;涧河河口、杭州湾和九龙江口则为淤泥质类型[32]。已有研究发现胶州湾大沽河口沉积物类型为黏土粉砂质[33],黄河三角洲南部沉积物类型为粉砂质[34],崇明东滩沉积物类型为粉质[35],本次研究不同站位沉积物类型基本与历史研究相一致。

表1 14个调查区域沉积物的粒度组成与类型

续表1
3.2 硅藻群落空间特征差异
在14个调查区域的表层沉积物样品中,共鉴定出硅藻153种(包括变种),中心纲55种,羽纹纲98种,分别属于14个科45属(附表1)。圆筛藻科是中心纲的主要类群,物种数占到硅藻总数目的24.2%,以圆筛藻属(Coscinodiscus)的物种为主;舟形藻科是羽纹纲的主要类群,物种数占到硅藻总数目的23.5%,以舟形藻属(Navicula)的物种为主。海湾潮间带的硅藻群落的物种以海水种为主,在河口区域,受淡水输入影响,多数样品中混合有淡水物种(如:膨胀桥弯藻(Cymbellatumida)、海氏窗纹藻(Epithemiahyndmanii)、膨大窗纹藻(E.turgida)、大形羽纹藻(Pinnulariamajor)等)与半咸水物种(如:条纹小环藻(Cyclotellastriatavar.striata)和柱状小环藻(C.stylorum)等)。
调查区域中硅藻物种多样性呈现出一定的空间差异(图3a),Shannon-Weaver 指数介于1.61~4.39之间,平均值为3.27,尽管在大辽河口(3.66)与涧河河口(3.90)出现了高值,但长江口以南调查区域Shannon-Weaver 指数的值高于长江口以北。硅藻生物量的空间变化表现出明显差异(图3b)。硅藻生物量的范围0.09×103~ 10×103个/g(干质量),平均值为3×103个/g(干质量);其中,高值区出现在大辽河口(7.1×103个/g,干质量)、涧河河口(6.2×103个/g,干质量)、闽江口(7.0×103个/g,干质量)和九龙江口(10×103个/g,干质量),低值区出现在秦皇岛浅滩(0.11×103个/g,干质量)、黄河口(0.18×103个/g,干质量)及四十里湾浅滩(0.09×103个/g,干质量)。结果表明,尽管在长江口以北的大辽河口与涧河河口出现了高值,但长江口以南多数调查区域硅藻生物量普遍高于长江口以北,尽管在沉积物类型为砂的英罗湾硅藻物种丰富度及硅藻生物量出现了高值,这可能与英罗湾的气温有关,适宜的温度有利于细胞的分裂,可以增加细胞的数量[36—38]。
进一步通过 PRIMER 6.0软件对14个调查区域的底栖硅藻群落结构进行聚类分析,并利用相似性分析检验(ANOSIM)对聚类结果进行差异性检验(r=0.738,P=0.1%<0.01)。结果表明,14个调查区域的硅藻群落在空间上可以分为4个大的组合(图4),各组合的优势类群与相对丰度见附表2。
组合 Ⅰ 包括渤海与北黄海区域的秦皇岛浅滩、黄河口与四十里湾浅滩3个站点;优势种以淡水种、半咸水种、广温种占优势,主要为卵形藻(Cocconeissp.)、圆筛藻(Coscinodiscussp.)、微小小环藻(C.caspia)、小环藻(C. sp.)、条纹小环藻(C.striatavar.striata)。其中,优势种小环藻(C. sp.)的相对丰度最高。另外,有部分海水物种,如:史密斯双壁藻扩大变种(Dploncissmithiivar.dilatata)、柔弱井字藻(Eunotogrammadebile)、艾氏舟形藻(Naviculaeymei)和缢缩辐节藻(Stauroneisconstricta)等。
根据相似度,组合Ⅱ可分成4个小的组合:Ⅱ(a)包括渤海区域的大辽河口与涧河河口,优势种以龙骨舟形藻(N.carinifera)和柱状小环藻(C.stylorum)为主。Ⅱ(b)包括南黄海区域的大沽河口与苏北浅滩,优势种以小环藻(C. sp.)和柱状小环藻(C.stylorum)为主。Ⅱ(c)包括东海区域的崇明岛与杭州湾,优势种明显多样化,出现了星形柄链藻(Podosirastelliger)、波状辐裥藻(Actinoptycgusundulatus)、离心列海链藻(Thalassiosiraexcentrica)、虹彩圆筛藻(Cos.oculus-iridis)和卵形褶盘藻(Tryblioptychuscocconeiformis)等多个优势物种。Ⅱ(d)包括台湾海峡区域的闽江口与九龙江口,以诺氏辐环藻(Actinocyclusnormanii)和具槽帕拉藻(Paralinasulcata)为主要优势种。优势种中半咸水种、广温种仍占优势,但与组合Ⅰ相比出现了多个暖温性物种,如:爱氏辐环藻(A.ehrenbergiivar.ehrenbergii)、小眼圆筛藻 (Cos.Oculatus)、星形柄链藻(P.stelliger)、卵形褶盘藻(T.cocconeiformis)等。

图3 底栖硅藻群落的多样性指数(a)与生物量(b)的空间分布特征Fig.3 The spatial distribution of diversity index (a) and biomass (b) of diatoms at sampling sites
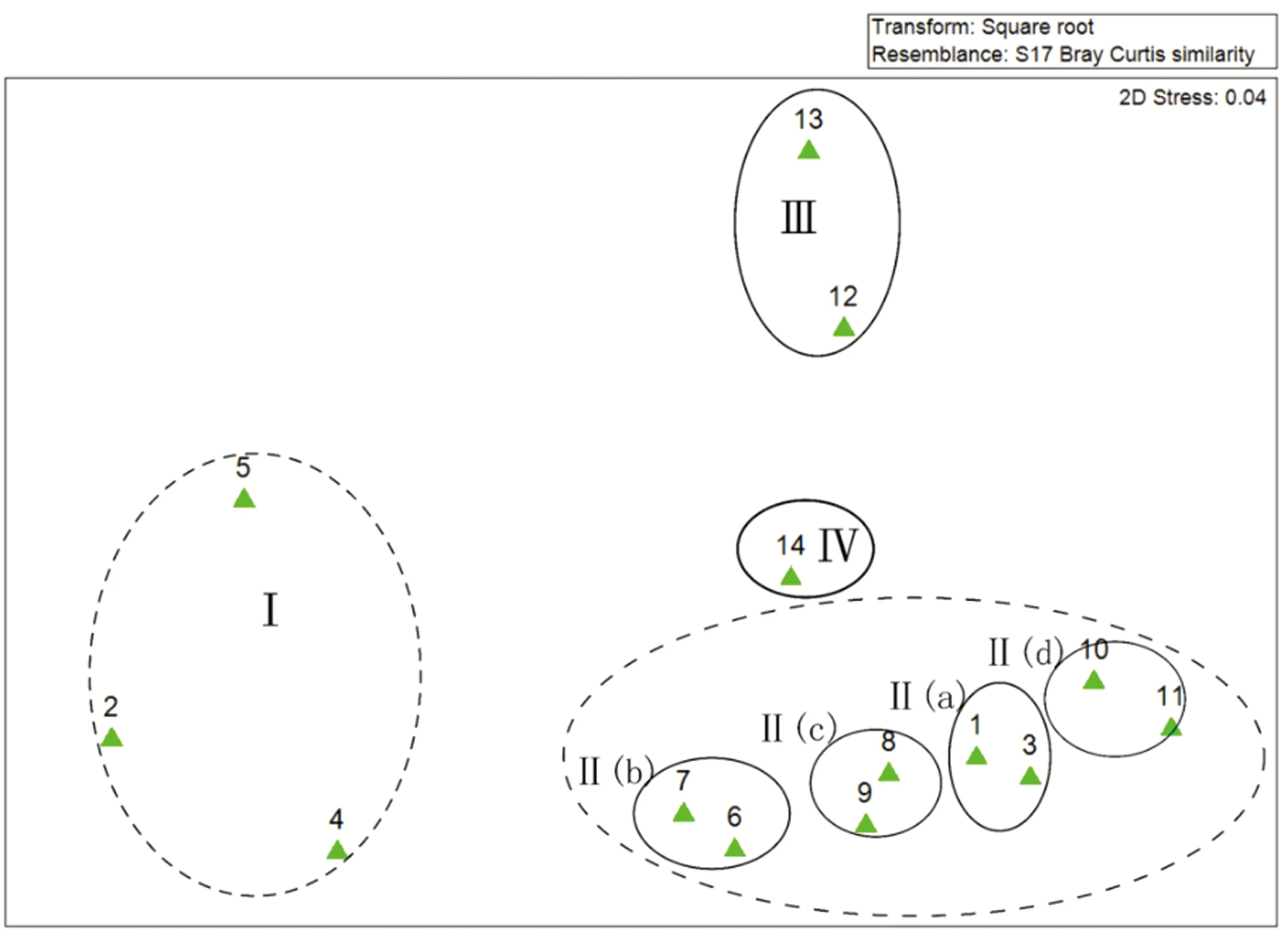
图4 硅藻群落的聚类分析特征Fig.4 Cluster analysis of diatom community
组合Ⅲ包括南海区域的珠江口与英罗湾。该组合的优势种组成明显不同于其他组合,优势种以海水种为主,如:双眉藻(Amphorasp.)、披针菱形藻(Nitzschialanceolata)、安蒂斜斑藻 (Plagiogrammaattenuatum)、双菱缝舟藻(Rhaphoneissurirella)等。受温度影响,出现了大量喜好生活在热带海水中的双菱缝舟藻(R.surirella)。
组合Ⅳ为东寨港。主要有4个优势种类,广温种、半咸水种占优势,如微小小环藻(C.caspia)、条纹小环藻(C.striatavar.striata)、柱状小环藻(C.stylorum)。同时,喜好生活在热带海水中的双菱缝舟藻(R.surirella)相对丰度最高。
以上4个组合在地理分布上显示出:底栖硅藻群落从广温广布种逐渐过渡到暖温性种类的空间变化特征。这符合以往生物地理学的研究结果,渤、黄海的近岸硅藻以温带种类为主,其中含有少量亚热带种类[39];东海近岸硅藻以暖温性与亚热带种类为主,兼有温带和热带种;而南海近岸硅藻则以热带和亚热带种类为主[40]。此外,盐度也是影响硅藻群落组合的重要因素。河口与潮间带盐度变化,取决于河流的径流量与外海水的作用程度,不同硅藻种类适应不同的盐度范围,由此在河口与潮间带形成为淡水种、半咸水种和海水种的混合组合[23—25]。本研究中,盐度与多样性指数H′ 呈现显著的负相关关系(表 2),盐度较低的大河口区域均呈现淡水种、半咸水种、海水种的混合群落,有较高的多样性。
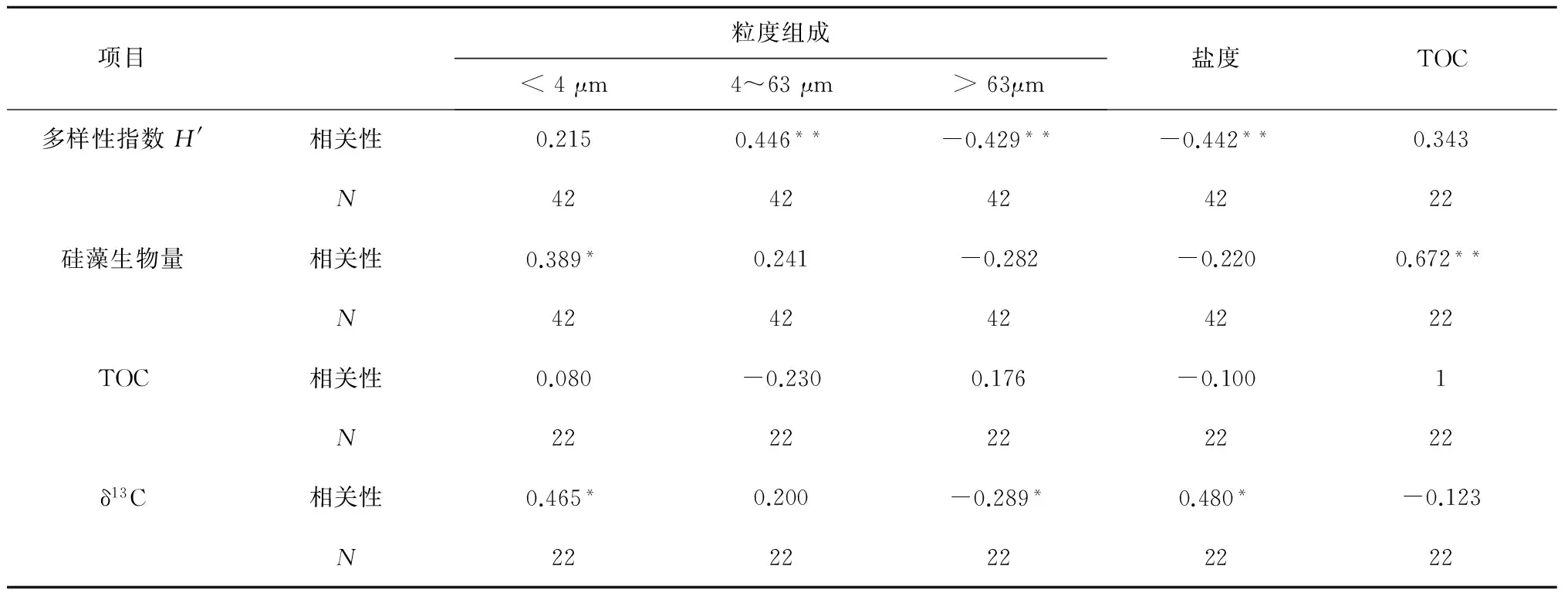
表2 硅藻生物参数、TOC含量与环境因素之间的相关性分析
注:** 在 0.01 水平(双侧)上显著相关,* 在0.05水平(双侧)上显著相关,N表示样本量。
此外,沉积物类型也是影响底栖硅藻多样性与生物量的重要因素。已有研究表明,沉积物颗粒越细,越有利于硅藻的保存与繁殖,而粗颗粒形成的沉积物孔隙大,营养物质匮乏,不利于底栖硅藻的附着、保存与繁殖[41]。因此,在淤泥含量较高的潮间带区域,通常具有较高的底栖硅藻生物量(如:80%的硅藻细胞存在于淤泥中)[42—48]。我们的调查结果表明,在淤泥质(涧河河口、杭州湾和九龙江口)、粉砂质淤泥(大辽河口、黄河口、大沽河口、苏北浅滩和崇明岛)、粉砂质砂(闽江口、珠江口和东寨港)的沉积物类型中,底栖硅藻物种多样性及生物量明显高于沉积物类型为砂相(秦皇岛浅滩、四十里湾浅滩)的区域。相关性分析进一步证实,沉积物淤泥含量与硅藻生物量呈显著正相关,粉砂含量(4~63 μm)与多样性指数H′呈显著正相关,而砂质含量与多样性指数H′及硅藻生物量呈显著负相(表2)。
3.3 表层沉积物TOC含量以及碳来源分析
表层沉积物中TOC的含量通常是表达沉积物生产力的重要指标[49]。在有些河口的研究中,甚至发现底栖硅藻是表层沉积物中TOC的主要贡献者,可以高达78%[50—51]。本研究中,由于秦皇岛浅滩、四十里湾浅滩和英罗湾沉积物的砂含量太高,故无法进行TOC的测量。其余11个站位的测量结果表明,TOC含量介于0.12%~1.10%之间,平均含量为0.56%,表现出明显的空间差异(图5a)。其中,显著的高值区出现在涧河河口(0.88%)、闽江口(0.89%)、九龙江口(1.10%)和珠江口(1.10%),低值区出现在黄河口(0.12%)。吕晓霞等[52]和刘敏[53]等对长江口TOC含量(0.34%~1.14%)的研究及张凌等[51]对珠江口TOC含量(0.48%~1.60%)的研究,表明本次研究中TOC含量与历史数据基本相一致。整体看来,TOC含量的空间分布特征与硅藻生物量存在相似性,硅藻生物量在涧河河口、九龙江口及珠江口也出现高值。进一步对硅藻生物量与TOC含量的相关性分析表明,它们之间存在极显著正相关性(P<0.01)(表2)。
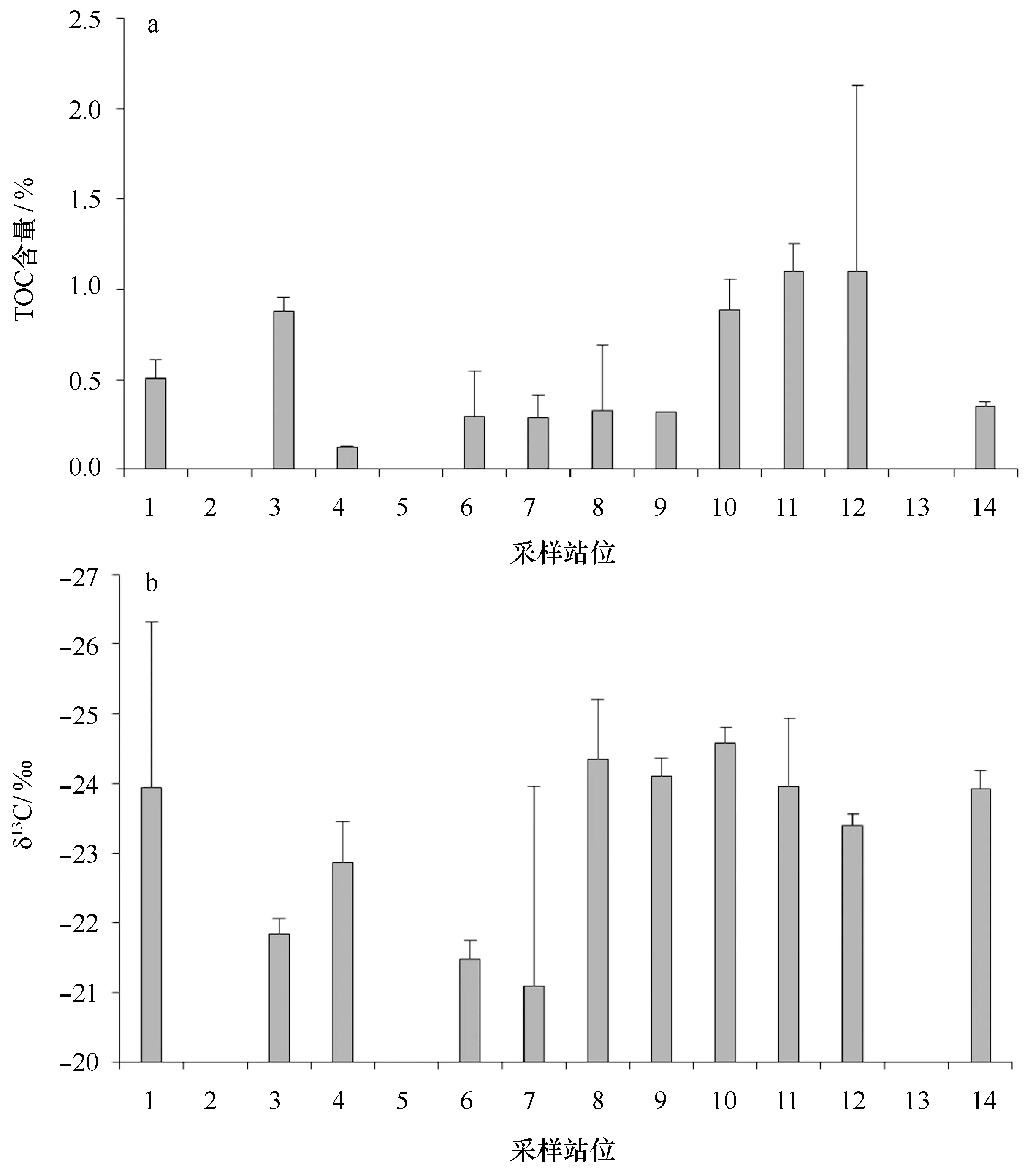
图5 14个站位表层沉积物中TOC含量(a)与δ13C(b)数值的空间特征比较Fig.5 The spatial comparison of TOC contents (a) and δ13C values (b) in the surface sediments at 14 sampling sites
δ13C是用来判定沉积物中TOC来源的重要指标,河口与近岸沉积物中的TOC多为陆源和海源混合物,δ13C值一般界于-27‰~-20‰之间[54—57]。已有研究发现,典型的陆源C3植物多为-23‰~-30‰,C4植物多为-13‰(-9‰~-17‰),典型的海洋浮游植物约为-22‰(-17‰~-24‰)[58—59]。本研究中表层沉积物δ13C值的范围是-25‰~-20‰(图5b),指示了沉积物中TOC存在混合来源。吕晓霞等[52]、刘敏等[53]发现长江口δ13C值在-29.8‰~-24.9‰之间,张凌等[51]研究发现珠江口δ13C值在-24.7‰~-21.7‰之间,表明本次研究δ13C值与历史数据基本一致。其中,站位3(涧河河口)、4(黄河口)、6(大沽河口)、7(苏北浅滩)表现出了与海洋浮游植物更为接近的数值,指示了底栖硅藻的重要贡献,但其贡献的百分比还有待于进一步研究。此外,δ13C与盐度存在显著正相关性(P<0.01),指示了TOC含量中的陆源成份显著受到河流径流量的影响,这也可能是沉积物中TOC含量与粒度没有表现出显著相关性的原因。
4 结论
通过对14个典型潮间带区域的调查,发现底栖硅藻群落在空间上可以划分为4个明显的组合,分别对应着渤、黄、东、南海4个区域,这吻合了我国近海浮游植物的地理分布特征。相关性分析表明,底栖硅藻群落物种多样性与生物量受到沉积物类型与盐度的显著影响。
调查区域表层沉积物中TOC含量与底栖硅藻生物量表现出显著正相关性,δ13C数值的空间变化,指示出在涧河河口、黄河口、大沽河口、苏北浅滩区域,底栖硅藻可能是沉积物中有机碳的重要贡献者。
[1] Mitsch W J, Gosselink J G. Wetlands[M]. 3rd ed. New York: John Wiley, 2000.
[2] 李凡. 海岸带陆海相互作用(LOICZ)研究及我们的策略[J]. 地球科学进展, 1996, 11(1): 19-23.
Li Fan. Study on land-ocean interaction in the coastal zone and our strategy[J]. Advances in Earth Sciences, 1996, 11(1): 19-23.
[3] Sawai Y, Horton B P, Kemp A C, et al. Relationships between diatoms and tidal environments in Oregon and Washington, USA[J]. Diatom Research, 2016, 31(1): 17-38.
[4] 陈品健. 尖刀蛏食性和食料的研究[J]. 台湾海峡, 1998, 17(S1): 39-43.
Chen Pinjian. Study on feeding habits and food species of dagger clam, cultellus scalprum[J]. Journal of Oceanography in Taiwan Strait, 1998, 17(S1): 39-43.
[5] 尤仲杰, 王一农, 徐海军. 泥螺Bullactaexarata(Philippi)生态的初步观察[J]. 浙江水产学院学报, 1994, 13(4): 245-250.
You Zhongjie, Wang Yinong, Xu Haijun. A preliminary study on ecological habit of the mud snail,Bullactaexarata[J]. Journal of Zhejiang College of Fisheries, 1994, 13(4): 245-250.
[6] Sundback K, Granéli W. Influence of microphytobenthos on the nutrient flux between sediment and water: a laboratory study[J]. Marine Ecology Progress Series, 1988, 43(1/2): 63-69.
[7] Nilsson C, Sundbäck K. Growth and nutrient uptake studied in sand-agar microphytobenthic communities[J]. Journal of Experimental Marine Biology and Ecology, 1991, 153(2): 207-226.
[8] Nilsson P, Jonsson B, Swanberg I L, et al. Response of a marine shallow-water sediment system to an increased load of inorganic nutrients[J]. Marine Ecology Progress Series MESEDT, 1991, 71(3): 275-290.
[9] Rysgaard S, Christensen P B, Nielsen L P. Seasonal variation in nitrification and denitrification in estuarine sediment colonized by benthic microalgae and bioturbating infauna[J]. Marine Ecology Progress Series, 1995, 126: 111-121.
[10] Edgar L A, Pickett-Heaps J D. Diatom locomotion[J]. Progress in Phycological Research, 1984, 3: 47-88.
[11] Grant J, Bathmann U V, Mills E L. The interaction between benthic diatom films and sediment transport[J]. Estuarine, Coastal and Shelf Science, 1986, 23(2): 225-238.
[12] Paterson D M. Short-term changes in the erodibility of intertidal cohesive sediments related to the migratory behavior of epipelic diatoms[J]. Limnology and Oceanography, 1989, 34(1): 223-234.
[13] Heinzelmann C H, Wallisch S. Benthic settlement and bed erosion. A review[J]. Journal of Hydraulic Research, 1991, 29(3): 355-371.
[14] 沈瑞生, 冯砚青, 牛佳. 中国海岸带环境问题及其可持续发展对策[J]. 地域研究与开发, 2005, 24(3): 124-128.
Shen Ruisheng, Feng Yanqing, Niu Jia. Synthesis of the Chinese Coastal Zone environment problems[J]. Areal Research and Development, 2005, 24(3): 124-128.
[15] 刘瑞玉. 胶州湾生态学和生物资源[M]. 北京: 科学出版社, 1992.
Liu Ruiyu. Ecology and Living Resources of Jiaozhou Bay[M]. Beijing: Science Press, 1992.
[16] 陈兴群, 陈其焕, 张明. 厦门潮间滩涂小型底栖硅藻和叶绿素的分布[J]. 生态学报, 1991, 11(4): 372-376.
Chen Xingqun, Chen Qihuan, Zhang Ming. Distribution of chlorophyll and benthic diatoms in the intertidal flat around Xiamen[J]. Acta Ecological Sinica, 1991, 11(4): 372-376.
[17] 朱根海, 陈国通, 杨俊毅. 南麂列岛潮间带的微小型底栖藻类[J]. 东海海洋, 1994, 12(2): 16-28.
Zhu Genhai, Chen Guotong, Yang Junyi. Benthic nano-and microalgae on intertidal zone in Nanji Archipalego[J]. Donghai Marine Science, 1994, 12(2): 16-28.
[18] 吴瑞, 蓝东兆, 高亚辉, 等. 象山港潮间带底栖硅藻的分布及其与环境关系探讨[J]. 台湾海峡, 2008, 27(4): 445-451.
Wu Rui, Lan Dongzhao, Gao Yahui, et al. Preliminary study on the distribution of benthic diatoms and their environments in intertidal zone of Xiangshan Bay[J]. Journal of Oceanography in Taiwan Strait, 2008, 27(4): 445-451.
[19] Renberg I. A procedure for preparing large sets of diatom slides from sediment cores[J]. Journal of Paleolimnology, 1990, 4(1): 87-90.
[20] Last W M, Smol J P. Tracking environmental change using lake sediments[M]. Dordrecht Boston: Kluwer Academic, 2001.
[21] 金德祥, 陈金环, 黄凯歌. 中国海洋浮游硅藻类[M]. 上海: 上海科学技术出版社, 1965.
Jin Dexiang, Chen Jinhuan, Huan Kaige. Chinese Marine Planktonic Dacillariophyta[M]. Shanghai: Shanghai Science and Technology Press, 1965.
[22] 金德祥, 程兆第, 林均民, 等. 中国海洋底栖硅藻类(上卷)[M]. 北京: 海洋出版社, 1982.
Jin Dexiang, Cheng Zhaodi, Lin Junmin, et al. Chinese Marine Denthic Dacillariophyta (volume)[M]. Beijing: China Ocean Press, 1982.
[23] 金德祥, 程兆第, 刘师成, 等. 中国海洋底栖硅藻类(下卷)[M]. 北京: 海洋出版社, 1992.
Jin Dexiang, Cheng Zhaodi, Liu Shicheng, et al. Chinese Marine Denthic Dacillariophyta (scroll down)[M]. Beijing: China Ocean Press, 1992.
[24] 郭玉洁. 中国海藻志(第五卷)硅藻门(第一册)中心纲[M]. 北京: 科学出版社, 2003.
Guo Yujie. Flora Algarum Marinarum Sinicarum (Tomus Ⅴ) Dacillariophyta NO.1 Centricae[M]. Beijing: Science Press, 2003.
[25] 程兆第, 高亚辉, Dickman M. 硅藻彩色图集[J]. 北京: 海洋出版社, 1996.
Cheng Zhaodi, Gao Yahui, Dickman M. Colour Plates of the Diatoms[M]. Beijing: China Ocean Press, 1996.
[26] Hasle G R. The biogeography of some marine planktonic diatoms[J]. Deep Sea Research and Oceanographic Abstracts, 1976, 23(4): 319-338.
[27] Tomas R, Hasle G R, Syvertsen E E, et al. Identifying marine diatoms and dinoflagellates[M]. San Diego: Academic Press, 1996.
[28] Battarbee R W, Jones V J, Flower R J, et al. Diatoms[M]//Smol J P, Birks H J B, Last W M, et al. Tracking Environmental Change Using Lake Sediments. Netherlands: Springer, 2001: 155-203.
[29] Shannon C E, Weaver W. The mathematical theory of information[J]. Journal Article, 1949, 19(7): 1.
[30] 中华人民共和国国家质量监督检疫总局. GB/T 12763.8-2007, 海洋调查规范 第8部分: 海洋地质地球物理调查[S]. 北京: 中国标准出版社, 2007.
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 12763.8-2007, Specifications for oceanographic survey-Part 8: marine geology and geophysics survey[S]. Beijing: China Standard Press, 2007.
[31] Folk R L, Andrews P B, Lewis D W. Detrital sedimentary rock classification and nomenclature for use in New Zealand[J]. New Zealand Journal of Geology and Geophysics, 1970, 13(4): 937-968.
[32] 郭慧丽, 王玉珏, 高伟明, 等. 我国典型潮间带不同形态氮的空间分布特征[J]. 海洋环境科学, 2016, 35(5): 678-684.
Guo Huili, Wang Yujue, Gao Weiming, et al. Different forms of nitrogen in the typical intertidal zones in China[J]. Marine Environmental Science, 2016, 35(5): 678-684.
[33] 尹盛乐, 刘晓收, 袁超, 等. 胶州湾大沽河口潮间带沉积物中叶绿素和有机质含量的季节变化[J]. 海洋湖沼通报, 2012(2): 97-106.
Yin Shengle, Liu Xiaoshou, Yuan Chao, et al. Seasonal changes of chlorophyll and organic matter contents in sediment in the intertidal zone of dagu estuary, Jiaozhou Bay[J]. Transactions of Oceanology and Limnology, 2012(2): 97-106.
[34] 姚晓, 山口一岩, 邹立, 等. 黄河三角洲南部潮间带沉积环境对底栖叶绿素a分布特征的影响[J]. 生态学杂志, 2010, 29(9): 1762-1769.
Yao Xiao, Hitomi Y, Zou Li, et al. Effects of sediment environment on distribution pattern of benthic chlorophyllain southern intertidal area of Yellow River Delta[J]. Chinese Journal of Ecology, 2010, 29(9): 1762-1769.
[35] 李万会, 丁平兴. 滩涂沉积物中叶绿素a浓度与沉积特性的关系[J]. 华东师范大学学报(自然科学版), 2007(4): 26-33.
Li Wanhui, Ding Pingxing. Study on relation between variation of chlorophyllaconcentration and sediment grain size on an intertidal flat[J]. Journal of East China Normal University (Natural Science), 2007(4): 26-33.
[36] McIntire C D. The distribution of estuarine diatoms along environmental gradients: a canonical correlation[J]. Estuarine and Coastal Marine Science, 1978, 6(5): 447-457.
[37] Admiraal W, Peletier H. Influence of seasonal variations of temperature and light on the growth rate of cultures and natural populations of intertidal diatoms[J]. Marine Ecology Progress Series, 1980, 2: 35-43.
[38] Fogg G E, Bajpai S P. Temperature effects on natural phytoplankton populations[J]. Algae and the Aquatic Environment, 1988: 197-204.
[39] Wang Yanna, Liu Dongyan, Di Baoping, et al. Distribution of diatoms and silicoflagellates in surface sediments of the Yellow Sea and offshore from the Changjiang River, China[J]. Chinese Journal of Oceanology and Limnology, 2016, 34(1): 44-58.
[40] 陆钧. 南海深海表层沉积硅藻的分布[J]. 海洋地质与第四纪地质, 2001, 21(2): 27-30.
Lu Jun. Diatom distribution in surface sediments in the deep-sea area of the South China Sea[J]. Marine Geology & Quaternary Geology, 2001, 21(2): 27-30.
[41] Cunningham L, Snape I, Stark J S, et al. Benthic diatom community response to environmental variables and metal concentrations in a contaminated bay adjacent to Casey Station, Antarctica[J]. Marine Pollution Bulletin, 2005, 50(3): 264-275.
[42] Staats N, de Deckere E M G T, de Winder B, et al. Spatial patterns of benthic diatoms, carbohydrates and mud on a tidal flat in the Ems-Dollard estuary[J]. Hydrobiologia, 2001, 448(1/3): 107-115.
[43] Colijn F, Dijkema K S. Species composition of benthic diatoms and distribution of chlorophyll a on an intertidal flat in the Dutch Wadden Sea[J]. Marine Ecology Progress Series, 1981, 4: 9-21.
[44] Sundbäck K. Distribution of microbenthic chlorophyllaand diatoms species related to sediment characteristics[J]. Ophelia, 1984, 3: 229-246.
[45] De Jonge V N. The occurrence of ‘epipsammic’diatom populations: a result of interaction between physical sorting of sediment and certain properties of diatom species[J]. Estuarine, Coastal and Shelf Science, 1985, 21(5): 607-622.
[46] Brotas V, Cabrita T, Portugal A, et al. Spatio-temporal distribution of the microphytobenthic biomass in intertidal flats of Tagus Estuary (Portugal)[J]. Hydrobiologia, 1995, 300(1): 93-104.
[47] De Jonge V N, van Beusekom J E E. Wind-and tide-induced resuspension of sediment and microphytobenthos from tidal flats in the Ems estuary[J]. Limnology and Oceanography, 1995, 40(4): 766-778.
[48] Guarini J M, Blanchard G F, Bacher C, et al. Dynamics of spatial patterns of microphytobenthic biomass: inferences from a geostatistical analysis of two comprehensive surveys in Marennes-Oléron Bay (France)[J]. Marine Ecology Progress Series, 1998, 166: 131-141.
[49] 李友富. 大亚湾海域环境变化的沉积记录研究[D]. 广州: 暨南大学, 2008.
Li Youfu. Research on the sedimentary records of environmental changes in the Daya Bay, South China Sea[D]. Guangzhou: Ji′nan University, 2008.
[50] 李欣. 沉积物中生物硅在黄渤海的环境指示意义[D]. 北京: 中国科学院大学, 2016.
Li Xin. The environmental indication of biogenic silica the sediment of the Bohai and Yellow seas, China[D]. Beijing: University of Chinese Academy of Sciences, 2016.
[51] 张凌, 陈繁荣, 殷克东, 等. 珠江口及近海表层沉积有机质的特征和来源[J]. 热带海洋学报, 2001, 29(1): 98-103.
Zhang Ling, Chen Fanrong, Yin Kedong, et al. The characteristics and sources of surface sediments in the Pearl River Estuary and its adjacent shelves[J]. Journal of Tropical Oceanography, 2001, 29(1): 98-103.
[52] 吕晓霞, 翟世奎, 于增慧, 等. 长江口内外表层沉积物中营养元素的分布特征研究[J]. 海洋通报, 2005, 24(2): 40-45.
Lü Xiaoxia, Zhai Shikui, Yu Zenghui, et al. Distribution characteristics of nutrients in the surface sediments of Yangtze River Estuary[J]. Marine Science Bulletin, 2005, 24(2): 40-45.
[53] 刘敏, 侯立军, 许世远, 等. 长江口潮滩有机质来源的C、N稳定同位素示踪[J]. 地理学报, 2004, 59(6): 918-926.
Liu min, Hou Lijun, Xu Shiyuan, et al. Carbon and Nitrogen stable isotopes as tracers to source organic matter in the Yangtze Estuary[J]. Acta Geographica Sinica, 2004, 59(6): 918-926.
[54] Spiker E C, Schemel L E. Distribution and stable isotope composition of carbon in San Francisco Bay[C]//Conoms T J. San Francisco Bay: The Urbanized Estuary: Proceeding of 58th Annual Meeting of the Pacific Division/American Association for the Advancement of Science. San Francisco, California: California Academy of Sciences, 1979.
[55] Hackney C T, Haines E B. Stable carbon isotope composition of fauna and organic matter collected in a Mississippi estuary[J]. Estuarine and Coastal Marine Science, 1980, 10(6): 703-708.
[56] Schoell H P. Applications of isotope analysis to petroleum and natural gas research[J]. Spectra, 1982, 8(2/3): 32-41.
[57] Schwinghamer P, Tan F C, Gordon Jr D C. Stable carbon isotope studies on the Pecks Cove mudflat ecosystem in the Cumberland Basin, Bay of Fundy[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1983, 40(S1): S262-S272.
[58] Boutton T W. Stable carbon isotope ratios of natural materials: II. Atmospheric, terrestrial, marine, and freshwater environments[M]//Coleman D C, Fry B. Carbon Isotope Techniques. San Diego, CA: Academic Press, 1991: 173.
[59] Maksymowska D, Richard P, Piekarek-Jankowska H, et al. Chemical and isotopic composition of the organic matter sources in the Gulf of Gdansk (Southern Baltic Sea)[J]. Estuarine, Coastal and Shelf Science, 2000, 51(5): 585-598.
Spatial distribution of benthic diatom in the typical intertidal zones in China
Xu Shuaishuai1,2, Di Baoping2, Wang Yujue2, Liu Dongyan2,3, Wang Xiaodong1
(1.ResearchCenterforHarmfulAlgaeandMarineBiology,Ji′nanUniversity,Guangzhou510632,China; 2.KeyLaboratoryofCoastalEnvironmentalProcessesandEcologicalRemediation,YantaiInstituteofCoastalZoneResearch,ChineseAcademyofSciences,Yantai264003,China; 3.StateKeyLabofEstuarineandCoastalResearch,EastChinaNormalUniversity,Shanghai200062,China)
Benthic diatom is an important biological community in ecosystems of estuaries and mud flats. The abundance and distribution of the benthic diatom could affect the food supply of marine organism and the survival and migration of sea birds. In this study, the community structure and spatial distribution of benthic diatoms in the surface sediments were investigated at the 14 intertidal zones along the Chinese coastline. 153 diatom species were identified from the samples, and diversity index (Shannon-Weaver index from 1.61 to 4.39) and biomass (from 0.09×103to 10×103valves/g DW; DW means dry sediment weight) are significantly different in the spatial distribution. Cluster analysis and ANOSIM (r=0.738,P=0.1%<0.01) indicated that the 14 sampling sites can classify 4 geological groups, according to their diversity and biomass, and the geological groups are in response to the geographical distribution of phytoplankton in the Bohai, Yellow, East and South China Seas, respectively. The correlation analysis indicated that the sediment types and salinity had significant effects on diatom diversity and biomass. Muddy sediments were better for diatom preservation, and species diversity was higher at sites with sandy mud and low salinity. The contents of organic carbon and the biomasses of benthic diatoms in the surface sediments showed significant positive correlation, and the carbon stable isotope ratio (δ13C) values ( from -25‰ to -20‰) indicated that organic matters were a mixture of terrestrial and sea sources at most sites. Lower δ13C values in tidal flats of Jian River, Yellow River, Dagu River and Subei coast indicated the significant contribution of benthic diatoms on the organic carbon.
intertidal zone; surface sediments; benthic diatom; spatial distribution; organic carbon







附表2 各组合中优势藻种及其相对丰度
Appendix 2 Relative abundance of dominant species in four groups with sub-groups

组合站位优势种及其比例/%Ⅰ2卵形藻Cocconeissp.(13.5),小环藻Cyclotellasp.(59.6),艾氏舟形藻Naviculaeymei(5.8),缢缩辐节藻Stauroneisconstric-ta(7.7)4微小小环藻C.caspia(8.6),小环藻C.sp.(58.0),条纹小环藻C.striatavar.striata(6.2),艾氏舟形藻N.eymei(9.9)5卵形藻Coc.sp.(7.3).圆筛藻Cos.sp.(9.8),微小小环藻C.caspia(7.3),史密斯双壁藻扩大变种Dploncissmithiivar.dila-tata(22.0),柔弱井字藻Eunotogrammadebile(14.6)Ⅱ(a)1条纹小环藻C.striatavar.striata(6.0),柱状小环藻C.stylorum(12.9),史密斯双壁藻扩大变种D.smithiivar.dilatata(11.3),卵形菱形藻Nitzschiacocconeiformis(24.9),颗粒菱形藻Nit.granulata(17.1)3条纹小环藻C.striatavar.striata(6.5),柱状小环藻C.stylorum(24.6),龙骨舟形藻N.carinifera(17.2)Ⅱ(b)6小环藻C.sp.(30.1),柱状小环藻C.stylorum(23.7),颗粒菱形藻Nit.granulata(19.3),星行柄链藻Podosirastelliger(6.2)7蛇目圆筛藻Coscinodiscusargus(6.1),小眼圆筛藻Cos.oculatus(6.1),小环藻C.sp.(21.8),柱状小环藻C.stylorum(19.6),星行柄链藻P.stelliger(7.8)Ⅱ(c)8波状辐裥藻Actinoptycgusundulatus(6.2),结节圆筛藻Cos.nodulifer(5.8),小眼圆筛藻Cos.oculatus(5.3),圆筛藻Cos.sp.(5.8),微小小环藻C.caspia(15.2),小环藻C.sp.(13.8),柱状小环藻C.stylorum(6.2),离心列海链藻Thalassiosiraexcentrica(5.9)9虹彩圆筛藻Cos.oculus-iridis(5.2),圆筛藻Cos.sp.(9.6),小环藻C.sp.(5.6),条纹小环藻C.striatavar.striata(5.6),柱状小环藻C.stylorum(6.6),钝头菱形藻Nit.obtusa(9.4).星行柄链藻P.stelliger(5.4),卵形褶盘藻Tryblioptychuscoccone-iformis(5.4)Ⅱ(d)10爱氏辐环藻Actinocyclusehrenbergiivar.ehrenbergii(5.4),爱氏辐环藻优美变种A.ehrenbergiivar.tenella(6.4),诺氏辐环藻A.normanii(37.7).圆筛藻Cos.sp.(16.7)11小眼圆筛藻Cos.oculatus(5.0),条纹小环藻C.striatavar.striata(12.0),柱状小环藻C.stylorum(14.9),具槽帕拉藻Paralinasulcata(26.9)Ⅲ12诺氏辐环藻A.normanii(18.1),短缝双眉藻巨大变种Amphoraeunotiavar.gigantea(6.0),强壮双眉藻Amp.robusta(5.7),长舟形藻N.lonnga(7.5),披针菱形藻Nit.lanceolata(15.3),双菱缝舟藻Rhaphoneissurirella(5.3)13双眉藻Amp.sp.(17.2),双壁藻D.sp.(5.5),马氏槌棒藻Opephoramaryi(22.5),安蒂斜斑藻Plagiogrammaattenuatum(19.4),双菱缝舟藻R.surirella(18.6)Ⅳ14微小小环藻C.caspia(8.8),条纹小环藻C.striatavar.striata(10.4),柱状小环藻C.stylorum(8.1),双菱缝舟藻R.surirella(12.3)
10.3969/j.issn.0253-4193.2017.06.010
2016-10-26;
2017-02-19。
科技基础性工作专项(2014FY210600);国家自然科学基金(41376121);山东省自然科学基金杰出青年基金项目(JQ201414)。
徐帅帅(1990—),女,山东省潍坊市人,主要从事海洋生态学研究。E-mail:ssxu0922@163.com
Q949.27
A
0253-4193(2017)06-0095-19
徐帅帅,邸宝平,王玉珏,等. 我国典型潮间带底栖硅藻群落空间分布特征[J].海洋学报,2017,39(6):95—113,
Xu Shuaishuai, Di Baoping, Wang Yujue,et al. Spatial distribution of benthic diatom in the typical intertidal zones in China[J]. Haiyang Xuebao,2017,39(6):95—113, doi:10.3969/j.issn.0253-4193.2017.06.010

