黄河口及其邻近水域强壮箭虫密度的时空分布及其与环境因子的关系
刘晓慧,薛莹,张崇良,任一平,徐宾铎*
(1.中国海洋大学 水产学院,山东 青岛 266003)
黄河口及其邻近水域强壮箭虫密度的时空分布及其与环境因子的关系
刘晓慧1,薛莹1,张崇良1,任一平1,徐宾铎1*
(1.中国海洋大学 水产学院,山东 青岛 266003)
为探究强壮箭虫(Sagittacrassa)在黄河口及其邻近水域的时空分布特征及其与生物和非生物环境等因子的关系,本文依据2013—2014年在黄河口及其邻近水域6个航次的调查数据,采用丛生指标(I)、聚块性指标(A)和负二项分布参数的倒数(CA)等聚集指标,分析了强壮箭虫的空间分布特征;应用广义可加模型(GAM)研究了强壮箭虫密度的时空分布和环境因子的关系。结果表明,黄河口及其邻近水域强壮箭虫平均密度为21.85 ind/m3,春、秋季高,冬、夏季低;其密度的空间分布以黄河入海口附近水域为密集中心,向远岸水域逐渐降低;强壮箭虫在黄河口及其邻近水域的聚集特征随密度的变化存在两次聚集和两次扩散;水深、表层水温和浮游桡足类密度是影响其密度时空分布的主要因子,总偏差解释率为55.11%,强壮箭虫密度随水深的增加而减小,随表层水温的升高先增加后减小,随桡足类密度的增加而增加。强壮箭虫密度受黄河口及其邻近水域环境因子变动的影响,具有明显的季节变化和空间分布规律。
黄河口;强壮箭虫;聚集指标;广义可加模型
1 引言
黄河口水域是黄、渤海渔业生物重要的产卵场、育肥场和栖息地,对黄、渤海渔业资源的补充具有重要意义[1—2]。毛颚动物作为海洋浮游动物的重要类群[3—4],既是鳀鱼(Engraulisjaponicus)等中上层鱼类的主要饵料生物之一[5—7],又是摄食其他浮游动物种类的捕食者[8—9],在海洋食物网中有着重要作用。强壮箭虫(Sagittacrassa)是黄河口及其邻近水域浮游动物的主要优势种,也是渤、黄海数量最多、分布最广的毛颚动物,其平均密度在春、夏两季可占黄河口及其邻近水域浮游动物密度组成的47.11%和43.73%[10],数量变动及空间分布往往直接影响浮游动物总生物量的分布[11—13],对该水域渔业资源养护具有较重要的影响[14—15]。
不同生命周期的浮游动物对环境因子的变动常表现出不同的响应[16—17],是近岸水域生态系统的重要指示种[18—19]。因此,探究浮游动物的生态学特征及其与环境因子之间的关系,可以为海洋环境监测提供支持,也可以为研究气候变化的区域响应提供科学依据。强壮箭虫对海洋水文环境的敏感性常使其作为近岸低盐水团的指示种,其密度的时空分布特征和季节变化规律可以从侧面反映黄河口及其邻近水域环境的变化,具有重要的生态指示意义[20—21]。
目前,我国对强壮箭虫时空分布及其与环境因子关系等方面的研究,在沿海各项浮游生物调查中多有涉及[22—24],但针对性弱。毕洪生等[12]及白雪娥和庄志猛[24]发现强壮箭虫在渤海的最高密度值出现在9月。李云等[25]通过分析强壮箭虫密度的平面分布和季节变化特征,认为其可作为长江口海洋变暖长期变化的重要指示种。徐风风等[26]研究表明,山东半岛黄海沿岸强壮箭虫的年平均密度为63.2 ind/m3,秋季最高,冬、夏季次之,春季最低,影响其分布的主要环境因子有温度、盐度和桡足类分布。盖建军和倪金俤[15]研究认为海州湾强壮箭虫呈聚集分布,中北部海域平均密度高于南部,春、冬季节平均密度高于夏、秋季节。
本文利用2013—2014年在黄河口及其邻近水域6个航次的调查数据,分析了强壮箭虫的时空分布、数量变化、聚集情况等密度特征及其与环境因子的关系,以期为进一步研究毛颚动物在海洋生态系统结构和功能方面的作用提供参考依据,为深入探讨黄河口生态系统结构和功能提供基础资料。
2 材料与方法
2.1 数据来源
于2013年6月、8月、10月和2014年2月、4月、5月在黄河口及其邻近水域进行了6个航次的浮游动物和环境调查,其中6月、8月为夏季,10月为秋季,2月为冬季,4月、5月为春季。以黄河入海口为中心,向外延伸设置5条断面,其中断面3为沿黄河入海口方向断面,共18个站位,分别以断面-序号命名,入海口附近的站位较密集(图1、表1)。
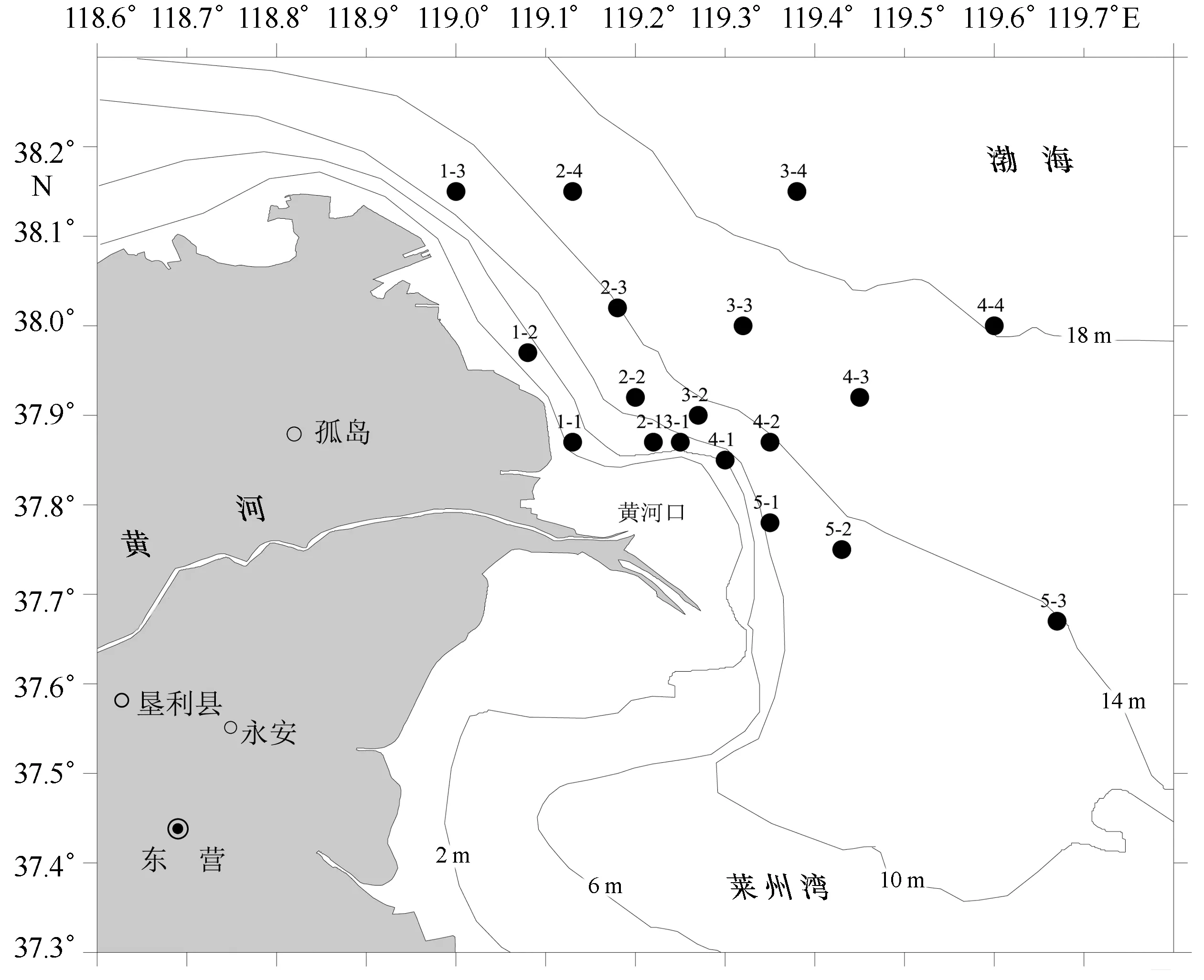
图1 黄河口及其邻近水域调查站位分布Fig.1 Sampling stations in the Yellow River Estuary and its adjacent waters
按照《海洋调查规范第6部分:海洋生物调查》(GB/T 12763.6-2007)的要求,使用浅水Ⅰ型浮游生物网(网长145 cm,网口内径50 cm,网口面积0.2 m2,筛绢CQ14,孔径0.505 mm)自底至表垂直拖网采集浮游动物,样品用5%甲醛溶液固定,浓缩后进行镜检、鉴定和计数。根据采样滤水量将浮游动物个数换算为个体密度(ind/m3)。本文所用强壮箭虫和桡足类密度数据来自该项浮游动物调查。浮游植物数据来自同期浅水Ⅲ型浮游生物网的拖网采集,处理方法同浮游动物[27]。鱼类数据来自同期底拖网调查[28]。每站起网后,用CTD仪同步进行温度、盐度、水深和溶解氧等环境因子的测定。
表1 黄河口及其邻近水域调查站位地理坐标

Tab.1 Geographic coordinate of sampling stations in the Yellow River Estuary and its adjacent waters
2.2 数据分析
2.2.1 密度的月变化
分析强壮箭虫密度的月变化,并对不同月份间强壮箭虫密度进行Aspin-Welch差异显著性检验[29]。
2.2.2 聚集强度
应用丛生指标(I)、聚块性指标(A)和负二项分布参数的倒数(CA),分析该海域强壮箭虫的空间分布型[30]。
丛生指标(I):
(1)
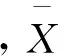
聚块性指标(A):
(2)

负二项分布参数的倒数(CA):
(3)
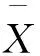
2.2.3 强壮箭虫密度时空分布与环境因子的关系
利用广义可加模型(GAM)分析黄河口及其邻近水域强壮箭虫密度时空分布与环境因子之间的关系,其一般表达形式为[33]:
Y=α+∑f(x)+ε,
(4)
式中,Y为连接函数,α为模型中线性部分的截距,f(x)为非线性平滑函数,ε为残差。利用AIC准则检验模型的拟合程度,AIC值越小,模型拟合效果越好[33]。利用F检验评估环境因子的显著性[34]。以上模型构建利用R软件中的gam软件包实现[35]。
为降低环境因子之间的自相关性对模型方差估计的影响,在把环境因子引入GAM模型之前,首先进行相关性分析,排除了显著相关的环境因子[36]:底温、底盐和溶解氧,保留了水深(depth)、表温(SST)、表盐(SSS)、浮游植物个体密度(phytoplankton)、浮游桡足类个体密度(Copepoda)和摄食强壮箭虫的鱼类生物量(fish)共6个环境因子。其中,水深、表温、表盐和浮游植物是影响强壮箭虫时空分布的常规因素,浮游桡足类是强壮箭虫的主要饵料种类,鳀鱼、白姑鱼(Argyrosomusargentatus)、斑鰶(Konosiruspunctatus)、赤鼻棱鳀(Thryssachefuensis)、方氏云鳚(Pholisfangi)、黑鳃梅童鱼(Collichthysniveatus)、黄鲫(Setipinnataty)、皮氏叫姑鱼(Johniusbelangeri)、青鳞小沙丁鱼(Sardinellafimbriata)、小黄鱼(Larimichthyspolyactis)等鱼类是强壮箭虫的主要捕食者。
3 结果
3.1 强壮箭虫密度的空间分布
在黄河口及其邻近水域的不同季节强壮箭虫呈现出较为相似的空间分布规律,以黄河入海口附近水域为密集中心,向远岸水域密度逐渐降低(图2)。夏季强壮箭虫密度整体较低,变化范围为0.46~33.30 ind/m3,其中8月的最高密度值出现在黄河入海口东北部海域;秋季密度略有上升,变化范围为1.16~47.97 ind/m3;冬季密度最低,变化范围为0.51~11.31 ind/m3;春季密度最高,各站位密度分布不均匀,且波动较大,黄河入海口北部个别站位密度达718.91 ind/m3和201.13 ind/m3,远岸少数站位则未发现强壮箭虫,其余各站位密度的变化范围为0.76~148.59 ind/m3。

图2 黄河口及其邻近水域强壮箭虫密度的空间分布Fig.2 Spatial distributions of Sagitta crassa density in the Yellow River Estuary and its adjacent waters
3.2 强壮箭虫密度的月变化
黄河口及其邻近水域强壮箭虫的平均密度为21.85 ind/m3,月均密度的变化范围为3.76~76.92 ind/m3。Aspin-Welch差异显著性检验表明,除6月和8月外,其他各月份之间的密度存在显著差异(p<0.05)。4月密度最高,比次高值5月高出近3倍,2月密度最低,仅为4月密度的5%,6月、8月和10月的密度值较低,变化较小(图3)。整体来看,强壮箭虫春、秋季的密度高于夏、冬季。

图3 黄河口及其邻近水域强壮箭虫密度的月变化(平均值+标准误差)Fig.3 Monthly variation in density of S. crassa in the Yellow River Estuary and its adjacent waters (mean + standard error)
3.3 强壮箭虫聚集特征
强壮箭虫在不同月份呈现出不同的聚集特征,全部聚集指标均显示其在夏季8月和冬季为均匀分布,在其他月份为聚集分布,但聚集强度不同(表2)。夏季,其密度整体较低,6月聚集,8月即呈现出均匀分布的状态;秋季密度上升,种群再次聚集,但聚集强度较弱,各指标值相对较小;冬季密度降到最低,种群经过扩散回到均匀分布;春季密度上升,种群重新开始聚集,聚集强度达到全年最高,但丛生指标指示4月聚集强度最大,而负二项分布参数的倒数和聚块性指标表明5月聚集强度最大。
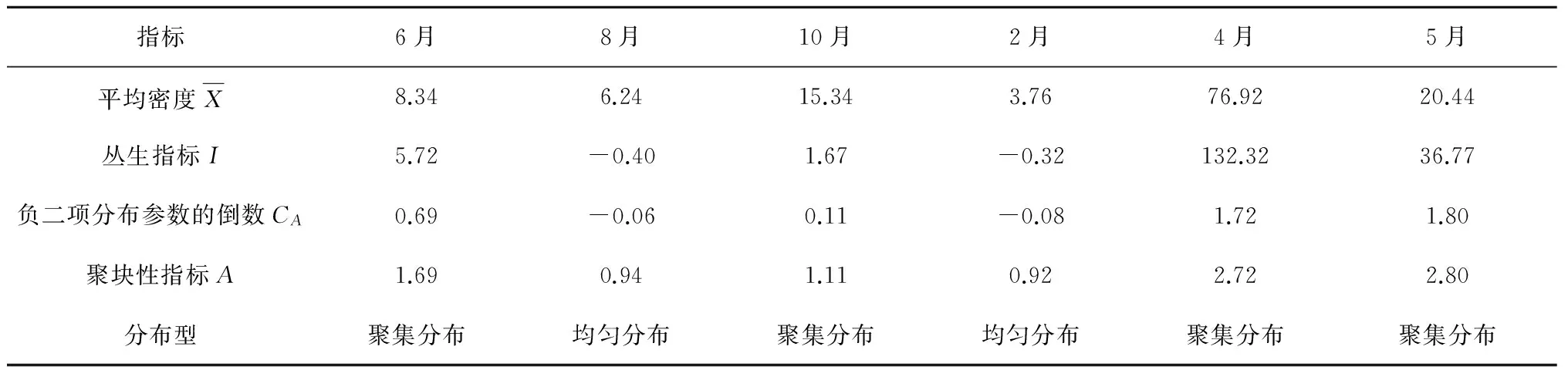
表2 黄河口及其邻近水域强壮箭虫的聚集强度指标
3.4 强壮箭虫密度时空分布与环境因子的关系
3.4.1 GAM模型的结果
为检验初始模型中每个因子的重要性及遴选出最优模型,以AIC为检验准则,对初始模型进行逐步回归(表3),当AIC值最小时,得到最适GAM模型的具体表达形式:
ln(density+1)~s(depth)+s(SST)+
s(ln(Copepoda+1))+ε,
(5)
式中,density为强壮箭虫的密度。
最适模型中逐步加入影响因子后拟合结果的偏差分析见表4,每一行显示了拟合过程和解释变量加入后的相关信息。该模型对强壮箭虫密度时空变化的总偏差解释率为55.11%;其中贡献率最大的因子为水深(25.02%);其次为表温和浮游桡足类密度,贡献率分别为21.39%和8.70%。
F检验表明,除水深外,强壮箭虫密度与表温呈显著相关(P<0.05),与浮游桡足类密度成极显著相关(P<0.01)。水深的加入使模型的AIC值明显下降,表明模型拟合程度有所提高,且其对总偏差解释率的贡献最大,因此在模型中最终保留了水深因子。

表3 GAM模型筛选
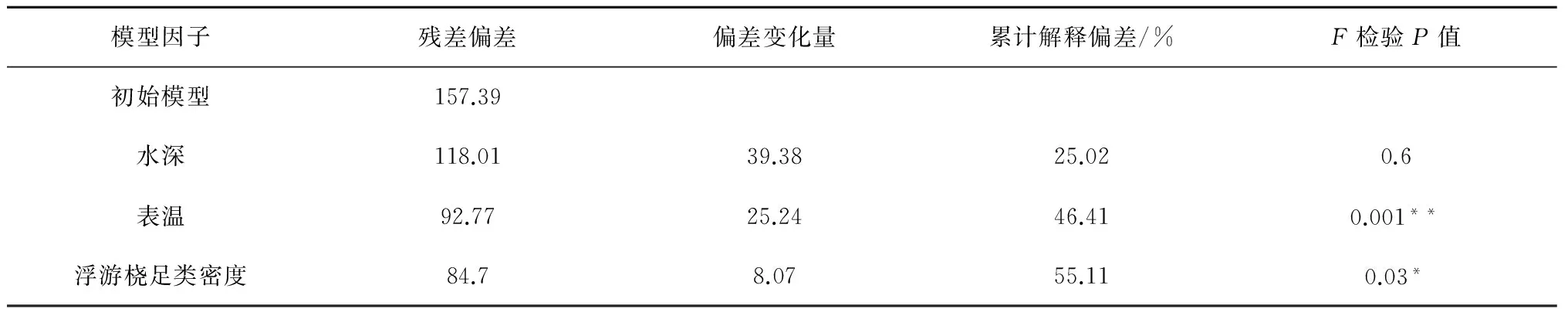
表4 GAM模型统计结果
注:*代表显著相关,**代表极显著相关。
3.4.2 强壮箭虫密度对环境因子的响应
在非生物环境因子中,强壮箭虫密度与水深的关系最为密切(表4),随水深的增加而减小,且下降趋势明显,在水深10~15 m范围内密度较大,较浅或较深时可信度变小(图4a)。随着表温升高,强壮箭虫密度呈现出先增加后减小的趋势,最适范围为10~20℃,温度低于5℃或高于25℃时强壮箭虫密度较低(图4b)。浮游桡足类作为强壮箭虫的主要饵料,是影响强壮箭虫密度的重要生物环境因子,随着桡足类密度增加,强壮箭虫密度逐渐升高(图4c)。
4 讨论与分析
4.1 强壮箭虫密度的时空分布
强壮箭虫密度在黄河口及其邻近水域具有春、秋季高,冬、夏季低的季节变化特征和近岸高于远岸的空间分布规律,海域温盐环境特征是影响其时空分布的重要因子[23,26]。
受到黄河冲淡水和渤海高盐度海水的共同影响,黄河口及其邻近水域的盐度具有季节性和年变幅大的特点,但其一般分布规律为靠近河口水域盐度最低,朝海峡方向逐渐增高[37]。强壮箭虫在该水域的空间分布规律与盐度变化趋势相反,其在黄河入海口附近水域密度较高,向远岸水域密度逐渐降低。有研究表明,强壮箭虫喜冷水、低盐,多分布于近岸,在盐度大于32的外海数量较少,是典型的暖温带、近岸低盐表层浮游动物[3,24,38]。本研究中黄河口水域空间尺度较小,数据显示调查海域盐度最高值为31.1,环境条件与外海有所不同,但从强壮箭虫的空间分布来看,其在适盐范围内也有一定的喜低盐习性。在GAM模型中,强壮箭虫密度随水深增加而减小,黄河口附近海域的水深随离岸距离的增大有明显增加趋势,进一步表明其密度在近岸的分布高于远岸水域,从侧面反映了盐度对强壮箭虫分布的影响。
浮游动物自主游动能力较弱,主要靠随波漂流进行运动,水动力条件对其群落结构有重要影响[21,39],强壮箭虫的空间分布和数量变动与黄河径流的强弱密切相关[24]。夏季是黄河的伏汛期,淡水的大量注入使黄河口水域温、盐、密度跃层较普遍,强大的跃层使黄河径流淡水很难向下层混合,于是沿水平方向扩散到更远的地方[37,40—41],受其影响,强壮箭虫8月的高密度区出现在调查海域的东北部。马静[22]的研究结果也表明,秋季强壮箭虫在黄河入海口附近及调查海区的北部形成密度高值区,夏季高值区则出现在入海口东部水域,可见冲淡水的强弱对强壮箭虫的空间分布具有重要影响。
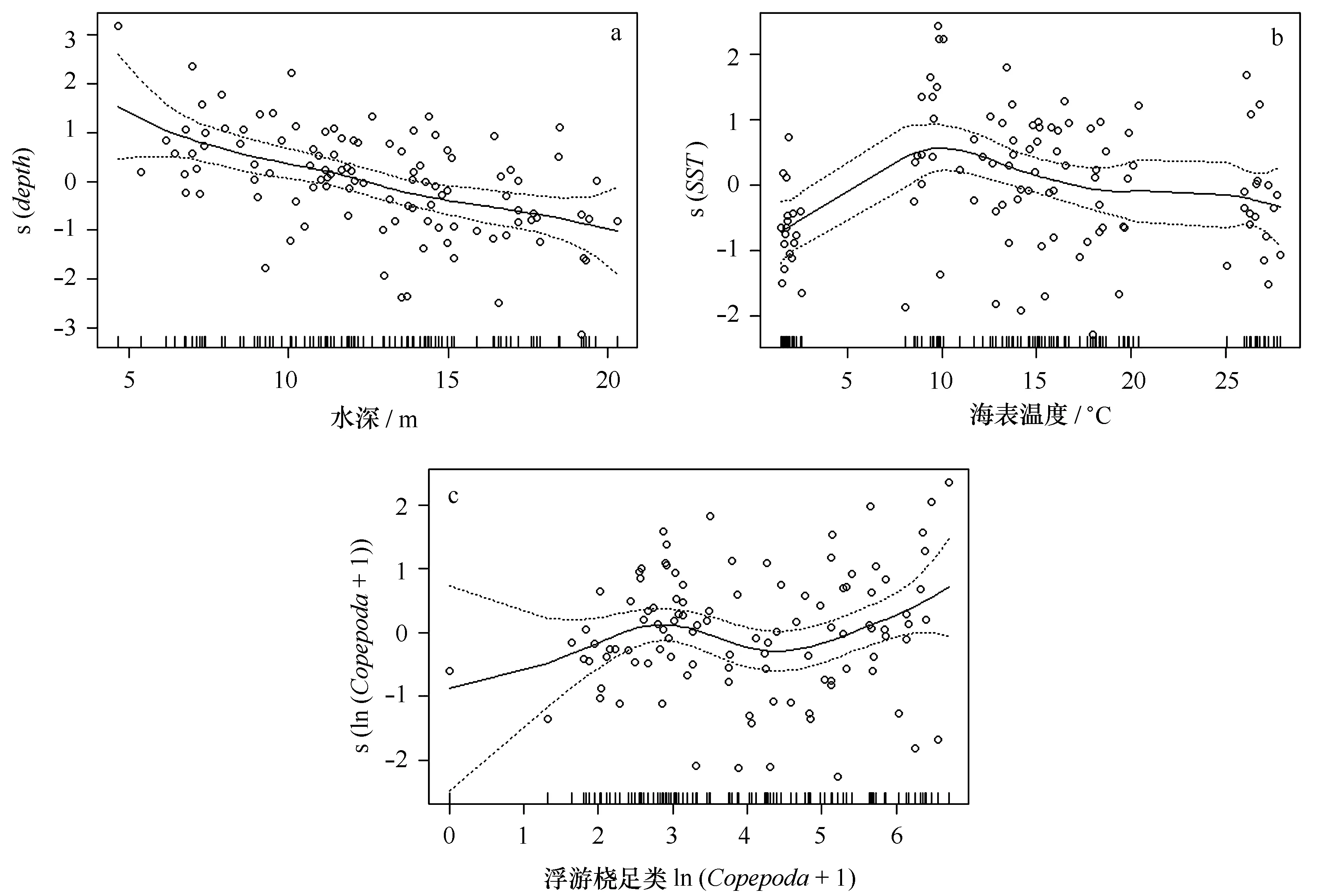
图4 黄河口及其邻近水域强壮箭虫密度与环境因子之间的关系Fig.4 The relationship between environmental factors and density of S. crassa in the Yellow River Estuary and its adjacent waters
强壮箭虫对盐度的生存幅为9.3~48.7,以摄食强度为标准的最适盐度范围为20~25[42—43],调查海域各季节平均盐度的变化范围为22.0~27.3,与强壮箭虫的适盐范围较为接近,这一定程度上解释了GAM模型中未保留表层盐度的原因。相比之下,水温作为海洋环境的关键指标,在本次调查中对强壮箭虫密度空间分布和季节变化的影响更为突出。GAM模型结果表明,强壮箭虫分布主要集中在水表温度10~20℃范围内,与其对最适水温10~15℃相吻合[42—43]。该海域春、秋季节的平均水温分别为(11.6±2.5)℃和(14.9±1.4)℃,与夏季(22.8±4.1)℃和冬季(1.9±0.3)℃相比,春、秋季的水温条件更适宜强壮箭虫的生存,因而其密度在春、秋季高于夏、冬季。强壮箭虫密度在黄河口及其邻近水域的季节变化规律与渤海、山东半岛黄海沿岸及海州湾有所不同[12,15 24,26],极有可能与黄河径流的季节性变化有关,在其影响下,黄河口水域温盐等环境因子随时空变化的响应与其他海域也有所不同,可见不同海区独特的水文环境使强壮箭虫的时空分布具有一定的区域性。
此外,有研究发现浮游桡足类作为强壮箭虫的主要饵料生物,对其密度的时空分布也有一定的影响[8—9,26],GAM模型显示随着桡足类密度的增加,强壮箭虫密度逐渐升高,进一步支持了这一观点。春季,在黄河入海口北部水域,强壮箭虫密度较高,桡足类密度也远高于其他站位;相反的,低值区的桡足类密度也相对较低。季节变化方面,春季4月份,浮游桡足类的密度远高于其他月份,为强壮箭虫提供了良好的饵料条件,加之温盐条件比较适宜,强壮箭虫的密度达到了峰值,但二者之间的数量变动关系还有待进一步的研究。
4.2 聚集强度分析
生物种群的聚集是种群本身生物学特性与其分布水域环境因素相互作用的结果,与其种群密度有很大关系[30]。从季节变化来看,春、秋季黄河口及其邻近水域温度适宜,强壮箭虫密度逐步增加,种群呈现聚集状态。聚集强度在春季达到最高值,其中4月强壮箭虫密度最高,丛生指标表明的聚集强度也达到最大,5月密度虽不及4月,但聚块性指标和负二项分布参数的倒数达到峰值,可见丛生指标更易受密度的影响,在判断时应综合考虑。调查海域夏季水温较高,变化范围为17.3~27.9℃,冬季水温较低,变化范围为1.5~2.6℃,与强壮箭虫的最适水温差别较大[42—43],其整体密度较低,淡水径流和海流的冲击作用更加明显,因此夏季、冬季强壮箭虫分布聚集强度较小或未能形成聚集种群,呈均匀分布。春季,强壮箭虫密度在各站位的分布波动较大,也从侧面反映了其聚集特征。此外,密集区的种群由于生存空间的局限会进行自我调节,个体之间相互排斥,促使种群开始向周围海域扩散,聚集强度也会降低[44]。
环境异质性和强壮箭虫对环境的敏感性,必然会使其分布在某些海域中受到限制,从而在温盐适宜、饵料充足的水域形成密集种群[30]。徐风风等[26]及盖建军和倪金俤[15]的研究结果表明,强壮箭虫在山东半岛黄海沿岸和海州湾均呈现出聚集分布的特征,与之不同,强壮箭虫在黄河口及其邻近水域的空间分布会随密度的波动出现两次聚集和两次扩散。浮游动物游泳能力弱,其生存和分布受水流和环境的影响较大,可见与其他海域相比,黄河口水文条件受径流、潮流和风浪的影响表现出更为强烈的季节变化。
[1] 金显仕, 邓景耀. 莱州湾渔业资源群落结构和生物多样性的变化[J]. 生物多样性, 2000, 8(1): 65-72.
Jin Xianshi, Deng Jingyao. Variations in community structure of fishery resources and biodiversity in the Laizhou Bay, Shandong[J]. Chinese Biodiversity, 2000, 8(1): 65-72.
[2] 邓景耀, 金显仕. 莱州湾及黄河口水域渔业生物多样性及其保护研究[J]. 动物学研究, 2000, 21(1): 76-82.
Deng Jingyao, Jin Xianshi. Study on fishery biodiversity and its conservation in Laizhou Bay and Yellow River estuary[J]. Zoological Research, 2000, 21(1): 76-82.
[3] 杜飞雁, 李纯厚, 贾晓平. 我国毛颚类的研究状况与展望[J]. 上海水产大学学报, 2003, 12(1): 65-71.
Du Feiyan, Li Chunhou, Jia Xiaoping. The situation and development trend of the study on Chaetognatha in China[J]. Journal of Shanghai Fisheries University, 2003, 12(1): 65-71.
[4] 黄凤鹏, 黄景洲, 杨玉玲, 等. 胶州湾浮游桡足类时空分布[J]. 生态学报, 2009, 29(8): 4045-4052.
Huang Fengpeng, Huang Jingzhou, Yang Yuling, et al. Spatial-temporal distribution of planktonic copepod in the Jiaozhou Bay[J]. Acta Ecologica Sinica, 2009, 29(8): 4045-4052.
[5] 唐启升, 叶懋中. 山东近海渔业资源开发与保护[M]. 北京: 农业出版社, 1990.
Tang Qisheng, Ye Maozhong. Exploitation and Conservation of Nearshore Fisheries Resources Off Shandong[M]. Beijing: Agriculture Press, 1990.
[6] 邓景耀, 孟田湘, 任胜民. 渤海鱼类的食物关系[J]. 海洋水产研究, 1988(9): 151-171.
Deng Jingyao, Meng Tianxiang, Ren Shengmin. Food web of fishes in Bohai Sea[J]. Marine Fisheries Research, 1988(9): 151-171.
[7] 杨纪明. 渤海鱼类的食性和营养级研究[J]. 现代渔业信息, 2001, 16(10): 10-19.
Yang Jiming. A study on food and trophic levels of Bohai Sea fish[J]. Modern Fisheries Information, 2001, 16(10): 10-19.
[8] Kehayias G, Lykakis J, Fragopoulu N. The diets of the chaetognathsSagittaenflata,S.serratodentataatlanticaandS.bipunctataat different seasons in Eastern Mediterranean coastal waters[J]. ICES Journal of Marine Science, 1996, 53(5): 837-846.
[9] 杨纪明, 李军. 渤海强壮箭虫摄食的初步研究[J]. 海洋科学, 1995, 9(6): 38-42.
Yang Jiming, Li Jun. Study on the feeding of the Bohai SeaSagittacrassa[J]. Marine Sciences, 1995, 9(6): 38-42.
[10] 冷宇, 张继民, 刘霜, 等. 黄河口及邻近海域海洋生物物种多样性[M]. 青岛: 中国海洋大学出版社, 2013.
Leng Yu, Zhang Jimin, Liu Shuang, et al. Biodiversity in the Yellow River Estuary and Its Adjacent Waters[M]. Qingdao: Ocean University of China Press, 2013.
[11] 王真良, 徐汉光, 朱建东, 等. 黄海的浮游动物[J]. 海洋通报, 1985, 4(5): 33-39.
Wang Zhenliang, Xu Hanguang, Zhu Jiandong, et al. The zooplankton of the Yellow Sea[J]. Marine Science Bulletin, 1985, 4(5): 33-39.
[12] 毕洪生, 孙松, 高尚武, 等. 渤海浮游动物群落生态特点Ⅲ.部分浮游动物数量分布和季节变动[J]. 生态学报, 2001, 21(4): 513-521.
Bi Hongsheng, Sun Song, Gao Shangwu, et al. The characteristics of zooplankton community in the Bohai Sea Ⅲ. The distribution of abundance and seasonal dynamics of major taxa except copepod[J]. Acta Ecologica Sinica, 2001, 21(4): 513-521.
[13] 霍元子, 孙松, 杨波. 南黄海强壮箭虫(Sagittacrassa)的生活史特征[J]. 海洋与湖沼, 2010, 41(2): 180-185.
Huo Yuanzi, Sun Song, Yang Bo. Life cycle of the chaetognathSagittacrassain the southern Yellow Sea, China[J]. Oceanologia et Limnologia Sinica, 2010, 41(2): 180-185.
[14] Mills C E. Medusae, siphonophores, and ctenophores as planktivorous predators in changing global ecosystems[J]. ICES Journal of Marine Science, 1995, 52(3/4): 575-581.
[15] 盖建军, 倪金俤. 海州湾强壮箭虫的生态学特征研究[J]. 生物学杂志, 2012, 29(6): 59-61.
Gai Jianjun, Ni Jindi. The study on the ecological characteristics ofSagittacrassain the Haizhou Bay[J]. Journal of Biology, 2013, 29(6): 59-61.
[16] Vieira L, Azeiteiro U, Ré P, et al. Zooplankton distribution in a temperate estuary (Mondego estuary southern arm: Western Portugal) [J]. Acta Oecologica, 2003, 24(S1): S163-S173.
[17] Intxausti L, Villate F, Uriarte I, et al. Size-related response of zooplankton to hydroclimatic variability and water-quality in an organically polluted estuary of the Basque coast (Bay of Biscay)[J]. Journal of Marine Systems, 2012, 94: 87-96.
[18] Falcão J, Marques S C, Pardal M A, et al. Mesozooplankton structural responses in a shallow temperate estuary following restoration measures[J]. Estuarine, Coastal and Shelf Science, 2012, 112: 23-30.
[19] Tomczak M T, Heymans J J, Yletyinen J, et al. Ecological network indicators of ecosystem status and change in the Baltic Sea[J]. PLoS One, 2013, 8(10): e75439.
[20] 郑执中, 肖贻昌. 毛颚动物作为中国海及邻近水域海流指标种的初步研究[C]//中国海洋湖沼学会1963年学术会论文摘要汇编. 北京: 科学出版社, 1964: 84-86.
Zheng Zhizhong, Xiao Yichang. A preliminary discussion of using Chaetognatha as an indicator of ocean currents in China Sea and adjacent area[C]//Chinese Society for Oceanology and Limnology. Beijing: Science Press, 1964: 84-86.
[21] 郑重, 李少菁, 许振祖. 海洋浮游生物学[M]. 北京: 海洋出版社, 1984.
Zheng Zhong, Li Shaojing, Xu Zhenzu. Marine Planktology[M]. Beijing: China Ocean Press, 1984.
[22] 马静. 夏、秋季黄河口及其邻近海域大中型浮游动物群落生态学研究[D]. 青岛: 中国海洋大学, 2011.
Ma Jing. Studies on the meso- and macro-zooplankton community ecology in the Yellow River estuary and its adjacent waters in summer and autumn[D]. Qingdao: Ocean University of China, 2011.
[23] 李自尚. 春季黄河口及其邻近水域浮游动物群落特征与粒径谱的初步研究[D]. 青岛: 中国海洋大学, 2012.
Li Zishang. Studies on the community characteristics and size spectra of zooplankton in the Yellow River estuary and its adjacent waters in spring[D]. Qingdao: Ocean University of China, 2012.
[24] 白雪娥, 庄志猛. 渤海浮游动物生物量及其主要种类数量变动的研究[J]. 海洋水产研究, 1991(12): 71-92.
Bai Xue′e, Zhuang Zhimeng. Studies on the fluctuation of zooplankton biomass and its main species number in the Bohai Sea[J]. Marine Fisheries Research, 1991(12): 71-92.
[25] 李云, 徐兆礼, 高倩. 长江口强壮箭虫和肥胖箭虫的丰度变化对环境变暖的响应[J]. 生态学报, 2009, 29(9): 4773-4780.
Li Yun, Xu Zhaoli, Gao Qian. Effects of global warming onSagittacrassaandSagittaenflata(Chaetognatha) in the Changjiang estuary during different years[J]. Acta Ecologica Sinica, 2009, 29(9): 4773-4780.
[26] 徐风风, 朱丽岩, 徐潇峰, 等. 山东半岛黄海沿岸强壮箭虫丰度的季节变化和分布特征[J]. 中国海洋大学学报(自然科学版), 2014, 44(5): 54-60.
Xu Fengfeng, Zhu Liyan, Xu Xiaofeng, et al. Seasonal variation and distribution characteristics ofSagittacrassain Yellow Sea coast of the Shandong Peninsula[J]. Periodical of Ocean University of China, 2014, 44(5): 54-60.
[27] 秦雪, 徐宾铎, 杨晓改, 等. 黄河口及其邻近水域夏季浮游植物群落结构及其与环境因子的关系[J]. 水产学报, 2016, 40(5): 711-720.
Qin Xue, Xu Binduo, Yang Xiaogai, et al. Phytoplankton community structure and its relationship with environmental variables in summer in the Yellow River estuary and its adjacent waters[J]. Journal of Fisheries of China, 2016, 40(5): 711-720.
[28] 翟璐, 徐宾铎, 纪毓鹏, 等. 黄河口及其邻近水域夏季鱼类群落空间格局及其与环境因子的关系[J]. 应用生态学报, 2015, 26(9): 2852-2858.
Zhai Lu, Xu Binduo, Ji Yupeng, et al. Spatial pattern of fish assemblage and the relationship with environmental factors in Yellow River estuary and its adjacent waters in summer[J]. Chinese Journal of Applied Ecology, 2015, 26(9): 2852-2858.
[29] 杜荣骞. 生物统计学[M]. 北京: 高等教育出版社, 2009.
Du Rongqian. Biostatistics[M]. Beijing: Higher Education Press, 2009.
[30] 徐兆礼, 陈亚瞿. 东黄海秋季浮游动物优势种聚集强度与鲐鲹渔场的关系[J]. 生态学杂志, 1989, 8(4): 13-15.
Xu Zhaoli, Chen Yaqu. Aggregated intensity of dominant species of zooplankton in autumn in the East China Sea and Yellow Sea[J]. Journal of Ecology, 1989, 8(4): 13-15.
[31] 徐兆礼, 王云龙. 长江河口锋区桡足类优势种聚集特征的研究[J]. 中国水产科学, 1999, 6(5): 15-19.
Xu Zhaoli, Wang Yunlong. The study on assemblage density of copepods dominants in plume front zone of the Changjiang estuary[J]. Journal of Fishery Sciences of China, 1999, 6(5): 15-19.
[32] 胡长效, 朱静, 丁梁斌, 等. EXCEL在昆虫种群空间分布型分析中的应用[J]. 江西植保, 2006, 29(3): 105-108.
Hu Changxiao, Zhu Jing, Ding Liangbin, et al. Statistical analysis of spatial distribution of insect’s population with EXCEL[J]. Jiangxi Plant Protection, 2006, 29(3): 105-108.
[33] Hastie T J, Tibshirani R J. Generalized Additive Models[M]. New York: Chapman and Hall, 1990.
[34] Venables W N, Dichmont C M. GLMs, GAMs and GLMMs: an overview of theory for applications in fisheries research[J]. Fisheries Research, 2004, 70(2/3): 319-337.
[35] R Core Team. R: a Language and Environment for Statistical computing[M]. Vienna, Austria: R Foundation for Statistical Computing, 2015.
[36] Yemane D, Field J G, Leslie R W. Spatio-temporal patterns in the diversity of demersal fish communities off the south coast of South Africa[J]. Marine Biology, 2010, 157(2): 269-281.
[37] 李泽刚. 黄河口附近海区水文要素基本特征[J]. 黄渤海海洋, 2000, 18(3): 20-28.
Li Zegang. Basic features of hydrologic elements in the sea area near the Yellow River estuary[J]. Journal of Oceanography of Huanghai & Bohai Seas, 2000, 18(3): 20-28.
[38] 田家怡, 李洪彦. 黄河口附近海域浮游动物的分布特征及其与环境因子的关系[J]. 海洋环境科学, 1985, 4(3): 32-41.
Tian Jiayi, Li Hongyan. Distribution characteristics of zooplankton and the relationship with environmental factors in Yellow River estuary[J]. Marine Environmental Science, 1985, 4(3): 32-41.
[39] Marques S C, Azeiteiro U M, Martinho F, et al. Evaluation of estuarine mesozooplankton dynamics at a fine temporal scale: the role of seasonal, lunar and diel cycles[J]. Journal of Plankton Research, 2009, 31(10): 1249-1263.
[40] Wang Yuchuan, Liu Zhe, Gao Huiwang, et al. Response of salinity distribution around the Yellow River mouth to abrupt changes in river discharge[J]. Continental Shelf Research, 2011, 31(6): 685-694.
[41] 朱兰部, 赵保仁, 刘克修. 黄河冲淡水转向问题的初步探讨[J]. 海洋科学集刊, 1997(1): 61-67.
Zhu Lanbu, Zhao Baoren, Liu Kexiu. A preliminary study on the turning phenomena of the Yellow River diluted water[J]. Studia Marina Sinica, 1997(1): 61-67.
[42] 刘青, 曲晗, 张硕, 等. 强壮箭虫摄食生态的实验研究[J]. 水产学报, 2006, 30(6): 767-772.
Liu Qing, Qu Han, Zhang Shuo, et al. Experimental study on the feeding ecology ofSagittacrassa[J]. Journal of Fisheries of China, 2006, 30(6): 767-772.
[43] 刘青, 曲晗, 张硕. 强壮箭虫对温度、盐度的耐受性研究[J]. 海洋湖沼通报, 2007(1): 111-116.
Liu Qing, Qu Han, Zhang Shuo. Preliminary studies on the tolerance to temperature and salinity inSagittacrassa[J]. Transactions of Oceanology and Limnology, 2007(1): 111-116.
[44] 袁骐, 王云龙. 东海北部肥胖箭虫和百陶箭虫空间分布参数的特征[J]. 海洋渔业, 2007, 29(3): 240-244.
Yuan Qi, Wang Yunlong. On the parametric features of the spatial distribution ofSagittaenflataandSagittabedotiin the northern part of the East China Sea[J]. Marine Fisheries, 2007, 29(3): 240-244.
Spatio-temporal distribution of density ofSagittacrassaand its relationship with environmental factors in the Yellow River Estuary and its adjacent waters
Liu Xiaohui1, Xue Ying1, Zhang Chongliang1, Ren Yiping1, Xu Binduo1
(1.CollegeofFisheries,OceanUniversityofChina,Qingdao266003,China)
The aim of this study was to investigate the spatio-temporal distribution ofSagittacrassadensity and its relationship with environmental factors in the Yellow River estuary and its adjacent waters. The spatial distribution pattern ofS.crassawas analyzed by several indices of aggregated intensity based on the data collected in six cruises in 2013 and 2014, and the spatio-temporal distributions ofS.crassadensity in relation to environmental factors was revealed by generalized additive model (GAM). The results showed that the spatial distribution ofS.crassawas in twice aggregation and twice spread, the density ofS.crassawas relatively high in the estuary area and low in the offshore waters. The average monthly density ofS.crassawas 21.85 ind/m3, and the density in spring and autumn was larger than those in winter and summer. GAM analysis indicated that depth, SST and density of Copepoda were the main affecting factors, which accounted for 55.11% of the residual deviance. The density ofS.crassadecreased with the increase of depth, and rose with the increase of Copepoda density, and increased at first then decreased later with the SST increasing in the Yellow River Estuary. The overall results revealed an obvious seasonal variation and regular spatial pattern ofS.crassadistribution in the Yellow River Estuary and its adjacent waters, which would contribute a better understanding of the effects of environment on zooplankton, providing useful information for further studies on Chaetognatha.
Yellow River Estuary;Sagittacrassa; index of aggregated intensity; generalized additive model (GAM)
10.3969/j.issn.0253-4193.2017.06.008
2016-10-10;
2017-01-05。
公益性行业(农业)科研专项经费资助(201303050)。
刘晓慧(1992—),女,山东省济南市人,主要从事浮游动物生态学研究。E-mail:xiaohuilala@126.com
*通信作者:徐宾铎,副教授,主要从事渔业资源、渔业生物多样性和生态学研究。E-mail:bdxu@ouc.edu.cn
Q178.53
A
0253-4193(2017)06-0074-10
刘晓慧,薛莹,张崇良,等. 黄河口及其邻近水域强壮箭虫密度的时空分布及其与环境因子的关系[J].海洋学报,2017,39(6):74—83,
Liu Xiaohui, Xue Ying, Zhang Chongliang,et al. Spatio-temporal distribution of density ofSagittacrassaand its relationship with environmental factors in the Yellow River Estuary and its adjacent waters[J]. Haiyang Xuebao,2017,39(6):74—83, doi:10.3969/j.issn.0253-4193.2017.06.008

