Fenton氧化—微生物法降解土壤中石油烃
韩 旭,李广云,尹宁宁,许锐伟,王丽萍
(中国矿业大学 环境与测绘学院,江苏 徐州 221116)
土壤修复
Fenton氧化—微生物法降解土壤中石油烃
韩 旭,李广云,尹宁宁,许锐伟,王丽萍
(中国矿业大学 环境与测绘学院,江苏 徐州 221116)
以长期被苯系物污染的活性污泥为菌源,采用液相“诱导物-中间产物-目标污染物”驯化模式驯化出专性混合石油降解菌群,并将其用于Fenton氧化—微生物法处理模拟石油污染土壤。高通量测序结果表明,产黄杆菌属(Rhodanobacter)、分支杆菌属(Mycobacterium)和根瘤菌属(Rhizobiales)为主导菌属。实验结果表明:接种混合菌群后降解50 d,土样的总石油烃(TPH)去除率较土著菌提高了13.4~20.5百分点;对于TPH含量(w)分别为4%,8%,11%的土样,Fenton氧化的最佳H2O2加入量分别为3,4,4 mol/L(Fe2+加入量0.04 mol/L),TPH总去除率分别可达88.8%,65.0%,47.7%,较单独Fenton氧化或单独微生物法均有很大程度的提高,且缩短了降解时间,增加了土壤有机质。
专性混合石油降解菌;Fenton氧化;微生物法;石油烃
石油是一种重要的化石能源,伴随着石油的开采、运输、分离提纯等作业过程,引发了不同程度的环境污染。其中,滞留、富集于土壤或地层中的石油烃污染物具有高毒性、脂溶性、难降解、易生物富集等特点,会破坏生物的正常生活环境,造成生物机能障碍[1]。
Fenton氧化法被广泛应用于土壤中石油烃的去除。刘其友等[2]对比了Fenton氧化前后土壤中石油烃的红外光谱,发现经Fenton氧化处理后试样中的羰基和芳香环均减少,表明Fenton氧化对土壤中大分子石油烃组分的降解相对明显;但对于不易化学降解的石油烃组分,单独Fenton氧化法难以处理,从而导致矿化不完全,且对土壤有机质(SOM)易造成损伤。另一方面,微生物法作为一种环境友好的处理方法也大量应用于土壤中石油烃的降解[3],但微生物法也存在明显的缺点,如对于复杂石油烃以及高浓度、高毒性污染物的降解效果不明显,且降解周期长,易受温度、pH、营养元素等因素的影响[4-5]。
本工作以长期被苯系物污染的活性污泥为菌源,采用液相“诱导物-中间产物-目标污染物”驯化模式驯化出专性混合石油降解菌群,并将其用于Fenton氧化-微生物法处理模拟石油污染土壤中,考察了土壤中总石油烃(TPH)和SOM的变化,以期为土壤中石油污染物的去除提供数据支持和理论依据。
1 实验部分
1.1 试剂、材料和仪器
30%(w)H2O2溶液:购于天津市大茂化学试剂厂;FeSO4·7H2O、无水硫酸钠:购于上海国药集团化学试剂有限公司;石油醚(沸程30~60 ℃)、重铬酸钾:购于上海苏懿化学试剂有限公司。以上试剂均为分析纯。
石油:取自江苏省徐州市中国石化集团管道储运公司。
活性污泥:取自徐州华裕煤气有限公司焦化废水处理厂污泥浓缩池,长期被苯系物污染,MLVSS为6 102 mg/L,有效活菌数为4.24×108CFU/mL。
原始土样:采自中国矿业大学校园内的表层(0~10 cm)土壤,去除大颗粒物后置于阴凉处风干72 h,反复研磨后过2 mm筛,保存待用。原始土样的理化性质见表1。

表1 原始土样的理化性质
DHG-9240B型电热鼓风干燥箱:杭州汇锐仪器设备有限公司;CRY-100B型恒温培养摇床:上海茸研仪器有限公司;TG16C/TG16型台式离心机:长沙英泰仪器有限公司;pHS-3CA型精密pH计:上海世羲精密仪器有限公司;HH-3A型恒温水浴锅:常州市万合仪器制造有限公司。
1.2 模拟石油污染土样的制备
采用均匀混合法制备不同污染强度的土样:分别称取19.2,18.4,17.8 g原始土样于3个250 mL锥形瓶中,向其中分别加入0.8,1.6,2.2 g石油,再分别倒入约50 mL石油醚溶解石油使其均匀分布于土壤中;轻轻振荡,混合均匀后将锥形瓶置于通风橱,待石油醚完全挥发后待用。将TPH含量(w)分别为4%,8%,11%的模拟石油污染土样分别编号为S1,S2,S3。
1.3 石油降解菌的驯化
采用液相“诱导物-中间产物-目标污染物”递进式驯化方式。活性污泥用高温灭菌后的生理盐水稀释制得菌悬液,置于塑料桶中曝气48 h,以消耗其中的碳源。然后进入液相驯化阶段,每天添加无机营养液和底物(添加量50~2 000 mg/L,逐日递增)。第1周期为期5 d,为诱导阶段,每天添加乳化甲苯溶液;第2周期为期5 d,每天添加邻苯二酚溶液;第3周期为期10 d,为“中间产物-目标污染物”双底物驯化阶段,每天添加邻苯二酚和石油烃;第4周期为期10 d,每天添加石油烃。取第4周期后得到的菌悬液备用,其中的菌群即为本实验的石油降解菌。
1.4 石油烃的降解实验
1.4.1 微生物法
将20 g污染土样置于250 mL锥形瓶中,加入一定量的菌悬液;固定C,N,P的质量比为100∶15∶1,在恒温(25 ℃)摇床中降解一段时间后取样测定。同时,以未添加菌悬液的土样进行对照实验。
1.4.2 Fenton氧化法
将20 g污染土样置于250 mL锥形瓶中,根据Fenton试剂的配比加入一定量的FeSO4溶液,使Fe2+加入量为0.04 mol/L,搅拌摇匀,调节pH至3.5左右,在搅拌下缓慢加入一定量的H2O2溶液,固定水土比为5∶2 mL/g,氧化反应120 min后取样待测。
1.4.3 Fenton氧化—微生物法
将经Fenton氧化法处理后的土样,按1.4.1小节的方法进行微生物处理。
1.5 分析方法
驯化后的微生物群落的总DNA根据细菌基因组DNA提取试剂盒(离心柱型)的规范步骤进行提取,提取后委托上海派森诺生物科技股份公司采用Illumina MiSeq平台的宏基因组进行高通量测序分析。
采用重量法[6]测定土样的TPH含量;采用重铬酸钾法[7]测定土样的SOM含量。
2 结果与讨论
2.1 石油降解菌的鉴定结果
石油降解菌在纲、属水平上的分布见表2,Genbank登录号SRP083938。由表2可见,从纲水平上讲,α-变形菌纲、γ-变形菌纲和放线菌纲为优势菌纲,分别占总菌群的41%、35%和12%。研究表明,α-变形菌纲细菌在氧气充足的条件下可以成为降解多环芳烃的优势菌之一[8]。韩平等[9]从胜利油田滩涂区土壤中筛选出γ-变形菌纲,该菌对石油烃的降解率大于90%,能降解石油中大部分的石油烷烃。

表2 石油降解菌在纲、属水平上的分布
由表2还可见,从属水平上分析,占比34.48%的产黄杆菌属菌株最多,其次为占比11.77%的分支杆菌属菌株和占比11.44%的根瘤菌属菌株。Kanaly等[10]从土壤中分离出的产黄杆菌属菌株,可有效降解多环芳烃中的苯并芘,矿化度达60%以上。分支杆菌属菌株可高效降解环境中的多环芳烃,特别是四环和五环以上的芳烃[11]。张帆等[12]从华北某油田污染土壤中筛选出5株具有较强降解能力的石油降解菌,根瘤菌属菌株作为其中之一经过10 d培养后对的石油烃的降解率可达34.2%。
以上结果表明,驯化后所得菌群中的优势菌株可降解石油烃中某些难降解组分,具有一定的专性石油降解能力,为专性混合石油降解菌群。
2.2 石油降解菌的降解性能
当菌悬液加入量为0.10 mL/g时,石油降解菌加入前后TPH的去除率对比见图1。

图1 石油降解菌加入前后TPH的去除率对比
对于3种污染程度的土样,10~30 d时TPH均降解迅速,30 d后TPH去除率升势趋缓。这可能有两个原因:1)随着土壤中营养盐和碳源的消耗,菌类的生命活性受到营养物质匮乏的影响,活性下降[13];2)降解生成的中间产物很难被菌株再次降解,这与污染物质的结构有关[14],且剩余未降解石油成分也难以被土著菌降解。50 d时:加入石油降解菌前后的TPH去除率均达测定范围最大值;引入石油降解菌后土壤修复效果较单纯土著菌修复效果明显改善,TPH去除率提升了13.4~20.5百分点,且对较轻污染程度的土壤修复效果更好。可能的原因是:1)污染程度较重土壤毒性较高,对于菌类有毒害作用[15],导致耐受性差的菌群生命活性下降;2)由于污染土壤中石油黏稠性质的影响,土壤的通透性下降,导致菌类呼吸作用受阻[16],从而影响其生命活性。
2.3 Fenton氧化条件的优化
H2O2与Fe2+加入量对芬顿试剂的氧化能力影响很大[17],投加过多会消耗羟基自由基(·OH),从而影响·OH氧化石油污染物的效果,故需对实验条件进行优化。
H2O2加入量对TPH去除率和SOM含量的影响见图2。由图2可见:对于S1,随着H2O2加入量的不断增加,TPH去除率也逐渐提高;当H2O2加入量为3 mol/L时,S1的TPH去除率达60.0%;但继续增加H2O2加入量TPH去除率的提升不明显。原因可能是当H2O2加入量过多时,单位时间内产生的·OH处于过量状态,·OH间会发生内部反应[18],降低了其与目标污染物的接触概率,且吸附在深层土壤中的石油烃难以解析,作为难溶有机物降低了传质效果,使得总体氧化能力不再继续增强。S2和S3与S1的情况类似,但其H2O2加入量的拐点为4 mol/L。
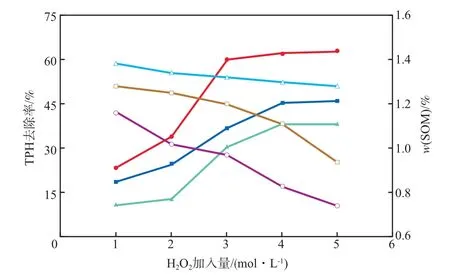
图2 H2O2加入量对TPH去除率和SOM含量的影响
SOM在菌群生存环境和有机污染物的吸附过程中都起着重要的作用[19],鉴于Fenton试剂的强氧化性,·OH能无选择地与有机物反应,同时也能把SOM部分氧化[20]。由图2可见,土样S1,S2,S3经Fenton氧化处理后,SOM含量均有不同程度的降低,且H2O2加入量越多SOM含量越低,说明高浓度的H2O2对SOM有损坏。因此,为保证土壤的综合修复效果,H2O2加入量不宜过多。
综上所述,对于土样S1,S2,S3,最佳H2O2加入量分别为3,4,4 mol/L。
2.4 Fenton氧化—微生物法的处理效果
在上述优化条件下进行Fenton氧化处理后的土样再经微生物降解20 d后,其处理效果见图4。由图4可见,随着菌悬液加入量的增加,不同污染程度土样的TPH去除率均呈现先升后降的趋势。分析其原因可能是接种的微生物过多时,使菌体过度繁殖,菌体对土壤中营养物质的相互竞争导致营养短缺[21],致使其新陈代谢和生长速率减缓,影响了菌群对石油烃的吸收降解。通过对SOM含量的测定,发现菌悬液的加入在一定程度增加了土壤中的有机质。

图4 Fenton氧化—微生物法的处理效果
由图4还可见:对于低污染程度的土样S1,该方法的TPH去除率最高达88.8%(菌悬液加入量0.10 mL/g),S2和S3的最高TPH去除率分别为65.0%和47.7%(菌悬液加入量0.20 mL/g);对于3种污染程度的土样,其最高TPH去除率较单独Fenton氧化法提高9.6~28.8百分点。与刘其友等[2]单独使用Fenton氧化法处理8%(w)稠油污染土壤中石油烃的效果相比,本实验的联合处理效果有明显改善。另一方面,由于S3污染程度较大,TPH去除率最高仅为47.7%,土壤中的石油烃约一半还未降解,可见对于高浓度石油烃污染,该方法未能达到很好的降解效果。Fenton氧化—微生物法20 d时对S1的TPH去除率达到88.8%,而单独微生物法50 d时对S1的TPH去除率仅为44.0%,说明Fenton氧化—微生物法不仅提升了降解效果,而且缩短了降解时间,体现了其高效性;同时,Fenton氧化—微生物法还增加了SOM,是一种环境友好的方法。
3 结论
a)以长期被苯系物污染的活性污泥为菌源,采用液相“诱导物-中间产物-目标污染物”驯化模式驯化出专性混合石油降解菌群,高通量测序结果表明:产黄杆菌属(Rhodanobacter sp.)、分支杆菌属(Mycobacterium sp.)和根瘤菌属(Rhizobiales sp.)为主导菌属。
b)向3种不同污染程度土壤中加入0.10 mL/g菌悬液后降解50 d,TPH去除率较土著菌提高了13.4~20.5百分点。
c)对于土样S1,S2,S3,Fenton氧化的最佳H2O2加入量分别为3,4,4 mol/L。
d)Fenton氧化—微生物法对土样S1,S2,S3的TPH去除率分别可达88.8%,65.0%,47.7%,较单独Fenton氧化或单独微生物法均有很大程度的提升,且缩短了降解时间,增加了SOM。
[1] 刘晓艳,史鹏飞,孙德智,等. 大庆土壤中石油类污染物迁移模拟[J]. 中国石油大学学报:自然科学版,2006,30(2):120 - 124.
[2] 刘其友,李琳,张云波,等. Fenton氧化技术处理稠油污染土壤[J]. 环境工程学报,2013,7(4):1563 -1567.
[3] Shen Weihang,Zhu Nengwu,Cui Jiaying,et al. Ecotoxicity monitoring and bioindicator screening of oilcontaminated soil during bioremediation[J]. Ecotoxicol Environ Saf,2016,124:120 - 128.
[4] Nikolopoulou M,Kalogerakis N. Enhanced bioremediation of crude oil utilizing lipophilic fertilizers combined with biosurfactants and molasses[J]. Mar Pollut Bull,2008,56(11):1855 - 1861.
[5] Suominen L,Jussila M M,Mäkeläinen K,et al. Evaluation of the Galega-Rhizobium galegae system for the bioremediation of oil-contaminated soil[J]. Environ Pollut,2000,107(2):239 - 244.
[6] 王如刚,王敏,牛晓伟,等. 超声-索氏萃取-重量法测定土壤中总石油烃含量[J]. 分析化学,2010,38(3):417 - 420.
[7] 鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科技出版社,2000:108 - 109.
[8] Zhang S Y,Wang Q F,Xie S G. Bacterial and archaeal community structures in phenanthrene amended aquifer sediment microcosms under oxic and anoxic conditions[J]. Int J Environ Res,2012,6(4):1077 - 1088.
[9] 韩平,郑立,崔志松,等. 胜利油田滩涂区石油降解菌的筛选、鉴定及其多样性分析[J]. 应用生态学报,2009,20(5):1202 - 1208.
[10] Kanaly R A,Harayama Shigeaki,Watanabe Kazuya. Rhodanobacter sp. strain BPC1 in a benzo[a]pyrenemineralizing bacterial consortium[J]. Appl Environ Microbiol,2002,68(12):5826 - 5833.
[11] Miller C D,Hall K,Liang Y N,et al. Isolation and characterization of polycyclic aromatic hydrocarbondegrading Mycobacterium isolates from soil[J]. Microb Ecol,2004,48(2):230 - 238.
[12] 张帆,郝春博,王丽华,等. 华北某油田石油降解菌的筛选及降解特性[J]. 环境工程学报,2014,8(10):4533 - 4539.
[13] Riffaldi R,Levi-Minzi R,Cardelli R,et al. Soil biological activities in monitoring the bioremediation of diesel oil-contaminated soil[J]. Water,Air,Soil Pollut,2006,170(1):3 - 15.
[14] Vasilieva V,Janik L,Scherr K E,et al. Data evaluation of tar oil degradation using comprehensive GC2/ MS:Individual compounds and principal component analysis[J]. J Chem Technol Biotechnol,2012,87(9):1237 - 1245.
[15] Dorn P B,Salanitro J P. Temporal ecological assessment of oil contaminated soils before and after bioremediation[J]. Chemosphere,2000,40(4):419 - 426.
[16] 孟娟,郑西来,王玉华,等. 石油污染海岸线生物修复技术研究进展[J]. 化工环保,2016,36(2):143 - 150.
[17] 程丽华,黄君礼,倪福祥. Fenton试剂生成·OH的动力学研究[J]. 环境污染治理技术与设备,2003,4(5):12 - 14,33.
[18] Kröger M,Fels G. Combined biological-chemical procedure for the mineralization of TNT[J]. Biodegradation,2007,18(4):413 - 425.
[19] 陈涛,孙成勋,杨晓瑛,等. 土壤主要组分对多氯联苯吸附及共存Cu2+的影响[J]. 中国矿业大学学报,2012,41(5):821 - 826.
[20] Bissey L L,Smith J L,Watts R J. Soil organic matter-hydrogen peroxide dynamics in the treatment of contaminated soils and groundwater using catalyzed H2O2propagations(modified Fenton’s reagent)[J]. Water Res,2006,40(13):2477 - 2484.
[21] 何丽媛,党志,唐霞,等. 混合菌对原油的降解及其降解性能的研究[J]. 环境科学学报,2010,30(6):1220 - 1227.
(编辑 魏京华)
Degradation of petroleum hydrocarbons in soil by Fenton oxidation-microbial method
Han Xu,Li Guangyun,Yin Ningning,Xu Ruiwei,Wang Liping
(School of Environment Science and Spatial Informatics,China University of Ming and Technology,Xuzhou Jiangsu 221116,China)
Using the activated sludge which was long-term polluted by benzene as bacteria source,the specifi c mixed petroleum-degrading bacteria were acclimated in liquid phase by the model of “inducer-intermediate product-target pollutant”,and used for treatment of simulated petroleum contaminated soil by Fenton oxidation-microbial method. The high-throughput sequencing results showed that Rhodanobacter sp.,Mycobacterium sp. and Rhizobiales sp. were the dominant bacteria. The experimental results indicated that:After 50 d of degradation,the removal rate of total petroleum hydrocarbon(TPH)in the soil samples by mixed bacteria was 13.4-20.5 percentage points higher than that by native bacteria;When the TPH content(w)were 4%,8%,11%,the optimum H2O2concentration for Fenton oxidation were 3,4,4 mol/L respectively(with 0.04 mol/L of Fe2+concentration),the total removal rate of TPH were 88.8%,65.0%,47.7% respectively,which were much higher than those by single Fenton oxidation or single microbial method. The degradation time was shortened and organic matters in soil were increased by the combined process.
specific mixed petroleum-degrading bacteria;Fenton oxidation;microbial method;petroleum hydrocarbon
X53
A
1006-1878(2017)02-0237-06
10.3969/j.issn.1006-1878.2017.02.020
2016 - 06 - 16;
2016 - 11 - 24。
韩旭(1992—),男,山东省枣庄市人,硕士生,电话 18613655180,电邮 hanxu920608@cumt.edu.cn。联系人:王丽萍,电话 13952118180,电邮 wlpcumt@126.com。
国家自然科学基金项目(41472223)。

