高渗胁迫对玉米大斑病菌生长发育的影响及菌丝细胞中渗透调节物质的分析
巩校东,刘星晨,赵立卿,郑亚男,范永山,韩建民,谷守芹,董金皋
(1河北农业大学真菌毒素与植物分子病理学实验室,河北保定 071001;2唐山师范学院生命科学系,河北唐山063000)
高渗胁迫对玉米大斑病菌生长发育的影响及菌丝细胞中渗透调节物质的分析
巩校东1,刘星晨1,赵立卿1,郑亚男1,范永山2,韩建民1,谷守芹1,董金皋1
(1河北农业大学真菌毒素与植物分子病理学实验室,河北保定 071001;2唐山师范学院生命科学系,河北唐山063000)
【目的】了解不同高渗胁迫条件对玉米大斑病菌(Setosphaeria turcica)菌丝发育及胞内黑色素含量的影响,明确在病菌菌丝细胞中起主要作用的渗透调节物质的种类及这些物质在不同高渗胁迫条件下的变化规律。【方法】采用 3种不同浓度梯度(0.4、0.8、1.2 mol·L-1NaCl)的高渗胁迫条件处理玉米大斑病菌,分析高渗胁迫对菌落生长、菌丝发育及菌丝胞内黑色素含量的影响;利用高效液相色谱(high performance liquid chromatography,HPLC)技术测定3种高渗浓度处理下菌丝细胞中甘油、赤藓醇、葡萄糖、甘露醇、海藻糖5种多羟基醇的含量并分析其随时间变化的规律。【结果】与在普通PDA培养基上的病菌相比,在高渗胁迫条件下病菌菌落生长速率明显降低,菌丝细胞间隔变短、细胞显著膨大,且随胁迫浓度增加细胞膨大程度增强;高渗胁迫下的菌株在各个时间点的胞内黑色素含量与对照相比有明显差异,其中高渗处理12 h之前样品中黑色素的含量均比对照组低,但不同处理之间含量均很接近;而在24、48 h两个时间点不同处理浓度对黑色素的影响不同,1.2 mol·L-1NaCl处理下与对照相比黑色素含量均显著增加,0.8 mol·L-1NaCl处理下与对照相比黑色素含量降低,0.4 mol·L-1NaCl处理下样品的黑色素含量与对照相比在24 h时显著降低,但48 h时与对照基本一致;在不同的高渗胁迫条件下(0.4、0.8、1.2 mol·L-1NaCl)菌丝细胞中甘露醇的含量均有随处理时间延长而增加的趋势,在处理时间为36 h时甘露醇含量较对照增加最为明显,具有显著性差异;菌丝中甘油含量的变化与甘露醇的变化规律相似,且在高渗胁迫处理下甘油含量增加幅度更加明显,并在处理24 h后甘油含量较对照显著增加;菌丝中海藻糖含量总体上有随时间延长而降低的趋势,且渗透胁迫的强度越高该趋势越明显,不同浓度NaCl处理的菌丝中海藻糖含量均在36 h与对照相比显著降低;而赤藓醇、葡萄糖的含量与对照相比没有显著变化;在普通PD培养基或高渗处理条件下,菌丝培养滤液中均没有检测到甘露醇、海藻糖和甘油的存在,而培养基中葡萄糖的含量随高渗胁迫浓度的增加而减少。【结论】高渗胁迫抑制了玉米大斑病菌菌落的生长,使菌丝细胞膨大、间隔变短;高渗胁迫处理病菌12 h之前对菌丝胞内黑色素含量均有明显的抑制作用;甘露醇、甘油为病菌菌丝细胞中的主要渗透调节物质,海藻糖也参与了病菌的高渗胁迫反应。
玉米大斑病菌;高渗胁迫;生长发育;渗透调节物质
0 引言
【研究意义】由玉米大斑病菌(Setosphaeria turcica)所引起的玉米大斑病是世界各地玉米叶部重要病害之一,在中国以东北、华北北部、西北和南方山区的冷凉玉米产区发生较重,流行年份常常造成大面积减产[1-3]。高渗胁迫是植物病原真菌在生长发育及侵染过程中经常遇到的胁迫条件之一,病菌在长期的进化过程中已形成一系列的代谢机制来适应这种复杂的环境,其中产生和积累相应的渗透调节物质是应对高渗胁迫条件最显著的方式。因此,研究植物病原真菌的高渗胁迫反应机制对于病害的有效防控具有重要意义。【前人研究进展】目前的研究表明,在酿酒酵母(Saccharomyces cerevisiae)中的主要渗透调节物质是甘油[4];构巢曲霉(Aspergillus nidulans)中为甘油和赤藓醇[5-6];稻瘟病菌(Magnaporthe grisea)在低浓度盐胁迫下主要渗透调节物质是海藻糖和甘露醇[7-8];大豆褐红坏死病病菌(Mycoleptodiscus terrestris)菌核中产生的主要渗透调节物质是甘露醇和海藻糖[9]。另外的研究表明,在酿酒酵母中主要通过两条途径产生渗透调节物质:其一,通过调节与渗透调节物质生成相关基因的表达来控制渗透调节物质在细胞中的含量[10],如酿酒酵母通过调控GPD1和GPP2的表达来调控甘油的生成,进而调控酵母细胞中甘油的含量[11-12];其二,通过控制渗透调节物质进出细胞来控制细胞中渗透调节物质含量[9],如酿酒酵母中通过水甘油通道蛋白的开闭来调控甘油进出细胞,进而调控细胞中甘油的含量[13]。【本研究切入点】前期研究发现,高渗胁迫可抑制玉米大斑病菌菌落生长,甘油是病菌细胞中的一种渗透调节物质,但对于玉米大斑病菌中是否存在其他种类的渗透调节物质尚没有深入研究。【拟解决的关键问题】系统分析高渗胁迫对玉米大斑病菌菌落及菌丝发育的影响,并利用高效液相色谱技术(high performance liquid chromatography,HPLC)分析病菌中渗透调节物质的种类,为深入解析该病菌应对高渗胁迫反应的调控机制打下基础。
1 材料与方法
试验于 2015年在河北农业大学真菌毒素与植物分子病理学实验室完成。
1.1 材料
1.1.1 供试菌株 玉米大斑病菌野生型菌株01-23由河北农业大学真菌毒素与植物分子病理学实验室保存。
1.1.2 供试培养基及主要试剂 高渗固体培养基:在PDA培养基中加入 NaCl使培养基的终浓度分别为0.4、0.8、1.2 mol·L-1;高渗液体培养基:在改良Fries培养基中加入NaCl使培养基的终浓度分别为0.4、0.8、1.2 mol·L-1。
1.1.3 供试仪器 HPLC仪器型号:日立L-7110,检测器:Alltech ELSD 2000ES,柱子:依利特Hypersil NH2,5 μm,4.6 mm×250 mm。
1.2 试验方法
1.2.1 菌落、菌丝形态观察及生长速率测定 以PDA培养基为基本培养基,加入NaCl使其终浓度分别为0.4、0.8和1.2 mol·L-1。将野生型01-23菌株接种到PDA培养基上,25℃黑暗静置培养8 d。在菌落的外缘打取菌盘(Φ=9 mm),接种于含有不同浓度NaCl的PDA培养基中,2—3 d后开始按照十字交叉法逐日测定菌落直径,每种菌株至少测量3皿,整体试验至少重复3次。
1.2.2 菌株培养及液体高渗胁迫处理 将菌株01-23菌株接种到PDA培养基上,25℃黑暗静置培养7 d,在菌落的外缘打取菌盘(Φ=9 mm),接种于PD培养基中,培养7 d后,加入含有0.4、0.8、1.2 mol·L-1NaCl 的PD培养基中25℃黑暗静置培养,分别于12、24、36 h取少量菌丝,在显微镜下观察菌丝形态和颜色的变化,以接种于普通PD培养基中的菌丝做对照。
1.2.3 菌丝中黑色素含量的测定 参照 BASHYAL 等[14]的方法进行并略作修改。按照1.2.2的方法获得0、0.4、0.8、1.2 mol·L-1NaCl处理下的菌丝后,将菌丝用双层纱布过滤用滤纸吸干表面的溶液,之后置于冷冻干燥机中进行冷冻干燥24 h后得到干菌丝;称取0.1 g干菌丝,沸水浴5 min,5 000 r/min离心5 min,水洗后再次离心,加入10 mL NaOH(1 mol·L-1),高压蒸汽灭菌锅中121℃ 20 min,酸沉淀(pH 2),沉淀物用蒸馏水洗涤3次,20℃干燥过夜,干燥物用5 mL NaOH溶解2 h,12 000 r/min离心10 min,将上清液转至新的离心管中,400 nm测定OD400并计算黑色素含量。
1.2.4 病菌中渗透调节物质的分析 菌丝的高渗胁迫处理:按照1.2.2的方法将菌盘置于含有0.4、 0.8、1.2 mol·L-1NaCl的PD培养基中25℃黑暗静置分别培养12、24、36 h后,将菌丝及培养基置于3 000 r/min下离心5 min,最后将菌丝进行冷冻干燥24 h得到干菌丝备用,并收集培养滤液置于4℃备用。
菌丝中多羟基化合物的抽提及分析:称取 0.1 g干菌丝,加入 4 mL抽提液(甲醇﹕二氯甲烷﹕ddH2O=12﹕5﹕3)后研磨,在研磨过程中逐渐加入6 mL抽提液,并最终定容至40 mL;将所得菌丝悬液置于40℃水浴30 min,其间每10 min涡旋一次,最终3 000 r/min 4℃离心3 min,将上清转入新管中并置于冰上;在上述沉淀中再加入5 mL 抽提液重新抽提一次,涡旋后3 000 r/min 4℃离心3 min,将所得上清与前面得到的上清混合;在上清中加入7.5 mL无菌ddH2O 和7.5 mL二氯甲烷,涡旋1 min,3 000 r/min 4℃离心30 min;将所得水相放入无菌小瓶中,-80℃过夜,冷冻干燥3—5 d,0.5—1 mL水溶解,-20℃保存。
HPLC分析:以甘油、赤藓糖、阿拉伯糖醇、果糖、葡萄糖、甘露醇、海藻糖为标准样品;其他条件:HPLC仪器型号:日立L-7110;检测器:Alltech ELSD 2000ES;柱子:依利特 Hypersil NH2,5 μm,4.6 mm×250 mm;流动相:乙腈﹕水=85﹕15;温度:柱温为室温,检测温度80℃,空气流速2 L·min-1。
2 结果
2.1 高渗胁迫对病菌生长发育的影响
为了分析高渗胁迫对玉米大斑病菌生长发育的影响,将菌株分别培养在含有不同浓度梯度NaCl(0.4、0.8、1.2 mol·L-1)的PDA培养基上,观测菌落及菌丝的生长发育状况。结果发现与正常培养状态相比,在高渗胁迫下的菌落颜色没有明显变化,但气生菌丝生长稀疏、生长势明显减弱(图 1-A),菌落的生长速率显著降低(图 1-B),且随胁迫浓度增加这种趋势增强;进一步对基生菌丝进行显微观察发现,与正常培养的菌丝细胞相比,在高渗胁迫下的菌丝细胞间隔变短,菌丝细胞显著膨大,且随胁迫浓度增加细胞膨大程度增强,在供试的最高浓度(1.2 mol·L-1)下大部分菌丝细胞膨大成椭圆形(图 1-A)。结果表明高渗胁迫显著影响了玉米大斑病菌菌丝细胞的生长发育。
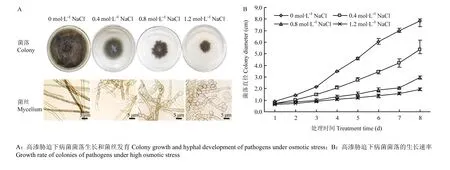
图1 高渗胁迫对玉米大斑病菌菌落生长及菌丝发育的影响Fig.1 The effect of hyperosmotic stress on colony growth and mycelium development of S. turcica
2.2 高渗胁迫对病菌菌丝中黑色素含量的影响
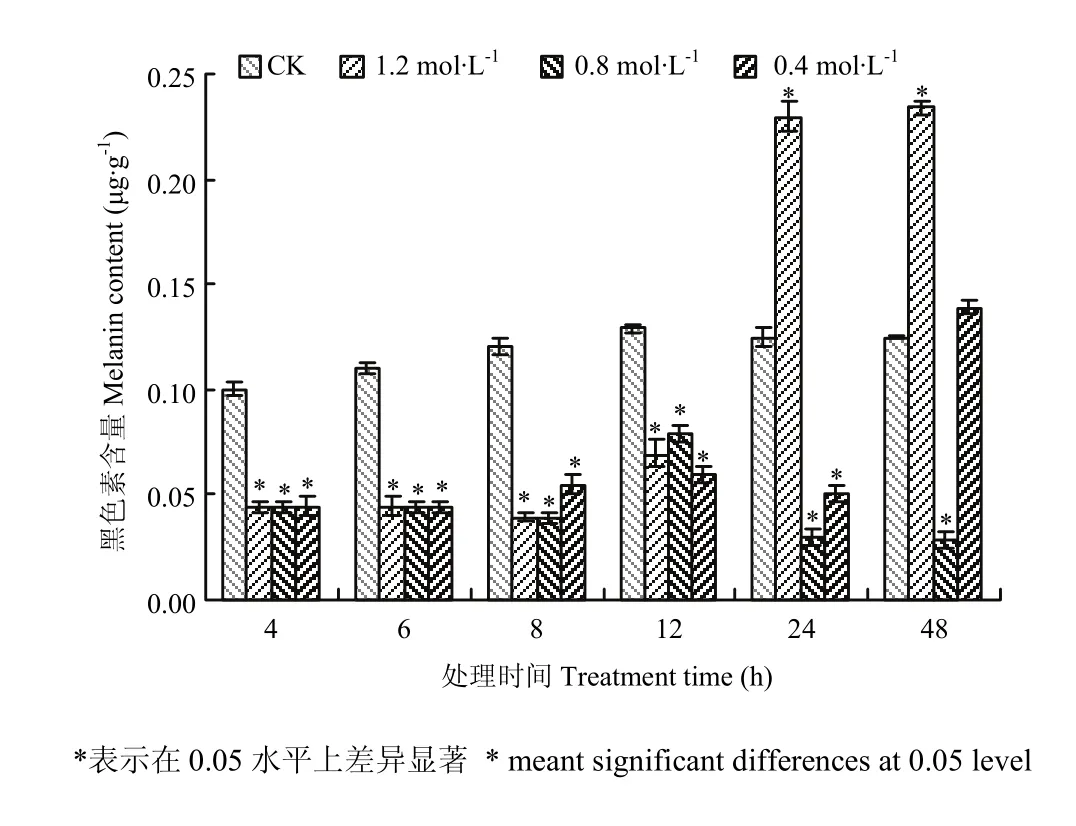
图2 高渗胁迫对玉米大斑病菌菌丝中黑色素含量的影响Fig. 2 The effect of hyperosmotic stress on melanin content in mycelium cells of S. turcica
采用含有不同浓度NaCl(0.4、0.8、1.2 mol·L-1)的 PD培养基培养玉米大斑病菌野生型菌株,并选取6个不同时间点(4、6、8、12、24、48 h)检测菌丝中黑色素的含量。结果发现,高渗胁迫下的菌株在各个时间点的黑色素含量与对照相比均有明显差别(图2);其中高渗处理12 h之前样品中黑色素的含量均比对照组低,但不同处理中菌丝细胞中黑色素含量均很接近;高渗胁迫下24、48 h两个时间点菌丝细胞中黑色素含量变化较为复杂,不同处理浓度对黑色素的影响不同,其中1.2 mol·L-1NaCl处理的与对照相比黑色素含量均明显增加,而0.8 mol·L-1NaCl处理下与12 h之前一样黑色素含量均较低,0.4 mol·L-1NaCl处理下样品的黑色素含量与对照相比在24 h时较低,但48 h时与对照基本一致。进一步进行统计分析表明,除0.4 mol·L-1NaCl处理48 h外,其他处理后菌丝黑色素含量与对照之间的差异显著(P<0.05)。以上结果表明,高渗胁迫处理玉米大斑病菌12 h之前对菌丝细胞的黑色素含量均有明显的抑制作用,但24 h之后不同高渗浓度对黑色素含量的影响各异。
2.3 玉米大斑病菌菌丝细胞渗透调节物质的分析
首先利用HPLC技术确定了在供试条件下多羟基化合物甘油、赤藓醇、葡萄糖、甘露醇、海藻糖标准样品的保留时间,分别为5.221、6.079、8.118、9.017、16.223 min。进一步利用该技术分析在不同处理时间(12、24、36 h)、不同高渗胁迫(0.4、0.8、1.2 mol·L-1NaCl)下菌丝细胞中上述多羟基化合物含量的变化。结果表明,与对照相比甘油、甘露醇和海藻糖的含量均发生了变化,而赤藓醇、葡萄糖的含量没有显著变化。进一步对甘露醇的含量变化分析,发现在不同的高渗胁迫条件下(0.4、0.8、1.2 mol·L-1NaCl)菌丝细胞中甘露醇的含量均有随处理时间而增加的趋势,在处理时间达到36 h时甘露醇含量较对照增加最为明显,具有差异显著性(P <0.05)。同时,分析了菌丝中甘油的含量,与甘露醇的变化有相似的规律,且在高渗胁迫处理下甘油含量增加幅度更加明显,并在处理24 h甘油含量较对照含量显著增加(P<0.05)。与甘露醇、甘油含量变化相反,在高渗胁迫处理下菌丝中海藻糖含量总体上有随着时间而降低的趋势,且渗透胁迫的强度越高该趋势越明显,不同浓度NaCl处理的菌丝中海藻糖含量均在36 h与对照相比有显著减少(P< 0.05)(图3)。而赤藓醇、葡萄糖的含量与对照相比没有显著变化。
2.4 高渗条件下菌丝培养滤液中培养基中羟基化合物的测定
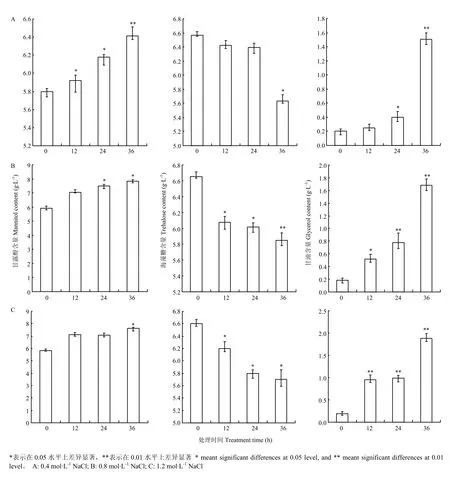
图3 高渗胁迫条件下玉米大斑病菌菌丝中甘露醇、海藻糖、甘油含量分析Fig.3 Analysis on the contents of mannitol, trehalose and glycerol in hyphae cell of S. turcica under hyperosmotic stress condition
为分析上述试验确定的高渗调节物质是否会被分泌到培养基中,检测了菌丝滤液中多羟基化合物的含量变化,发现在不同高渗处理条件下的滤液中均未检测到甘露醇、海藻糖和甘油。进一步分析了高渗处理条件下培养基中葡萄糖含量的变化,发现其含量随培养时间延长而减少(图4)。
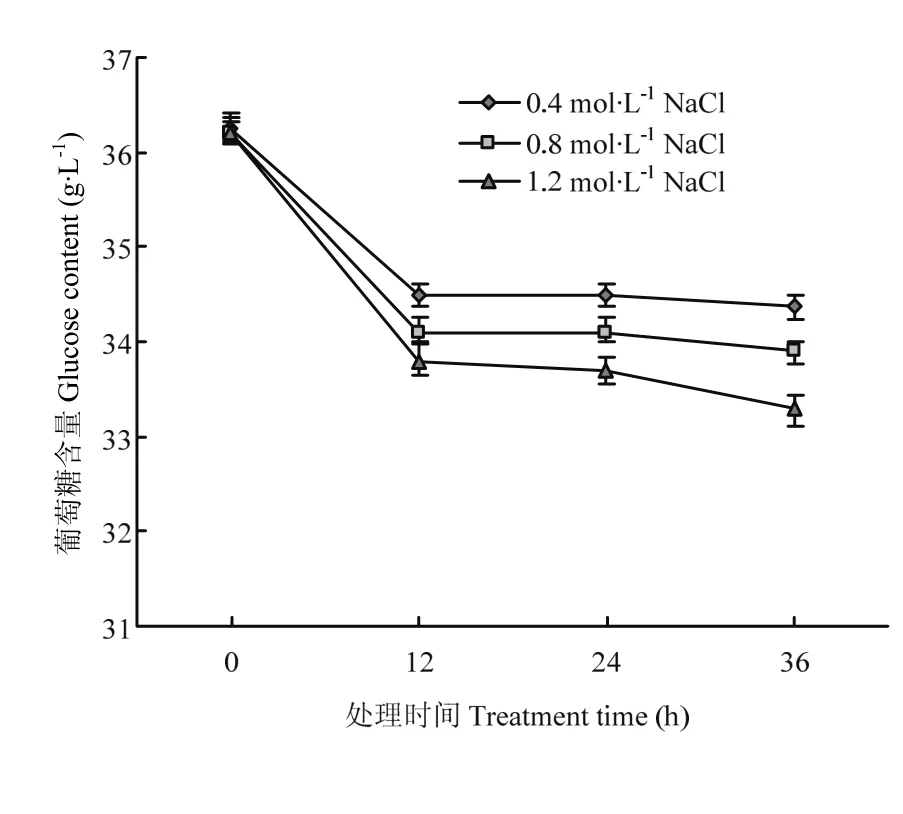
图4 高渗胁迫条件下培养基中葡萄糖含量分析Fig. 4 Analysis on the glucose content in PDA medium under hyperosmotic stress condition
3 讨论
真菌在生长发育过程中会受到渗透胁迫、盐胁迫、干旱胁迫等多种胁迫条件的威胁,其中高渗胁迫是较为常见的胁迫环境,在该条件下,会造成细胞内水分流失、细胞质中离子浓度增加、原生质体收缩等对细胞生长发育不利的反应[15]。生物在长期进化过程中细胞形成了一套有效的调控机制来适应高渗胁迫环境,其中产生和积累渗透调节物质以维持细胞内水平衡是最普遍的机制之一[16]。研究表明,参与细胞渗透调节过程的渗透调节方式主要有两大类,一是通过调节外界环境中的无机离子如 K+、Cl-和无机酸盐等进入细胞;二是通过细胞内合成有机小分子如甘油、阿拉伯糖醇、山梨醇、甘露醇、海藻糖等[17]。其中,在真菌中常见的渗透调节物质主要有甘油、海藻糖、赤藓糖醇、阿拉伯糖醇和甘露醇等多元醇类物质[18-20]。
目前的研究发现,真菌适应高渗胁迫的主要策略是积累多种多元醇混合物共同调控胁迫反应[21]。如在酿酒酵母中,其主要的渗透调节物质是甘油[22],但同时也产生少量的海藻糖和甘油磷酰胆碱来参与高渗反应[23]。在新赤壳菌(Neocosmospora vasinfecta)中,其高渗调节物质主要为甘油和赤藓糖醇[24]。在清酒假丝酵母(Candida sake)中其主要渗透调节物质为甘油和阿拉伯糖醇[25]。而在一些曲霉(Aspergillus)中甘油、赤藓糖醇、阿拉伯糖醇和甘露糖醇4种多元醇均为渗透调节物质[26]。在威尼克外瓶霉(Hortaea werneckii)中主要渗透调节物质为甘油和甘露醇[27]。在水稻稻瘟病菌和大豆褐红坏死病病菌中的主要渗透调节物质为海藻糖和甘露醇[7-8]。本研究发现,玉米大斑病菌在高渗胁迫处理条件下,菌丝细胞中甘油、海藻糖、甘露醇的含量发生了显著变化,表明上述3种多羟基醇类物质为该病菌中的主要渗透调节物质,这与前人在其他真菌中的研究结果相一致。至于在不同的真菌中其渗透调节物质不同的原因可能为:(1)试验分析过程中所采用的处理条件不同所致;(2)不同的物种本身存在代谢差异,具体原因有待进一步深入研究。另外,发现高渗处理条件下培养基中葡萄糖含量随培养时间延长而减少,推测病菌可能通过利用培养基中的葡萄糖,并将其转化为其他的渗透调节物质来适应外界高渗胁迫环境,且在高渗胁迫下,病菌产生的渗透调节物质并不分泌到培养基中去,以保证细胞的渗透平衡。
此外,有研究表明,植物病原真菌中的多羟基化合物不仅具有参与渗透调节的作用,还在平衡氧化还原电位反应中作为活性氧清除剂[28-29],同时还与病菌致病性密切相关。如对腐生真菌链格孢(Alternaria alternata)的研究发现,病菌在侵染过程中甘露醇的含量明显增加,敲除甘露醇代谢过程中的关键酶基因(MtDH、MPDH)后病菌的分生孢子可以正常萌发,接种烟草后MPDH基因突变体及MtDH、MPDH双基因突变体能够在宿主叶子上萌发形成附着胞进而侵染宿主,但其致病性显著下降,表明甘露醇是发病机制所必需的,但对于分生孢子萌发及早期侵染过程没有影响[30]。推测甘露醇可能是作为寄主活性氧(reactive oxygen species,ROS)的猝灭剂起作用,从而降低寄主的抗性反应[30-32]。在黄枝孢霉(Cladosporium fulvum)中发现侵染番茄的病菌中甘油含量大幅提高,表明甘油可能在该病菌的致病过程起重要作用[33]。在水稻稻瘟病菌中的研究发现,菌丝中的渗透调节物质(阿拉伯糖醇和甘油),在病菌侵染过程其附着胞中的甘油含量显著增加,二者产生的分子机制也不尽相同[7]。本研究对高渗胁迫下玉米大斑病菌菌丝细胞中黑色素的含量变化进行了测定,发现细胞中黑色素在24 h显著增加,其原因很可能是黑色素作为病菌细胞壁的一种组分,在高渗条件下可显著提高细胞壁的刚性,这对于在该条件下维持细胞的形态、抵御高渗胁迫具有一定的辅助作用。对于玉米大斑病菌在侵染寄主过程中其附着胞是不是产生渗透调节物质、渗透调节物质的种类和数量如何、调控这些物质的产生的分子机制等问题还需要深入研究。
4 结论
高渗胁迫抑制玉米大斑病菌菌落生长速率,使菌丝细胞间隔变短、细胞膨大,并显著影响了菌丝细胞黑色素含量;高渗胁迫条件下玉米大斑病菌菌丝细胞中甘露醇、甘油显著增加,海藻糖的含量显著降低,而葡萄糖、赤藓醇的含量没有显著变化,表明甘露醇、甘油可能为菌丝细胞中的主要渗透调节物质,海藻糖也参与了病菌的高渗胁迫反应。
[1] KUSAI N A, AZMI M M, ZAINUDIN N A, YUSOF M T, RAZAK A A. Morphological and molecular characterization, sexual reproduction, and pathogenicity of Setosphaeria rostrata isolates from rice leaf spot. Mycologia, 2016, 108(5): 905-914.
[2] 于舒怡, 傅俊范, 周如军, 康晓军, 刘博. 不同栽培模式对玉米大斑病发生和流行的影响. 玉米科学, 2011, 19(1): 132-135. YU S Y, FU J F, ZHOU R J, KANG X J, LIU B. Effects of different cultivation patterns on the occurrence and epidemic of northern leaf blight on maize. Maize Science, 2011, 19(1): 132-135. (in Chinese)
[3] DONG J G, FAN Y S, GUI X M, AN X L, MA J F, DONG Z P. Geographic distribution and genetic analysis of physiological races of Setosphaeria turcica in Northern China. American Journal of Agricultural and Biological Science, 2008, 3(1): 389-398.
[4] SHANKHDHAR D, SHANKHDHAR S C, PANT R C. Osmoprotectants: an overview. Physiology and Molecular Biology of Plants, 2004, 10(2): 167-180.
[5] RUIJTER G J, BAX M, PATEL H, FLITTER S J, VAN DE VONDERVOORT P J, DE VRIES R P, VANKUYK P A, VISSER J. Mannitol is required for stress tolerance in Aspergillus niger conidiospores. Eukaryot Cell, 2003, 2(4): 690-698.
[6] WYATT T T, VAN LEEUWEN M R, WÖSTEN H A, DIJKSTERHUIS J. Mannitol is essential for the development of stress-resistant ascospores in Neosartorya fischeri (Aspergillus fischeri). Fungal Genetics and Biology, 2014, 64(2): 11-24.
[7] DIXON K P, XU J R, SMIRNOFF N, TALBOT N J. Independent signaling pathways regulate cellular turgor during hyperosmotic stress and appressorium-mediated plant infection by the rice blast fungus Magnaporthe grisea. The Plant Cell, 1999, 11(10): 2045-2058.
[8] DURAN R, CARY J W, CALVO A M. Role of the osmotic stress regulatory pathway in morphogenesis and secondary metabolism in filamentous fungi. Toxins (Basel), 2010, 2(4): 367-381.
[9] DUNLAP C A, JACKSON M A, SAHA B C. Compatible solutes of sclerotia of Mycoleptodiscus terrestris under different culture and drying conditions. Biocontrol Science and Technology, 2011, 21(1): 113-123.
[10] KAYINGO G, WONG B. The MAP kinase Hog1p differentially regulates stress-induced production and accumulation of glycerol and D-arabitol in Candida albicans. Microbiology, 2005, 151(9): 2987-2999.
[11] YAN H, JIA L H, LIN Y P, JIANG N. Glycerol accumulation in the dimorphic yeast Saccharomycopsis fibuligera: cloning of two glycerol 3-phosphate dehydrogenase genes, one of which is markedly induced by osmotic stress. Yeast, 2008, 25(9): 609-621.
[12] GORI K, MORTENSEN H D, ARNEBORG N, JESPERSEN L. Expression of the GPD1 and GPP2 orthologues and glycerol retention during growth of Debaryomyces hansenii at high NaCl concentrations. Yeast, 2005, 22(15): 1213-1222.
[13] THORSEN M, DI Y, TÄNGEMO C, MORILLAS M, AHMADPOUR D, VANDER DOES C, WAGNER A, JOHANSSON E, BOMAN J, POSAS F, WYSOCKI R, TAMAS M J. The MAPK Hog1p modulates Fps1p-dependent arsenite uptake and tolerance in yeast. Molecular Biology of the Cell, 2006, 17(10): 4400-4410.
[14] BASHYAL B M, RAMESH C, CHANDA K, DEVYANI S, PRASAD L C, JOSHI A K. Association of melanin content with conidiogenesis in Bipolaris Sorokiniana of barley (Hordeum vulgare L.) . World Journal of Microbiology and Biotechnology, 2010, 26(2): 309-316.
[15] WOOD J M. Bacterial osmoregulation: a paradigm for the study of cellular homeostasis. Annual Review of Microbiology, 2011, 65: 215-238.
[16] SAITO H, POSAS F. Response to hyperosmotic stress. Genetics, 2012, 192(2): 289-318.
[17] BURG M B, FERRARIS J D. Intracellular organic osmolytes: function and regulation. Journal of Biological Chemistry, 2008, 283(12): 7309-7313.
[18] HOHMANN S, KRANTZ M, NORDLANDER B. Yeast osmoregulation. Methods in Enzymology, 2007, 428: 29-45.
[19] WESTFALL P J, PATTERSON J C, CHEN R E, THORNER J. Stress resistance and signal fidelity independent of nuclear MAPK function. Proceedings of the National Academy of Sciences of the United Statesof America, 2008, 105(34): 12212-12217.
[20] DE NADAL E, AMMERER G, POSAS F. Controlling gene expression in response to stress. Nature Reviews Genetics, 2011, 12(12): 833-845.
[21] DAVIS D J, BURLAK C, MONEY N P. Osmotic pressure of fungal compatible osmolytes. Mycological Research, 2000, 104(7): 800-804.
[22] HOHMANN S. Osmotic stress signaling and osmoadaptation in yeasts. Microbiology and Molecular Biology Reviews, 2002, 66(2): 300-372.
[23] KIEWIETDEJONGE A, PITTS M, CABUHAT L, SHERMAN C, KLADWANG W, MIRAMONTES G, FLORESVILLAR J, CHAN J, RAMIREZ R M. Hypersaline stress induces the turnover of phosphatidylcholine and results in the synthesis of the renal osmoprotectant glycerophosphocholine in Saccharomyces cerevisiae. FEMS Yeast Research, 2006, 6(2): 205-217.
[24] KELLY D J A,BUDD K. Polyol metabolism and osmotic adjustment in the mycelial ascomycete Neocosmospora vasinfecta (E. F. Smith). Experimental Mycology, 1991, 15(1): 55-64.
[25] ABADIAS M, TEIXIDO N, USALL J, VINAS I, MAGAN N. Solute stresses affect growth patterns, endogenous water potentials and accumulation of sugars and sugar alcohols in cells of the biocontrol yeast Candida sake. Journal of Applied Microbiology, 2000, 89(6): 1009-1017.
[26] NESCI A, ETCHEVERRY M, MAGAN N. Osmotic and matric potential effects on growth, sugar alcohol and sugar accumulation by Aspergillus section Flavi strains from Argentina. Journal of Applied Microbiology, 2004, 96(5): 965-972.
[27] KOGEI T, STEIN M, VOLKMANN M, GORBUSHINA A A, GALINSKI E A, GUNDE-CIMERMAN N. Osmotic adaptation of the halophilic fungus Hortaea werneckii: role of osmolytes and melanization. Microbiology, 2007, 153(12): 4261-4273.
[28] DIANO A, BEKKER-JENSEN S, DYNESEN J, NIELSEN J. Polyol synthesis in Aspergillus niger: influence of oxygen availability, carbon and nitrogen sources on the metabolism. Biotechnology & Bioengineering, 2006, 94(5): 899-908.
[29] VOEGELE R T, HAHN M, LOHAUS G, LINK T, HEISER I, MENDGEN K. Possible roles for mannitol and mannitol dehydrogenase in the biotrophic plant pathogen Uromyces fabae. Plant Physiology, 2005, 137(1): 190-198.
[30] VÉLËZ H, GLASSBROOK N J, DAUB M E. Mannitol biosynthesis is required for plant pathogenicity by Alternaria alternata. FEMS Microbiology Letters, 2008, 285(1): 122-129.
[31] CALMES B, GUILLEMETTE T, TEYSSIER L, SIEGLER B, PIGNÉ S, LANDREAU A, IACOMI B, LEMOINE R, RICHOMME P, SIMONEAU P. Role of mannitol metabolism in the pathogenicity of the necrotrophic fungus Alternaria brassicicola. Frontiers in Plant Science, 2013, 4(2): 131.
[32] MEENA M, PRASAD V, ZEHRA A, GUPTA V K, UPADHYAY R S. Mannitol metabolism during pathogenic fungal-host interactions under stressed conditions. Frontiers in Microbiology, 2015, 6: 1019. [33] CLARK A J, BLISSETT K J, OLIVER R P. Investigating the role of polyols in Cladosporium fulvum during growth under hyper-osmotic stress and in planta. Planta, 2002, 216(4): 614-619.
(责任编辑 岳梅)
Effect of Hyperosmotic Stress on Growth and Development of Setosphaeria turcica and Determination of Osmolytes in the Mycelium Cells of the Pathogen
GONG XiaoDong1, LIU XingChen1, ZHAO LiQing1, ZHENG YaNan1, FAN YongShan2, HAN JianMin1, GU ShouQin1, DONG JinGao1
(1Mycotoxin and Molecular Plant Pathology Laboratory, Agricultural University of Hebei, Baoding 071001, Hebei;2Department of Life Sciences, Tangshan Normal College, Tangshan 063000, Hebei)
Setosphaeria turcica; hyperosmotic stress; growth and development; osmolyte
2016-11-26;接受日期:2017-02-15
国家自然科学基金(31171805,31271997,31371897)、河北省自然科学基金(C2014105067,C2016204164)、河北省研究生创新资助项目(1099009)
联系方式:巩校东,E-mail:gxdjy@126.com。刘星晨,E-mail:1552788293@qq.com。巩校东和刘星晨为同等贡献作者。通信作者谷守芹,Tel:0312-7528876;E-mail:gushouqin@126.com。通信作者董金皋,E-mail:dongjingao@126.com
Abstract:【Objective】The objective of this study is to understand the effect of hyperosmotic stress on the growth and development, melanin content in mycelium cells, determine the probable osmolytes in the mycelium cells and to clarify the variation rule of these substances under different hyperosmotic stress conditions in Setosphaeria turcica. 【Method】The effects of hyperosmotic stress on colony growth rate, mycelium morphological characteristics and melanin content in S. turcica mycelium cell were analyzed under different hyperosmotic stress media, in which 0.4, 0.8, and 1.2 mol·L-1NaCl were added in PDA medium. High performance liquid chromatography (HPLC) technology was employed to detect the content of polyhydroxy-alcohol including glycerol, erythrol, glucose, mannitol, trehalose and analyzed the change profiles of these substances as time increased. 【Result】Compared to the strain cultured on PDA medium, the strain cultured under hyperosmotic stress treatments appeared with decreased in colony growth rate, shortened septum and swollen cells. Melanin content in mycelium cells cultured under hyperosmotic stress treatments in all time points showed a significant difference compared to the control group, in which melanin content in the samples treated before 12 h were lower than that in control, but there were no obvious differences between the samples treated. Moreover, there were different effects under different times (24, 48 h) and different concentration treatments. Compared to the control group, melanin content in the samples treated with 1.2 mol·L-1NaCl was significantly increased, melanin content treated with 0.8 mol·L-1NaCl was significantly decreased, melanin content in samples treated with 0.4 mol·L-1NaCl was significantly decreased in 24 h, but the content in the samples after 48 h treatment was almost the same with the control. Mannitol contents in mycelium cell under different hyperosmotic stress treatments were increased with the increase in time, especially the mannitol content significantly increased after 36 h treatment. There was a similar change tendency in glycerol and mannitol contents in mycelium cells under different treatments. Glycerol content increased most obviously compared with the control group and the content was significantly increased after 24 h treatment. Trehalose content in mycelium cells showed an increasing tendency as time increased, and the tendency increased with the increase of stress intensity, however, trehalose content after 36 h treatment was significantly lower than that in control group, while no significant difference was found in the changes of erythrol and glucose contents. No mannitol, trehalose and glycerol were detected in culture filtrate, while glucose content had no significant change no matter the fact that the mycelium was cultured in PDA medium or under hyperosmotic stress treatments.【Conclusion】 The colony growth rate was inhibited, mycelium cell was swollen, and septum was shortened under hyperosmotic stress. There was a significant inhibition on mannitol content before 12 h treatment. Mannitol and glycerol were main osmolytes in mycelium cells. Trehalose was also involved in hyperosmotic stress reaction in S. turcica.

