采前乙酰水杨酸处理对厚皮甜瓜果实后熟及软化的影响
刘耀娜,王毅,毕阳,李生娥,姜红,朱艳,王斌
(甘肃农业大学食品科学与工程学院,兰州 730070)
采前乙酰水杨酸处理对厚皮甜瓜果实后熟及软化的影响
刘耀娜,王毅,毕阳,李生娥,姜红,朱艳,王斌
(甘肃农业大学食品科学与工程学院,兰州 730070)
【目的】研究果实发育期间乙酰水杨酸(ASA)4次喷施处理对厚皮甜瓜果实采收及贮藏期间后熟和软化的影响及作用机理,为采后调控提供参考。【方法】以‘玛瑙’厚皮甜瓜为试材,采用1 mmol·L-1ASA分别在甜瓜幼果期(花后2周)、膨大期(花后3周)、网纹形成期(花后4周)及采前48 h四个时期连续喷施处理,测定果实采收及冷藏期间(7℃,RH 55%—60%)的呼吸强度和乙烯释放量,硬度、细胞壁组分以及细胞壁降解酶活性的变化。【结果】采前乙酰水杨酸处理可有效降低甜瓜果实采收时的呼吸强度和乙烯释放量,使果实贮藏期间呼吸和乙烯跃变峰的出现时间推迟1周。ASA处理提高了果实采收时的硬度及原果胶、纤维素、半纤维素和富含羟脯氨酸糖蛋白(HRGPs)含量,延缓了原果胶向可溶性果胶的转化,维持了较高的纤维素、半纤维素和HRGPs水平,有效保持了贮藏期间的果实硬度。采前ASA处理显著降低了采收时和贮藏期间甜瓜果实细胞壁降解酶的活性,主要抑制了果实果胶甲酯酶(PME)、多聚半乳糖醛酸酶(PG)、纤维素酶(Cx)和β-葡萄糖苷酶(β-Glu)的活性。相关性分析表明,处理果实的乙烯释放量和呼吸强度与多聚半乳糖醛酸酶(PG)活性呈显著正相关,与β-葡萄糖苷酶(β-Glu)活性呈极显著正相关;处理果实的硬度与果胶甲酯酶(PME)活性、原果胶和半纤维素含量呈极显著正相关,与纤维素酶(Cx)活性和可溶性果胶(WSP)含量呈显著正相关,与乙烯释放量和呼吸强度均呈显著负相关。【结论】采前ASA处理可促进甜瓜果实发育期间细胞壁物质的合成,有效抑制甜瓜果实采收及贮藏期间的呼吸强度和乙烯释放,降低胶甲酯酶(PME)、多聚半乳糖醛酸酶(PG)、纤维素酶(Cx)和β-葡萄糖苷酶(β-Glu)等细胞壁降解酶的活性,阻止细胞壁物质的释放,有效维持了冷藏期间的甜瓜果实硬度。
厚皮甜瓜;采前喷洒;乙酰水杨酸;后熟;软化
0 引言
【研究意义】厚皮甜瓜(Cucumis melo L.)是中国西北地区的特色经济作物,但是由于产期集中,且正值高温季节,加之缺乏有效的采后处理及必要的冷链,采后成熟和衰老速度加快,果实迅速软化变质[1]。因此,有效抑制厚皮甜瓜的采后软化变质是当前生产中亟待解决的问题。【前人研究进展】质地软化是软肉型厚皮甜瓜后熟衰老的重要特征[2-3]。软化期间,细胞壁组分降解、细胞间隙扩大、果实硬度迅速降低[4-5]。果实软化过程中原果胶降解,可溶性果胶含量上升,中胶层初生壁分解,细胞相互分离[2,6]。多种细胞壁降解酶,如多聚半乳糖醛酸酶、果胶甲酯酶、纤维素酶和β-葡萄糖苷酶等活性迅速增高[7]。有研究表明,采后水杨酸(salicylic acid,SA)处理可有效维持桃[8-9]、香蕉[10]和苹果[11]贮藏期间的硬度,抑制甜樱桃[12]和李[13]的采后呼吸强度和乙烯生成,延缓猕猴桃[14]、番茄[15]、李[16]和香蕉[17]的后熟软化。此外,采前 SA喷洒也可抑制苹果的呼吸速率及多聚半乳糖醛酸酶和果胶甲酯酶活性,维持果实的采后硬度[18],降低葡萄果胶甲酯酶活性,维持其果皮硬度[19]。【本研究切入点】乙酰水杨酸(acetylsalicylic acid,ASA)是水杨酸(salicylic acid,SA)的衍生物,在生物体内很快转化为SA,与SA具有类似作用[20],但ASA溶解性明显优于SA,更便于使用[21]。目前关于SA对果实采后生理及品质软化的研究大多集中于采后处理,对采前处理的报道不多,软化机理的探讨也不系统。此外,果实发育期 ASA处理对果实后熟软化的影响还未见研究报道。【拟解决的关键问题】本研究以‘玛瑙’厚皮甜瓜为试材,探索采前果实发育期4次喷洒ASA处理对果实采收及冷藏期间呼吸强度和乙烯释放量的影响,分析采收及冷藏期间果实硬度、细胞壁组分及细胞壁降解酶活性的变化,揭示采前ASA处理对果实软化的抑制机理,为厚皮甜瓜果实的采后软化控制提供技术及理论依据。
1 材料与方法
1.1 材料
供试甜瓜‘玛瑙’(Cucumis melo L. cv. Agate)2015年3月12日播种于甘肃省民勤县收成乡露天大田,土壤为砂壤土,基肥为羊粪(60 t·hm-2),田间生长期间追3次氮肥(碳铵和尿素),灌水10次,果实于2015年7月15日采收。
乙酰水杨酸(acetylsalicylic acid,ASA)(纯度>99%)为天津光复精细化工研究所产品。
1.2 方法
1.2.1 ASA采前处理 参照ZHANG等[22]方法,采用1 mmol·L-1ASA分别在甜瓜幼果期(花后2周)、膨大期(花后3周)、网纹形成期(花后4周)及采前48 h四个时期用手动式喷雾器均匀喷洒甜瓜果实,以清水处理为对照。每处理用果实 400个,重复 3次。果实于商业成熟度(花后35 d)采收,单果套发泡网袋后入标准包装箱(16个/箱),于24 h内运抵甘肃农业大学食品科学与工程学院实验室。挑选成熟度、大小、颜色均一,无机械伤,无病害的健康果实,先用自来水冲洗净果实表面尘土及异物,然后在2%次氯酸钠溶液中浸泡2 min进行表面消毒后,用清水冲洗干净,晾干后装箱,于7℃,RH 55%
—60%冷库中贮藏待测。
1.2.2 呼吸强度及乙烯释放量的测定
1.2.2.1 呼吸强度的测定 参照LI等[23]的方法,采用JFQ-315OH果蔬呼吸测定仪(北京均方理化科技研究所)测定。气体流速为0.9 L·min-1。
呼吸强度采用以下公式计算,每处理用果实6个,重复3次。单位为mg CO2·kg-1·h-1。
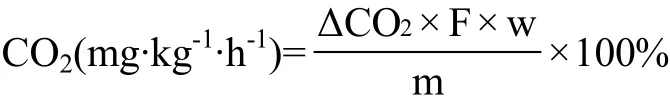
式中,ΔCO2为CO2浓度;F为气体流量(L·h-1);w(℃));m为被测果实质量(kg)。
1.2.2.2 乙烯释放量的测定 参照LI等[23]的方法,采用Agilent Technologies 7820A气相色谱(北京科普生分析科技有限公司)测定。取2个甜瓜(约1.5 kg)放入5 L干燥器中密封12 h,抽取0.2 mL混合气体注入气相色谱仪测定乙烯释放量。乙烯释放量分析条件:检测器温度230℃,进样口温度80℃,流速8 mL·min-1,氮气流量25 mL·min-1,柱温50℃,平衡时间1 min,保持时间2 min,FID检测器,外标法定量。
乙烯释放量采用以下公式计算,每处理用果实 6个,重复3次。
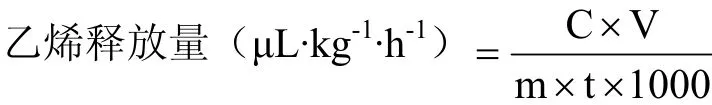
式中:C—待测样品释放的乙烯含量(μL·L-1);V—干燥器的体积与待测样品体积之差值(mL);m—待测样品重量(kg);t—密闭时间(h)。
1.2.3 硬度的测定 参照YUAN等[24]的方法,采用GY-4型水果硬度计测定。在果实的赤道部位削去果皮后均匀取4个点进行测定。每处理用果实12个,重复3 次。
1.2.4 生化分析样品采集 参照GE等[25]的方法,分别在果实采收后的第0、7、14、21和28天用水果刀取“赤道”附近皮下4—8 mm处组织,锡箔纸包好,液氮速冻,在-80℃超低温冰箱中保存待用。
1.2.5 细胞壁组分的测定
1.2.5.1 可溶性果胶和原果胶含量的测定 参照曹建康等[26]的方法并略作修改。称取1.0 g样品于研钵中研磨,加25 mL 95%(v/v)乙醇煮沸30 min,冷却后4℃,6 088×g离心15 min,弃上清。加95%(v/v)乙醇溶液加热洗涤4次。加20 mL蒸馏水,50℃水浴30 min,溶解果胶。冷却离心,得可溶性果胶提取液。沉淀中加25 mL 0.5 mol·L-1硫酸溶液,沸水浴1 h水解原果胶。冷却离心,得原果胶提取液。各吸取1.0 mL可溶性果胶和原果胶提取液,加0.2 mL1.5 g·L-1咔唑-乙醇溶液、6 mL浓硫酸,85℃水浴10 min,冷却,测定530 nm处吸光值。以半乳糖醛酸作标准曲线。单位分别以每克鲜重中可溶性果胶和原果胶的毫克数表示,即mg·g-1FW。
1.2.5.2 纤维素含量的测定 采用李合生[27]的方法并略作修改。称取5.0 g样品于烧杯并置于冷水浴中,加60 mL 11.2 mol·L-1H2SO4消化30 min 后转入100 mL容量瓶,用11.2 mol·L-1H2SO4H2SO4定容,摇匀并过滤。取滤液5 mL用蒸馏水稀释至100 mL摇匀。取上述溶液 2 mL,加0.5 mL 0.1 mol·L-1蒽酮试剂,并沿管壁加3 mL浓H2SO4,摇匀,静置12 min,测定620 nm处吸光值。以葡萄糖作标准曲线,纤维素含量用mg·g-1FW表示。
1.2.5.3 半纤维素含量的测定 采用王聘等[28]的方法并略作修改。称取0.5 g样品于烧杯中,加10 mL 12.5 mol·L-1硝酸钙溶液,小火煮沸5 min,热水清洗4次,吸去水分,向沉淀加10 mL 2 mol·L-1HCl沸水浴45 min,冷却后离心,上清液移入50 mL容量瓶,用NaOH中和至显玫瑰色,并过滤。用DNS法测还原糖,取2 mL滤液,加1.5 mL DNS试剂沸水浴5 min,冷却,测定540 nm处吸光值,分析葡萄糖标准曲线,测得还原糖含量乘以0.9得半纤维素含量,用mg·g-1FW表示。
1.2.5.4 富含羟脯氨酸糖蛋白(Hydroxyproline-rich glycoproteins,HRGPs)含量的测定 参照胡景江等[29]的方法并改进。称取3 g样品用3 mL 0.1 mol·L-1磷酸缓冲液(pH 7.2)冰浴研磨,10 000×g离心10 min,沉淀用缓冲液清洗4次,TritonX-100(0.5%)洗1次,水洗3次,1 mol·L-1NaCl洗1次,水洗3次,丙酮洗1次,烘干得细胞壁。取细胞壁制品20 mg,盐酸酸解。取酸解液2 mL,KOH调pH(7.0),硼酸缓冲液(pH 8.7)和氯胺T反应25 min,Na2S2O3终止反应,KCl饱和后用甲苯萃取,取萃取液2 mL与1 mL对二甲氨基甲醛(DMAB)试剂显色20 min,560 nm测定OD值,根据标准曲线计算羟脯氨酸(Hyp)含量,即代表样品中HRGPs相对含量,单位以每克鲜重中HRGPs的微克数表示,即μg·g-1FW。
上述各项指标测定均重复3次。
1.2.6 细胞壁降解酶活性的测定
1.2.6.1 粗酶液的提取
1.2.6.1.1 多聚半乳糖醛酸酶(Polygalacturonase,PG)、纤维素酶(Cellulase,Cx)和 β-葡萄糖苷酶(β-gluosidase,β-Glu)等粗酶液的提取参照曹建康等[26]的方法略作修改。称取3 g样品用6 mL预冷的95%乙醇冰浴研磨成匀浆,低温放置10 min,4℃,10 000×g离心10 min,倾去上清液,沉淀中加3 mL预冷80%乙醇,振荡,低温放置10 min,离心,再倾去上清液,沉淀中加5 mL预冷的提取缓冲液,4℃下放置提取20 min,离心后得粗酶提取液。4℃保存备用。
1.2.6.1.2 果胶甲酯酶(Pectin methylesterase,PME)粗酶液的提取参照HAGERMAN等[30]的方法并略作修改。称取3 g样品用5 mL 8.8%预冷的NaCl冰浴研磨,4℃,10 000×g离心 10 min,收集上清液,用 0.1 mol·L-1NaOH调 pH(7.5)后即为粗酶提取液,4℃保存备用。
1.2.6.2 酶活性的测定
1.2.6.2.1 PG活性的测定 取0.5 mL粗酶提取液,加1.0 mL 50 mmol·L-1的乙酸-乙酸钠缓冲液(pH 5.5)和0.5 mL 10 g·L-1的多聚半乳糖醛酸溶液,37℃水浴1 h后,迅速加入1.5 mL 3,5-二硝基水杨酸试剂,沸水浴5 min,迅速冷却,加8 mL蒸馏水,混匀。540 nm处测定吸光值。PG活性以每小时每克果蔬组织样品(鲜重)中酶在37℃催化多聚半乳糖醛酸水解生成半乳糖醛酸的质量表示,即mg·h-1·g-1。
1.2.6.2.2 PME活性的测定 反应液包括4 mL 0.5%果胶溶液,0.3 mL 0. 01%溴麝香草酚兰,在加入粗酶液前初始A620约在0.091左右,加500 μL粗酶液,酶与果胶即作用释放出-COOH,使反应液的pH下降,指示剂溴麝香草酚兰对pH很敏感,颜色立即变化并使吸光度A620发生变化,反应2 min后测定其吸光值,记录每分钟酶活性变化,以△A620min-1表示。
1.2.6.2.3 Cx活性的测定 取0.5 mL粗酶提取液,加1.5 mL 10 g·L-1CMC(羧甲基纤维素钠)溶液,混匀后37℃水浴1 h,迅速加入1.5 mL 3,5-二硝基水杨酸试剂,沸水浴5 min,迅速冷却,加8 mL蒸馏水,混匀。540 nm处测定吸光值。Cx活性以每小时每克果蔬组织样品(鲜重)中酶在37℃催化CMC水解生成还原糖(葡萄糖)的质量表示,即mg·h-1·g-1。
1.2.6.2.4 β-Glu活性的测定 取0.5 mL粗酶提取液,加入1.5 mL 10 g·L-1水杨苷溶液,混匀后置于37℃水浴1 h后,迅速加入1.5 mL 3,5-二硝基水杨酸试剂,沸水浴5 min,迅速冷却,加8 mL蒸馏水,混匀。在540 nm处测定吸光值。β-Glu活性以每小时每克果蔬组织样品(鲜重)中酶在37℃催化水杨苷水解生成还原糖(葡萄糖)的质量表示,即mg·h-1·g-1。
上述各项测定指标均重复3次。
1.2.7 数据统计 全部数据用Excel 2007计算平均值和标准误,用SPSS 17.0进行Duncan’s多重差异显著性分析及相关性分析。
2 结果
2.1 采前 ASA处理对甜瓜果实采收及冷藏期间呼吸强度和乙烯释放量的影响
采前 ASA处理有效降低了果实采收时的呼吸强度,与对照相比,处理果实的呼吸强度降低了11.99%。贮藏期间,处理组和对照组果实的呼吸强度均呈跃变型单峰型变化。但 ABA处理显著抑制了跃变前期果实的呼吸强度,第14天时处理果实的呼吸强度低于同期对照13.52%。此外,处理还使果实的呼吸跃变高峰推迟出现了1周(图1-Ⅰ)。
采前 ASA处理显著抑制了果实采收时的乙烯释放量,比对照降低了 24.38%。贮藏期间,处理组和对照组果实的乙烯释放均呈单峰型变化。但处理降低了跃变前期的果实乙烯释放量,第7天时处理果实的乙烯释放量低于同期对照18.47%。此外,ABA处理使果实乙烯高峰的出现时间推迟了 1周(图1-Ⅱ)。
2.2 对果实硬度及细胞壁组分的影响
采前ASA处理有效提高了果实采收时的硬度,处理果实的硬度高于对照10.89%;贮藏期间,处理和对照果实的硬度均逐渐下降,但处理果实的硬度均高于对照,第28天时,ASA处理果实的硬度高于同期对照11.98%(图2-Ⅰ)。虽然采前ASA处理增加了果实采收时的原果胶含量,但与对照相比无显著差异;贮藏期间,处理和对照果实的原果胶含量均逐渐降低,但处理果实的原果胶含量均高于对照,第 14天和第28天时,分别高出同期对照26.02%和41.52%(图2-Ⅱ)。同样,采前处理有效降低了果实采收时的可溶性果胶含量,处理果实比对照含量降低了25.90%;贮藏期间,处理和对照果实的可溶性果胶含量均整体呈下降的趋势。但处理组贮藏后期显著低于对照,第21天和第28天时,分别低于同期对照34.36%和21.92%(图2-Ⅲ)。
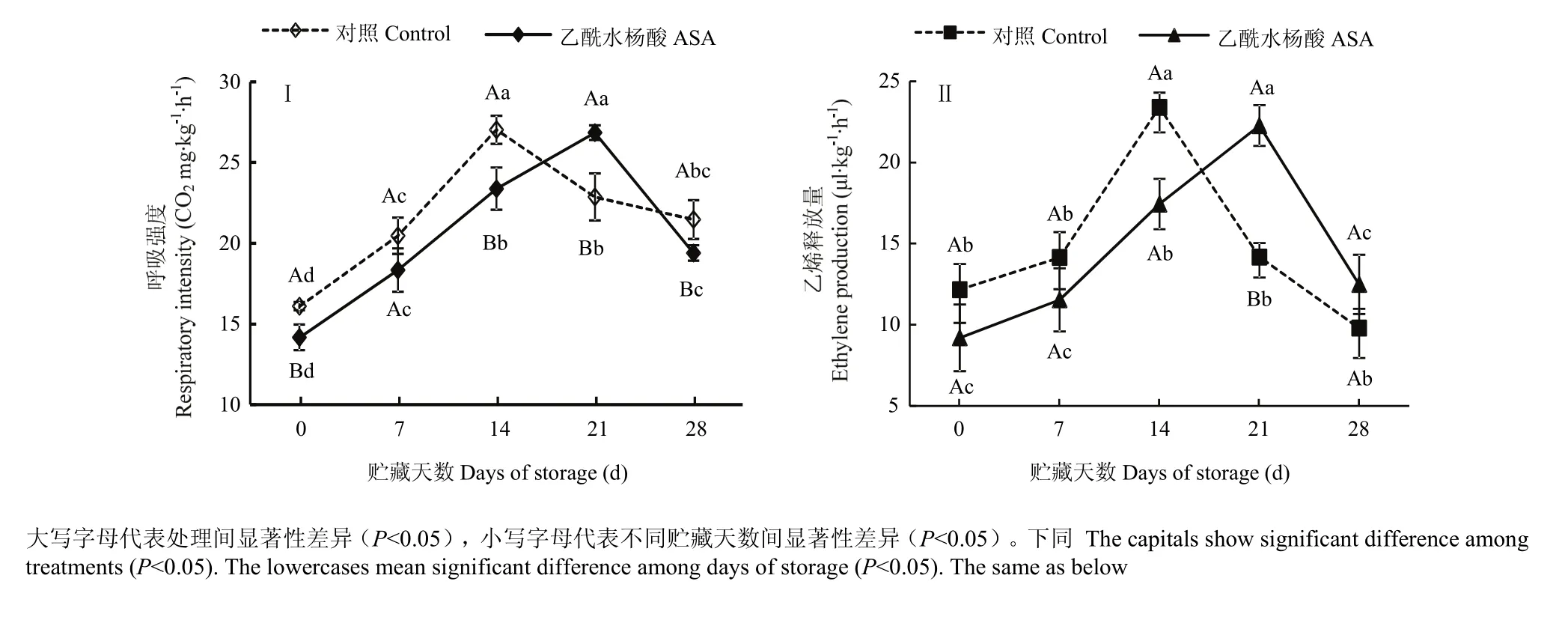
图1 采前多次ASA喷洒对甜瓜果实采收及冷藏期间呼吸强度(Ⅰ)和乙烯释放量(Ⅱ)的影响Fig. 1 Effect of preharvest multiple ASA sprays on respiratory rate (Ⅰ) and ethylene production (Ⅱ) of muskmelon fruit at harvest and during cool storage
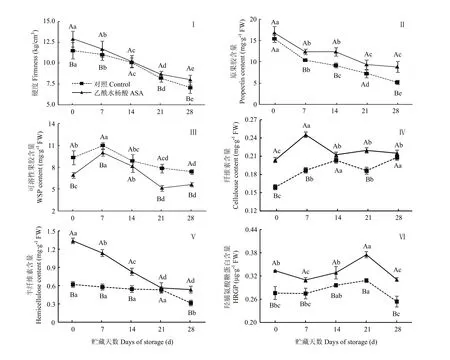
图2 采前多次ASA喷洒对甜瓜果实采收及冷藏期间硬度及细胞壁组分的影响Fig. 2 Effect of preharvest multiple ASA sprays on firmness and cell wall components of muskmelon fruit at harvest and during cool storage
采前 ASA处理显著提高了果实采收时的纤维素含量,处理果实比对照提高了20.84%;贮藏期间,处理果实的纤维素含量大体呈下降的趋势,而对照果实变化比较平缓。但处理果实的含量高于对照,第7天和第21天时,分别高于同期对照22.85%和14.46%(图2-Ⅳ)。采前处理也能有效增加果实采收时的半纤维素含量,处理组的含量高于对照51.51%;贮藏期间,对照果实的半纤维素的含量变化趋势较平缓,而处理果实的含量呈下降趋势,但处理果实的含量高于对照,第7天时,高出同期对照46.90%(图2-Ⅴ)。采前处理还有效提高了果实采收时的HRGPs含量,处理果实的含量高于对照17.34%;贮藏期间,处理和对照的 HRGPs含量均呈先上升后下降的趋势,但处理组明显高于对照,第21和28天时,处理果实的含量分别高于同期对照 17.75%和 18.34%(图2-Ⅵ)。
2.3 对果实细胞壁降解酶活性的影响
采前ASA处理有效抑制了果实采收时的PG活性,处理果实的PG活性比对照低12.25%;贮藏期间,处理和对照果实的 PG活性均呈先升高后下降的趋势,处理果实的PG活性低于对照,第14天时,低于同期对照17.43%(图3-Ⅰ)。采前处理有效降低了果实采收时的PME活性,处理果实的PME活性低于对照35.40%;贮藏前期,处理和对照果实的PME活性均呈先上升后下降的趋势,而贮藏后期处理和对照果实的PME活性均趋于稳定。第7天时,处理组的活性低于同期对照26.04%(图3-Ⅱ)。
采前处理可有效抑制果实采收时的 Cx活性,处理果实的Cx活性低于对照39.24%;贮藏期间,处理和对照果实的 Cx活性均呈现先上升后下降的趋势。但处理果实的 Cx活性低于对照,第 7天和第14天时分别低于同期对照79.16%和57.89%(图3-Ⅲ)。采前处理还有效降低了果实采收时的β-Glu活性,处理组的活性低于对照40.01%;贮藏期间,处理和对照果实的 β-Glu活性均呈先上升后下降的趋势,但处理果实的β-Glu活性低于对照,第21天和第 28天时分别低于同期对照 15.06%和 27.56%(图3-Ⅳ)。
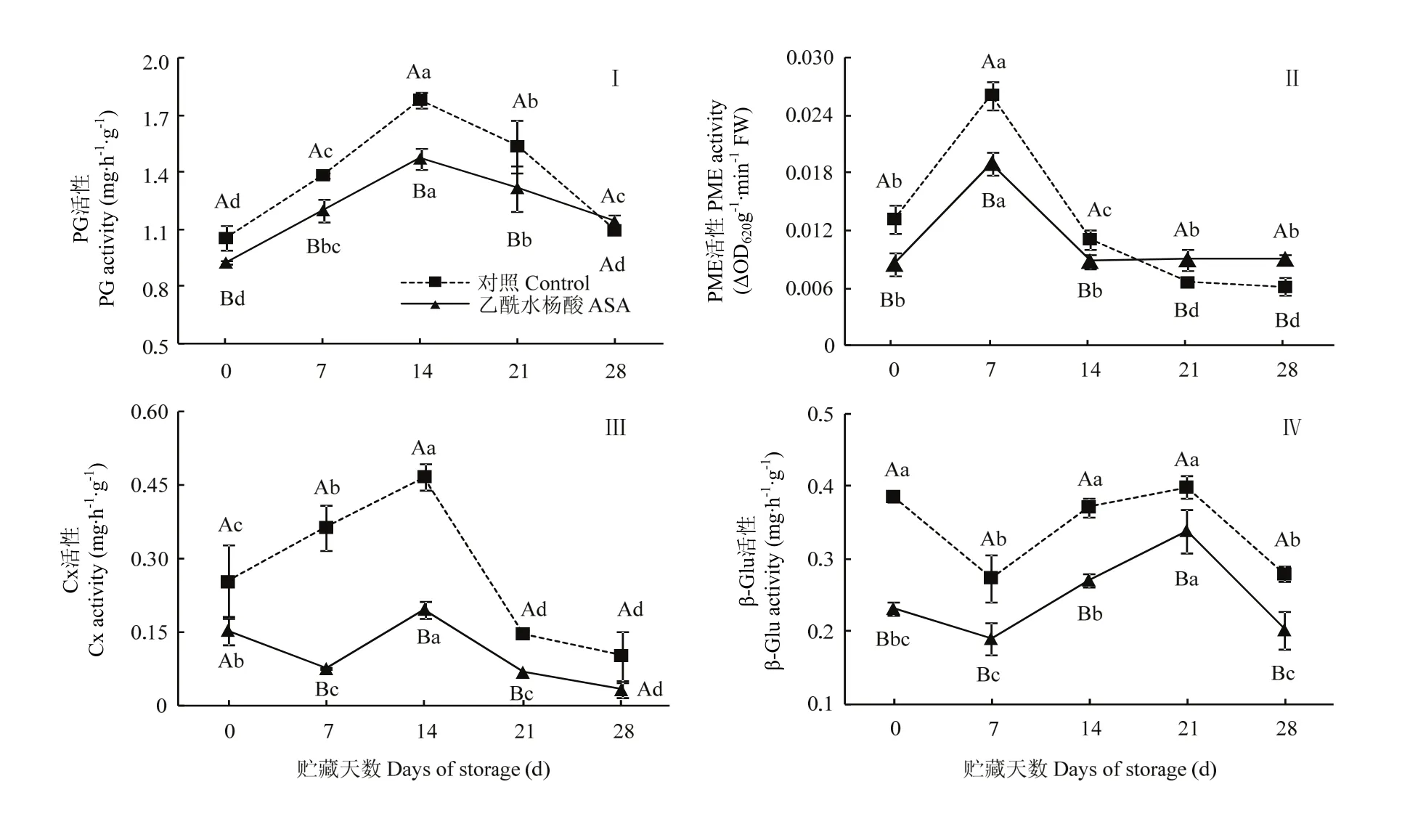
图3 采前多次ASA喷洒对甜瓜果实采收及冷藏期间细胞壁降解酶活性的影响Fig. 3 Effect of preharvest multiple ASA sprays on the activity of cell wall-degrading enzymes of muskmelon fruit at harvest and during cool storage
2.4 采前 ASA处理与甜瓜果实采收及冷藏期间后熟及软化指标间的相互关系
采前ASA处理果实的乙烯释放量和呼吸强度与PG活性呈显著正相关,相关系数分别为 0.596和0.789;与β-Glu活性呈极显著正相关,相关系数分别为0.645和0.697(表1)。由此表明,果实的乙烯释放量在促进甜瓜细胞壁降解酶活性中发挥了重要作用。ASA处理果实的硬度与PME活性、原果胶和半纤维素含量均呈极显著正相关,相关系数分别为0.721、0.909和0.978;与Cx活性和可溶性果胶呈显著正相关,相关系数分别为0.532和0.602,与乙烯释放量和呼吸强度均呈显著负相关,相关系数分别为-0.520和-0.680(表1)。由此表明,采前ASA处理可通过抑制果实的乙烯释放和呼吸强度来维持果实的硬度。
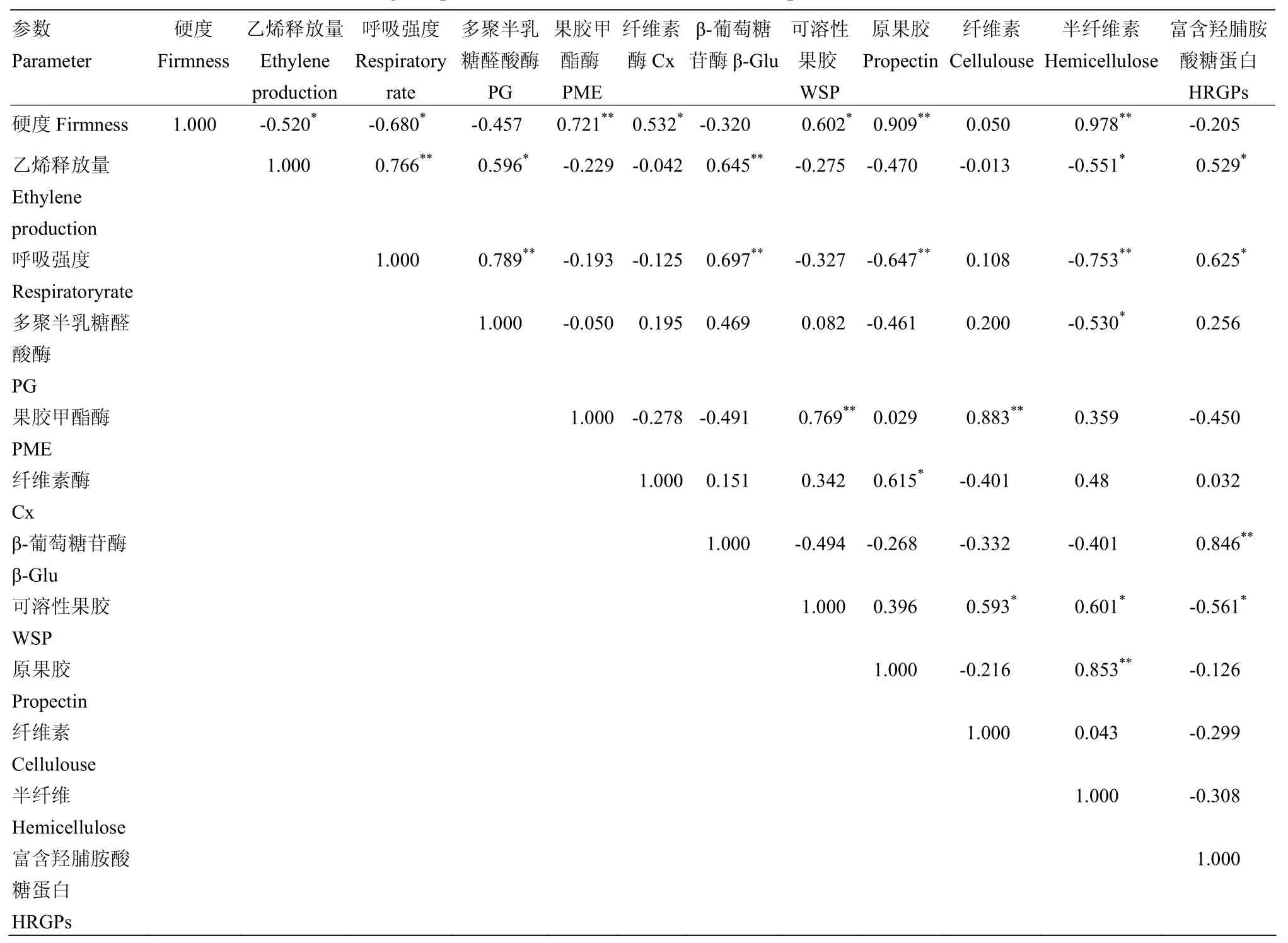
表1 采前ASA处理甜瓜果实参数间的相关系数Table 1 Correlation coefficients among the parameters of muckmelon fruit with preharvest ASA treatments
3 讨论
果实发育期ASA 4次喷洒明显降低了厚皮甜瓜采收及冷藏期间的呼吸速率和乙烯释放,并推迟了果实的呼吸跃变和乙烯释放高峰。该结果与前人采用SA采后处理抑制桃[31]、猕猴桃[14]及草莓[32]果实的乙烯释放和呼吸速率的结果基本类似。有报道指出,SA可抑制猕猴桃[33]乙烯合成关键酶 ACS和ACO的活性及其基因表达。由此表明,采前 ASA处理可通过抑制乙烯代谢关键酶从而减少甜瓜果实的乙烯释放,进而降低果实采收及冷藏期间的呼吸速率,推迟了呼吸跃变。本研究所采用的4次ASA喷洒是在前期次数及时期筛选的基础上获得的最佳处理,其效果明显优于1次、2次和3次单独及组合处理。在笔者课题组采用SA的类似物ASM采前处理甜瓜中曾得到类似的结果[22]。ASA是SA的衍生物,在植物体内很快转化为SA。SA可延缓果实成熟衰老进程,提高果实采后品质,抑制果实的成熟软化[34]。VALERO等[35]研究表明,ASA可延缓甜樱桃的采后软化,提高果实采后品质。采前ASA处理可有效抑制甜瓜果实的采后失重,延缓果皮转黄,维持可溶性固形物和可滴定酸含量[36]。此外,采前ASA提高了果实采收及贮藏期间硬度,这可能与 SA作为信号分子,调节细胞壁相关酶,维持细胞壁完整性有关[19]。
本研究发现的采前 ASA处理显著促进了厚皮甜瓜采收时的细胞壁物质积累与 ASA促进果实发育期间果实细胞壁物质的合成密切相关。有研究表明,采前SA处理能有效促进甜瓜叶片的光合作用[37],光合效率的提高可促进果实体内糖的积累及转化,促进果实发育期间细胞壁各类组分的合成及交联。此外,采前 ASA处理的果实原果胶和半纤维素含量变化均与硬度变化存在极显著相关性。由此表明,原果胶和半纤维素在 ASA处理甜瓜果实采收及冷藏期间软化过程中发挥了关键作用。
多种细胞壁降解酶在果实软化过程中发挥了积极作用[7]。SA可通过抑制细胞壁降解酶的活性来防止果实软化[14,17]。本研究发现,采前ASA处理能有效降低甜瓜果实多种细胞壁降解酶的活性。该结果与前人在SA采后处理甜椒以及香蕉上的发现基本一致[17,38]。此外,本研究还发现,甜瓜果实贮藏期间 PME活性上升较早,在采收后就迅速增加,其活性高峰出现在果实软化的早期。采前ASA处理能有效抑制PME活性的上升。同时,PME活性的上升与原果胶向水溶性果胶快速转化阶段一致,原果胶主要是果胶(水溶性果胶(WSP))和纤维素[42],而原果胶在 PME的作用下快速转化为WSP和纤维素。相关性分析表明,PME活性与可溶性果胶含量呈极显著正相关。该结果可能与贮藏前期 PME首先启动果胶降解,为其他降解酶如PG等提供底物有关[39]。此外,ASA处理对PME活性的抑制作用与其对硬度的保持呈极显著相关性。该结果与CHAMPA等[19]采前SA处理葡萄果实的结果一致。
果胶多糖是植物细胞壁中胶层的主要成分,其结构的改变是导致果实硬度下降的主要原因;半纤维素(主要成分木葡聚糖)在细胞壁“经纬结构”中起‘闩锁’作用[6],其降解会引起细胞壁结构松弛,纤维素是细胞壁的骨架,其降解会引起细胞壁解体和果实软化[40]。贮藏期间随果实硬度及果胶、纤维素和半纤维素含量的降低,PG和Cx活性增加,在贮藏中期达到活性高峰。果实软化期间PG主要参与果胶(即WSP)解聚[41],其作用于细胞壁果胶(WSP)中多聚半乳糖醛酸主链的α-1,4-糖苷键,生成寡聚半乳糖醛酸和半乳糖醛酸,引起中胶层的完整性变化,使细胞壁结构解体,从而导致果实质地软化[42]。Cx是参与果实软化的重要细胞壁酶,主要底物是木葡聚糖,作用于连接木葡聚糖与纤维素微纤丝之间的键,能够分解含β-1,4糖苷键的半纤维素基质多糖,但并不作用于非水溶性纤维素。Cx使纤维素降解,导致细胞壁纤维素微纤丝-半纤维素-果胶质“经纬结构”松散,使果实软化。其活性增加是果实软化的主要原因之一[43],本试验中,采前ASA处理能有效降低甜瓜果实PG和Cx活性。同时,ASA处理果实的Cx活性与硬度存在显著相关性。此外,采前ASA处理也能有效降低β-Glu活性。β-Glu属于聚糖水解酶类,能与Cx协调作用,主要水解非还原性末端的β-D-糖苷键生成β-D-葡萄糖[44]。β-Glu在甜瓜果实成熟后期具有较高的活性,主要在果实后期的软化中发挥作用。β-Glu降解经Cx先降解纤维素大分子后的低聚糖,因此β-Glu活性高峰迟于Cx。果实成熟软化期间,硬度的降低与多种降解反应相关,这些反应包括中胶层降解,细胞间隙增大,纤维素和半纤维素降解,微纤丝结构松弛,最终导致细胞壁结构破坏[7]。
本研究还发现,采前ASA处理甜瓜果实的PG活性与呼吸强度和乙烯释放量均呈显著正相关,ASA处理显著推迟了果实的乙烯和呼吸跃变峰。此外,乙烯和呼吸跃变高峰发生时间与与 β-Glu活性高峰一致,并且之间存在极显著正相关。有报道指出,香蕉果实 PG活性高峰的出现与其乙烯跃变峰同步,表明乙烯参与了果实细胞壁降解酶的活化[45]。乙烯可调节果实 PG[7,46]和 Cx[47]等细胞壁降解酶的活性,并调控 PG基因的表达和转录[48]。由于采前ASA处理后果实的乙烯和呼吸与硬度之间均呈显著正相关,由此表明,采前ASA处理可通过抑制呼吸和乙烯降低PG、PME、Cx、β-Glu等细胞壁降解酶的活性,从而抑制果胶、纤维素、半纤维素和细胞壁蛋白等物质的降解,有效维持果实的硬度,延缓甜瓜果实的软化。
4 结论
采前乙酰水杨酸处理能有效抑制甜瓜果实采收和贮藏期间的呼吸强度和乙烯释放,降低多聚半乳糖醛酸酶、果胶甲酯酶、纤维素酶和β-葡萄糖苷酶等细胞壁降解酶的活性,维持细胞壁结构的完整性,减少细胞壁组分的释放,从而减缓果实硬度的下降,抑制果实软化。甜瓜果实的软化与乙烯和呼吸密切相关,乙烯调控了细胞壁降解酶的活性。软化过程中,可溶性果胶含量增加,原果胶、纤维素和半纤维素含量降低。果胶甲酯酶在贮藏前期出现活性高峰,主要为多聚半乳糖醛酸酶提供底物;多聚半乳糖醛酸酶和纤维素酶在贮藏中期出现活性高峰,在甜瓜果实软化过程中起主导作用,参与细胞壁组分的降解;而贮藏后期甜瓜果实β-葡萄糖苷酶活性明显升高,加速了果实的软化。
[1] BI Y, GE Y H, WANG C L, LI X W. Melon production in China. Acta Horticulturae, 2007, 731: 493-500.
[2] BRUMMELL D A. Cell wall disassembly in ripening fruit. Functional Plant Biology, 2006, 33: 103-119.
[3] MORENO E, OBANDO J M, DOSSANTOS N, FERNÁNDEZTRUJILLO J P, MONFORTE A J. Candidate genes and QTLs for fruit ripening and softening in melon. Theoreticaland Applied Genetics, 2008, 116: 589-602.
[4] 齐秀东, 魏建梅, 高海生, 贾艳茹, 张海娥. 梨果实发育软化与果胶多糖降解特性的关系. 中国农业科学, 2015, 48(15): 3027-3037. QI X D, WEI J M, GAO H S, JIA Y R, ZHANG H E. Pectin polysaccharide degradation in relation to the texture softening in pear fruit. Scientia Agricultura Sinica, 2015, 48(15): 3027-3037. (in Chinese)
[5] 陆胜民, 金勇丰, 张耀州, 席玙芳. 果实成熟过程中细胞壁组成的变化. 植物生理学报通讯, 2001, 37(3): 246-249. LU S M, JIN Y F, ZHANG Y Z, XI Y F. The changes of cell wall composition in fruit ripening. Plant Physiology Communications, 2001, 37(3): 246-249. (in Chinese)
[6] 赵云峰, 林瑜, 林河通. 细胞壁组分变化与果实成熟软化的关系研究进展. 食品科技, 2012(12): 29-33. ZHAO Y F, LIN Y, LIN H T. Change of cell wall component in fruit ripening and softening. Food Science and Technology, 2012(12): 29-33. (in Chinese)
[7] BRUMMELL D A, HARPSTER M H. Cell wall metabolism in fruit softening and quality and its manipulation in transgenic plants. Plant Molecular Biology, 2001,47(1): 311-339.
[8] TAREEN M J, ABBASI N A, HAFIZ I A. Postharvest application of salicylic acid enhanced antioxidant enzyme activity and maintained quality of peach cv. ‘Flordaking’ fruit during storage. Scientia Horticulturae, 2012, 142(142): 221-228.
[9] WANG L J, CHEN S J, KONG W F, LI S H, ARCHBOLD D D. Salicylic acid pretreatment alleviates chilling injury and affects the antioxidant system and heat shock proteins of peaches during cold storage. Postharvest Biology and Technology, 2006, 41: 244-251.
[10] 李雯, 邵远志, 陈维信. 水杨酸处理对香蕉果实采后品质的影响.中国农学通报, 2005, 21(2): 75-76. LI W, SHAO Y Z, CHEN W X. Effects of salicylic acid on quality of banana after harvest. Chinese Agricultural Science Bulletin, 2005, 21(2): 75-76. (in Chinese)
[11] KAZEMI M, ARAN M, ZAMANI S. Effect of salicylic acidtreatments on quality characteristics of apple fruits during storage. American Journal of Plant Physiology, 2011, 6: 113-119.
[12] YAO H J, TIAN S P. Effects of pre-and post-harvest application of salicylic acid or methyljasmonate on inducing disease resistance of sweet cherry fruit in storage. Postharvest Biology and Technology, 2005, 35: 253-262.
[13] LUO Z S, CHEN C, XIE J. Effect of salicylic acid treatment on alleviating postharvest chilling injury of ‘Qingnai’ plum fruit. Postharvest Biology and Technology, 2011, 62: 115-120.
[14] ZHANG Y, CHEN K S, ZHANG S L, FERGUSON I. The role of salicylic acid in postharvest ripening of kiwifruit. Postharvest Biology and Technology, 2003, 28: 67-74.
[15] KANT K, ARORA A, SINGH V P. Salicylic acid influences biochemical characteristics of harvested tomato (Solanum lycopersicon L.) during ripening. Indian Journal of Plant Physiology, 2016, 21(1): 50-55.
[16] DAVARYNEJAD G H, ZAREI M, NASRABADI M E, ARDAKANI E. Effects of salicylic acid and putrescine on storability, quality attributes and antioxidant activity of plum cv. ‘Santa Rosa’. Journal of Food Science and Technology, 2015, 52(4): 1-10.
[17] SRIVASTAVA M K, DWIVEDI U N. Delayed ripening of banana fruit by salicylic acid. Plant Science, 2000, 158: 87-96.
[18] 田志喜, 张玉星. 水杨酸对新红星苹果果实后熟的影响. 园艺学报, 2001, 28(6): 557-559. TIAN Z X, ZHANG Y X. Studies on the effects of salicylic acid on ripening of ‘Starkrimson’ apple. Acta Horticulturae Sinica, 2001, 28(6): 557-559. (in Chinese)
[19] CHAMPA W A, GILL M I, MAHAJAN B V, ARORA N K. Preharvest salicylic acid treatments to improve quality and postharvest life of table grapes (Vitis vinifera L.) cv. Flame Seedless. Journal of Food Science and Technology, 2015, 52(6): 3607-3616.
[20] HAYAT S, AHMAD A. Salicylcic Acid: A Plant Hormone. Dordrecht: Springer, 2007.
[21] 余璐璐, 曹中权, 朱春娇, 徐飞. 不同浓度水杨酸处理对草莓采后保鲜的影响. 植物生理学报, 2015(11): 2047-2053. YU L L, CAO Z Q, ZHU C J, XU F. Effects of salicylic acid treatment at different concentrations on postharvest storage of strawberry. PlantPhysiology Journal, 2015(11): 2047-2053. (in Chinese)
[22] ZHANG Z K, BI Y, GE Y H, WANG J J, DENG JJ, XIE D F, WANG Y. Multiple pre-harvest treatments with acibenzolar-S-methyl reduce latent infection and induce resistance in muskmelon fruit. Scientia Horticulturae, 2011, 130(1): 126-132.
[23] LI X, BI Y, WANG J J, DONG B Y, LI H J, GONG D, ZHAO Y, TANG Y M, YU X Y, SHANG Q. BTH treatment caused physiological, biochemical and proteomic changes of muskmelon (Cucumis melo L.) fruit during ripening. Journal of Proteomics, 2015, 120: 179-193.
[24] YUAN L, BI Y, GE Y H, WANG Y, LIU Y Y, LI G. Postharvest hot water dipping reduces decay by inducing disease resistance and maintaining firmness in muskmelon (Cucumis melo L.) fruit. Scientia Horticulturae, 2013, 161:101-110.
[25] GE Y H, DENG H W, BI Y, LI C Y, LIU Y Y, DONG B Y. Postharvest ASM dipping and DPI pre-treatment regulated reactive oxygen species metabolism in muskmelon (Cucumis melo L.) fruit. Postharvest Biology and Technology, 2015, 99: 160-167.
[26] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导. 北京: 中国轻工业出版杜, 2007: 28. CAO J K, JIANG W B, ZHAO Y M. Fruit and Vegetables Postharvest Physiological and Biochemical. Beijing: China Light Industry Press, 2007: 28. (in Chinese)
[27] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000: 7. LI H S. Principle and Technology of Plant Physiological and Biochemical Experiments. Beijing: Higher Education Press, 2000: 7. (in Chinese)
[28] 王聘, 郜海燕, 周拥军, 房祥军, 毛金林. 减压处理对新疆白杏果实软化和细胞壁代谢的影响. 农业工程学报, 2012, 28(16): 254-258. WANG P, GAO HY, ZHOU Y J, FANG X J, MAO J L. Effects of hypobaric storage on softening and cell wall metabolism of Xinjiang kuqa apricot fruits. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(16): 254-258. (in Chinese)
[29] 胡景江, 朱玮, 文建雷. 杨树细胞壁HRGP和木质素的诱导积累与其对溃疡病抗性的关系. 植物病理学报, 1999, 29(2): 151-156. HU J J, ZHU W, WEN J L. The relation between the accumulation of HRGP and lignin in cell wall of poplars and the resistance to poplar canker. Acta Phytopthologica Sinica, 1999, 29(2): 151-156. (in Chinese)
[30] HAGERMAN A E, AUSTIN P J. Continuous spectrophotometric assay for plant pectin methyleasterase. Journal of Agricultural and Food Chemistry, 1986, 34(3): 440-444.
[31] 蔡冲, 陈昆松, 贾惠娟, 张玉, 胡亚东, 丁建国. 乙酰水杨酸对采后玉露桃果实成熟衰老进程和乙烯合成的影响. 果树学报, 2004, 21(1): 1-4. CAI C, CHEN K S, JIA H J, ZHANG Y, HU Y D, DING J G. Effects of acetylsalicylic acid on the postarvest senescence process and ethylene biosynthesis of Yulu peach fruit. Journal of Fruit Science, 2004, 21(1): 1-4. (in Chinese)
[32] BABALAR M, ASGHARI M, TALAEI A, KHOSROSHAHI A. Effect of pre- and postharvest salicylic acid treatment on ethylene production fungal decay and overall quality of Selva strawberry fruit. Food Chemistry, 2007, 105(2): 449-453.
[33] YIN X R, ZHANG Y, ZHANG B, YANG S L, SHI Y N, FERGUSON I B, CHEN K S. Effects of acetylsalicylic acid on kiwifruit ethylene biosynthesis and signaling components. Postharvest Biology and Technology, 2013, 83(2): 27-33.
[34] ROMANAZZIA G, SANZANIB S M, BI Y, TIAN S P, MARTÍNEZ P G, ALKAN N. Induced resistance to control postharvest decay of fruit and vegetables. Postharvest Biology and Technology, 2016, 122: 82-94.
[35] VALERO D, DÍAZ-MULA H M, ZAPATA P J, CASTILLO S, GUILLÉN F, MARTÍNEZ-ROMERO D, SERRANO M. Postharvest treatments with salicylic acid, acetylsalicylic acid or oxalic acid delayed ripening and enhanced bioactive compounds and antioxidant capacity in sweet cherry. Journal of Agricultural and Food Chemistry, 2011, 59(10): 5483-5489.
[36] 尚琪, 王婷, 李欣, 刘耀娜, 白晓东, 张溪桐, 王毅, 毕阳. 采前乙酰水杨酸与采后1-MCP处理对厚皮甜瓜冷藏品质及抗氧化能力的影响. 食品科学, 2016, 37(20): 247-252. SHANG Q, WANG T, LI X, LIU Y N, BAI X D, ZHANG X T, WANG Y, BI Y. Effect of preharvest acetylsalicylic acid and postharvest 1-MCP treatments on quality and antioxidant ability of muskmelon fruit during cool storage. Food Science, 2016, 37(20): 247-252. (in Chinese)
[37] 李喜娥, 陈年来, 王春林, 乔昌萍, 冯建明. BTH和SA处理及白粉菌接种对甜瓜叶片光合特性的影响. 西北植物学报, 2007, 27:1643-1649. LI X E, CHEN N L, WANG C L, QIAO C P, FENG J M. Effects of BTH and SA treatment and Sphaerotheca fuliginea on photosynthetic Characteristics of muskmelon. Acta Botanica Boreali-Occidentalia Sinica, 2007, 27(8): 1643-1649. (in Chinese)
[38] RAMANA R T V. NEETA B G, KHILANA K S. Effect of postharvest treatments and storage temperatures on the quality and shelf life ofsweet pepper (Capsicum annum L.). Scientia Horticulturae, 2011, 132(4): 18-26.
[39] BRUMMELL D A, CIN V D, Crisosto C H, LABAVITCH J M. Cell wall metabolism during maturation, ripening and senescence of peach fruit. Journal of Experimental Botany, 2004, 55: 2029-2039.
[40] 张海新, 及华. 果实成熟软化与相关的酶学研究. 食品科技, 2008(11): 57-60. ZHANG H X, JI H. The research on fruit ripening and softening and related enzymes. Food Science and Technology, 2008(11): 57-60. (in Chinese)
[41] SUNNY G G, SANDY V B, VERLINDEN B E, CHRISTIAENS S, SHPIGELMAN A, VICENT V, KERMANI Z J, NICOLAI B M, HENDRICKX M, GEERAERD A. Pectin modifications and the role of pectin-degrading enzymes during postharvest softening of Jonagold apples. Food Chemistry, 2014, 158: 283-291.
[42] WEI J M, MA F W, W SHI S G, QI X D, ZHU X Q, YUAN J W. Changes and the postharvest regulation in the activity and gene expression of enzymes related to cell wall degradation in ripening apple fruit. Postharvest Biology and Technology, 2010, 56(2): 147-154.
[43] BU J W, YU Y C, AISIKAER G, YING T J. Postharvest UV-C irradiation inhibits the production of ethylene and the activity of cell wall-degrading enzymes during softening of tomato (Lycopersicon esculentum L.) fruit. Postharvest Biology and Technology, 2013, 86: 337-345.
[44] 李灿英, 张丽华, 葛永红, 董柏余, 漆倩涯. 采后茉莉酸甲酯处理对桃果实青霉病及细胞壁降解酶的影响. 食品工业科技, 2015, 36(20): 326-330. LI C Y, ZHANG L H, GE Y H, DONG B Y, QI Q Y. Effect of jasmonic acid methylester treatment on blue mould and cell wall degrading enzymes activities in peach fruit. Science and Technology of Food Industry, 2015, 36(20): 326-330. (in Chinese)
[45] PRABHA T N, BHAGYALAKSHMI N. Carbohydrate metabolism in ripening banana fruit. Phytochemistry, 1998, 48: 915-920.
[46] BENNETT A B, LABAVITCHJ M. Ethylene and ripening-regulated expression andfunction of fruit cell wall modifying proteins. Plant Science, 2008, 175: 130-136.
[47] LASHBROOK C C, GONZALEZ-BOSCH C, Bennett A B. Two divergent endo-beta-1,4-glucanase genes exhibit over lapping expression in ripening fruit and abscising flowers. Plant Cell, 1994, 10: 1485-1493.
[48] SITRIT Y, BENT A B. Regulation of tomato fruit polygalacturonasem RNA accumulation by ethylene a re-examination. Plant Physiology, 1998, 116: 1145-1150.
(责任编辑 赵伶俐)
Effect of Preharvest Acetylsalicylic Acid Treatments on Ripening and Softening of Harvested Muskmelon Fruit
LIU YaoNa, WANG Yi, BI Yang, LI ShengE, JIANG Hong, ZHU Yan, WANG Bin
(College of Food Science and Engineering, Gansu Agricultural University, Lanzhou 730070)
【Objective】The experiment was conducted to study the effects of preharvest acetylsalicylic acid (ASA) sprayed for four times during fruit development on ripening and softening of muskmelon fruit (Cucumis melo cv. Agate) at harvest and during storage, and to explore softing mechanism caused by ASA treatments.【Method】The muskmelon, cultivar ‘Agate’, was used as material. The plants were sprayed with ASA at 1mmol·L-1for four times at young fruit period (2 weeks after flowering), enlarging period (3 wk after flowering), netting period (4 wk after flowering) and mature period (preharvest 48 h). The changes of physiological and biochemical parameters were determined on respiratory rate and ethylene production, firmness, cell wall component and cell wall-degrading enzymes activity of fruit at harvest and during storage (7℃, RH 55%-60%).【Result】Preharvest spray of ASA significantly decreased respiratory rate and ethylene production of muskmelon fruit at harvest, and delayed climecteric peak and ethylene peak for 1wk during storage. ASA treatments increased the firmness of fruit, the contents of propectin, cellulose,hemicellulose and hydroxyproline-rich glycoproteins (HRGPs) in fruit at harvest, retarded the conversion of propectin to water soluble pectins (WSP), maintained a higher level of cellulose, hemicellulose and HRGPs, kept firmness of fruit during storage. Preharvest spray of ASA noticeably decreased the activity of cell wall degrading enzymes in fruit at harvest and during storage, mainly inhibited the activity of pectin methylesterase (PME), polygalacturonase (PG), cellulase (Cx) and β-gluosidase (β-Glu). The correlation analysis indicated that there was a significant positive correlation between ethylene production and PG activity, respiratory rate and PG activity. And a very significant positive correlation between ethylene production and β-Glu activity, respiratory rate and β-Glu activity in treated fruit. There was a highly significant positive correlation between firmness and PME activity, propectin and hemicellulose content in treated fruit. Moreover, a significant positive correlation was found between firmness and Cx activity, and WSP content in treated fruit, and a significant negative correlation was also observed between firmness and ethylene production, and respiratory rate in treated fruit.【Conclusion】Preharvest ASA treatments promoted the synthesis of cell wall components during fruit development, significantly inhibited the respiratory rate and ethylene production, reduced the activity of cell wall degrading enzyme, such as PME, PG, Cx and β-Glu, prevented the release of cell wall components and maintained higher fruit firmness at harvest and during storage.
muskmelon fruit; preharvest sprays; acetylsalicylic acid; ripening; softening
2016-11-08;接受日期:2017-01-19
国家自然科学基金(31371869)、国家公益性行业(农业)科研专项(201303075)
联系方式:刘耀娜,Tel:18793114269;E-mail:1518082837@qq.com。通信作者毕阳,Tel:13119421362;E-mail:biyang@gsau.edu.cn

