发酵苹果渣多糖分离纯化、结构及其与加工特性的关系
贾丰,郭玉蓉,杨曦,刘冬,李洁
(陕西师范大学食品工程与营养科学学院,西安 710119)
发酵苹果渣多糖分离纯化、结构及其与加工特性的关系
贾丰,郭玉蓉,杨曦,刘冬,李洁
(陕西师范大学食品工程与营养科学学院,西安 710119)
【目的】在研究发酵苹果渣多糖分离纯化动态趋势的基础上,对其结构特性进行深入研究,进一步探究发酵苹果渣多糖分离纯化、活性及加工特性。【方法】以苹果原渣多糖(apple pomace polysaccharides,AP)、苹果酒渣多糖(wine fermented apple pomace polysaccharides,WFP)、苹果醋渣多糖(vinegar fermented apple pomace polysaccharides,VFP)为原料,对其含量进行分析,利用发酵苹果渣多糖不同组分间极性差异,采用DEAE-52纤维素,以NaCl溶液进行梯度洗脱,部分收集器进行逐管收集,苯酚硫酸法测定吸光值,制作洗脱曲线;同时,对DEAE-52纤维素层析所得组分利用去离子水经Sephadex G-200凝胶柱,根据一定分子量截留的特点进行进一步分离纯化,测定所得组分纯度后,对不同组分进行结构表征,主要包括X衍射仪(XRD)观察晶体结构、热重分析仪进行热重分析(TG)、激光粒度仪对溶液粒度进行分析(LPSA)、同时通过刚果红试验探究其是否具有三螺旋结构,运用台式扫面电镜进行微观结构分析。【结果】粗多糖含量达到70%左右,同时不含蛋白质、核酸,提取效率较高;AP在0.1和0.2 mol·L-1NaCl洗脱液浓度下经DEAE-52纤维素层析、Sephadex G-200凝胶层析可得NAP0.1、NAP0.2;WFP在0.0、0.1和0.2 mol·L-1NaCl浓度洗脱下可得NWFP0、NWFP0.1、NWFP0.2,VFP可得NVFP0、NVFP0.1、NVFP0.2,以上所得成分含量均达到92%以上,分离纯化效果良好;3种多糖分离纯化前后皆为非晶态物质,呈无定型结构;多糖溶液浓缩过程温度应低于65℃,在加工中应注意控制温度在150℃以内;分离纯化前,3种多糖都存在三螺旋结构,分离纯化后,组分NWFP0、NVFP0、NVFP0.1出现了三螺旋结构,AP经分离纯化无三螺旋结构成分出现;苹果渣多糖在分离纯化后更加稳定,粒径差异更小,主要表现在经分离纯化后多糖的粒径分散系数更小;分离纯化导致片状结构变小,交联作用减弱,能更好发挥其生物活性。【结论】发酵苹果渣多糖含量达70%,经分离纯化后的含量与AP均可达92%;由XRD、TG、LPSA、刚果红、微观结构等方面得出其在溶解度、黏度、物理性质等方面的改变有利于更好发挥生物活性,同时获得更好的加工特性。
发酵;苹果渣;多糖;分离纯化;结构表征;加工特性
0 引言
【研究意义】植物多糖一直是研究热点,因其特有的生物活性、加工特性为研究者所青睐[1],苹果多糖是植物多糖的一种,且苹果是大众消费最多的水果之一[2]。苹果渣利用常集中在饲料,常常造成极大浪费。对发酵苹果渣多糖进行分离纯化、结构表征研究,对指导苹果渣的利用具有重要指导意义。【前人研究进展】在目前的研究中,马文杰[3]、苏钰琦[4]、张丽萍[5]、付成程[2]、李锦运[6]等对苹果多糖的制备、脱色、提取工艺优化以及分离纯化进行了研究;李倩[7]、孙阳[1]、杨素[8]、张典[9]、李洁[10]等在苹果多糖的生物活性、加工特性以及结构表征等方面进行了研究;LIU[11]、LI[12-14]、YANG[15]、ZHANG[16]、QIAN[17]、DOU[18]、LI[19]、WANG[20]、NG[21]、GALVEZ-LOPEZ[22]等在苹果多糖生物活性与结构、分离纯化与功能特性方面进行了研究。【本研究切入点】尽管国内外对于苹果(渣)多糖进行了深入的研究,但对于发酵苹果渣多糖的分离纯化、结构表征尚未进行。因此,对于发酵苹果渣多糖进行进一步研究显得尤为重要。【拟解决的关键问题】通过对发酵苹果渣粗多糖进行分离纯化、结构表征,来解释结构与活性、加工特性之间的关系,为发酵苹果渣多糖的应用提供理论保证。
1 材料与方法
试验于 2015—2016年在陕西师范大学食品工程与营养科学学院进行。
1.1 材料与试剂
苹果(秦冠)原渣,2015年4月陕西蓝海果业有限公司苹果酒加工副产物原渣;苹果酒渣,苹果原渣接种安琪酵母DV10,常温固态发酵20 d;苹果醋渣,苹果原渣经陕西咸阳三原甘露池醋厂酿醋工艺(添加 5%左右蔗糖,3—5 d安琪酵母固态发酵,6—15 d 醋酸菌固态发酵,室温发酵)获得醋渣;3种苹果渣于50℃烘干,破碎,过40目筛,经超声辅助热水浸提法提粗取多糖成分,经透析,干燥得苹果原渣多糖(AP)、酒渣多糖(WFP)、醋渣打多糖(VFP),待用。2015年9月至2016年4月进行分离纯化;2016年3—5月进行结构研究。氢氧化钠、盐酸、硫酸、苯酚、刚果红等药品均为分析纯;Cellulose DE-52 Whatman,北京索莱宝科技有限公司;Sephadex G-200,Pharmacia公司。
1.2 仪器与设备
Multiskan Go全波长酶标仪,美国热电公司;TM3030台式扫描电子显微镜,日立公司;LGJ-18C真空冷冻干燥机,北京四环科学仪器厂;层析柱BOMEX,内径2、5 cm各一套;DHL-A 电脑数显恒流泵,上海沪西分析仪器厂有限公司;BS-100A 自动部分收集器,上海沪西分析仪器厂有限公司;Q1000DSC+LNCS+FACS Q600SDT热分析系统,美国TA公司;BI-90Plus 激光粒度仪,美国布鲁克海文仪器公司;DX-2700 X射线衍射仪,丹东浩元仪器有限公司;TU-1810 紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.3 试验方法
1.3.1 发酵苹果渣多糖纯度测定
1.3.1.1 紫外扫描纯度鉴定分析 参照李洁等[10]的方法,200—400 nm紫外光谱扫描,以检测样品蛋白质和核酸是否除尽。
1.3.1.2 发酵苹果渣多糖含糖量测定 参照李洁等的[10]方法,利用苯酚硫酸法测定含糖量。
1.3.2 发酵苹果渣多糖分离纯化
1.3.2.1 DE-52纤维素柱处理
(1)DEAE-52纤维素首次处理 将100 g DE-52纤维素用去离子水冲洗2—3次,去除杂质,浸泡24 h,待用[23]。
(2)DEAE-52纤维素装柱预(再生)处理 分别配制0.5 mol·L-1NaOH、HCl溶液;用300 mL NaOH溶液浸泡30 min后用蒸馏水迅速洗至中性,抽干;然后用300 mL HCl溶液浸泡30 min同样洗至中性,抽干;再用300 mL NaOH溶液浸泡30 min,洗至中性,抽干,待用[23]。
(3)DEAE-52纤维素装柱平衡 将1.3.2.1(1)处理样装入抽滤瓶,用塞子密封,抽气至无气泡,装柱,填料体积为柱体积的3/4,平衡12 h,待用[23]。
1.3.2.2 G-200凝胶柱处理
(1)G-200凝胶柱首次处理 称取20 g Sephadex G-200,按1.3.2.1⑴操作。
(2)G-200凝胶装柱预(再生)处理 用去离子水冲洗3—5次,每次浸泡30 min,去除杂质与漂浮物,抽干,待用[23]。
(3)G-200凝胶装柱平衡 按1.3.2.1(3)操作。
1.3.2.3 发酵苹果渣多糖样品的获得
(1)DEAE-52纤维素柱发酵苹果渣多糖样品的获得方法 称取粗多糖样品0.3 g溶于10 mL去离子水中,缓慢加入 DEAE-52纤维素柱,以 0.00—0.30 mol·L-1NaCl溶液进行梯度洗脱,流速1.0 mL·min-1,部分收集器每管收集8 min,苯酚硫酸法测定吸光值,制作洗脱曲线[23]。
(2)Sephadex G-200柱发酵苹果渣多糖样品的获得方法 称取1.3.2.3(1)多糖样品0.03 g溶于5 mL去离子水,缓慢加入Sephadex G-200柱,去离子水为洗脱液,流速0.5 mL·min-1,部分收集器每管收集10 min,苯酚硫酸法测定吸光值,制作洗脱曲线[23]。
1.3.2.4 发酵多糖分离纯化组分纯度测定 参考窦姣等[23]方法测定分离纯化组分纯度。
1.3.3 发酵苹果渣多糖结构表征
1.3.3.1 发酵苹果渣多糖XRD分析 参照王小梅等[24]方法采用X射线衍射仪,条件为:Cukα辐射,管压40 kV,管电流60 mA,角度5—50°,角度梯度0.02°进行样品测定。
1.3.3.2 发酵苹果渣多糖热重分析 参照马青等[25]的方法,在温度范围20—800℃,升温速度10℃·min-1,扫描速度2 ℃·min-1,利用热分析系统对样品分析。
1.3.3.3 发酵苹果渣多糖刚果红试验分析 参照王小梅等[24]方法利用紫外可见分光光度计在波长范围 400—600 nm 进行扫描,以刚果红为对照,以氢氧化钠浓度为横轴,测定该氢氧化钠浓度下最大波长,以此为纵轴,作图。
1.3.3.4 发酵苹果渣多糖溶液粒度分析 参照王小梅等[24]方法配制20 mg·L-1多糖溶液,25℃,633 nm处用激光粒度仪检测粒度分布情况。
1.3.3.5 发酵苹果渣多糖微观结构分析 采用TM3030台式扫描电子显微镜在电压为15 kV的条件下观察发酵苹果渣多糖样品的形貌特征[26]。
1.4 数据分析与处理
空间自相关是指在具有差异性的空间区位商的地理现象,它们的某个特征值存在统计关联性,空间自相关可分为全局空间自相关和局域空间自相关[8]。基于Geoda软件计算出沈阳448个小区房价的莫兰指数I,通过莫兰指数I来判断不同空间区位的小区房价在空间方面是否具有空间关联性。
DPS v7.05统计软件进行统计分析,Excel 2010、Origin 8.0软件绘图制表。
2 结果
2.1 发酵苹果渣多糖的鉴定结果
2.1.1 发酵苹果渣多糖纯度鉴定
如图1,3种多糖在260、280 nm无明显紫外吸收,而蛋白质、核酸分别在280、260 nm处具有特征吸收峰,同时3种多糖在200 nm有多糖的特征吸收峰,说明3种粗多糖的核酸和蛋白质已除尽[27]。
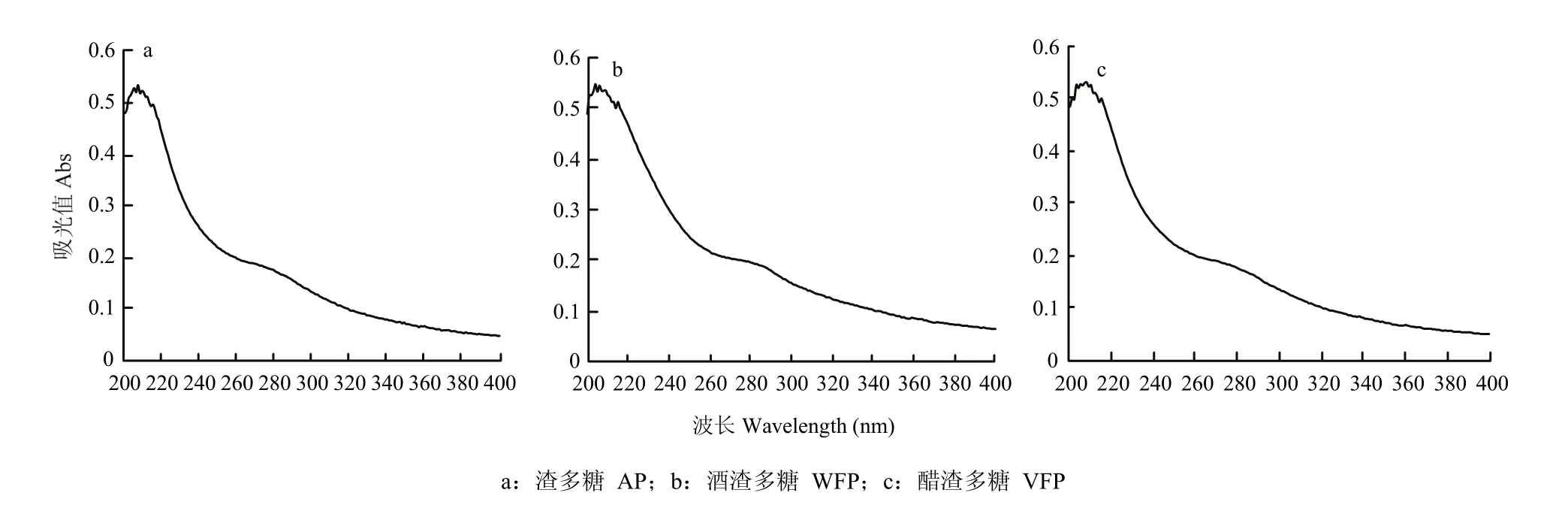
图1 多糖的紫外光谱图Fig. 1 UV spectra of polysaccharides
2.1.2 发酵苹果渣多糖含糖量测定 葡萄糖标准曲线为Y=3.6319X+0.0014,可计算苹果原渣多糖(AP)、酒渣多糖(WFP)和醋渣多糖(VFP)含糖量,分别为70.17%、69.67%、71.34%,不存在显著性差异,可见提取工艺所得多糖含糖量基本维持在70%左右,提取工艺具有可重复性[23]。
2.2 发酵苹果渣多糖分离纯化结果
2.2.1 DEAE-52纤维素处理对发酵苹果渣多糖成分的影响 AP、WFP、VFP经DEAE-52纤维素柱根据多糖极性大小进行分离纯化,由图2-a可知AP经NaCl浓度梯度洗脱可得5种组分,其中以AP0.1、AP0.15、AP0.2较多,且 AP0.15>AP0.2>AP0.1,但水未能将AP分离开;由图2-b可知,WFP经NaCl浓度梯度洗脱可得6种组分,其中以WFP0、WFP0.1、WFP0.15较多,且WFP0.15>WFP0.1>WFP0;图2-c可知VFP 经NaCl浓度梯度洗脱可得6种组分,其中以VFP0、VFP0.1、VFP0.15、VFP0.2较多,且VFP0.15>VFP0.1>VFP0.2>VFP0。
2.2.2 G-200凝胶处理对发酵苹果渣多糖成分的影响2.2.2.1 样品前处理 根据DEAE-52纤维素柱层析处理结果,将AP0.05与AP0.10记为DAP0.1,AP0.15 与AP0.20记为DAP0.2;同样WFP可记为DWFP0(水洗脱组分)、DWFP0.1、DWFP0.2;VFP记为DVFP0、DVFP0.1、DVFP0.2。
2.2.2.2 G-200凝胶处理对 AP 的影响 DAP0.1、
DAP0.2经 G-200凝胶柱根据分子量筛选达到分离纯化的目的,可得NAP0.1、NAP0.2。由图3可以看出两种组分均得到单一的峰,且峰型基本一致,可见经Sephadex G-200柱层析后得到均一的多糖成分[23]。
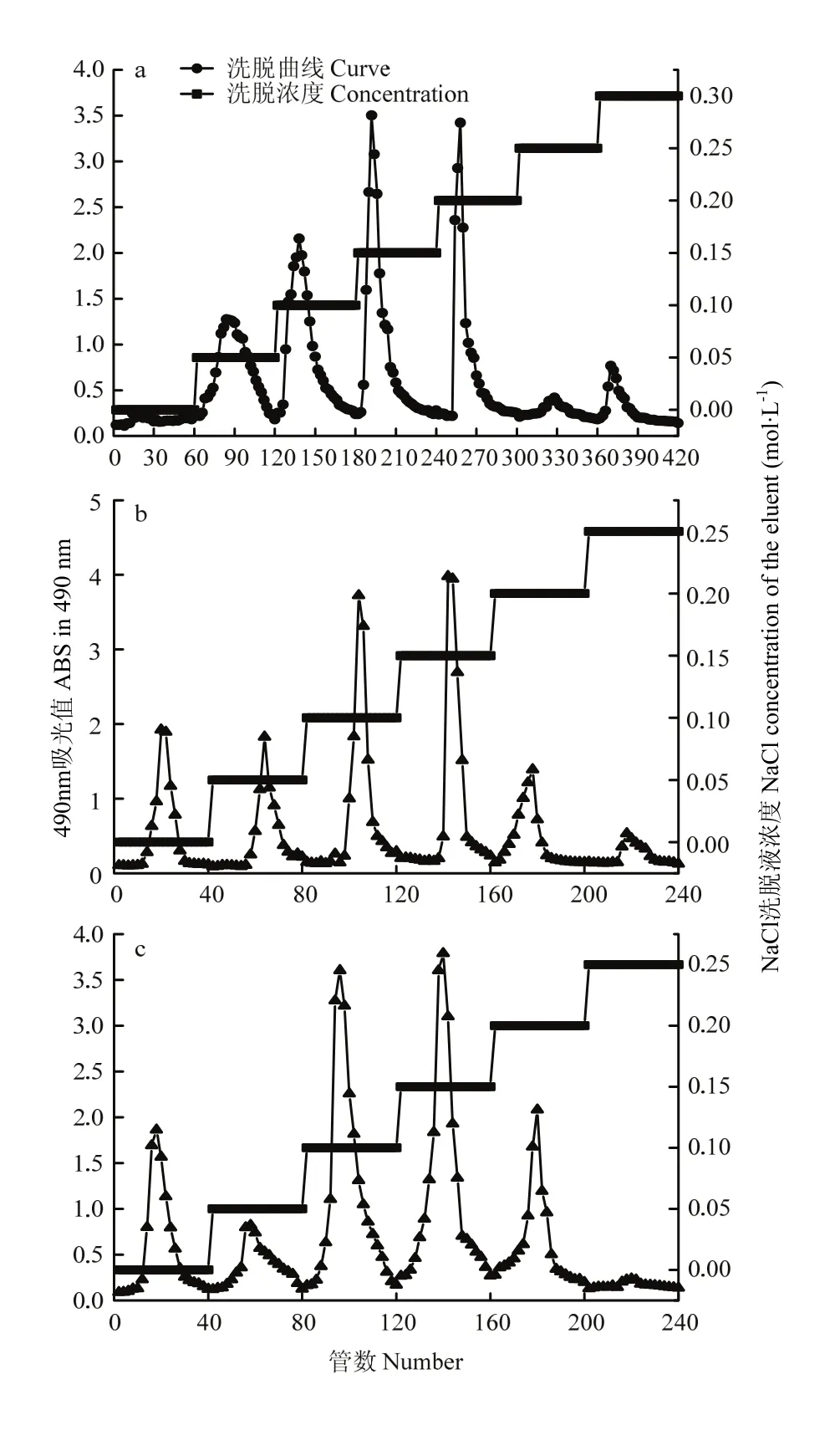
图2 DEAE-52纤维素NaCl溶液梯度洗脱曲线Fig. 2 NaCl gradient elution curve with DEAE-52 cellulose column
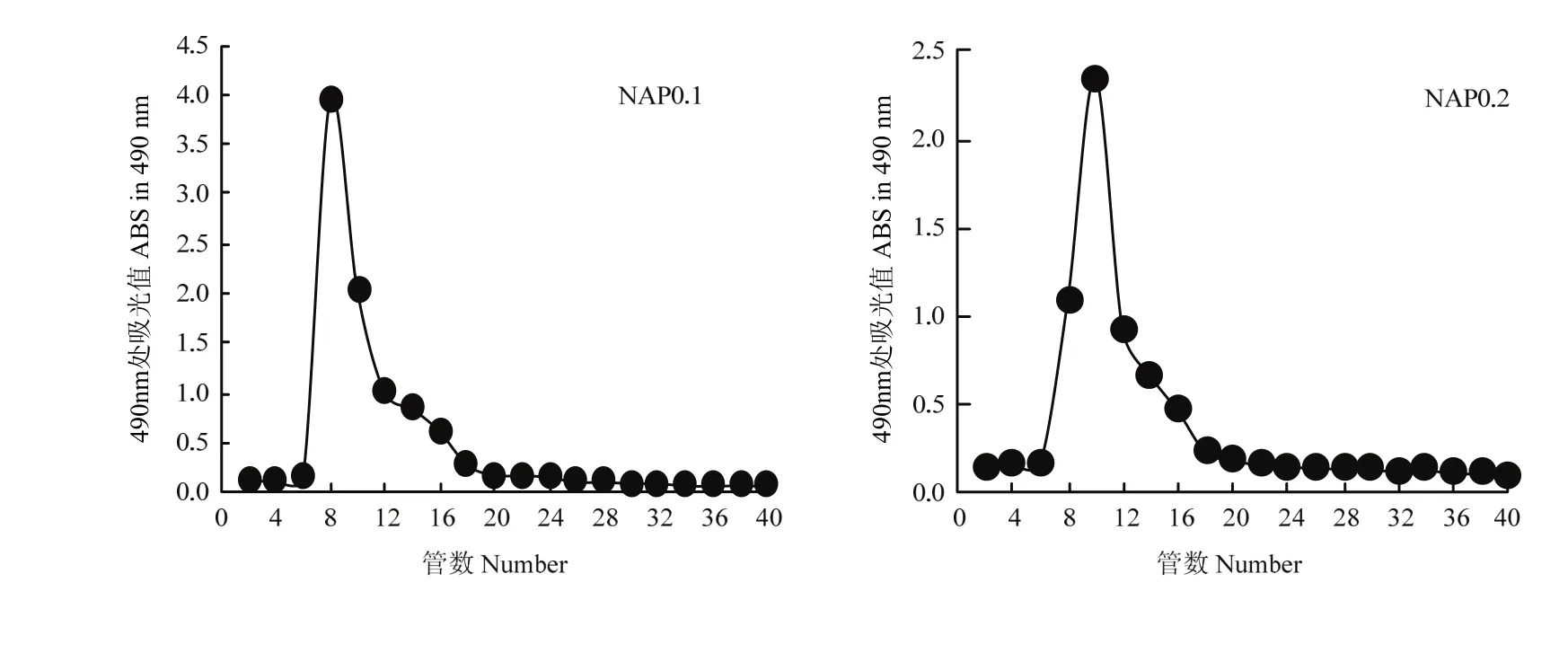
图3 AP Sephadex G-150洗脱曲线Fig. 3 Elution curve of AP on Sephadex G-150 column
2.2.2.3 G-200凝胶处理对WFP 的影响 DWFP0、DWFP0.1、DWFP0.2经去离子水G-200凝胶柱层析,得到NWFP0、NWFP0.1、NWFP0.2。由图4可以看出经Sephadex G-200层析得到均一的多糖成分[23]。
2.2.2.4 G-200凝胶处理对 VFP 的影响 DVFP0、DVFP0.1、DVFP0.2经 Sephadex G-200层析,得到NVFP0、NVFP0.1、NVFP0.2。由图5可以看出得到了分子量在一定范围的均一纯品[23]。

图4 WFP Sephadex G-150洗脱曲线Fig. 4 Elution curve of WFP on Sephadex G-150 column
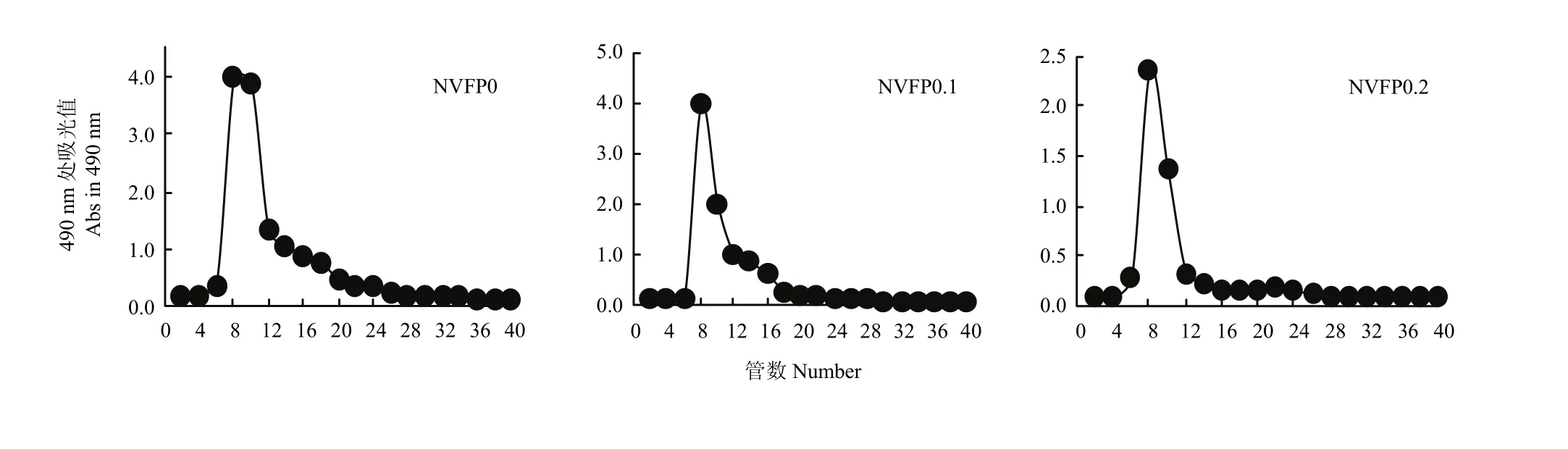
图5 VFP Sephadex G-150洗脱曲线Fig. 5 Elution curve of VFP on Sephadex G-150 column
2.3 发酵苹果渣多糖结构表征
2.3.1 发酵苹果渣多糖XRD结果 XRD是利用X衍射原理来对样品晶体结构进行研究的一种方法,可精确进行物相分析以及定性、定量[24]。3种多糖分离纯化前后XRD如图6-a、b、c,可见分离纯化前后晶体结构变化并不明显。根据晶体衍射布拉格公式2dsinθ=nλ可知当n=1,λ=1.54Å时,由图6可知θ计算晶格间距d,同时可知衍射最大峰值CPSmax,如表1。
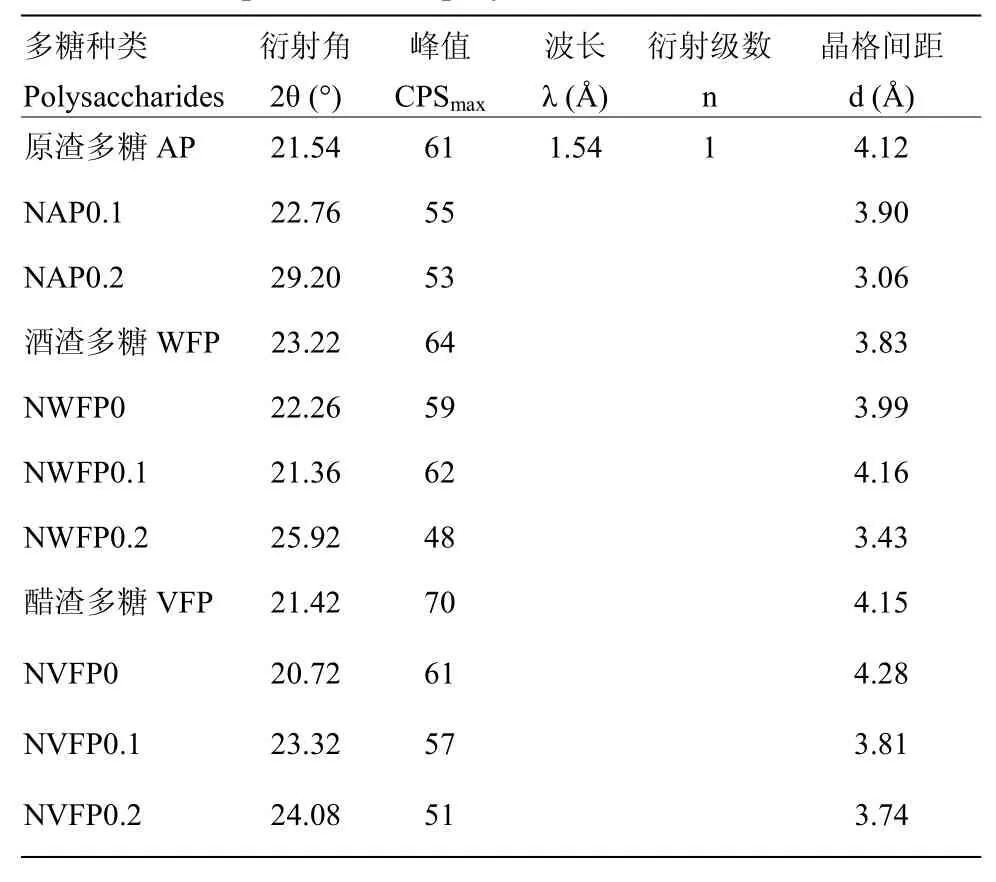
表1 XRD参数汇总表Table 1 The parameter of polysaccharides with XRD
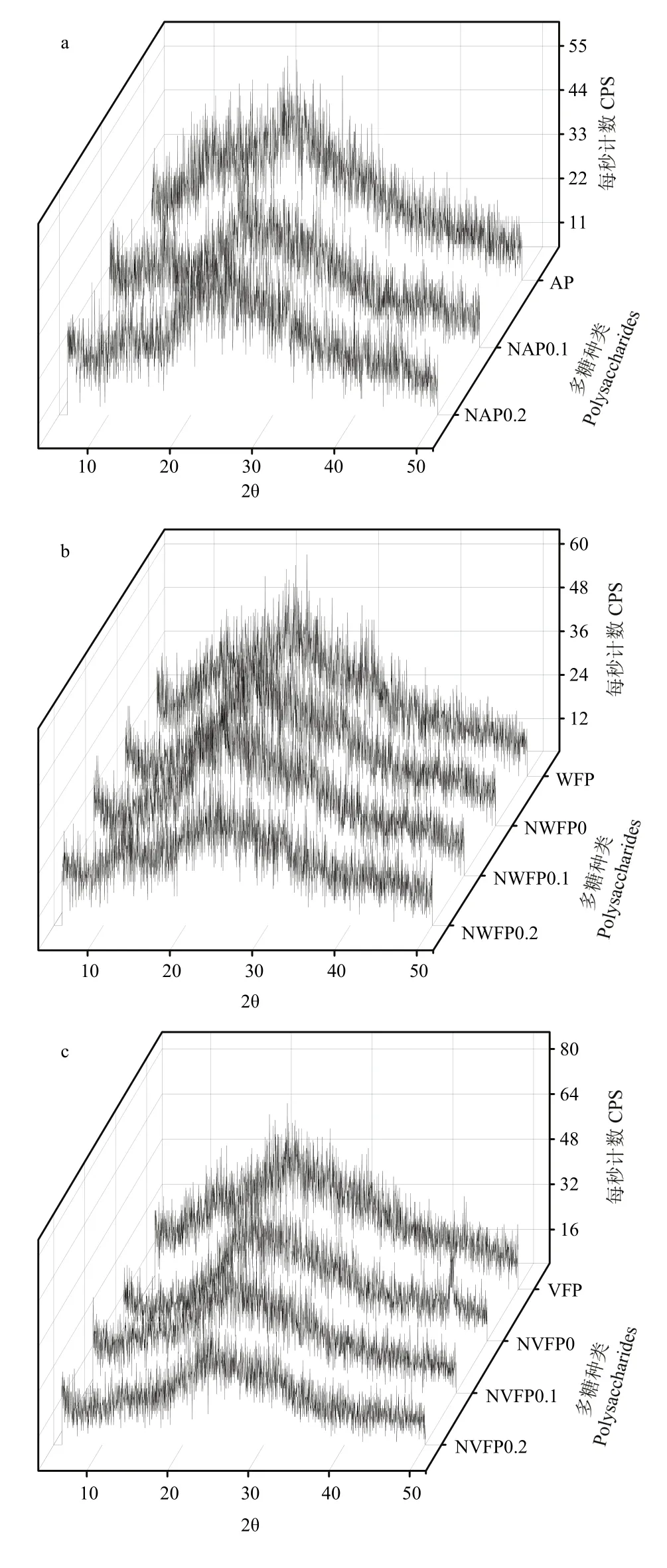
图 6 原渣多糖(a)、酒渣多糖(b)、醋渣多糖(c)分离纯化前后XRD对比Fig. 6 Comparison of AP and NAP0.1, NAP0.2 with XRD (a), comparison of WFP and NWFP0, NWFP0.1, NWFP0.2 with XRD (b), comparison of VFP and NVFP0, NVFP0.1, NVFP0.2 with XRD (c)
结合前人[28-29]研究可知,3种多糖分离纯化前后衍射角2θ在5—50°都有衍射峰,且在分离纯化后衍射峰值有减小趋势,即分离纯化不利于3种多糖晶体结构的形成。
2.3.2 发酵苹果渣多糖热重分析结果 热重分析研究物质的晶体性质,如熔化、蒸发、升华和吸附等物质的物理现象及其热稳定性、分解过程、脱水以及相关定量分析[30]。如图7-a、b、c,AP在30.06℃左右质量开始下降,说明样品中还有一定的自由水分,30.06—80℃重量损失较快,即80℃左右自由水分损失完全;80——230℃质量损失减缓,根据已有研究判断是结合水损失阶段;230℃以后质量损失速率达到最大,即230℃为AP的分解点温度,重量半损失温度为275℃,800℃重量损失85%。同样方法可对其余成分进行分析,可知经分离纯化处理发酵的多糖与AP所得成分有一定的差异,但区别不明显。由表2可知,主要可以通过自由水损失温度、结合水损失温度、样品分解温度、半重损失温度、末重损失率来分析晶体特性,对于失重初温度只可作为参考值,因为试验中每次加入样品量难以达到统一,会直接影响到失重初温度,而其余指标则基本不受添加量影响。
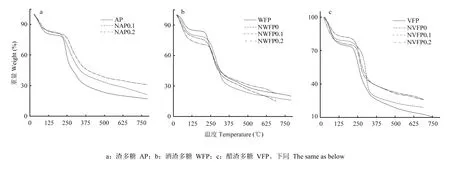
图7 不同多糖热重分析对比Fig. 7 Comparison of TG of different polysaccharides
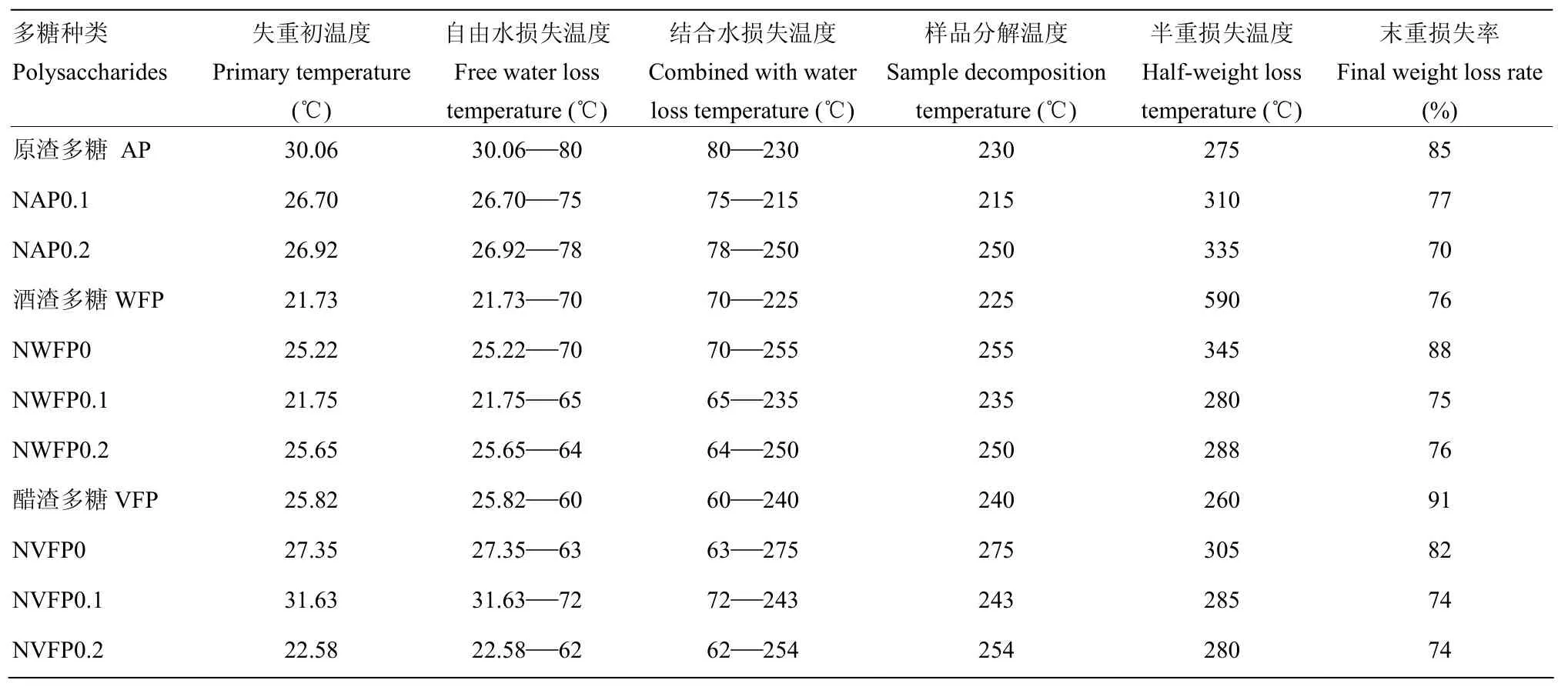
表2 热重分析结果Table 2 TG results
2.3.3 发酵苹果渣多糖刚果红检测 刚果红试验是检验多糖是否具有螺旋结构的重要方法[24]。结合已有研究[31],刚果红与3种多糖溶液混合时,溶液最大吸光值发生了明显红移,随着 NaOH浓度由0—0.5 mol·L-1,AP出现了亚稳区,结合最大吸收波长减小等特征可知存在三螺旋结构,但随着 NaOH浓度由 0—0.5 mol·L-1,纯化所得两种组分并未出现亚稳区,因此,多糖在分离纯化后并不存在三螺旋结构(图8-a);如图8-b所示,当刚果红与4种多糖溶液混合时溶液最大吸光值发生了明显红移,但随着NaOH浓度由0—0.5 mol·L-1,WFP、NWFP0出现亚稳区、最大吸收波长减小,因此WFP、NWFP0存在三螺旋结构;如图8-c所示,同样可知VFP、NVFP0、NVFP0.1存在三螺旋结构。
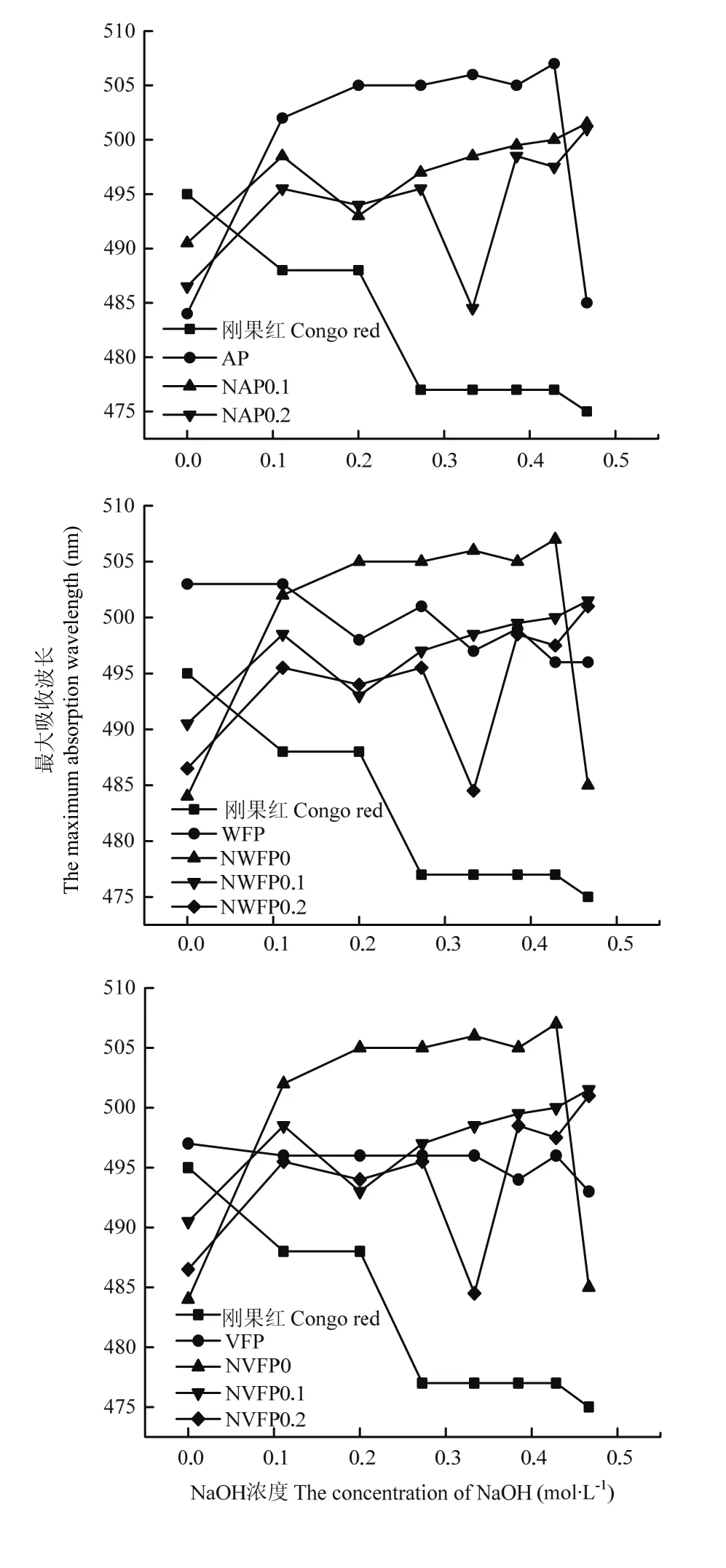
图8 纯化原渣多糖(a)、酒渣多糖(b)、醋渣多糖(c)刚果红试验对比Fig. 8 Comparison of NAP0.1, NAP0.2 (a), NWFP0, NWFP0.1, NWFP0.2 (b), NVFP0, NVFP0.1, NVFP0.2 (c) with Congo red experiments
2.3.4 发酵苹果渣多糖溶液粒度测定 多糖粒度大小与分子量、生物活性等密切联系,越来越受到研究者的重视[24]。由表3知,AP由于分子量较大,为1 025.12 nm,分离纯化后粒径显著减小(P<0.05),减小到692.45 nm,且根据不同极性分离的多糖组分表现出极性越大、粒径越大的特点,可见当极性达到最大时,组分粒径大于AP;对于发酵多糖,由于分子量小、粒径小,经DE-52纤维素和Sephadex G-200处理,加上透析对于分子量选择作用,将小分子多糖或单糖丢失,造成粒径在分离纯化过程有所增加,但无显著性差异;WFP粒径为392.98 nm,经分离纯化粒径为449.07—691.16 nm;VFP粒径为553.69 nm,经分离纯化处理粒径无明显差异[32]。
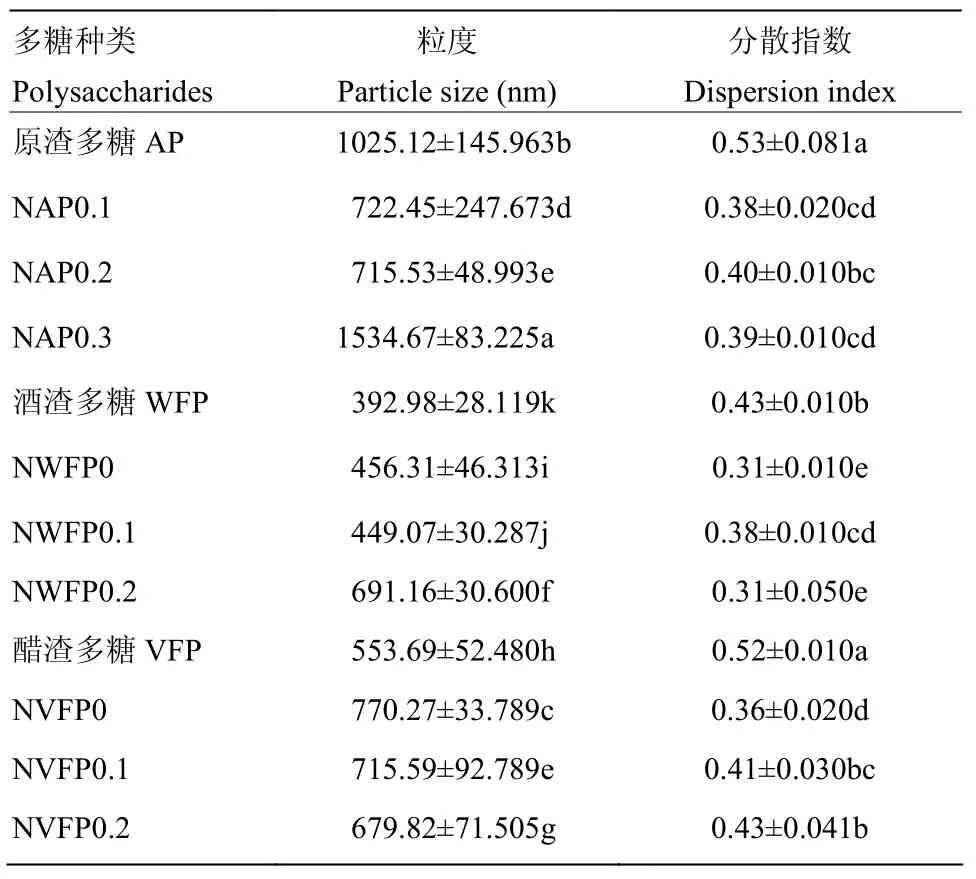
表3 不同多糖粒度对比Table 3 Comparison of different particle sizes of polysaccharides
2.3.5 发酵苹果渣多糖微观结构 台式扫描电镜(DSEM)可广泛应用于材料科学、纳米颗粒、生物医学、食品药品等诸多领域[33]。如图9,AP为片状、条状,同时有片状出现弯曲现象,片状之间存在一定的交联,组合连接紧密,片状结构大,形成网状结构;NAP0.1、NAP0.2在DEAE-52纤维素与G-200凝胶层析作用下片状明显减小,NAP0.1主要是小块片状,且交联作用弱化,组织连接相对松散,不存在网状结构;NAP0.2主要是小块片状与颗粒(球)状,交联作用进一步弱化。此外,经DEAE-52纤维素与G-200凝胶层析作用,由AP、NAP0.1、NAP0.2可以看出三者可塑性越来越大,从另一方面证明交联作用减弱,更加分散。
如图10,WFP电镜观察为片状、锯齿状,结构间连接紧密,有一定交联作用;经DEAE-52纤维素与G-200凝胶层析作用,NWFP0,NWFP0.1,NWFP0.2片状结构变小,与AP结果基本一致,可能是分离纯化过程破坏分子间作用力、氢键等作用,同时齿状结构消失,这与填料的筛分作用有关。此外,随着极性增大,片状结构依次减小,交联作用减弱,NWFP0.1、 NWFP0.2出现了杆状、颗粒状结构[24]。
VFP电镜观察为片状,结构间连接紧密,有一定交联作用,但与AP、WFP相比,依次减弱(图11);经DEAE-52纤维素与G-200凝胶层析作用,NVFP0、NVFP0.1、NVFP0.2片状结构变小,NVFP0出现孔状、球形结构,NVFP0.1出现棒状结构[24]。
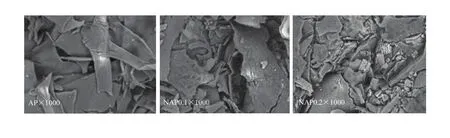
图9 苹果原渣多糖分离纯化前后台式扫描电镜对比(×1000)Fig. 9 Comparison of AP and NAP0.1, NAP0.2 with DSEM
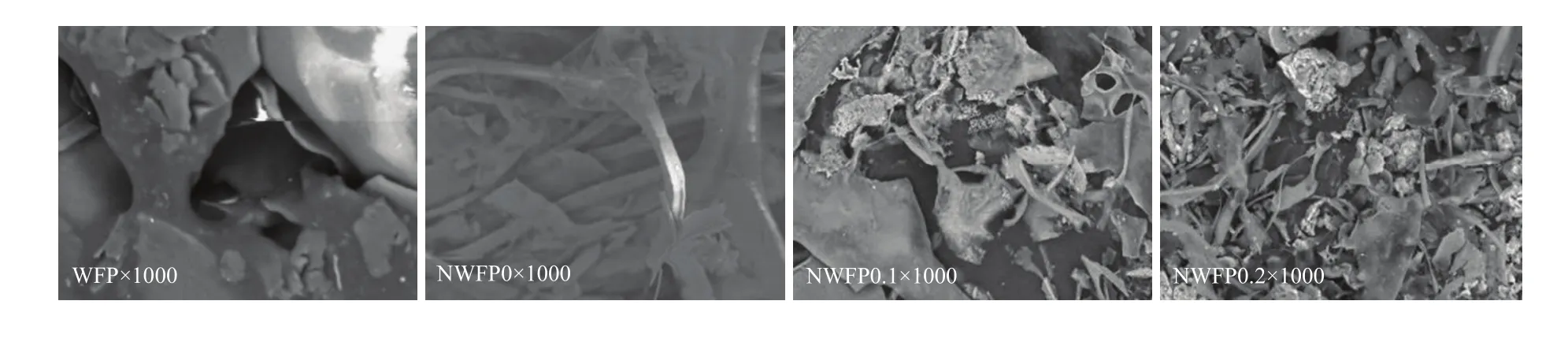
图10 苹果酒渣多糖分离纯化前后台式扫描电镜对比(×1000)Fig. 10 Comparison of WFP and NWFP0, NWFP0.1, NWFP0.2 with DSEM

图11 苹果醋渣多糖分离纯化前后台式扫描电镜对比(×1000)Fig. 11 Comparison of VFP and NVFP0, NVFP0.1, NVFP0.2 with DSEM
3 讨论
3.1 发酵苹果渣多糖分离纯化
AP、WFP、VFP提取率在70%左右,且经提取工艺处理后无核酸、蛋白质特征吸收峰,结果与窦姣[23]等研究相同。AP和发酵粗多糖经DEAE-52纤维素、Sephadex G-200层析筛选出均一的纯品多糖,总糖含量在92%—95%,分离纯化效果明显[23-24]。
经DE-52纤维素梯度洗脱发酵苹果渣多糖的极性减弱,原因是微生物作用下多糖分子链打开,分子量减小,此结果与前期研究[34]发酵对苹果渣多糖溶解度、黏均分子量影响结果一致。根据王兆梅[35]、王晓娟[36]、戴伟[37]等研究结果,多糖的生物活性与分子量、黏度、溶解度等密切相关,即高溶解度是多糖发挥生物活性的前提,同时多糖黏度的大小直接影响其活性与加工特性,发酵苹果渣多糖在溶解度方面的提升、黏度的减小都有利于更好的发挥抗癌、抗病毒等方面的生物活性,也有利于食品加工[35-37]。DEAE-52纤维素柱层析过程中极性越大的成分其分子量越大,经G-200凝胶柱层析部分大分子多糖在筛分作用下未能流出,导致分子量大的组分停留在固定相中,最终表现在峰高有所减小,与发酵苹果渣多糖加工特性研究一致[25,34]。此外,发酵苹果渣多糖分离纯化各组分峰高区别不大的原因是酿醋过程不但包括酒精发酵还包括醋酸发酵,相对于酒渣发酵过程,醋渣具有周期长、菌种繁杂等特点,导致多糖分子经菌种利用后分子链破坏,分子量减小,经G-200凝胶柱层析作用大部分组分流出,峰高较大[23-24]。此外,分子量的大小直接影响多糖的生物活性与加工特性[25,35-37],多糖分子量的减小对增加生物活性意义重大[36]。
经分离纯化片状结构变小,交联作用减弱,导致多糖表观黏度减小、溶解度增大,同时吸油性、吸水性等性质发生相应变化,与先前有关发酵苹果渣多糖加工特性研究中物性、流变性等加工特性变化一致[34]。此外,交联性减弱可能与 DEAE-52纤维素与 G-200凝胶层析作用有关,分离纯化过程导致分子间作用力、氢键等作用减弱[23]。
3.2 发酵苹果渣多糖结构表征
多糖在生物功能方面一直为多国研究者所青睐,但由于多糖结构复杂仍处于研究初期,需要更多深入的研究将多糖结构与其生物活性之间的关系进行进一步阐释[35-36]。根据已有研究,除纤维素、淀粉外其余多糖皆为非晶态物质,结合吕峰[28]的研究,由于衍射峰强度较小,3种多糖分离纯化前后皆为非晶态物质,呈无定型结构[23-24]。由表3知多糖加热温度不宜超过65℃,因此,多糖溶液浓缩温度应小于65℃;多糖样品在200℃会发生分解,在加工过程要注意温度控制,避免影响多糖性质;由末重损失率可以看出多糖在高温条件下不是很稳定,会发生分解,加工中应注意控制温度在 150℃以内较好[23-24],这将为发酵苹果渣多糖加工与应用提供借鉴与理论支撑。
根据刚果红试验可知粗多糖都存在三螺旋结构,经发酵处理,组分NWFP0、NVFP0、NVFP0.1存在三螺旋结构,AP经分离纯化无三螺旋结构成分,说明极性小的多糖组分可能含有三螺旋结构,这对于其生物活性也具有重大意义[35-37]。
苹果渣多糖分离纯化后更加稳定,粒径差异更小,经分离纯化后多糖的粒径分散系数更小,说明分离纯化效果明显,原因是在DEAE-52纤维素与G-200凝胶层析作用下破坏了分子间的交联作用,或破坏了氢键、范德华力等作用[24];随着极性变化导致聚集状态有所变化,最终结构出现变化,导致相关物性、流变学发生相应变化,与之前在物性与流变学等加工特性方面的研究结果一致[34]。
4 结论
发酵苹果渣多糖纯度达70%,经分离纯化后可得组分NAP0.1、NAP0.2、NWFP0、NWFP0.1、NWFP0.2、NVFP0、NVFP0.1、NVFP0.2,纯度均达 92%以上。在结构研究中,由X衍射仪观察、热重、粒度、刚果红、微观结构等方面得出其在溶解度、黏度、物理性质等方面的改变有利于更好地发挥生物活性。另外,发酵多糖溶液浓缩温度应小于65℃,加工温度应小于150℃,发酵多糖在溶解度、黏度、物理性质等方面的改变也可获得更好的加工特性。
[1] 孙阳. 结肠炎癌变过程中 MUC1粘蛋白的变化及苹果多糖对MUC1的影响[D]. 西安: 陕西中医学院, 2013. SUN Y. Changes of MUC1 mucin during the colitis carcinogenesis and influence of apple polysaccharide on MUC1 Mucin [D]. Xi’an: College of Shaanxi Chinese Medcine, 2013. (in Chinese)
[2] 付成程, 郭玉蓉, 刘艳芳, 李景景, 李冰, 符恒. 苹果多糖的制备方法及防癌功能研究进展. 农产品加工·学刊, 2012(2): 100-102. FU C C, GUO Y R, LIU Y F, LI J J, LI B, FU H. Apple polysaccharides preparation methods and the research progress of cancer prevention function. Academic Periodical of FarmProducts Processing , 2012(2):100-102. (in Chinese)
[3] 马文杰, 郭玉蓉, 魏决. 应用二次回归旋转正交组合设计提取水溶性苹果多糖的工艺研究. 食品科学, 2009, 30(20): 105-108. MA W J, GUO Y R, WEI J. Optimization of water-soluble apple polysaccharides extraction using quadratic orthogonal combination design. Food Science, 2009, 30(20): 105-108. (in Chinese)
[4] 苏钰琦, 马惠玲, 罗耀红, 左莹. 苹果多糖提取的优化工艺研究.食品工业科技, 2008(5): 198-201. SU Y Q, MA H L, LUO Y H, ZUO Y. Optimization of extractionprocess of maluspumila polysaccharides from apple pomace. Journal of Food Industry Science and Technology, 2008(5): 198-201. (in Chinese)
[5] 张丽萍, 盛义保, 马惠玲, 左莹. 苹果多糖除杂脱色工艺的筛选.西北林学院学报, 2007, 22(1): 141-144. ZHANG L P, SHENG Y B, MA H L, ZUO Y. Deprotein and depigment of maluspumila polysaccharides from apple pomace. Northwest Forestry University, 2007, 22(1): 141-144. (in Chinese)
[6] 李锦运, 郭玉蓉, 董守利, 段亮亮, 仇农学, 牛鹏飞. 冷破碎苹果皮渣中多糖提取工艺优化及除杂方法研究. 食品工业科技, 2011, 32(7): 274-277. LI J Y, GUO Y R, DONG S L, DUAN L L, QIU N X, NIU P F. Study on optimization of extraction process and deprotein,depigment of polysaccharides from apple cold-break peel pomace. Food Science and Technology, 2011, 32(7): 274-277. (in Chinese).
[7] 李倩, 郭振军, 李宇华, 伍焕杰, 孙阳, 邓雅婷, 张敏, 刘莉. HPLC检测肠灌流模型中 PMP 衍生化葡寡糖含量的方法学建立. 现代生物医学进展, 2010, 22(12): 2201-2204. LI Q, GUO Z J, LI Y H, WU H J, SUN Y, DENG Y T, ZHANG M, LIU L. HPLC detection of intestinal perfusion model PMP derivatizedglucosamine oligosaccharide content established methodology. Progress in Modern Biomedicine, 2010, 22(12): 2201-2204.(in Chinese)
[8] 杨素. 苹果中多糖和黄酮类化合物肝损伤保护作用的药理活性研究[D]. 西安: 陕西师范大学, 2013. YANG S. Pharmacological activities of polysaccharides and apple flavonoids liver injury in rats [D]. Xi’an: Shaanxi Normal University, 2013. (in Chinese)
[9] 张典, 王粉侠, 弥曼, 孙阳, 李宇华, 樊磊, 刘莉, 梅其炳. 苹果多糖预防小鼠结肠炎癌变的作用及其机制研究. 中国药学杂志, 2015, 50(17): 1527-1531. ZHANG D, WANG F X, MI M, SUN Y, LI Y H, FAN L, LIU L, MEI Q B. Prevention of apple polysaccharide colitis carcinogenesis in mice and its mechanism. Chinese Pharmaceutical Journal, 2015, 50(17): 1527-1531. (in Chinese)
[10] 李洁, 郭玉蓉, 窦姣. 4种方法提取苹果肉渣果胶的流变学特性研究. 食品工业科技, 2015, 36(12): 109-112. LI J, GUO Y R, DOU J. Rheological properties of apple flesh pomace pectins extracted by four methods. Journal of Food Industry Science and Technology, 2015, 36(12): 109-112. (in Chinese)
[11] LIU L, LI Y H, NIU Y B, SUN Y, GUO Z J, LI Q, LI C, FENG J, GAO S S, MEI Q B. An apple oligogalactan prevents against inflammation and carcinogenesis by targeting LPS/TLR4/NF-κB pathway in a mouse model of colitis-associated colon cancer. Carcinogenesis, 2010, 31(10): 1822-1832.
[12] LI Y, NIU Y, WU H, SUN Y, LI Q, KONG X, LIU L, MEI Q. Modified apple polysaccharides could induce apoptosis in colorectal cancer cells. Journal of Food Science, 2010, 75(8): 224-229.
[13] LI Y H, MEI L, NIU Y B, SUN Y, HUA H T, LI Q. Low molecular weight apple polysaccharides induced cell cycle arrest in colorectal tumor. Nutrition & Cancer, 2012, 64(3): 439-463.
[14] LI Y, LIU L, NIU Y, FENG J, SUN Y, KONG X, CHEN Y, GAN H, GAO S, MEI Q. Modified apple polysaccharide prevents against tumorigenesis in a mouse model of colitis-associated colon cancer: Role of galectin-3 and apoptosis in cancer prevention. European Journal of Nutrition, 2011, 51(1): 107-117.
[15] YANG X, SU Y, GUO Y, JIAO Y, ZHAO Y. Compositional characterisation of soluble apple polysaccharides, and their antioxidant and hepatoprotective effects on acute CCl4-caused liver damage in mice. Food Chemistry, 2013, 138(2/3): 1256-1264.
[16] ZHANG D, SUN Y, YUE Z, LI Q, MENG J, LIU J, HE K X, JIANG F, MI M, LIU L, MEI Q. Apple polysaccharides induce apoptosis in colorectal cancer cells. International Journal of Molecular Medicine, 2012, 30(1): 100-106.
[17] QIAN L, ZHOU S, JING J,YANG T H, DUAN S Y, WANG Z F, MEI Q B, LIU L. Oligosaccharide from apple induces apoptosis and cell cycle arrest in HT29 human colon cancer cells. International Journal of Biological Macromolecules, 2013, 57(6): 245-254.
[18] DOU J, MENG Y H, LIU L, LI J,REN D Y,GUO Y R. Purification, characterization and antioxidant activities of polysaccharides from thinned-young apple. International Journal of Biological Macromolecules, 2015, 72: 31-40.
[19] LI J, GUO Y R, LI Z, LIN Y M, LIU L, ZHANG X R, DENG H. Supercritical carbon dioxide and hexane extraction of wax from apple peel pomace: Content, composition and thermal properties. Separation Science & Technology, 2015, 50(14): 335-336.
[20] WANG X, LÜ X. Characterization of pectic polysaccharides extracted from apple pomace by hot-compressed water. Carbohydrate Polymers, 2014, 102(1): 174-184.
[21] NG J K T, ZUJOVIC Z D, SMITH B G. Solid-state 13 C NMR study of the mobility of polysaccharides in the cell walls of two apple cultivars of different firmness. Carbohydrate Research, 2014, 386: 1-6.
[22] GALVEZ-LOPEZ D, LAURENS F, QUEMENER B. Variability of cell wall polysaccharides composition and hemicellulose enzymatic profile in an apple progeny. International Journal of Biological Macromolecules, 2011, 49(5): 1104-1109.
[23] 窦姣. 苹果疏除幼果多糖的分离纯化、药理活性及结构表征[D].西安: 陕西师范大学, 2015. DOU J. Isolation and Purification of young apple polysaccharides and its pharmacological activity and structural characterization [D]. Xi’an: Shaanxi Normal University, 2015. (in Chinese)
[24] 王小梅. 超声对麦冬多糖结构、溶液行为及生物活性影响的研究[D]. 西安: 陕西师范大学, 2013. WANG X M. Effect on polysaccharides structure, behavior and biological activity of the solution with ultrasound [D]. Xi’an: Shaanxi Normal University, 2013. (in Chinese)
[25] 马青, 商鸿生. 小麦高温抗锈品种与条锈菌互作的超微结构研究.中国农业科学, 2002, 35(8): 939-942. MA Q, SHANG H S. Ultrastructural changes concerning interact ion of rust-resistant wheat cultivars in high-temperature with sripe rust. Scientia Agricultura Sinica, 2002, 35(8): 939-942. (in Chinese)
[26] 梁涛, 张静, 张力妮, 张化朋, 张鹏, 刘阿娟. 碱提杏鲍菇多糖PEAP-1的结构初探及形貌观察. 食品与生物技术学报, 2013, 32(9): 951-956. LIANG T, ZHANG J, ZHANG L N, ZHANG H P, ZHANG P, LIU A J. Preliminary structure analysis and structure morphology observation of alkali-extractable polysaccharide PEAP-1 from Pleurotus eryngii. Journal of Food and Biological Technology, 2013, 32(9): 951-956. (in Chinese)
[27] 张化朋, 张静, 南征. 杏鲍菇多糖WPP2的结构表征及抗肿瘤活性.高等学校化学学报, 2013, 34(10): 2327-2333. ZHANG H P, ZHANG J, NAN Z. Structure characterization and antitumor activity of polysaccharide WPP2 from Pleurotus eryngii. Journal of High School Chemistry, 2013, 34(10): 2327-2333. (in Chinese)
[28] 吕峰. 我国薏苡仁资源主要品质及薏苡仁活性多糖的研究[D]. 福州: 福建农林大学, 2008. LÜ F. Study on the quality and biological activity of Yiyiren polysaccharide in China [D]. Fuzhou: Fujian Agriculture and Forestry University, 2008. (in Chinese)
[29] JEDDOU K B, CHAARI F, MAKTOU F S. Structural, functional, and antioxidant properties of water-soluble polysaccharides from potatoes peels. Food Chemistry, 2016, 205: 97-105.
[30] JEDDOU K B, CHAARI M S. Structural, functional, and antioxidant properties of water-soluble polysaccharides from potatoes peels. Food Chemistry, 2016, 205: 97-105.
[31] 王辑. 产胞外多糖植物乳杆菌的分离筛选、分子表征及其应用研究[D]. 长春: 吉林大学, 2015. WANG J. Study on Lactobacillus isolation and molecular characterization and application of exopolysaccharides [D]. Changchun: Jilin University, 2015. (in Chinese)
[32] 杨焱, 李巧珍, 吴迪, 周帅, 唐传红, 刘艳芳. 猴头菌子实体发育过程中多糖结构和活性的变化. 菌物研究, 2013(2): 147-147. YANG Y, LI Q Z, WU D, ZHOU S, TANG C H, LIU Y F. Changes in the structure and activity of the polysaccharides during the development of fruiting bodies Hericium. Fungal Research, 2013(2): 147-147. (in Chinese)
[33] 牛庆凤, 王斌, 李涛, 金鑫, 陈荫. 假酸浆籽胶质多糖的结构及凝胶特性研究. 现代食品科技, 2015(9): 68-73, 123. NIU Q F, WANG B, LI T, JIN X, CHEN Y. Structure and gelling properties of false physalis seed gum polysaccharides . Modern Food Science and Technology, 2015(9): 68-73, 123. (in Chinese)
[34] 贾丰, 郭玉蓉, 刘冬, 杨曦, 邓红, 孟永宏. 发酵对苹果渣多糖加工特性的影响. 中国农业科学, 2016, 49(19): 3831-3844. JIA F, GUO Y R, LIU D, YANG X, DENG H, MENG Y H. Effect of fermentation on the polysaccharides processing characteristics in apple pomace . Scientia Agricultura Sinica, 2016, 49(19): 3831-3844. (in Chinese)
[35] 王兆梅, 李琳, 郭祀远, 蔡妙颜. 活性多糖构效关系研究评述. 现代化工, 2002, 22(8): 18-21. WANG Z M, LI L, GUO S Y, CAI M Y. Review of polysaccharides structure-activity relationship study. Modern Chemical Industry, 2002, 22(8): 18-21. (in Chinese)
[36] 王晓娟, 魏传晚, 徐淑永, 吕梅香, 曾和平. 生物活性多糖结构与功效关系的研究进展. 广州化工, 2004, 32(1): 6-10. WANG X J, WEI C W, XU S Y, LÜ M X, ZENG H P. Progress in Polysaccharides Chemical Structure and Structure-activity. Guangzhou Chemical Industry, 2004, 32(1): 6-10. (in Chinese)
[37] 戴伟, 刘新义, 胡雄彬, 廖德华, 向大雄. 香菇多糖的分子量和结构与生物活性之间的关系. 中南药学, 2012, 10(6): 453-456. DAI W, LIU X Y, HU X B, LIAO D H, XIANG D X. The relationship of molecular, structure and biological activity of mushrooms polysaccharides. Central South Pharmacy, 2012, 10(6): 453-456. (in Chinese)
(责任编辑 赵伶俐)
Isolation and Purification of Polysaccharide from Fermented Apple Pomace and Its Relationship with Processing Characteristics
JIA Feng , GUO YuRong, YANG Xi, LIU Dong, LI Jie
(College of Food Engineering and Nutritional Science, Shaanxi Normal University, Xi’an 710119)
【Objective】On the basis of dynamic trend of separating and purifying of fermented apple pomace polysaccharides, the authors further investigated the structural properties , and in hoping of further elucidating the separating, purifying, bioactivity and processing properties of fermented apple pomace polysaccharides.【Method】Apple pomace polysaccharides (AP), wine fermented apple pomace polysaccharides (WFP) and vinegar fermented apple pomace polysaccharides (VFP) were used as experimental materials. On the basis of analysis of polysaccharides content, the authors used DEAE-52 cellulose column, NaCl as eluent, to separate polysaccharides according to the polarity difference among polysaccharides components. Through collecting effluent liquid using fraction collector and then the polysaccharides content was determined using with phenol sulfuric acid method,and the elution curve was depicted. Meanwhile, the obtained polysaccharides components with DEAE-52 cellulose column were further separated using Sephadex G-200 gel column, distilled water as eluent. After obtaining the separated polysaccharides components, the structural properties were thoroughly analyzed by using X-ray powder diffraction to observe the crystallographic structure, Thermogravimetric Analyzer was used to analyze thermogravimetric characteristics, Laser particle size analyzer to analyze granularity, and Congo red was used to explore triple helix structure of polysaccharides. Finally, Desktop Scanning Electron Microscope was also used to observe and analyze micro-structure of apple pomace polysaccharides.【Result】The content of original apple pomace polysaccharides was approximately 70%. Because the polysaccharides didn’t include protein and nucleic acid, so the extraction efficiency was excellent. NAP0.1 and NAP0.2 were obtained after AP were purified firstly through DEAE-52 cellulose column and 0.1, 0.2 mol·L-1NaCl were respectively used as eluents and then through Sephadex G-200 gel column and distilled water as eluent. Meanwhile, NWFP0, NWFP0.1 and NWFP0.2 were obtained after WFP was purified with DEAE-52 cellulose column and subsequently Sephadex G-200 gel column. After VFP was separated, NVFP0, NVFP0.1 and NVFP0.2 were obtained, too. All the separated constituents included over 92% polysaccharides, suggesting separation effect was satisfactory. Three polysaccharides, AP, WFP and VFP, were non-crystalline material between before and after separation. Concentration temperature of polysaccharides was strictly limited below 65 ℃, and the processing temperature was below 150 ℃. Before separation, AP, WFP and VFP all had triple helix structure. After separation, triple helix structure still existed in NWFP0, NVFP0, and NVFP0.1, while NAP0.1 and NAP0.2 had no triple helix structure. Compared with the original apple pomace polysaccharides, the separated apple pomace polysaccharides had better stability and smaller particle size, because lower dispersion coefficient of particle size was observed. Besides, flake structure in polysaccharides was less, and cross-linking effect attenuated after separation, which is beneficial for development of polysaccharides bioactivity.【Conclusion】Fermented apple pomace included over 70% polysaccharides, and polysaccharides content was up to 92% after crude polysaccharides was separated and purified. Besides, according to XRD, TG, LPSA and Congo red as well as DSEM analysis, it was concluded that the changes of solubility, viscosity and physical characteristics facilitated separated apple pomace polysaccharides developing bioactivity and processing characteristics.
fermentation; apple pomace; polysaccharides; separation and purification; structure Characterization; processing characteristics
2016-08-29;接受日期:2016-11-29
农业部现代产业技术体系建设专项(CARS-28)
联系方式:贾丰,E-mail:feng_juslin@163.com。通信作者郭玉蓉,E-mail:yurongguo730@163.com

