慢病毒介导小鼠 K26/KAP26.1 基因过表达对相关基因的调控作用
金梅,康琳,孙东禹,朴君,朴敬爱,赵凤琴
(辽宁师范大学生命科学学院/辽宁省生物技术与分子药物研发重点实验室,辽宁大连 116081)
慢病毒介导小鼠 K26/KAP26.1 基因过表达对相关基因的调控作用
金梅,康琳,孙东禹,朴君,朴敬爱,赵凤琴
(辽宁师范大学生命科学学院/辽宁省生物技术与分子药物研发重点实验室,辽宁大连 116081)
【目的】利用慢病毒介导过表达技术,明确小鼠 K26 和 KAP26.1 基因过表达后对角蛋白关联蛋白基因 KAP6.2、KAP7.1、KAP8.2、KAP11.1 和对骨形态发生蛋白基因 BMP-4、BMPR-IB 的影响,探究小鼠绒毛细度变化的影响机制,达到人为调控(如慢病毒载体技术)使相关基因过表达,改善动物绒毛品质的目的,为哺乳动物绒毛细度调控的研究奠定理论基础,【方法】试验在辽宁省生物技术与分子药物研发重点实验室完成,小白鼠采自大连医科大学实验动物中心,选取出生后 5 周龄昆明种雄鼠。在 Genebank 查找到小鼠基因 K26(Gene ID:NM_001033397)及 KAP26.1(Gene ID:NM_027105.2)序列,根据目的基因序列设计引物,将质粒转入生长状态良好的 293T 细胞,构建小鼠 K26 和 KAP26.1 基因慢病毒过表达载体,将含有目的基因 K26 及 KAP26.1 的慢病毒表达载体分别转染小鼠皮肤成纤维细胞,用荧光显微镜观察其转染情况,确定慢病毒表达载体转染成功后,从病毒感染后的细胞中抽提总 RNA,将 RNA 反转录成 cDNA后放入 Eppendorf Realplex 荧光定量 PCR 仪,检测 K26 和 KAP26.1 基因过表达对 KAP6.2、KAP7.1、KAP8.2、KAP11.1、BMP-4和BMPR-IB 基因表达的影响。【结果】经 RT-PCR 检测,证明小鼠慢病毒载体 pLenti6.3-K26-IRES-EGFP 和 pLenti6.3-K26.1-IRES-EGFP 构建成功。经荧光场对比,发现目的慢病毒载体转染293T细胞 72h 时转染率最高。经 PCR 检测,证实包装好的目的慢病毒 K26 及 KAP26.1 转染小鼠成纤维细胞 72 h 后转染成功。经 RT-PCR 检测 与 SPSS Statistics 19 软件分析目的基因表达量与阳性对照组(空载体质粒组,BLACK)、阴性对照组(小鼠表皮成纤维细胞,NC)表达量之间的显著性差异,发现 K26 基因过表达会导致 KAP26.1 基因上调,反之亦然,说明 K26 和 KAP26.1 基因之间存在一定的协同作用;K26 和 KAP26.1 基因过表达后,均能导致 KAP6.2、KAP7.1、KAP8.2、KAP11.1 基因下调;K26 基因过表达能使 BMP-4 基因表现为上调,而 BMPR-IB 基因表现为下调;KAP26.1 基因过表达时,BMP-4 和BMPR-IB 基因均表现为上调。【结论】K26 与 KAP26.1 基因在毛囊的内根鞘中起到协同作用,K26和KAP26.1 基因的高表达会抑制 KAP6.2、KAP7.1、KAP8.2、KAP11.1 基因的表达,影响 mTOR 下游蛋白合成信号,进而起到调节绒毛粗细的作用;K26 和 KAP26.1 基因过表达均能使 BMP-4 基因表现为上调,BMP-4 是 BMP 信号通路的激活剂,能够激活 BMP 信号通路向下游转导,进而影响到毛囊的发育周期; K26 基因过表达下调 BMPR-IB 基因的表达,而 KAP26.1 基因过表达上调 BMPR-IB 基因的表达,BMPR-IB 基因是 BMP 信号的Ⅰ型受体,当 BMPR-IB 受体减少时,会抑制 BMP 信号向下游转导,从而使绒毛生长周期重新开始;当 BMPR-IB 受体增加时,会促进下游信号分子转录,进而影响毛囊发育周期。说明 K26 和 KAP26.1 基因过表达均能激活 BMP 信号通路,并由 BMP 和mTOR 信号调节 KAP6.2、KAP7.1、KAP8.2、KAP11.1、BMP-4和BMPR-IB 基因的表达,但 K26 与 KAP26.1 基因对BMPR-IB 基因的相反调节作用有待深入研究。
慢病毒介导;K26/KAP26.1 基因;角蛋白关联蛋白基因;BMP信号通路
0 引言
【研究意义】利用慢病毒介导过表达技术,明确小鼠 K26 和 KAP26.1 基因过表达后对角蛋白关联蛋白基因 KAP6.2、KAP7.1、KAP8.2、KAP11.1 和骨形态发生蛋白基因 BMP-4、BMPR-IB 的影响,探究小鼠绒毛细度变化的影响机制。角蛋白(keratin)与角蛋白关联蛋白(KAPs)是哺乳动物毛发纤维的主要组成成分,能够维持毛囊的结构,同时也是毛囊中表达最丰富的蛋白质[1]。骨形态发生蛋白(bone morphogenetic proteins, BMPs)是转化生长因子-β (transforming growth factor-β, TGF-β)超家族中最大的分泌信号传导分子家族[2],其作用广泛,不仅能影响动物不同时期的生长发育以及骨骼的形成,也是毛囊发育所涉及的信号分子之一[3-5]。角蛋白、角蛋白关联蛋白及骨形态发生蛋白在哺乳动物皮肤细胞中的表达情况对哺乳动物绒毛品质有重要影响,可以通过人为调控(如慢病毒载体技术)使其中部分基因过表达,实现提高动物绒毛品质的目的,本研究对畜牧业生产具有重要的理论和实践意义。【前人研究进展】NANASHIMA等证明了角蛋白基因 K2-K25 参与鼠的毛发生长过程[6]。王杰等发现,角蛋白关联蛋白基因 KAP6.2 与羊毛细度存在相关性[7];MICHAEL 等发现角蛋白关联蛋白基因 KAP7.1,KAP8.2 特异表达于人皮肤毛囊中,可能与毛发结构的分化有关[8];金梅等研究发现角蛋白基因 K26 在辽宁绒山羊毛囊内根鞘上表达[9],并在绒山羊皮肤细胞中发现了 K26,KAP26.1,KAP6.2,KAP7.1,KAP8.2 、KAP11.1 等基因的表达,经生物信息学分析证实,这些基因对绒毛纤维直径具有重要的调节作用[10]。SHUNSUKE 等发现角蛋白关联蛋白基因 KAP11.1 可能影响鼠的毛发结构[11];ROGERS等研究发现,K26.1 基因与人的毛囊生长发育有关[12]。田月珍等应用基因多态性技术分析内蒙古细毛羊发现,K26 基因是调节羊绒细度性状的分子标记[13]。然而,上述角蛋白及角蛋白关联蛋白基因间相互作用关系的报道却不多。BMP-4 和BMPR-IB 基因属于 TGF-β 超家族成员,与毛囊形态发生、发育和分化密切相关[14-15];毛青青等以皮肤组织中构建 BMP-4 基因的 siRNA 转基因小鼠为研究对象,发现 BMP-4 基因下调,小鼠毛囊数量增加,表明 BMP-4 基因抑制了毛囊形成[16];樊振华等的研究证实BMP-4和BMPR-IB为羊和小鼠保守基因[17-18]。BMP 信号通路在毛囊生长发育方面应用较为经典,其路径为 BMP 与丝氨酸/苏氨酸受体磷酸化位点结合,信号转导到核内与 Smad1、Smad5 和 Smad8 结合,进而诱导下游信号分子转录。BMP-4 与 Wnt 信号通路中的 LRP-6 特异性结合能够促进 DKK3 高表达,从而激活毛发的生长周期,促进毛发生长[19]。DENG 等对人的毛囊再生研究中发现,mTOR complex 1(mTORC1)信号通路在毛囊干细胞中被激活,mTORC1 多个下游信号使毛囊发育自发进入生长期,如果将 mTORC1 信号抑制,毛囊将始终保持休止期[20];相反,BMP 信号通路从休止期开始到休止期后期由强变弱,到达临界值后,能够维持毛囊干细胞静止,为毛发再生做准备[21-22]。因此可以得知,mTOR 信号通过抑制 BMP 信号,使毛囊干细胞激活,进入毛囊生长期,实现毛发再生,说明毛囊生长发育是多方信号相互作用产生的结果。慢病毒载体和其它病毒载体相比具有免疫原性弱,同时又能够转导非分裂相的细胞的优点,并能在宿主细胞内稳定表达。慢病毒载体技术应用广泛,已经成为生物及医学等领域较为重要的实验方法。YAMAGUCHI等通过实验验证慢病毒载体比逆转录载体具有更高的转染效率[23]。ZHANG 等研究了慢病毒载体干扰 TNF-α 上调PRDX6,其中 PRDX6 可以提高大鼠双侧后肢的运动功能,为临床治疗脊椎损伤疾病提供新的方法[24]。还有学者研究发现通过制作含缺陷整合酶慢病毒载体的疫苗能够抑制肿瘤细胞的生长,并能将小鼠体内的肿瘤消除,为人类治疗肿瘤提供了新的途径[25]。【本研究切入点】大量的研究证明,角蛋白和角蛋白关联蛋白家族基因,以及 BMPs 及其所介导的信号通路都与毛囊的发育过程以及毛发的生长情况密切相关,但是其间的相互影响及作用结果却还未知。【拟解决的关键问题】本研究分别构建小鼠 K26 和 KAP26.1基因的慢病毒表达载体,将含有目的基因 K26 及KAP26.1 的慢病毒表达载体分别转染小鼠皮肤成纤维细胞,检测 K26 和 KAP26.1 基因过表达对KAP6.2、KAP7.1、KAP8.2、KAP11.1、BMP-4和BMPR-IB 基因表达的影响,为角蛋白及角蛋白关联蛋白、骨形态发生蛋白基因间相互联系的研究奠定基础,并对畜牧养殖过程中提高动物绒毛品质的研究提供理论依据。
1 材料与方法
1.1 主要材料与试剂
293T 细胞(吉玛生物技术有限公司,上海),PLenti6.3-MCS 质粒(锐赛生物技术有限公司,上海),DH5α感受态细胞(全式金生物技术有限公司,大连),培养基 DMEM + 10% FBS + 1% P/S + 1% Glutamax(锐赛生物技术有限公司,上海),慢病毒包装质粒Mix(Invitrogen,美国),反转录试剂盒(takara公司,大连)。
1.2 皮肤样品采集及细胞培养
试验于2015年10月,在辽宁省生物技术与分子药物研发重点实验室完成。样品采自大连医科大学实验动物中心,于秋季选取出生后 5 周龄昆明种雄性小白鼠 5 只。初步灭菌后分别在其颈部(多毛区)剪取约 2 cm2的皮肤组织,用手术剪把皮肤块剪至 1mm3。用组织块贴附法原代培养小鼠细胞,接种皮肤块 20 瓶。而后将培养瓶转移到培养箱内,37℃ 5% CO2条件下培养,待细胞在瓶内长到 70%—80% 左右,进行传代,待传到第三代细胞稳定后用于试验。
1.3 小鼠目的基因的过表达慢病毒包装及测定
1.3.1 质粒准备 将测序正确的 pLenti-K26-IRESEGFP(pLenti-KAP26.1-IRES-EGFP)和菌液划线培养,挑单克隆接入含 Amp 的 LB,30℃ 摇菌过夜。用AXYGEN 质粒中抽提试剂盒进行质粒抽提。测定质粒浓度。
1.3.2 细胞准备 转染前一天,取生长状态良好的293T 细胞,弃旧培养液,加入 PBS 溶液洗涤细胞生长面,弃去 PBS 溶液。每皿加入 1 mL 胰酶消化液,消化约 1 min 直到细胞收缩变圆,吸弃胰酶,加入 3 mL DMEM + 10% FBS 培养基,吹打数次,将皿底的细胞冲洗下来,重悬均匀。5% CO2细胞培养箱中继续培养约 24 h。
1.3.3 慢病毒包装 在 GenBank 查找到小鼠基因K26(Gene ID:NM_001033397)及 KAP26.1(Gene ID:NM_027105.2)序列,根据目的基因序列设计引物,并在引物片段上下游分别添加酶切位点 PacI 和AscI,序列见表1。以PUC57-K26 及 PUC57-KAP26.1分别为模板进行 PCR 扩增目的片段,在目的片段两端添加酶切位点 PacI 和 AscI,PCR 扩增其序列。37℃ 酶切 4—5 h 后,电泳分离酶切片段,切胶回收目的片段。T4 DNA ligase 连接上述酶切后的 PCR 产物及目的载体。将 10 μL 连接产物转化 DH5α 感受态细胞,涂布于含氨苄(Amp)抗性的 LB 平皿,37ºC培养过夜。次日,挑取单菌落进行 PCR 扩增。将 PCR鉴定呈阳性的克隆接到 LB 液体培养基中,摇菌过夜,次日抽提质粒。将菌落 PCR 呈阳性的质粒进行酶切鉴定,将菌落 PCR 和酶切鉴定均呈阳性的克隆测序并进行序列比对。
1.3.4 病毒收获与浓缩 转染后 48 h,收集 293T细胞上清液,4°C 暂存。细胞更换新鲜的完全培养基,继续培养至 72—80 h,收集病毒上清液,与第一次收集的混合,共 300 mL,于 4°C 3 000 r/min 离心10 min,除去细胞碎片。以醋酸纤维素膜的滤器过滤上清液于离心管中,4°C 22 000 r/min 离心 2 h。离心完毕后,小心取出离心管,弃上清液,每管用预冷的DMEM 基本培养基溶解沉淀。待病毒沉淀溶解完全后收集至 EP 管后分装,-80°C 保存。
1.3.5 慢病毒滴度测定(qPCR 法) 感染前一天,用胰酶消化细胞并计数,准备 5×105细胞/mL 的293T 细胞接种 24 孔板,每孔 0.5 mL。细胞接种后第二天,根据病毒的预期滴度,准备 3 个无菌的 EP管,10 倍倍比稀释慢病毒浓缩液。13 μL 慢病毒原液+ 117 μL DMEM → 10-1病毒液 13 μL 10-1病毒液+ 117 μL DMEM → 10-2病毒液 13 μL 10-2病毒液+ 117 μL DMEM → 10-3病毒液 13 μL 10-3病毒液+ 117 μL DMEM → 10-4病毒液 细胞换液,每孔内加入 400 μL 无抗生素的 DMEM + 10 % FBS 培养液,除对照组外其余各孔均加入 polybrene 至终浓度为 8 μg·mL-1。各感染孔内分别加入相应稀释度的病毒液及病毒原液 100 μL,放入 37℃ 5% CO2的培养箱内。感染 24 h后,换液,每孔内加入 500 μL DMEM + 10% FBS + 1% P/S + 1% Glutamax,继续放回培养箱内。感染 72 h 后,每孔加 500 μL Trizol 裂解细胞,抽提RNA,经 DNase I 处理后将 RNA 反转录成 cDNA,qPCR 检测 WPRE 基因表达。

表1 目的基因引物Table 1 Primers of target gene
1.4 目的病毒及阴性对照慢病毒感染目的细胞
将细胞悬液接种于 6 孔培养板中(20 W 个/孔),37℃ 5% CO2培养箱培养。根据病毒滴度向细胞中分别加入适量的目的病毒和阴性对照病毒(MOI=30),同时加入终浓度为 8μg·mL-1的polybrene 增强感染 。感染 24 h 后更换无慢病毒的完全培养基继续培养。感染 72 h 后观察慢病毒。
1.5 从病毒感染后的细胞中抽提总 RNA
将培养液去除后,用 PBS 润洗细胞;向培养板中加入 Trizol,使裂解液均匀分布于细胞表面,然后用移液枪吹打细胞使细胞脱落;将细胞裂解液转移至离心管中,并用枪头反复吹打直至裂解液中无明显沉淀,在室温下放置 5 min,使核酸蛋白复合物完全分离;每管加入 200 µL 氯仿,上下颠倒 EP 管 15 s,然后室温静置 15 min;4℃ 12 000 r/min离心 15 min;吸取上清液移至新的 1.5 mL lep 管,加入等体积 -20℃ 预冷的异丙醇,混匀后 -20℃ 沉淀 10 min;4℃ 12 000 r/min 离心 10 min;去上清液,加入1 mL 4℃ 预冷的 75% 乙醇,洗涤沉淀;4℃ 10 000 r/min 离心 5 min,弃上清液,室温干燥;加入 20 µL RNase-free 水,至完全溶解,紫外分析测定所抽提RNA 的浓度。
1.6 RNA 反转录成 cDNA
使用Trizol(takara公司)试剂提取提取目的基因总RNA,1%琼脂糖凝胶电泳检测RNA完整性。按照RT-PCR(宝生物公司)试剂盒说明书进行反转录。
1.7 Real-time PCR 检测目的基因
使用Trizol试剂盒(Takara公司)提取目的基因总RNA 并 DNAse I处理,再按照RT-PCR试剂盒说明书(Takara公司)将RNA反转录成cDNA。进行荧光定量PCR反应,每个样本均做3个重复,引物序列如表2所述,试验前在普通PCR上进行试验条件的优化,包括退火温度和引物浓度等。
2 结果
2.1 小鼠目的基因载体构建
通过 RT-PCR 检测小鼠 K26 及 KAP26.1 基因慢病毒载体构建情况,发现目的基因的 PCR 扩增位置(图 1)与 PacI 和 AscI 对重组载体质粒双酶切后的扩增位置一致(图 2),即 K26 目的条带的位置在 1 421 bp,K26.1 目的条带的位置在 647 bp,结果表明小鼠慢病毒载体 pLenti6.3-K26-IRES-EGFP 和 pLenti6.3-K26.1-IRES-EGFP 构建成功。

表2 目的基因引物Table 2 Primers of target gene
2.2 小鼠目的基因的过表达慢病毒包装
转染前 293T 细胞在显微镜明场下呈扁平形(图3-A);在荧光场下无荧光,(图3-B)。以 Lenti-IRESEGFP NC 转染 293T 细胞为对照组(图 3-C 和D),对比荧光场对照组细胞,K26 及 KAP26.1 慢病毒载体分别成功转染 293T 细胞荧光场出现荧光,结果表明小鼠 K26 及 KAP26.1 慢病毒包装成功(图3-H 和 L)。本试验对转染慢病毒载体感染时间进行验证,目的慢病毒转染 72 h 的转染率远远高于 48 h的转染率,说明目的慢病毒载体转染293T细胞72 h转染最好(图3-E—L)。
将包装好的目的慢病毒 K26 及 KAP26.1 转染小鼠成纤维细胞 72 h 后(图 4),分别提取其总的RNA,反转录成 cDNA 后,PCR 证实 K26 病毒及KAP26.1 病毒转染小鼠成纤维细胞成功(图 5)。
从慢病毒感染后小鼠皮肤成纤维细胞中 K26 和KAP26.1 基因的表达检测结果来看,小鼠 K26 和KAP26.1 基因过表达效果明显,说明两个基因的慢病毒质量合格,感染细胞效果正常。
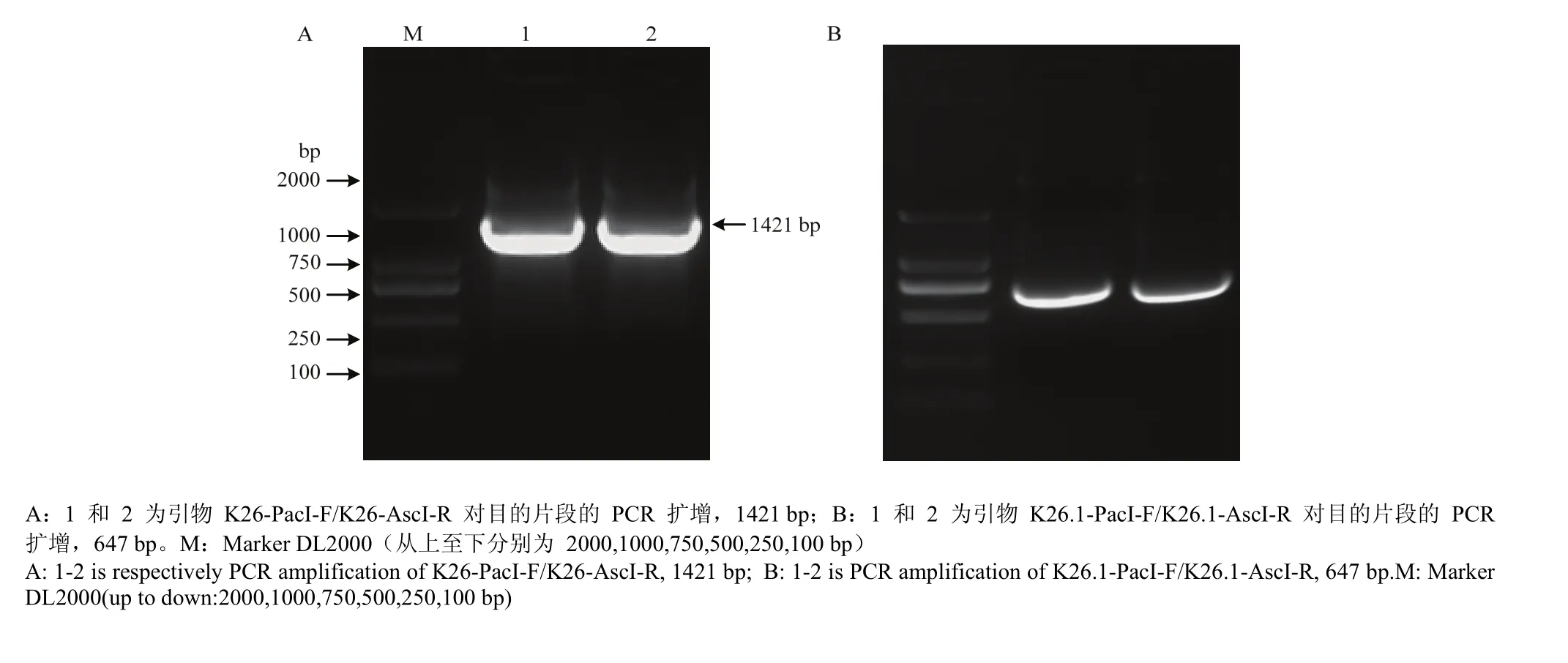
图1 目的片段的 PCR 扩增Fig. 1 PCR Amplification of target gene
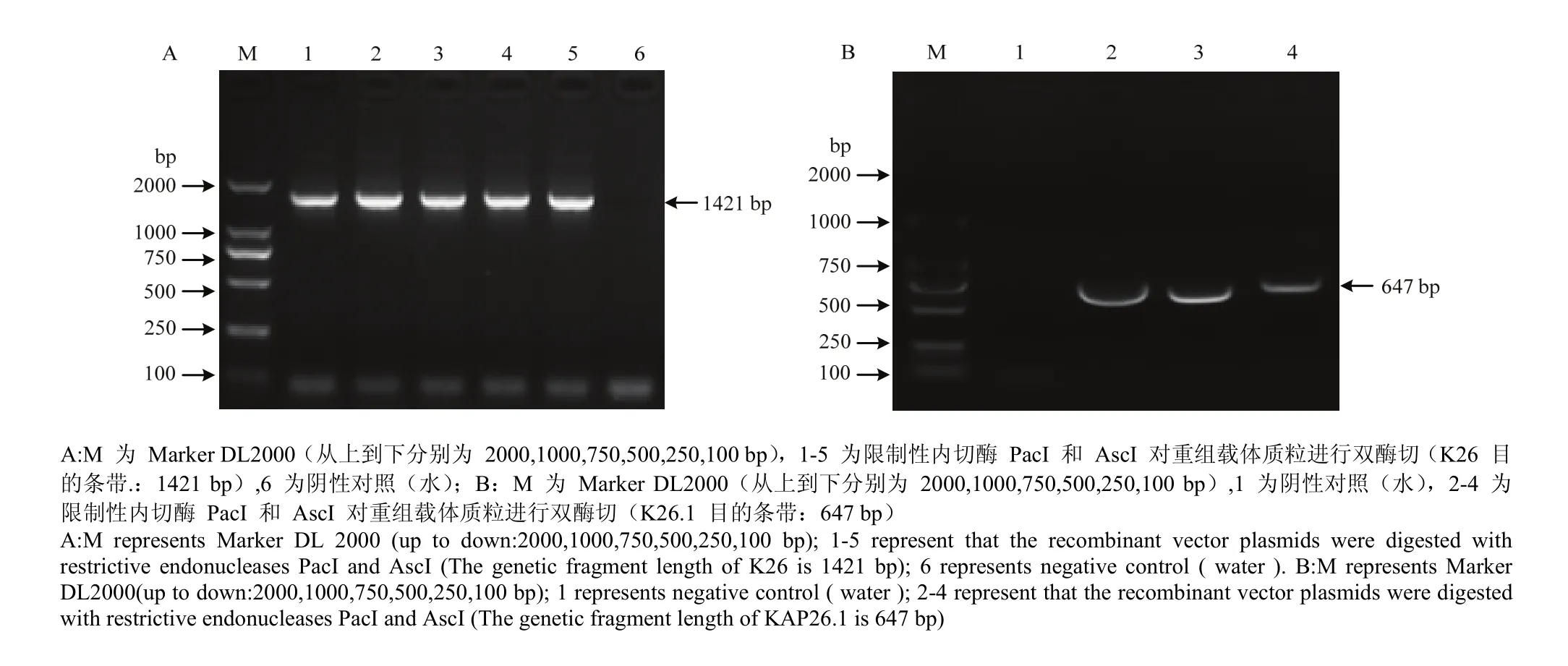
图2 重组克隆的酶切鉴定Fig. 2 Identification of recombinant clones by restriction enzyme digestion
2.3 小鼠目的基因过表达后对其他相关基因的影响
通过实时荧光定量 PCR 测得目的基因的 Ct值,根据 2-ΔΔCt 法计算目的基因的相对表达量,并计算其标准差,用 SPSS Statistics 19 软件分析目的基因表达量与阳性对照组(空载体质粒组,BLACK)、阴性对照组(小鼠表皮成纤维细胞,NC)表达量之间的显著性差异(图 6和7)。
如图6结果所示,当K26基因过表达后,KAP26.1基因与阳性对照组(空载体质粒组,BLACK)、阴性对照组(小鼠表皮成纤维细胞,NC)相比,表达量显著升高(P<0.01);BMPR-IB、KAP7.1、KAP8.2和KAP11.1 基因的表达与对阳性和阴性对照组相比明显降低;BMP4 基因的表达与阳性对照组相比差异不大,但是与阴性对照组相比明显升高;KAP6.2 基因的表达与阳性对照组相比无差异,但是与阴性对照组相比明显降低。总体看来,当 K26 基因过表达后,BMPR-IB、KAP6.2、KAP7.1、KAP8.2和KAP11.1 基因的表达下调,BMP4 基因的表达上调。如图 7 结果所示,当 KAP26.1 基因过表达后,K26基因表达量明显升高 (0.01<P<0.05),KAP6.2、KAP7.1、KAP8.2和KAP11.1 基因的表达明显下调,BMP4 和BMPR-IB 基因的表达明显上调。
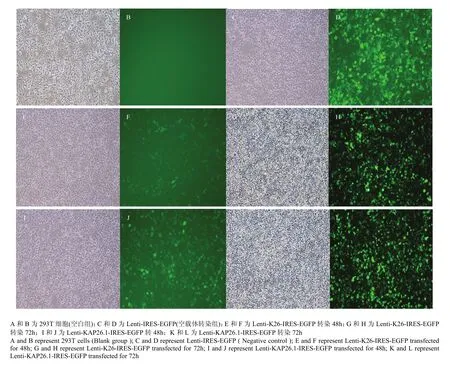
图3 慢病毒载体转染 293T 细胞Fig. 3 Lentiviral vector was transfected into 293T cells ( ×100 )
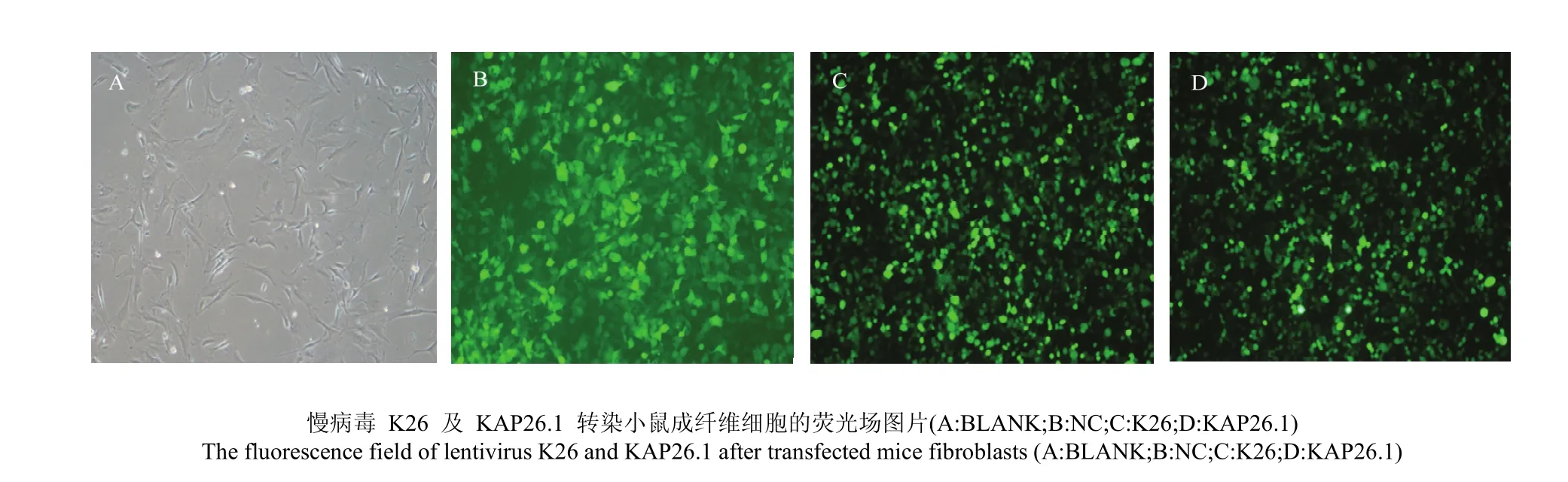
图4 慢病毒 K26 及 KAP26.1 转染小鼠成纤维细胞 72 hFig. 4 Lentivirus K26 and KAP26.1 were transfected into mice fibroblasts for 72 h
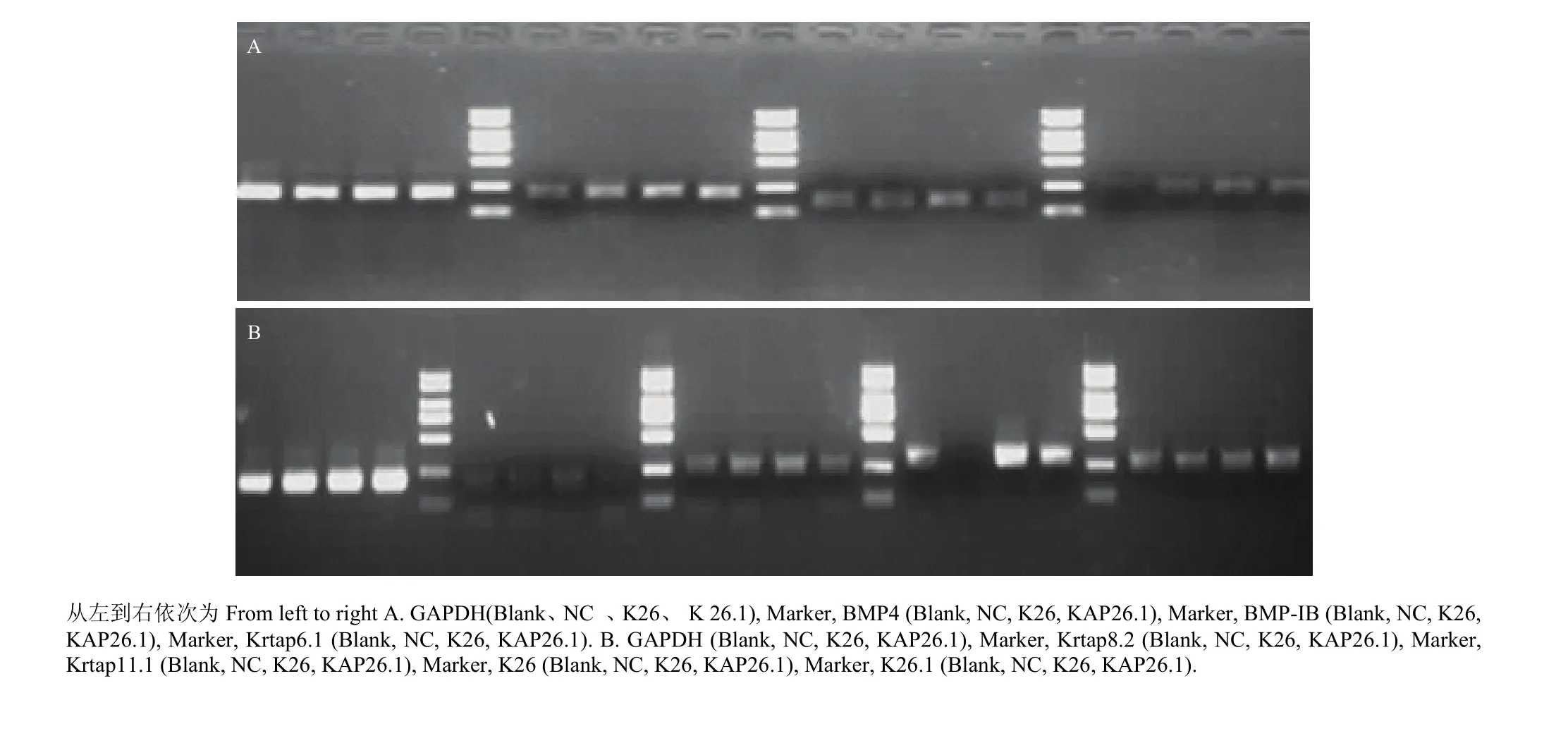
图5 PCR 电泳图Fig. 5 PCR electrophoresis
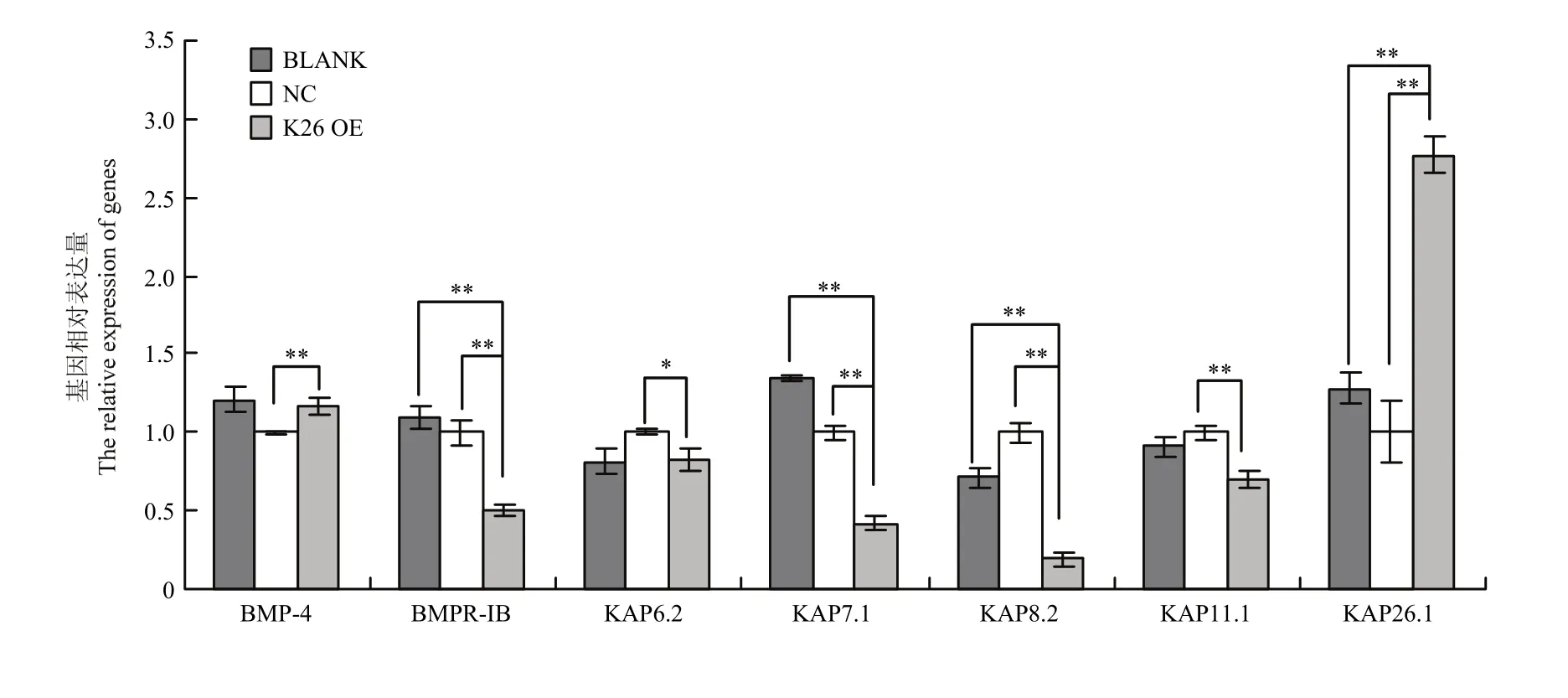
图6 K26基因过表达对其它相关基因表达量的影响Fig. 6 Effects of K26 gene overexpression on the other related genes
3 讨论
3.1 K26 和 KAP26.1 基因过表达
角蛋白和角蛋白关联蛋白两类家族基因定位在同一物种不同的染色体上,经过基因序列比对,发现它们基因排序的相似度极高,说明这两类基因是同源性较高的保守基因[26-30]。结果表明,角蛋白基因 K26及角蛋白关联蛋白基因 KAP26.1 均在小鼠皮肤成纤维细胞中表达,K26 过表达后,KAP26.1 表达量相对上调;相应地,KAP26.1 过表达后,K26 表达量也相对上调,说明 K26 及 KAP26.1 基因在小鼠皮肤成纤维细胞中存在协同关系。
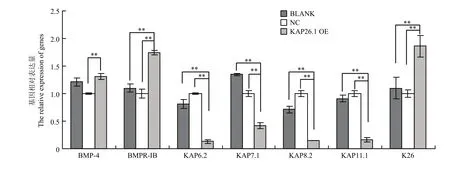
图7 KAP26.1 基因过表达对其它相关基因表达量的影响Fig. 7 Effects of KAP26.1 gene overexpression on the other related genes
有研究表明,Ⅰ 型角蛋白(如 K17)和 Ⅱ 型角蛋白集群(如 K1、K2、K5、K6a、K6b、K7、K8、K18、K71-K74和K76-K84)的减少,均能影响mTOR下游蛋白合成信号,导致角质细胞内的总蛋白合成减少[31-32]。因此可以推测,K26与KAP26.1基因过表达会促进mTOR下游合成蛋白信号,从而增加细胞内蛋白合成。还有研究表明,K26与KAP26.1基因均在毛囊内根鞘表达,参与调控不同种羊毛纤维细度[9,12-13]。由此可以通过生物技术调控动物皮肤细胞中 K26和KAP26.1基因的表达量,达到人为调控哺乳动物毛发直径的目的。
3.2 K26 和 KAP26.1 基因过表达对其它角蛋白关联蛋白的影响
K26和 KAP26.1基因过表达后,均能导致KAP6.2、KAP7.1、KAP8.2和KAP11.1基因表达下调,说明在小鼠皮肤成纤维细胞中,K26、KAP26.1、KAP6.2、KAP7.1、KAP8.2和KAP11.1基因存在动态的平衡关系,K26 和KAP26.1基因的高表达会抑制KAP6.2、KAP7.1、KAP8.2和KAP11.1基因的表达,以恢复平衡状态,这种变化的机制由特定的信号通路调节。
前人研究结果表明,KAP6.2、KAP7.1、KAP8.2 和KAP11.1 参与了绒毛的形成,对绒毛细度有调控作用,K26 及 KAP26.1 基因在毛囊生长不同时期的表达差异极其显著,对毛囊的周期性变化具有十分重要的调节作用。因此,可以通过外源干扰,在毛囊发育的不同时期利用 K26 及 KAP26.1 基因过表达对其它基因的影响调控绒毛细度。
3.3 K26 和 KAP26.1 基因过表达对 BMP 信号通路的影响
K26 和 KAP26.1 基因过表达均能使 BMP-4 基因表现为上调。BMP-4 是 BMP 信号通路的激活剂,激活 BMP 信号通路向下游转导,因此 K26 和KAP26.1 基因过表达均能激活 BMP 信号通路。可以推断,K26 和 KAP26.1 位于 BMP 信号通路的上游。KULESSA等研究发现,BMP 信号在毛囊休止期起主要作用[33]。因此,K26 或 KAP26.1 基因通过上调 BMP-4 基因,激活 BMP 信号通路,进一步影响到毛囊的发育周期。
K26 与 KAP26.1 基因对 BMPR-IB 基因的表达产生不同作用,K26 基因过表达会下调 BMPR-IB基因的表达,而 KAP26.1 基因过表达会上调BMPR-IB 基因的表达。BMPR-IB 基因是 BMP 信号的Ⅰ型受体,当 BMPR-IB 受体减少时,会抑制 BMP信号向下游转导,从而使绒毛生长周期从新开始;当BMPR-IB 受体增加时,会促进下游信号分子转录,进而影响毛囊发育周期。K26 与 KAP26.1 基因对BMPR-IB 作用影响的机制有待深入研究,期望通过揭示这一机制为研究哺乳动物毛囊生长周期调节机制提供新的证据。
4 结论
K26和KAP26.1基因位于角蛋白关联蛋白KAP6.2、KAP7.1、KAP8.2、KAP11.1 基因和骨形态发生蛋白BMP-4、BMPR-IB 基因的上游,间接参与 mTOR 与BMP 信号通路。 K26 与 KAP26.1 之间存在一定的协同作用,K26 与 KAP26.1 过表达均可间接抑制mTOR 信号通路,从而影响小鼠绒毛粗细程度;K26 与 KAP26.1 过表达均可间接激活 BMP 信号通路,从而调控小鼠毛囊发育周期。所以,可以通过人为调控哺乳动物皮肤细胞中 K26 和 KAP26.1 基因的表达,达到改善绒毛质量的目的。
[1] SHIMOMURA Y, AOKI N, SCHWEIZER J, LANGBEIN L, ROGERS M A, WINTER H, ITO M. Polymorphisms in the human high sulfur hair keratin-associated protein 1, KAP1, gene family. Journal of Biological Chemistry, 2002, 277(47): 45493- 45501.
[2] CHEN D, ZHAO M, MUNDY G R. Bone morphogentic proteins. Growth Factors, 2004, 22(4): 233-241.
[3] O’SHAUGHNESSY R F, CHRISTIANO A M. Stem cells in the epidermis. Skin Pharmacology Applied Skin Physiology, 2001, 14(6): 350-357.
[4] 苏蕊, 李金泉, 张文广. 骨形态发生蛋白 2 (BMP2) 基因在内蒙古绒山羊不同时期皮肤毛囊中的表达. 中国农业科学, 2008, 41(2): 559-563. SU R, LI J Q, ZHANG W G. Bone morphogenetic proteins 2 (BMP2) gene express in Inner Mongolia goat skin hair follicle in different periods. Scientia Agricultura Sinica, 2008, 41(2): 559-563. (in Chinese)
[5] 殷金凤, 倪蓉, 王庆增, 孙伟, 丁家桐, 张有法, 陈玲, 吴文忠, 周洪. 湖羊 BMP7 基因遗传多态、表达及与羔皮毛囊性状的关联.中国农业科学, 2014, 47(9): 1811-1818. YIN J F, NI R, WANG Q Z, SUN W, DING J T, ZHANG Y F, CHEN L, WU W Z, ZHOU H. The genetic polymorphism, expression of Hu Sheep BMP7 gene and relation with lamb skin hair follicle traits. Scientia Agricultura Sinica, 2014, 47(9): 1811-1818. (in Chinese)
[6] NANASHIMA N, AKITA M, YAMADA T, SHIMIZU T, NAKANO H, YANG F, TSUCHIDA S. The Hairless Phenotype of the Hirosaki Hairless Rat Is Due to the Deletion of an 80-kb Genomic DNA Containing Five Basic Keratin Genes. Journal of Biological Chemistry, 2008, 283(24): 16868-16875.
[7] 王杰, 代怡婧, 王永, 字向东, 欧阳熙, 刘鲁蜀. 高原型藏山羊KAP6.2 和 6.2 位点与产绒性状的关系研究. 西南民族大学学报(自然科学版), 2010, 36(6): 962-966. WANG J, DAI Y J, WANG Y, ZI X D, OU Y X, LIU L S. The study on the relation between Plateau Type Tibetan goat KAP6.2 and 6.2 loci and the production wool traits. Journal of Southwest University for Nationalities (Natural Science Edition), 2010, 36(6): 962-966. (in Chinese)
[8] ROGERS MA, LANGBEIN L, WINTER H, BECKMANN I, PRAETZEL S, SCHWEIZER J. Hair Keratin Associated Proteins: Characterization of a Second High Sulfur KAP Gene Domain on Human Chromosome 21. The Journal of Investigative Dermatology, 2004, 122(1): 147-158.
[9] JIN M, XING M, Li S. Keratin 26, a novel member of the goat type I keratin gene family. Small Ruminant Research, 2010, 93(1): 24-30.
[10] JIN M, XING M, Li S, XING M X, ZHANG X. Characterization and expression analysis of KAP7.1、KAP8.2 gene in Liaoning new-breeding cashmere goat hair follicle. Molecular Biology Reports, 2011, 38(5): 3023-3028.
[11] FUJIMOTO S, TAKASE T, KADONO N, MAEKUBO K, HIRAI Y. Krtap11-1, a hair keratin-associated protein, as a possible crucial element for the physical properties of hair shafts. Journal of Dermatological Science, 2014, 74(1): 39-47.
[12] ROGERS MA, LANGBEIN L, PRAETZEL S, GIEHL K. Characterization and expression analysis of the hair keratin associated protein KAP26.1. British Journal of Dermatology, 2008, 159(3): 725-729.
[13] 田月珍, 黄锡霞, 田可川. 细毛羊 KRT26 基因多态性及其与羊毛细度的关联性分析. 中国畜牧兽医, 2015, 42(1): 161-166. TIAN Y Z, HUANG X X, TIAN K C. Fine-wool sheep KRT26 gene polymorphism and correlation analysis with wool fineness. Chinese journal of Animal and Veterinary Sciences, 2015, 42(1): 161-166. (in Chinese)
[14] 李荣, 尹俊, 刘羿羿, 张燕军, 刘志红, 席海燕, 张俊霞, 李金泉. BMPR-IB 基因在内蒙古绒山羊皮肤毛囊中的表达. 中国草食动物科学, 2006(z1): 72-73. LI R, YIN J, LIU Y Y, ZHANG Y J, LIU Z H, XI H Y, ZHANG J X, LI J Q. The BMPR-IB gene expression in Inner Mongolia goat skin hair follicles. China Herbivores Science, 2006(z1): 72-73. (in Chinese)
[15] SCHMIDT R, PAUS R. Molecular principles of hair follicle induction and morphgenesis. Biology Essays, 2005, 27(3): 247-261.
[16] 毛青青, 代蓉, 沈思军, 郭洪, 万鹏程, 周平, 石国庆. BMP-4 对小鼠毛囊数量的影响. 西北农业学报, 2012, 21(6): 13-17. MAO Q Q, DAI R, SHEN S J, GUO H, WAN P C, ZHOU P, SHI G Q. The impact of BMP-4 on the number of mice follicles. Acta Agriculturae Boreali-occidentalis Sinica, 2012, 21(6): 13-17. (in Chinese)
[17] 樊振华, 张秋月, 范瑞文, 任玉红. 绵羊骨形态发生蛋白 4 (BMP4)的生物信息学分析. 中国畜牧兽医学报, 2015, 42(6): 1370-1376. FAN Z H, ZHANG Q Y, FAN R W, REN Y H. The bioinformatics analysis of sheep bone morphogenetic proteins 4 (BMP4). Chinese journal of Animal and Veterinary Sciences, 2015, 42(6): 1370-1376.(in Chinese)
[18] 李荣. 内蒙古绒山羊 BMP-4、BMPR-IB 基因 cDNA 的克隆及BMPR-IB 在皮肤毛囊中的表达[D]. 呼和浩特: 内蒙古农业大学, 2007. LI R. The cDNA cloning of Inner Mongolia goat BMP-4, BMPR-IB gene and the BMPR-IB expression in hair follicles[D]. Huhhot: Inner Mongolia Agricultural University, 2007. (in Chinese)
[19] 王洪涛, 陈璧, 胡大海, 陶克, 丁国斌, 汤朝武. 人胎儿毛囊隆突细胞的培养方法及其向皮脂腺细胞诱导分化的初步研究. 中华烧伤杂志, 2006, 22(3): 199-202. WANG H T, CHEN B, HU D H, TAO K, DING G F, TANG C W. The preliminary study on the cultivation method of human fetal hair follicle juga cells and induce the sebaceous gland cells differentiation. Chinese Journal of Burns, 2006, 22(3): 199-202. (in Chinese)
[20] DENG Z, LEI X, ZHANG X. mTOR signaling promotes stem cell activation via counterbalancing BMP-mediated suppression during hair regeneration. Journal of Molecular Cell, 2015, 7(1): 62-72.
[21] MAKSIM V. PLIKUS, JULIE A M, DAMON C, RUTH E. BAKER, PHILIP K. MAINI, ROBERT M, CHENG M C. Cyclic dermal BMP signalling regulates stem cell activation during hair regeneration. Nature, 2008, 451(7176): 340-344.
[22] OSHIMORI N, FUCHS E. Paracrine TGF-beta signaling counterbalances BMP-mediated repression in hair follicle stem cell activation. Cell Stem Cell, 2012, 10(1): 63-71.
[23] YAMAGUCHI, MORIKAWA A, MIYOSHI H. Comparison of gene-trapping efficiency between retroviral and lentiviral vectors in mouse embryonic stem cells. Biochemical and Biophysical Research Communications, 2012, 425(2): 297-303.
[24] ZHANG X, SHI L L, GAO X, JIANG D, ZHONG Z Q, ZENG X, RAO Y, HU X, LI T Z, LI X J, LI L, CHEN J M, XIA Q J, WANG T H. Lentivirus-mediated Inhibition of Tumour Necrosis Factoraimproves motor function associated with PRDX6 in spinal cord contusion rats. Scientific Reports, 2015, 5: 8486.
[25] GRASSO F, DONATELLA R M. NEGRI, ROSSI A, CESOLINI A, GIOVANNELLLI A, CHIANTORE M V, LEONE P, GIORGI C, CARA A. Successful therapeutic vaccination with integrase defective lentiviral vector expressing nononcogenic human papillomavirus E7 protein. International Journal of Cancer, 2013, 132(2): 335-344.
[26] ROGERS MA, LANGBEIN L, WINTER H, EHMANN C, PRAETZEL S, SCHWEIZER J. Characterization of a first domain of human high glycine-tyrosine and high sulfur keratin associated protein(KAP)genes on chromosome 21q22.1. The Journal of Biological Chemistry, 2002, 277(50): 48993-49002.
[27] ROGERS MA, WINTER H, LANGBEIN L, WOLLSCHLAGER A, PRAETZEL S, JAVE LF, SCHWEIZER J. Characterization of human KAP24.1, a cuticular hair keratin associated protein with unusual amino-acid composition and repeat structure. Journal of Investigative Dermatology, 2007, 127(5): 1197-1204.
[28] SCHWEIZER J, BOWDEN P E, COULOMBE P A, LANGBEIN L, LANE E B, MAGIN T M, MALTAIS L, OMARY M B, PARRY D A, ROGERS M A, WRIGHT M W. New consensus nomenclature for mammalian keratins. The Journal of Cell Biology, 2006, 174(2): 169-174.
[29] KHAN I, MALDONADO E, VASCONCELOS V, O’BRIEN S J, JOHNSON W E, ANTUNES A. Mammalian keratin associated proteins (KRTAPs) subgenomes: disentangling hair diversity and adaptation to terrestrial and aquatic environments. BMC Genomics, 2014, 15(1): 1-19.
[30] PRUETT N D, TKATCHENKO T V, JAVE L, JACOBS D F, POTTER C S, TKATCHENKO A V, SCHWEIZER J, AWGULEWITSCH A. Krtap16, characterization of a new hair keratin-associated protein (KAP) gene complex on mouse chromosome 16 and evidence for regulation by Hoxc13. The Journal of Biological Chemistry, 2004, 279(49): 51524-51533.
[31] KIM S, WONG P, COULOMBE P A. A keratin cytoskeletal protein regulates protein synthesis and epithelial cell growth. Nature, 2006, 441(7091): 362-365.
[32] VIJAYARAJ P, KROGER C, REUTER U, WINDOFFER R, LEUBE RE, MAGIN TM. Keratins regulate protein biosynthesis through localization of GLUT1 and -3 upstream of AMP kinase and Raptor. The Journal of Cell Biology, 2009,187 (2): 175-184.
[33] KULESSA H, TURK G, HOGAN B L. Inhibition of Bmp signaling affects growth and differentiation in the anagen hair follicle. EMBO Journal, 2000, 19(24): 6664-6674.
(责任编辑 林鉴非)
Regulation of Related Genes by Lentivirus-Mediated K26/KAP26.1 Gene Overexpression in Mice
JIN Mei, KANG Lin, SUN DongYu, PIAO Jun, PIAO JingAi, ZHAO FengQin
(Liaoning Provincial Key Laboratory of Biotechnology and Drug Discovery, College of Life Science, Liaoning Normal University, Dalian 116029, Liaoning)
【Objective】Using the lentivirus-mediated overexpression technique, the aims of this study were at determining the effects of K26 and KAP26.1 gene overexpression on keratin-associated protein genes KAP6.2, KAP7.1, KAP8.2, and KAP11.1, and bone morphogenetic protein genes BMP4 and BMPR1B, and exploring the mechanism by which these genes influence hair fineness in mice, to achieve the goal of improving the quality of animal hair, to realize artificial regulation (such as lentivirus-mediated technology) of overexpression of some genes, and to lay a theoretical foundation for investigating the artificial regulation of mammalian hair fineness.【Method】In October, the experiment was conducted in Liaoning Provincial Key Laboratory of Biotechnology and Drug Discovery. The Kunming species mice aged five weeks were obtained from Experimental Animal Center of Dalian Medical University. The mice gene sequences of K26 (Gene ID: NM_001033397) and KAP26.1 (Gene ID: NM_027105. 2) were retrieved from Genbank, and the primers were designed according to the sequences of target genes. The healthy 293T cells were transfected with the plasmid to establish the vectors of mice K26 and KAP26.1 gene lentivirus overexpression, respectively, which were transfected into mice skin fibroblasts. Transfection efficiency was observed by quantitative fluorescence microscopy. After determining the success of lentivirus overexpression, the total RNA was extracted from the transfected cells, and after reverse transcription, the obtained cDNA was measured with the Eppendorf Realplex florescent quantitative PCR to detect the influence of K26 and KAP26.1 genes overexpression on KAP6.2, KAP7.1, KAP8.2, KAP11.1, BMP-4 and BMPR-IB gene expression 【Result】Proved by RT-PCR detection, mice lentivirus vectors pLenti6.3-K26-IRES-EGFP and pLenti6.3-K26.1-IRES-EGFP were established successfully. Compared by fluorescent field, the highest transfection rate of 293T cell transfected lentivirus vectors was reached after 72hr. Confirmed by PCR detection, packaged K26 and KAP26.1 lentivirus vectors transfected into mice fibroblast successfully after 72hr.Through RT-PCR detection and analyzed by SPSS 19 software, expression levels showed significant difference among the target genes, positive control group (empty plasmid, BLACK) and negative control group (mice skin fibroblasts, NC), indicating that after K26 overexpression, the expression level of KAP26.1 was up-regulated, and vice versa. This finding suggested synergy between K26 and KAP26.1. After K26 and KAP26.1 overexpression, the expression levels of KAP6.2, KAP7.1, KAP8.2, and KAP11.1 were down-regulated. After K26 overexpression, BMP4 gene expression increased, while BMPR1B gene expression decreased. After KAP26.1 overexpression, expression levels ofBMP4 and BMPR1B both were up-regulated. 【Conclusion】 K26 and KAP26.1 genes had a synergistic effect on the inner root sheath of the hair follicle by influencing the downstream protein synthesis signal of mTOR pathway. The high expression of K26 and KAP26.1 genes could inhibit the expression of KAP6.2, KAP7.1, KAP8.2, and KAP11.1 genes and thereby regulated hair fineness. Both K26 and KAP26.1 overexpression could up-regulate the expression level of BMP-4 gene which is the activator of BMP signaling pathway and could activate the BMP signaling pathway and then affected the growth of hair follicle cycle. K26 gene overexpression could down-regulate BMPR-IB gene expression, while KAP26.1 gene overexpression up-regulate BMPR-IB gene expression. BMPR-IB gene is the receptor I of the BMP signal. When BMPR-IB receptors decreased, the BMP downstream signal transduction will be inhibited, and then restarted hair growth cycle. When BMPR-IB receptors increased, the downstream signaling molecules transcription will be promoted, and then affected hair follicle growth cycle. Both K26 and KAP26.1 overexpression could activate BMP signaling pathway, and the expressions of KAP6.2, KAP7.1, KAP8.2, KAP11.1,BMP-4 and BMPR-IB genes were in turn regulated by the mTOR and BMP signaling pathways. But the opposite regulation effects of K26 and KAP26.1 genes on BMPR-IB gene still need to be further explored.
lentivirus-mediated; K26/KAP26.1 gene; keratin-associated protein gene; BMP signaling pathway
2016-04-28;接受日期:2016-11-03
国家自然科学基金(31172188)、大连市科技计划(2013B12NC090)、辽宁省教育厅科研项目(L201683652)联系方式:金梅,E-mail:jm6688210@163.com。通信作者赵凤琴,E-mail:eco-env@163.com

