四肢长骨骨巨细胞瘤刮除术后填充植入骨与骨水泥疗效对比研究
付来华 李廷栋 宋建民 李晶 齐江华
四肢长骨骨巨细胞瘤刮除术后填充植入骨与骨水泥疗效对比研究
付来华 李廷栋 宋建民 李晶 齐江华
目的 探讨四肢长骨非恶性初发骨巨细胞瘤刮除植骨术与刮除骨水泥填充术治疗的疗效,为临床治疗提供参考依据。方法 回顾性分析2005年1月—2013年1月经本院收治手术病例证实的四肢长骨初发非恶性骨巨细胞瘤患者53例。按其病灶刮除后植入材料的不同分为两组,肿瘤刮除骨水泥填充组27例,Jaffe病理学I级13例,II级14例。肿瘤刮除植骨术填充组26例,Jaffe病理学I级11例,II级15例;分别观察两组1年和3年术后疗效并做出比较。结果 参加入组研究患者均获得随访,平均(36.7±1.2)个月,其中根据Mankin疗效评定标准:I~II级骨巨细胞瘤刮除骨水泥填充组术后1年复发率(8.1%)低于刮除植骨组(44.4%)(χ2=4.72,P<0.05)。I~II级骨巨细胞瘤刮除骨水泥填充组术后3年复发率(18.5%)低于刮除植骨组(46.5%)(χ2=4.64,P<0.05),结果差异均具有统计学意义。结论 四肢长骨非恶性初发骨巨细胞瘤刮除骨水泥填充术后1年和3年疗效均优于治疗刮除植骨术组。在临床情况中,从降低术后复发,提高疗效角度考虑,采用肿瘤刮除骨水泥填充术治疗四肢长骨初发非恶性骨巨细胞瘤是较为理想的手术方式。
骨巨细胞瘤,刮除术,疗效,复发率
骨巨细胞瘤(giant cell tumors,GCT)占原发骨肿瘤的4%~5%,是一种具有局部侵袭性和潜在恶性的原发性骨肿瘤,多侵犯四肢长骨末端,以股骨下端、胫骨上端、桡骨远端多见[1-2]。组织学形态及生物学行为复杂多变,易复发和转移,在我国占骨肿瘤的10%~15%[2]。组织学上没有恶变就可以发生转移。1818年,Cooper首先对GCT做出描述[3]。此后的研究逐渐深入,但仍存在一些问题尚未明确,例如手术治疗常用方法的术后疗效报道不一。现研究本院采用肿瘤刮除植骨术和刮除骨水泥填充术治疗四肢长骨初发非恶性骨肿瘤53例,并随访观察这两种手术方法在四肢长骨骨巨细胞瘤中的疗效并作比较分析,为临床手术方法提供参考,报告如下。
1 材料与方法
1.1 临床资料
回顾性分析2005年1月—2013年1月我院收治经手术病理证实且随访36个月以上的四肢长骨骨巨细胞瘤患者(Jaffe病理学I~II级)53例,男28例,女25例;年龄17~54岁,平均(33.9±7.5)岁。均为初次治疗患者,术前X线平片、CT和MRI检查病例骨壳完整或大部分完整,骨外均无软组织肿块,无肺部转移灶。术前临床评价后,对拟行刮除术的非恶性骨巨细胞瘤的患者在知情情况下遵其愿望选择刮除植骨术或肿瘤刮除骨水泥填充术,将患者根据手术方式不同分为两组。
(1)肿瘤刮除骨水泥填充组患者27例,男16例,女11例;病变部位:股骨近端6例,股骨远端8例,胫骨近段10例,桡骨远端3例,均为单发病灶;初次诊断病理学分期:I级13例,II级14例。(2)肿瘤刮除植骨术填充组患者26例,男14例,女12例;病变部位:股骨近端4例,股骨远端9例,胫骨近段9例,桡骨远端4例,均为单发病灶;初次诊断病理学分期:I级11例,II级15例。
1.2 治疗方法
硬膜外麻醉下,常规患骨开窗,坚持无瘤原则,采用各种型号的刮匙反复多次搔刮病灶,某些骨嵴部分可进行高速磨钻进行瘤腔内壁骨质的打磨直至露出正常骨质,碘酒灼烧灭活残腔内壁,高渗盐水及蒸馏水浸泡,最后用大量生理盐水反复冲洗。刮除术完成后,采用自体/异体骨质或者骨水泥填充残腔。
1.3 随访指标
所有病理于术后1周内,第3、6、12个月随诊复查,1年后每半年至少定期随访1次。随诊复查临床表现,患者病变部位X线平片表现异常、怀疑复发时进一步CT和/或MRI影像学检查,复发病例均经第2次手术病理证实。
1.4 疗效评定
采用Mankin提出的评分原则[4],将术后疗效分为优、良、中和差4级:优:肿瘤无并发症,肢体或局部功能基本正常,日常生活不受或者稍受影响;良:无明显并发症及疼痛,但肢体功能受限,不用支具可以负重,可从事大部分日常生活,但不能从事剧烈活动;中:肿瘤无复发,但功能受限,需用支具,日常生活受影响;差:因肿瘤复发须再次手术。
植骨术后1年疗效评估如图1。
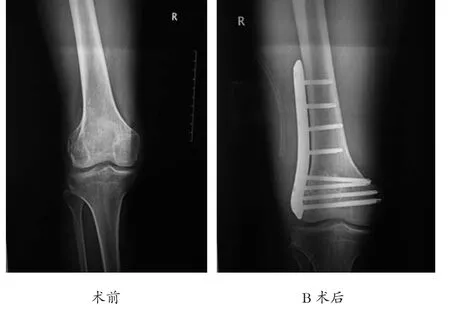
图1 右侧股骨下段I级GCT,肿瘤骨刮除术植骨术
骨水泥填充术后3年疗效评估如图2。
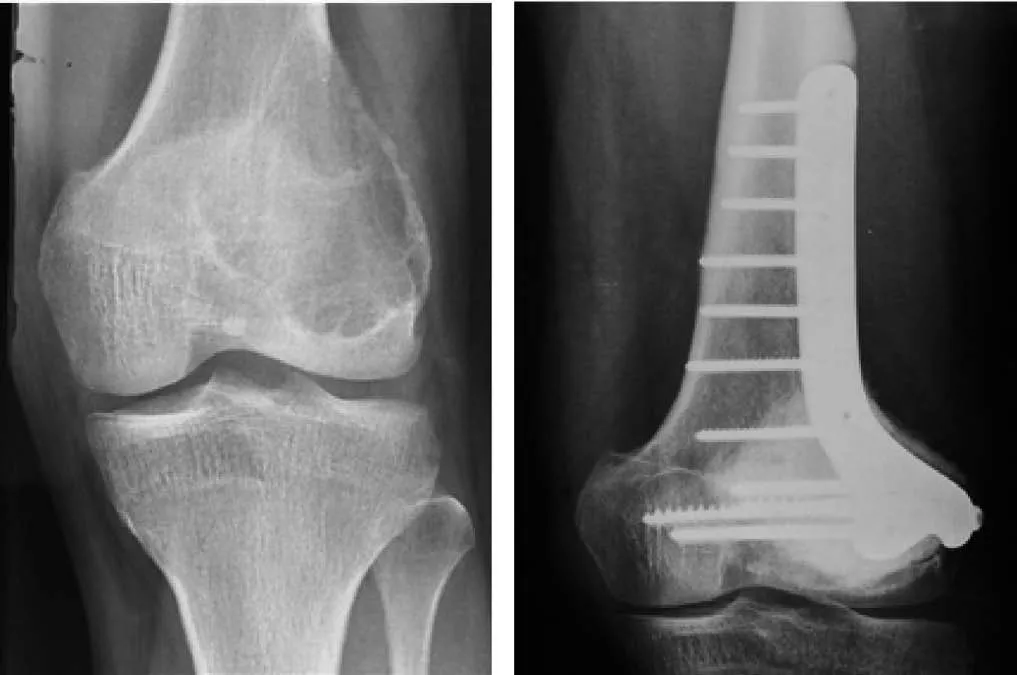
图2 右侧股骨下段II级GCT,肿瘤骨刮除术骨水泥填充术
1.5 统计学分析
采用SPSS 17.0统计学软件进行结果处理,两组采用不同手术方法之后的疗效比较采用χ2检验,检验水准α=0.05(双侧),以P<0.05为差异有统计学意义。
2 结果
所有病例获得随访,随访时间36个月以上,根据Mankin疗效评判标准评定结果如下:
2.1 术后1年疗效评估
I~II级骨巨细胞瘤刮除植骨组(26例)总的术后1年疗效优良率和复发率分别为44.6%和44.4%,而刮除骨水泥填充组中I~II级骨巨细胞瘤(27例)总的术后1年疗效优良率和复发率分别为81.4%和8.1%,I~II级骨巨细胞瘤刮除植骨组和刮除骨水泥填充组的术后1年复发率之间差异具有统计学意义(χ2=4.72,P<0.05),见表1。

表1 两种不同手术方式、病理分级与术后1年疗效随访

表2 两种不同手术方式、病理分级与术后3年疗效随访
2.2 术后3年疗效评估
I~II级骨巨细胞瘤刮除植骨组中(26例)总的术后3年疗效优良率和复发率分别为46.1%和46.11%,而刮除骨水泥填充组中I~II级骨巨细胞瘤(27例)总的术后3年疗效优良率和复发率分别为70.3%和18.5%,I~II级骨巨细胞瘤刮除植骨组和刮除骨水泥填充组术后3年复发率之间差异具有统计学意义(χ2=4.64,P<0.05),见表2。
3 讨论
骨巨细胞瘤分为骨巨细胞瘤和恶性骨巨细胞瘤两大类,临床表现无特异性,当病变破坏骨皮质并刺激骨膜时或当骨的强度下降即将出现病理骨折时,可以产生临床症状。同大多数骨肿瘤一样,往往因局部的肿胀和疼痛而发现。肿瘤好发于20~40岁青壮年的长骨骨端,临床上以采取保肢手术治疗为主,主要包括肿瘤刮除术和瘤段切除术。不同治疗方法直接影响到肢体功能的恢复,病灶刮除是基本治疗手段,单纯刮除,局部复发率较高,文献报道,病灶刮除术后单纯植骨填充、不使用其他辅助措施,其复发率在12%~65%[4]。故首次手术方式的选择十分重要。临床上以保留邻近关节的功能,改善患者生活质量为目的,对Jaffe病理学I~II级的骨巨细胞瘤行肿瘤刮除术。目前文献报道的假体置换治疗骨巨细胞瘤的近期随访结果显示疗效良好[5-7]。肿瘤刮除加植骨治疗是先行肿瘤组织刮除后再行自体骨或异体骨移植填充骨质缺损区,依赖移植骨与母体骨融合获得治愈。肿瘤刮骨加骨水泥填充治疗是先行肿瘤组织刮除后再行骨水泥填充骨质缺损区,骨水泥与周围骨质不会融合。
Jaffe等1940年提出的分级标准主要依据巨细胞数的多寡及间质细胞的分化程度。随着临床对骨巨细胞瘤的逐步认识,I~II级骨巨细胞瘤的生物性行为并非良性特点,术后易复发,并可发生远处转移。目前,手术方式与GCT术后复发的关系已经定论,不同术式,复发率不同,但以病灶刮除、整块或大段切除为主,不管采取何种方式手术,其关键为彻底的清楚肿瘤为防止复发的关键[5]。以往文献报道骨巨细胞瘤术后局部复发率为2.5%~45.0%,以术后24个月复发多见[6-7]。以往文献报道骨巨细胞瘤术后局部复发率为2.5%~45%,以术后24个月复发多见[6-8]。郭乾臣等[5]研究显示,肿瘤所在部位与肿瘤复发无明确关系,而与手术方式相关。骨巨细胞瘤复发原因复杂多样,但首次手术方式的选择对是否复发有着重要影响[5]。因此应术前完善CT及MRI影像学资料,结合患者具体病变局部情况、肿瘤所在部位等选择手术方式。本组资料研究显示四肢长骨I~II级骨巨细胞瘤刮除植骨术和刮除骨水泥填充术后1年复发率分别为44.4%和8.1%;四肢长骨I~II级骨巨细胞瘤刮除后3年复发17例中,骨水泥植入患者在1年和3年疗效均优于刮除植骨术。肿瘤刮除术类似边缘切除,难以完全清除骨腔内壁残留的肿瘤细胞,易在填充的骨质或骨水泥周围留下复发的隐患。刮除术填充骨水泥相对于植骨术,填充的骨水泥可以与残腔刮除缘牢固结合,另外,骨水泥聚合过程由于聚甲基丙烯酸甲酯(PM-MA)单体的细胞毒性,聚合时释放的热量,能使肿瘤组织部分或者全部变性、坏死,起到局部抗肿瘤作用。骨水泥聚合反映后产生的热效应可使骨皮质深部2~3 mm产生坏死,而未聚合的甲酯单体的化学毒性作用也有助于杀灭瘤细胞[7-8]。
本病患者年龄多较轻,有较多活动量,临床应结合个体选择手术方式以得到理想远期肢体功能。本组研究骨水泥植入组术后1年及3年随访复发率均低于植骨术,获得了较好治疗效果,证明了该术式的可行性,另外,骨水泥费用低廉,使用方便,无供体并发症,能即可恢复重建后稳定性,是临床上一种较为可靠的手术方法。
[1] Gao,ZH,Yin JQ,Xie XB,et al. Local control of giant cell tumors of the long bone after aggressive curettage with and without bone cement[J]. BMC Musculoskeletal Disorders,2014,2(15): 330.
[2] 刘潭,陈卫东,商冠宁. 骨巨细胞瘤的临床治疗进展[J]. 中国肿瘤外科杂志,2013,5(6): 377-379.
[3] Cooper A,Travers B. Surgical Essays,Part I[M]. London: Cox,Longman,1818: 178-179.
[4] Unni KK,Inwards CY,Inwards,et al. Dahlin’s bone tumors: general aspects and data on 10,165 cases[J]. Lippincott Williams andWilkins,2009:225-243.
[5] Kivioja AH,Blom qvist C,Hietaniemi K,et al. Cement is recommended in intral esional surgery of giant cell tumors:a Scandinavian sarcoma group study of 294 patients followed for a median time of 5 years[J]. Acta Orthop,2008,79(1): 86-93.
[6] Sun S,Zhang Q,Zhao CS,et al. Long-term outcomes of ultrasonic scalpel treatment in giant cell tumor of long bones[J]. Oncology letters,2014,8(1): 145-150.
[7] Panzica M,Lueke U,Omar M,et al. New therapy approaches for giant cell tumors[J]. Unfallchirurg,2014,117(10): 883-891.
[8] Zhang S,Xu MT,Wang Xq,et al. Functional outcome of en bloc excision and custom prosthetic replacement for giant cell tumor of the distal radius[J]. Journal of orthopaedic science,2015,20(6): 1090-1097.
Comparison of the Therapeutic Outcomes of Two Implants in Curettage Treatment for Giant Cell Tumor of Long Extremity Bones
FU Laihua LI Tingdong SONG Jianmin LI Jing QI Jianghua Department of Bone and Soft Tissue Tumors, Gansu Tumour Hospital, Lanzhou Gansu 730050, China
Objective To compare the therapeutic outcomes of curettages with bone graft and with bone cement f i lling for initial non-malignant giant cell tumor of long extremity bones. Methods A retrospective review of treatment outcomes was preformed in 53 patients with initial non-malignant GCTs, which were confirmed by surgical pathology and followed up more than 3 years. According to the different treatment method, all patients were divided into 2 groups. Group 1 that was treated by curettage of tumor and packing the cavity with bone cement, consisted of 27 patients. By Jaffe’s classification, 13 patients had grade 1 and 14 patients had grade II. Group 2 that was treated by curettage of tumor and packing the cavity with bone graft consisted of 26 patients. By Jaffe’s classification, 11 patients had grade 1 and 15 patients had grade II. Results The therapeutic outcomes were evaluated by Mankin’s standard. The recurrence rate after 1 year for grades I and II GCT with curettage in the bone cement packing group (8.1%) was lower than that of the bone grafting group (44.4%)(χ2=4.72, P < 0.05). The recurrence rate after 3 years in the bone cement packing group (18.5%) was lower than of the bone grafing group (46.5%)(χ2=4.64, P < 0.05). Conclusion For curettage initial non-malignant GCT of long bones, the 1-year and3-year therapeutic outcomes of bone cement treatment were better than those of graft treatment.
GCT; Curettage; effect; recurrence rate
R683
A
1674-9316(2017)10-0059-04
10.3969/j.issn.1674-9316.2017.10.033
甘肃肿瘤医院骨与软组织肿瘤科,甘肃 兰州 730050
付来华

