胶束电动毛细管色谱法测定金花茶和六堡茶中多糖的单糖组成
陆建平,覃梦琳,布静龙,梁海清,童张法
(广西大学化学化工学院,广西石化资源加工及过程强化技术重点实验室,南宁530004)
胶束电动毛细管色谱法测定金花茶和六堡茶中多糖的单糖组成
陆建平,覃梦琳,布静龙,梁海清,童张法
(广西大学化学化工学院,广西石化资源加工及过程强化技术重点实验室,南宁530004)
超声辅助提取茶中多糖,经纯化后以2mol·L-1硫酸溶液降解成单糖、1-苯基-3-甲基-5-吡唑啉酮衍生化后用胶束电动毛细管色谱法测定。优化的电泳条件为:缓冲溶液为pH 10的40mmol·L-1Na2B4O7-20mmol·L-1SDS,分离电压10kV,进样高度10cm,进样时间10s。8种单糖的线性范围均为10.0~180mg·L-1,检出限(3S/N)为4.87~8.32mg·L-1。测得相对标准偏差(n=5)为3.0%~7.5%,加标回收率为98.0%~105%。金花茶多糖和六堡茶多糖的单糖组成均为阿拉伯糖、葡萄糖、鼠李糖、甘露糖、半乳糖、半乳糖醛酸,前者物质的量之比为0.29∶0.02∶0.10∶0.06∶0.42∶0.35;后者物质的量之比为0.13∶0.19∶0.09∶0.05∶0.16∶0.03。
胶束电动毛细管色谱法;多糖;单糖;金花茶;六堡茶
金花茶是广西特有的植物资源,是国家一级保护植物。它不仅具有很好的观赏价值,还含有多种生理活性物质如茶多酚、茶多糖和微量元素等[1]。研究表明,金花茶具有降血脂[2]、抗氧化[3]、抗癌[4]等作用。六堡茶是广西梧州的名茶,除含多种活性成分和矿物元素[5]外,具有增强免疫力[6]、降血脂[7]、抗氧化[8]等功能。多糖的单糖分析方法有薄层色谱法[9]、高效液相色谱法[10]、气相色谱法[11]和高效毛细管电泳法[12]等。高效毛细管电泳具有快速、高效、所需样品量少等特点。目前关于多糖的单糖分析多用毛细管电泳区带电泳测定,胶束电动毛细管色谱法测定多糖少有报道,同时关于金花茶和六堡茶的多糖分析也少。超声提取多糖具有提取率高、提取时间短等特点,本工作以超声提取金花茶和六堡茶的多糖,采用胶束电动毛细管色谱法测定多糖的单糖组成。
1 试验部分
1.1 仪器与试剂
CL 1020型高效毛细管电泳仪;熔融石英毛细管(50μm×50cm);PXSJ-216型离子分析仪;AL 104型电子天平;RE-52AA型旋转蒸发器。
单糖标准溶液:分别称取木糖0.188 3g、阿拉伯糖0.188 1g、一水葡萄糖0.248 0g、一水鼠李糖0.227 6g、甘露糖0.225 3g、半乳糖0.225 1g、葡萄糖醛酸0.243 0g和一水半乳糖醛酸0.265 3g置于25mL容量瓶中,加水溶解并定容,摇匀。
内标溶液:称取硫代氨基脲1.250 0g置于50mL容量瓶中,加水溶解并定容,摇匀。
衍生溶液:0.5mol·L-1,称取1-苯基-3-甲基-5-吡唑啉酮(PMP)4.355g置于50mL容量瓶中,用甲醇溶解并定容。
所用试剂均为分析纯,试验用水为去离子水。
1.2 仪器工作条件
分离电压10kV,检测波长245nm,进样方式为虹吸进样,进样时间10s,进样高度10cm,缓冲溶液为pH 10的40mmol·L-1四硼酸钠-20mmol·L-1十二烷基硫酸钠(SDS)溶液。每次电泳试验前,用0.1mol·L-1氢氧化钠溶液、水各冲洗10min,然后用缓冲溶液平衡15min。试验所用溶液均用0.45μm微孔滤膜过滤,每2次进样用缓冲溶液冲洗毛细管3min。
1.3 试验方法
1.3.1 多糖的提取
称取已烘干的过0.425mm筛的茶粉末20g置于500mL烧杯中,加水300mL,在70℃超声60min[13],重复提取3次,合并提取液,减压浓缩至50mL。移取金花茶和六堡茶浓缩液各50.00mL,加乙醇250mL,静置过夜;离心后收集下层固体,并溶于水中;经活性炭脱色[14]后,用三氯甲烷-正丁醇(4+1)混合液5mL除蛋白,再加水至30mL,加乙醇150mL,静置过夜,离心收集下层固体,并于60℃下干燥,即可得多糖。
1.3.2 多糖的降解
称取多糖40mg,溶于2mol·L-1硫酸溶液3.0mL中,密封,在沸水中降解5h,冷却后,以4mol·L-1氢氧化钠溶液中和,定容至10mL,待衍生。
1.3.3 单糖的衍生与测定
移取供试品溶液2.00mL,加入0.5mol·L-1衍生溶液0.6mL和0.5mol·L-1氢氧化钠溶液0.5mL,在70℃水浴反应30min,冷却至室温后加入0.5mol·L-1盐酸溶液0.5mL中和,加三氯甲烷3mL萃取去除过量的PMP,再加内标溶液0.1mL,定容至5mL,用0.45μm微孔滤膜过滤,按仪器工作条件测定。
2 结果与讨论
2.1 仪器工作条件的选择
2.1.1 缓冲溶液的酸度
缓冲溶液的酸度会影响毛细管电泳的电渗流,因此调节pH可以改善被测物的迁移行为和分离效率。试验考察了pH在9.5~10.4范围内各组分的分离情况,结果见图1。
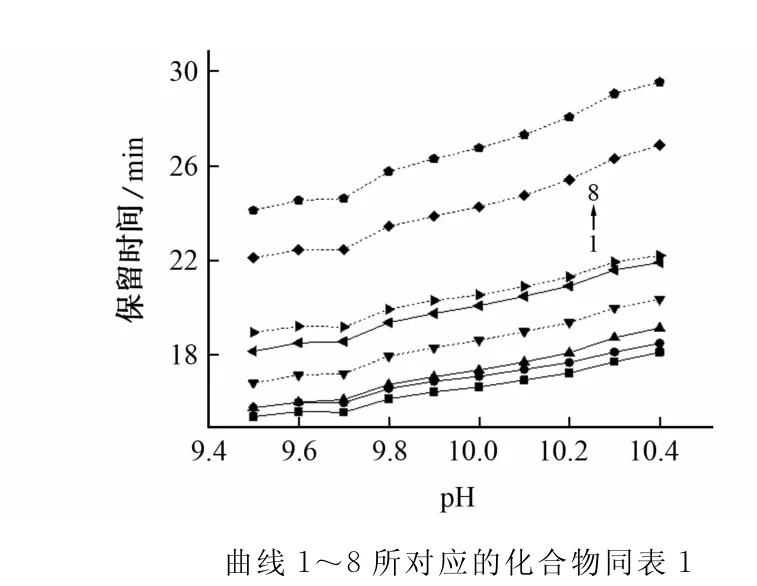
图1 缓冲溶液的酸度对各组分分离的影响Fig.1 Effect of the acidity of buffer solution on the separation of components
由图1可知:pH小于9.6时,阿拉伯糖和葡萄糖的保留时间一致;随着pH的增大,各峰的保留时间延长,电流增大,分离度增加;当pH大于10时,甘露糖和半乳糖的分离度开始减小,同时噪声和基线也增大。试验选择缓冲溶液的pH为10。
2.1.2 四硼酸钠的浓度
四硼酸钠的浓度会影响电泳介质的离子强度和电渗流。试验考察了四硼酸钠浓度在20~50mmol·L-1之间时各组分的分离情况,结果见图2。
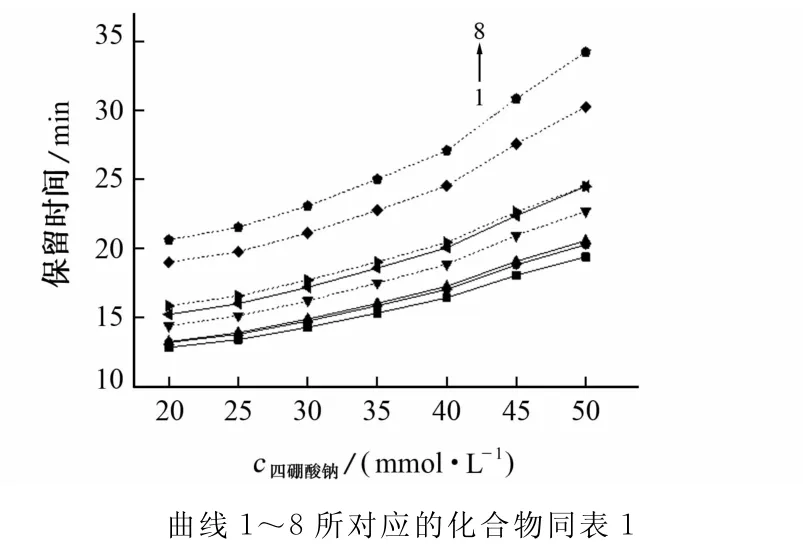
图2 四硼酸钠浓度对各组分分离的影响Fig.2 Effect of Na2B4O7concentration on the separation of components
由图2可知:随四硼酸钠浓度的增加,各峰的分离度增大;当四硼酸钠浓度大于40mmol·L-1时,阿拉伯糖和葡萄糖、甘露糖和半乳糖这两对峰的分离度逐渐减小。试验选择四硼酸钠的浓度为40mmol·L-1。
2.1.3 SDS的浓度
SDS在缓冲溶液中形成胶束,糖的衍生物在水相和胶束相间分配,通过与胶束间的作用力差异达到分离的目的。试验考察了SDS的浓度在5~60mmol·L-1内各组分的分离情况,结果见图3。
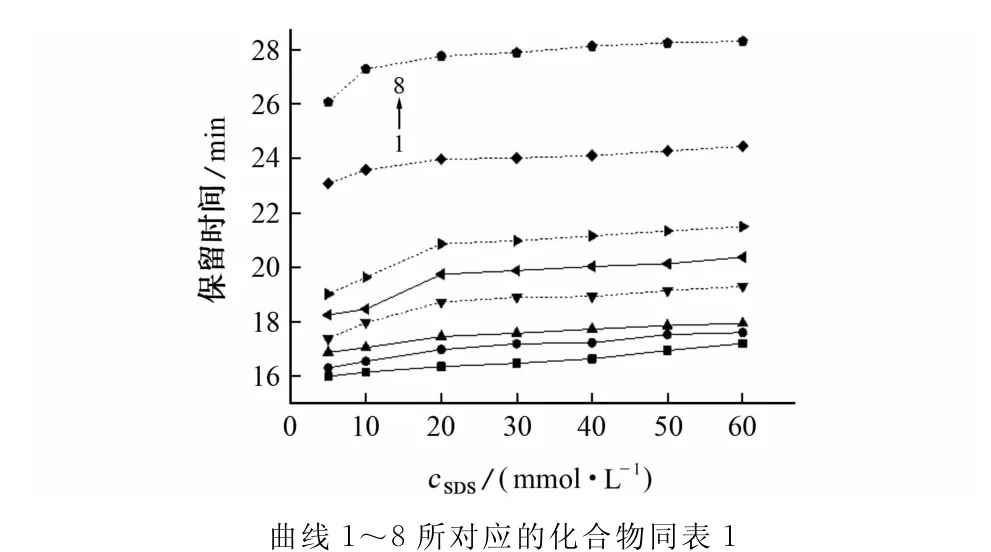
图3 SDS浓度对各组分分离的影响Fig.3 Effect of SDS concentration on the separation of components
由图3可知:随SDS的浓度增大,阿拉伯糖和葡萄糖的分离度逐渐增大,甘露糖和半乳糖的分离度逐渐减小,变化幅度不大。综合考虑分离度和分析时间,试验选择SDS的浓度为20mmol·L-1。
2.1.4 分离电压
分离电压也是控制电渗流的一个重要参数,电压增大,样品的迁移时间延长,分析时间缩短,但基线逐渐不平稳,会使灵敏度降低。试验考察了分离电压为8,10,12,14,16,18kV时各组分的分离情况,结果见图4。
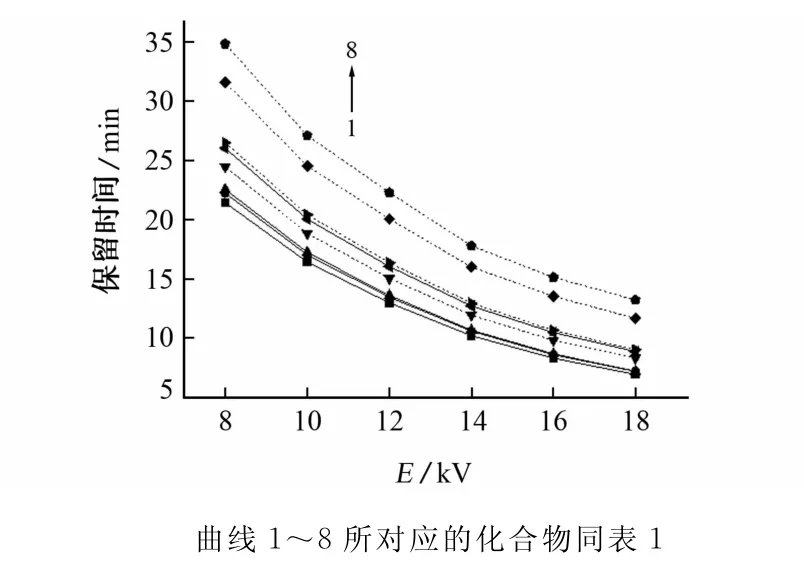
图4 工作电压对各组分分离的影响Fig.4 Influence of voltage on the separation of compounds
由图4可知:随电压的增大,迁移时间逐渐延长,分离度逐渐减小,综合考虑,试验选择分离电压为10kV。
2.2 内标物的选择
试验比较了二苯胍、硫代氨基脲、4-氨基安替比林等为内标时的谱图,见图5。
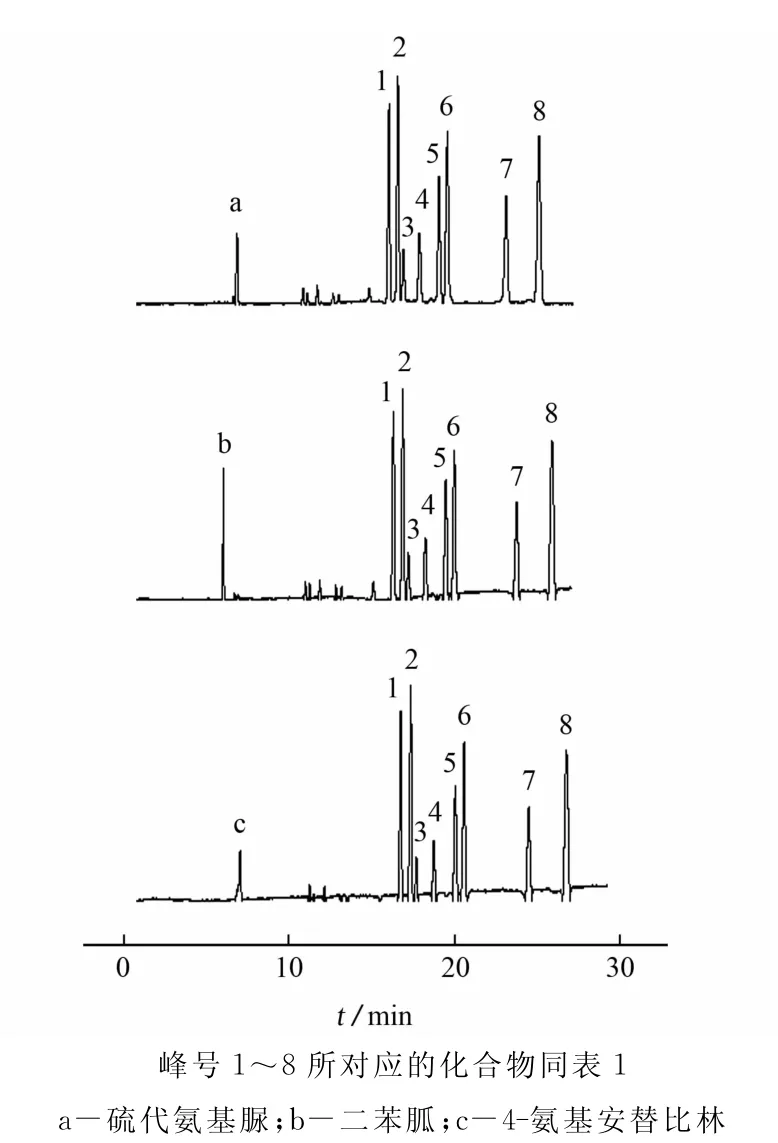
图5 内标的对比谱图Fig.5 Comparison diagrams of internal standard
由图5可知:相同条件下,硫代氨基脲较靠近糖峰,且峰面积较大,试验选择硫代氨基脲为内标。
2.3 标准曲线与检出限
按试验方法测定单糖的标准溶液系列,以单糖的质量浓度为横坐标,单糖与内标的峰面积比值为纵坐标绘制标准曲线,其线性回归方程、相关系数见表1。按3倍信噪比计算方法的检出限(3S/N),见表1。
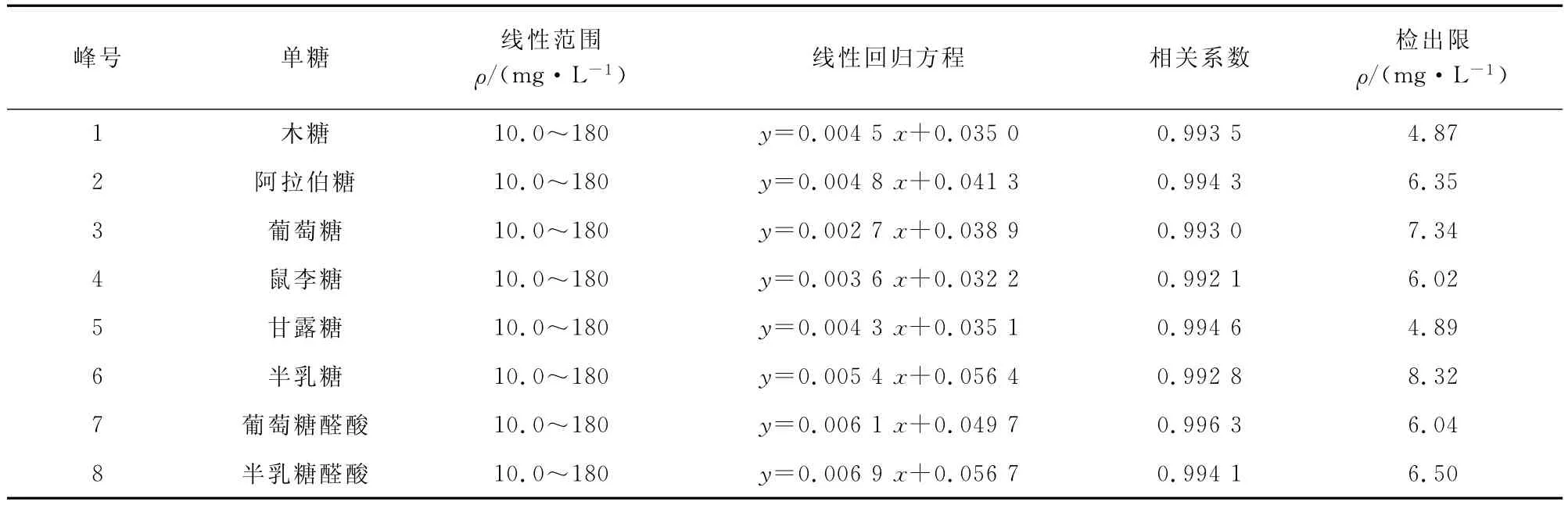
表1 线性参数及检出限Tab.1 Linearity parameters and detection limits
2.4 精密度试验
在最佳试验条件下,对90mg·L-1单糖(含100mg·L-1内标物)标准溶液平行测定5次,以单糖与内标的峰面积之比计算相对标准偏差(RSD),结果见表2。
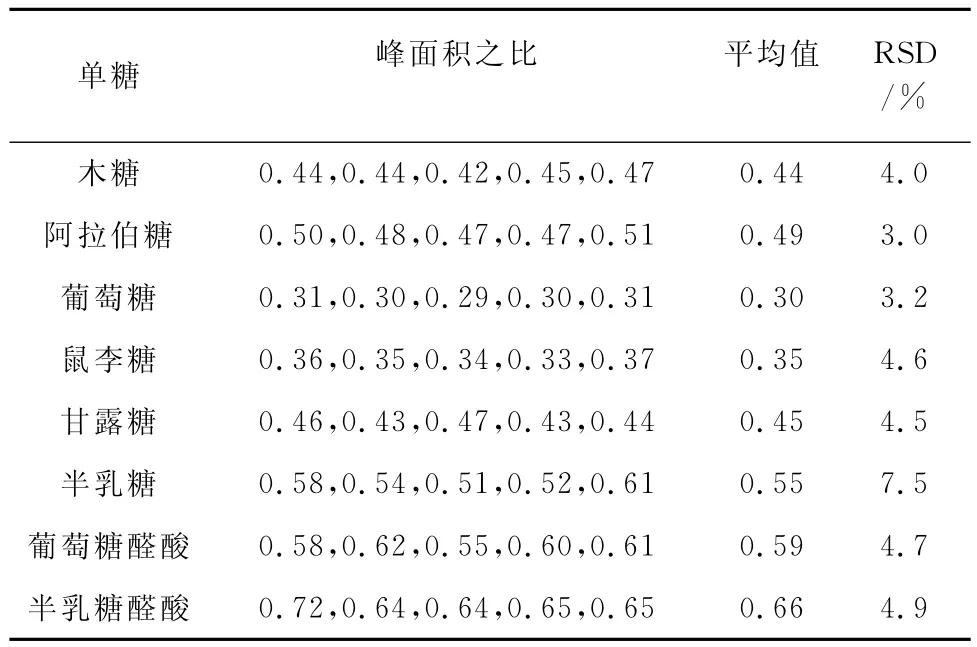
表2 精密度试验结果(n=5)Tab.2 Results of test for precision
2.5 稳定性试验
取同一样品溶液,分别于2,4,6,8h进行测定,试验结果发现,8种单糖测定值的RSD均小于2.5%,表明样品溶液在8h内稳定。
2.6 回收试验
称取已知含量的六堡茶多糖40mg降解,分别移取降解液2.00mL至9个离心管中,各加入单糖0.25mg,衍生后按仪器工作条件平行测定3次,结果见表3。
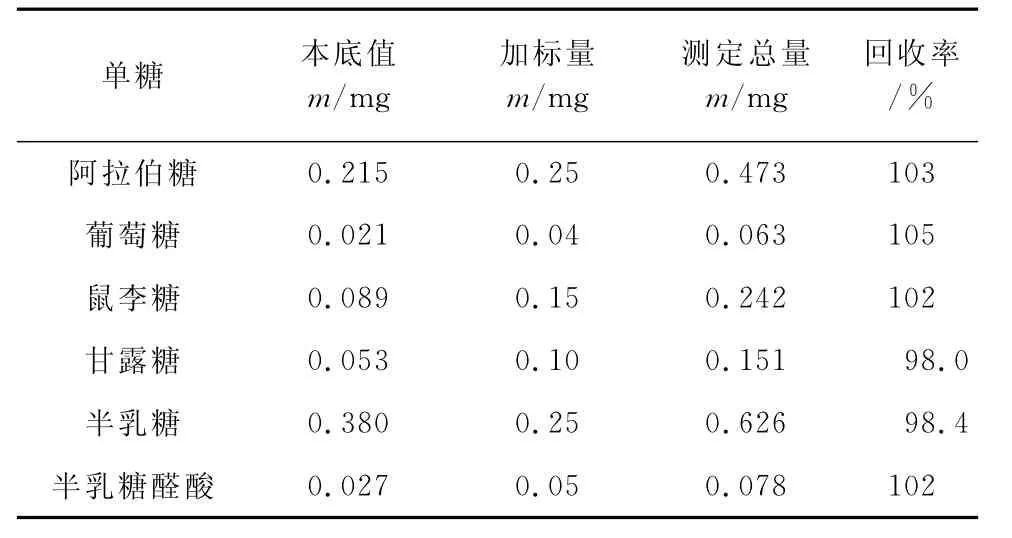
表3 回收试验结果Tab.3 Results of test for recovery
2.7 样品分析
移取金花茶多糖和六堡茶多糖的降解液各2.00mL,衍生后按仪器工作条件进行测定。结果发现:金花茶多糖和六堡茶多糖的单糖组成相同,均为阿拉伯糖、葡萄糖、鼠李糖、甘露糖、半乳糖和半乳糖醛酸,但各单糖比例不同。金花茶多糖中上述各单糖物质的量之比为0.29∶0.02∶0.10∶0.06∶0.42∶0.35,六堡茶多糖中上述各单糖物质的量之比为0.13∶0.19∶0.09∶0.05∶0.16∶0.03,见图6。其中金花茶多糖的试验结果与文献[15]报道的不一致,多了甘露糖组分。
本工作用超声辅助提取金花茶和六堡茶中的多糖,然后经过纯化、降解、衍生,采用胶束电动毛细管色谱法对单糖进行测定,取得了较好的分离效果。方法简单、快速、分离效率高,可用于茶多糖中单糖组成的测定。

图6 单糖衍生(a)、六堡茶多糖样品(b)和金花茶多糖样品(c)降解的色谱图Fig.6 Chromatograms of monosaccharide derivative(a),degraded of Liupu tea polysaccharide samples(b)and Camellia polysaccharides samples(c)
[1] LIN J N,LIN H Y,YANG N S,et al.Chemical constituents and anticancer activity of yellow camellias against MDA-MB-231human breast cancer cells[J].Journal of Agricultural and Food Chemistry,2013,61(40):9638-9644.
[2] 韦璐,秦小明,林华娟,等.金花茶多糖的降血脂功能研究[J].食品科技,2008,33(7):247-249.
[3] WAN C P,YU Y Y,ZHOU S R,et al.Antioxidant and free radical scavenging activity of camellia nitidissima Chi[J].Asian Journal of Chemistry,2011,23(7):2893-2897.
[4] 唐小岚,段小娴,苏建家,等.金花茶和银杏叶对2-乙基亚硝胺致大鼠肝癌前病变抑制作用的初步研究[J].实用癌症杂志,2007,22(3):224-227.
[5] 刘小玲,李颖,姜元欣,等.广西六堡茶主要特征成分分析[J].北京工商大学学报(自然科学版),2012,30(1):46-50.
[6] 刘冠萍,黄宇声,张栩颜,等.六堡茶对小鼠免疫功能的影响[J].中国医学创新,2013,10(6):155-156.
[7] 张栩颜,黄宇声,刘冠萍,等.六堡茶对高脂血症小鼠血脂及脂质过氧化的影响[J].医学理论与实践,2013,
26(5):563-564.
[8] 赵宝权,邵宛芳,刘家奇,等.六堡茶、黑茶茶粉和普洱(熟茶)茶粉对Wistar大鼠调节血脂及抗氧化功能的比较研究[J].云南农业大学学报,2013,28(2):236-241.
[9] 钱夕惠.薄层色谱法分析灵芝多糖中的单糖组成[J].中国现代药物应用,2013,7(18):13-14.
[10] 罗立梅,陈朝银,李时琪,等.高效液相色谱-蒸发光散射法测定皂荚壳多糖的单糖组分及其含量[J].理化检验-化学分册,2013,49(3):270-273.
[11] 高庚申,李存雄,张明时.预衍生化-毛细管柱气相色谱法测定单糖[J].理化检验-化学分册,2009,45(10):1225-1227.
[12] 郑春英,牛雯颖,吴优.高效毛细管电泳法分析茯苓多糖中的单糖组成[J].中国食品学报,2013,13(5):254-258.
[13] 周晓晴,余飞,邓丹雯,等.超声波辅助提取茶鲜叶中茶多糖实验研究[J].江西食品工业,2008(4):39-41.
[14] 廖春燕,杨远萍.桔梗多糖活性炭脱色工艺研究[J].食品工业,2011(11):22-24.
[15] 林华娟,田晓春,秦小明,等.金花茶多糖单一成分的化学结构特征解析[J].食品科学,2013,34(3):141-146.
MECC Determination of Monosaccharide Composition of Polysaccharides in Camellia and Liupu Teas
LU Jian-ping,QIN Meng-lin,BU Jing-long,LIANG Hai-qing,TONG Zhang-fa
(Guangxi Key Laboratory of Petrochemical Resource Processing and Process Intensification Technology,College of Chemistry and Chemical Engineering,Guangxi University,Nanning530004,China)
The polysaccharides in teas were obtained by ultrasonic assisted extraction.After purified,the polysaccharides were hydrolyzed to become monosaccharides with 2mol·L-1sulfuric acid.Their derivatives were obtained after monosaccharides reacted with 1-phenyl-3-methyl-5-pyrazolone,and determined by micellar electrokinetic capillary chromatography(MECC).The optimized electrophoresis conditions were as follows:the buffer solution was 40mmol·L-1Na2B4O7-20mmol·L-1SDS with pH 10,separation voltage was 10kV,injection height was 10cm,and injection time was 10s.Linearity ranges for 8monosaccharides were kept in the same range of 10.0-180mg·L-1,with values of detection limits(3S/N)in the range of 4.87-8.32mg·L-1.Values of RSDs(n=5)ranged from 3.0%to 7.5%.Test for recovery was made by standard addition method,giving results in the range of 98.0%-105%.Monosaccharide composition of polysaccharides in both camellia and liupu tea were arabinose,glucose,rhamnose,galactose,mannose and galacturonic acid.The ratio of the amount of substance was 0.29∶0.02∶0.10∶0.06∶0.42∶0.35for Camellia,and 0.13∶0.19∶0.09∶0.05∶0.16∶0.03 for Liupu tea.
MECC;Polysaccharide;Monosaccharide;Camellia;Liupu tea
O657.8
A
1001-4020(2017)04-0442-05
10.11973/lhjy-hx201704015
2016-03-08
广西石化资源加工及过程强化技术重点实验室主任课题基金(2014K0010)
陆建平(1955-),男,江苏常州人,教授,博士,研究方向为食品分析。E-mail:ljianpi@hotmail.com

