槐糖脂合成的廉价底物替代研究进展
刘新歌,马晓静,何洪波,姚日生
(合肥工业大学生物与医学工程学院,安徽合肥230009)
槐糖脂合成的廉价底物替代研究进展
刘新歌,马晓静,何洪波,姚日生
(合肥工业大学生物与医学工程学院,安徽合肥230009)
槐糖脂是一类主要由酵母菌合成的、目前发酵水平最高的生物表面活性剂。由于其优良的理化活性和生物活性,近些年得到了广泛的关注。发酵成本较高是制约槐糖脂大规模应用的最主要因素,廉价底物替代是降低其生产成本的有效途径。本文中,笔者从槐糖脂的合成通路出发,对槐糖脂合成在廉价底物选择和替代效果方面的研究进行综述,文中主要将廉价底物分为还原糖、脂肪酸类、烃、工业副产品和木质纤维素五大类,分析各自的优缺点。最后,对槐糖脂的工业化生产进行了展望,提出了木质纤维素类材料在槐糖脂合成中的重要潜在价值。
槐糖脂;合成代谢;碳源;廉价底物
槐糖脂(sophorolipids,SLs)是一类主要由非致病性酵母菌分泌的混合物,分为酸型和内酯型两类[1]。槐糖脂作为一种新型生物表面活性剂,因其具有产量高、生物可降解、环境友好、抗菌、抗肿瘤活性以及低毒性等优点,近年来备受关注[2-5]。
与化学表面活性剂相比,槐糖脂生产需要较高的生产成本(2~5 C=/kg),这限制了它的进一步开发和应用,而生产成本中的10%~30%来源于发酵底物——碳源[6]。槐糖脂合成中所提供的碳源种类不同,合成途径也有所差异。当发酵培养基中亲水性碳源和疏水性碳源同时存在时,槐糖脂的产量最高。选择价格低廉的工农业废弃物替代槐糖脂合成所需的疏水性和亲水性碳源是降低其成本的最有效途径之一。更重要的是,随着人类资源问题和环境问题的日益突出,通过微生物将废弃资源及可再生资源转化为生物表面活性剂及其他相关代谢产品,部分替代化石资源和动植物资源,是可持续发展的必然。

图1 以不同种类碳源为底物时槐糖脂的合成途径Fig.1 Biosynthetic pathway of sophorolipid with different carbon sources
目前,在槐糖脂发酵研究中,可替代碳源的廉价底物主要涉及还原糖类、脂肪酸类、烃类、工业副产品以及木质纤维素五大类。由于槐糖脂生物合成途径的不同,其结构和积累速率有所差异,因此,不是所有的廉价底物都能带来生产成本的降低。本文就相关研究进行总结分析,以期为槐糖脂的应用开发提供参考。
1 槐糖脂的生物合成
槐糖脂的生物合成通路如图1所示。由图1可知:当底物为还原糖、糖蜜、蜂蜜、甘油以及木质纤维素等时,其均可转化为还原糖,借助糖酵解途径(EMP),分解为丙酮酸,然后在丙酮酸脱羧酶的作用下生成乙酰CoA,进入三羧酸循环(TCA),为菌体的生长提供能量。当底物为烃、醇、醛、油脂、酯化油脂、脂肪酸和酯化脂肪酸等时,均可以脂肪酸形式存在。当培养基中只含有亲水性底物时,乙酰CoA通过从头合成转化为脂肪酸;当培养基中仅有疏水性底物时,脂肪酸通过β-氧化转化为乙酰CoA;当两种必需物质(活化后的葡萄糖和脂肪酸)同时存在时,脂肪酸在细胞色素P450单加氧酶(CytP450)催化下,转化为ω-/ω-1羟基脂肪酸,并和葡萄糖在葡萄糖基转移酶Ⅰ的作用下将1个葡萄糖分子转移到ω-/ω-1羟基脂肪酸生成葡萄糖酯,在葡萄糖基转移酶Ⅱ的作用下和另一个葡萄糖分子生成酸型槐糖脂。最后,在乙酰基转移酶/内酯酯酶的作用下,生成乙酰化的槐糖脂[7-9]。
综上所述,尽管发酵培养基提供的碳源底物有所不同,但是它们最终均可转化为活化的葡萄糖和脂肪酸,进而开始槐糖脂的合成,但其产量、合成效率和生产成本必然会受到底物转化路径的影响。因此,考察和比较不同廉价底物替代效果的途径之一就是探索底物向葡萄糖和脂肪酸转化的途径和效率。
2 槐糖脂合成的廉价底物替代
本文中,笔者将可用于槐糖脂发酵生产的廉价底物分为五类,分别是还原糖类、脂肪酸类、烃类、工业副产品及木质纤维素类,并对此五类进行综述。
2.1 还原糖类底物
目前,文献报道的可用于槐糖脂合成的还原糖主要包括单糖(葡萄糖、果糖和甘露糖等)和多糖(蔗糖、乳糖、麦芽糖和棉籽糖等)两大类。其中,葡萄糖是槐糖脂合成中最常用的亲水性碳源,可与多种疏水性碳源配合用作槐糖脂发酵的复合碳源,也是槐糖脂廉价底物替代的参照对象。以还原糖为替代底物的槐糖脂合成研究情况总结于表1。由表1不难发现,以还原糖作为唯一碳源产槐糖脂的评价性研究主要集中在20世纪90年代初期[10-13],因研究体系较简单,并未有人对其生物合成途径进行系统的分析论证。

表1 以还原糖为替代底物的槐糖脂合成研究概览
注:a—氮源为酵母粉(yeast extract);b—槐糖脂产量由产率换算而得。
当以葡萄糖为唯一碳源时,微生物吸收培养基中的葡萄糖,经EMP分解为丙酮酸,其中一部分通过糖异生途径合成新的葡萄糖分子;另一部分在丙酮酸脱氢酶的作用下,生成乙酰CoA,部分乙酰CoA进入三羧酸循环(TCA),为菌体的生长代谢提供能量,部分则通过从头合成转化为脂肪酸。当以单糖(非葡萄糖)为碳源时,其合成途径与葡萄糖相同,但槐糖脂积累速率相对较滞后,其主要是底物进入糖酵解途径的方式和速率不同。糖酵解路径通常为葡萄糖→6-磷酸葡萄糖→6-磷酸果糖→1,6-二磷酸果糖→3-磷酸甘油醛+磷酸二羟丙酮→1,3-二磷酸甘油酸→D-3-磷酸甘油酸+ATP→D-2-磷酸甘油酸→磷酸烯醇式丙酮酸→丙酮酸+ATP。
以果糖、半乳糖和甘露糖为例,其进入糖酵解途径为①D-果糖→1-磷酸果糖→甘油醛→3-磷酸甘油醛+磷酸二羟丙酮;②D-半乳糖→1-磷酸半乳糖→1-磷酸葡萄糖→6-磷酸葡萄糖;D-甘露糖→6-磷酸甘露糖→6-磷酸果糖。由此可见,单糖是通过转化成为葡萄糖糖酵解过程中的某一中间体来进入糖酵解的,不同酶的催化速率、转化效率以及中间体种类不同,均会影响其糖酵解的效率,最终影响槐糖脂的累积速率。当以多糖(二糖/三糖)为碳源时,首先需要通过酶水解将其转化为相应的单糖进而参与到槐糖脂的合成。还原糖种类不同,微生物将其转化为新的葡萄糖分子的途径和步骤不同,即丙酮酸的生成效率不同,槐糖脂的积累速率也不同。
还原糖种类的改变基本不影响槐糖脂的结构。这是因为一方面,不同种类的还原糖都是通过转化为葡萄糖糖酵解途径的某一中间体而进入糖酵解途径,其最终都是以丙酮酸为起点,转化为活化的葡萄糖分子或脂肪酸;另一方面,培养基中所添加的亲水性碳源大部分用于微生物的生长代谢,仅有小部分通过转化为活化的葡萄糖分子以直接结合 (direct incorporation) 的方式成为槐糖脂分子的组成部分[8]。
1984年,Göbbert等[10]首次研究了不同还原糖对酵母产槐糖脂的影响,结果发现:当底物浓度相同时,所得槐糖脂均具有类似的化学结构,且单糖(单糖>三糖>二糖)更利于槐糖脂的积累(表1)。由表1可知:葡萄糖是最适合槐糖脂合成的一种还原糖(0.325 g/g);除葡萄糖外,以甘露糖为底物时,槐糖脂产率最高为0.245 g/g;以麦芽糖为底物时,槐糖脂产率最低,为0.100 g/g。随后,Klekner等[11]和Zhou等[12]先后研究了复合碳源(还原糖和油脂同时添加)对槐糖脂合成的影响,并对酵母粉(YE)添加量(0.25%~2.00%)、油脂种类(葵花油、橄榄油、红花油和菜籽油)以及还原糖种类(蔗糖、乳糖和半乳糖)等影响因素进行了考察,结果发现:酵母粉的质量分数和复合碳源的配比均会对还原糖合成槐糖脂造成一定影响。Klekner等[11]发现,分别以蔗糖和葵花油为亲水性和疏水性碳源时,当酵母粉添加量为0.25%时,槐糖脂产量最高,达到33.0 g/L。
Hommel等[9]的研究发现,C.apicola可以在以葡萄糖、果糖或蔗糖为唯一碳源的培养基中生长并合成槐糖脂,且疏水性碳源十六烷的添加可显著提高槐糖脂的产量。值得注意的是,当以半乳糖或麦芽糖为唯一碳源时,槐糖脂的产量很低,且十六烷的添加也无明显促进作用。Zhou等[12]的研究表明,C.bombicola不能在乳糖为唯一碳源的培养基中代谢存活,而当以“乳糖+橄榄油”为复合碳源时,酵母可以存活且槐糖脂产量达到46.5 g/L,但以“半乳糖+橄榄油”为复合碳源时,槐糖脂产量仅为24.4 g/L,降低了47.5%。随后,采用1 L发酵罐进行了C.bombicola产槐糖脂的放大实验,培养基配方为100 g/L葡萄糖、10.5%菜籽油(体积分数)和4 g/L酵母粉,经过8 d的发酵培养,葡萄糖和菜籽油的转化率为80%,槐糖脂的产量达到90~110 g/L[13];而在相同条件下,以乳糖和菜籽油为底物进行发酵时,乳糖和菜籽油的转化率仅为45%,远低于葡萄糖和菜籽油。由此可见,葡萄糖仍然是槐糖脂发酵的理想碳源。
2.2 脂肪酸类底物
脂肪酸是指具有或包含脂肪酸结构的物质统称,是槐糖脂发酵的重要底物,一般作为次级碳源参与合成代谢。具有脂肪酸结构的碳源主要包括油脂、酯化油脂、脂肪酸及其衍生酯四类,根据碳链长度的不同分为短链脂肪酸、中链脂肪酸和长链脂肪酸。脂肪酸对槐糖脂发酵影响的研究也备受关注。
在槐糖脂生物合成通路中,当以脂肪酸类物质为唯一碳源时,该类物质可以通过TCA途径合成葡萄糖,为生物代谢提供能量并为槐糖脂合成提供直接底物;也可以直接在单加氧酶细胞色素P450的作用下合成ω-/ω-1羟基脂肪酸,为槐糖脂的合成提供脂肪酸类直接底物。脂肪酸类底物替代葡萄糖/油酸合成槐糖脂的能力受其所含脂肪酸碳链长度的影响,天然槐糖脂分子中脂肪酸碳链长度主要为16和18。一般来说,较长碳链的脂肪酸或带有支链的脂肪酸需要通过β-氧化降解,而较短的脂肪酸则需要延长至16或18碳,用于槐糖脂的有效合成[14]。
目前,在槐糖脂合成的廉价底物替代研究中,作为可替代性碳源的脂肪酸类底物主要有红花油、玉米油、大豆油、葵花油、菜籽油、棕榈油、椰子油、葡萄籽油、橄榄油、亚麻籽油和胚芽油等植物油,鱼油、牛油等动物油,硬脂酸、硬脂酸甲酯、向日葵脂肪酸甲酯、棕榈油脂肪酸甲酯、亚麻籽脂肪酸甲酯、豆油脂肪酸甲酯、油菜籽脂肪酸乙酯、豆油脂肪酸乙酯、豆油脂肪酸丙酯和硬脂酸残余、牛油脂肪酸残余、椰子油脂肪酸残余等脂肪酸及其衍生酯类等,这些脂肪酸为底物的研究总结见表2。由表2分析可知:以油脂为廉价底物合成槐糖脂的研究主要集中在1992—2009年期间,此后鲜有文献报道。Cooper等[15]的研究表明,相比于单一碳源,亲水性和疏水性碳源组成的复合碳源更利于槐糖脂的合成,且其配比也会影响槐糖脂的产量。当培养基中仅含有葡萄糖或红花油时,槐糖脂不能合成;当酵母粉添加量为0.5%、葡萄糖和红花油的比例分别为1∶ 2、1∶ 1或2∶ 1时,槐糖脂的产量可分别达到10.0、30.0和18.0 g/L;而当酵母粉添加量为1 g/L时,无论在何种碳源条件下,槐糖脂的产量均很低,仅为1~10 g/L。随后,Pekin等[28]以玉米油、葡萄糖和蜂蜜为复合碳源,获得了不低于400 g/L的槐糖脂产量。Kim等[33]以菜籽油和葡萄糖为复合碳源体系也得到了365.0 g/L的槐糖脂。值得注意的是,Asmer等[16]使用流加培养的方式培养T.bombicola时发现,以油酸为唯一碳源时,槐糖脂产量为77.0 g/L,而当油酸和葡萄糖配合使用时,产量降至33.0 g/L,且两种槐糖脂的组成和比例也不相同。
对于油脂和酯化油脂类替代底物,来源于植物油的油脂和酯化油脂替代效果优于来源于动物油替代底物,且酯化油脂和葡萄糖共体系的效果优于油脂和葡萄糖,可能原因为常用植物油中C16~C18饱和或不饱和的脂肪酸含量较高。另外,酵母粉添加量、油脂种类和碳源种类(亲水性碳源、疏水性碳源)及其配比、培养条件等也会影响槐糖脂的合成[8,33]。
Casas等[25]发现,当以葡萄糖和不同植物油为复合底物间歇培养C.bombicola时,疏水性底物为葵花油时槐糖脂产量最高,达到11.0 g/L,其次分别是橄榄油、玉米油、葡萄籽油和椰子油。由于避开了高浓度脂肪酸产生的抑制效应,“植物油脂+葡萄糖”比“植物油+葡萄糖”更利于槐糖脂的合成。Davila等[19]以菜籽油乙酯、红花油甲酯和棕榈油甲酯分别替代菜籽油、红花油和棕榈油时,所得槐糖脂产量高达340.0、235.0和240.0 g/L,分别提高了33%、37%和193%。这可能是因为脂肪酸甲酯/乙酯易被胞外水解酶水解,末端/近末端氧化率较高。

表2 以脂肪酸为替代底物的槐糖脂合成研究概览
注:a—不同复合碳源或其不同配比;b—复合碳源或不同配比得到的SL产量,且槐糖脂产量由产率换算而得;c—不同碳源及质量分数。
以鱼油、牛油和羊油等动物油为疏水性碳源时所得槐糖脂产量比植物油低。Solaiman等[30]发现在“牛油+葡萄糖”为培养基条件下,槐糖脂产量仅为32.0 g/L,相比于“油酸+葡萄糖”培养基的结果(100 g/L)下降了68%。Davila等[19]以鱼油为底物所得槐糖脂产量为51.0 g/L,略低于其他植物油培养基但优于牛油的32 g/L,原因可能是鱼油中不饱和脂肪酸含量高于其他动物油。
1998年,Daniel等[23]利用单细胞油脂和菜籽油为复合碳源获得了迄今为止最高的产量422.0 g/L。该项研究首次将合成周期短的微生物油脂引入了槐糖脂的合成过程中,不仅提高了槐糖脂产量,而且拓宽了槐糖脂合成的底物范围,一定程度地降低了原料成本。
对于脂肪酸类底物,含有C16~C18的饱和或不饱和脂肪酸,如油酸或硬脂酸,可直接参与槐糖脂的合成,且产槐糖脂的效果最佳;当碳链长度少于16或多于20时,槐糖脂的产量降低。除此之外,脂肪酸衍生物中脂肪酸酯取代基也会影响槐糖脂的产量,如以脂肪酸酯和甘油为共碳源流加培养C.bombicola时,豆油脂肪酸甲酯>豆油脂肪酸乙酯>豆油脂肪酸丙酯,槐糖脂产量分别为(46±4.0)、(42±7.0)和(18±6.0)g/L[29]。
2.3 烃类底物
表3为以烃类为底物合成槐糖脂的研究结果总结。由表3可知,目前用于合成槐糖脂的烃类底物主要是C12~C20的烷烃、烷醇和烷酮,尤其是C12~C20的烷烃。在槐糖脂合成通路中,烃类物质首先在脂肪醛脱氢酶/脂肪醇氧化酶的作用下转化为脂肪酸,部分经β-氧化生成乙酰CoA,进入TCA,为细胞生长代谢提供能量,并通过糖异生途径合成葡萄糖;部分在单加氧酶细胞色素P450的作用下生成羟基脂肪酸,直接用于槐糖脂的合成。
Davila等[19]分别以C12、C14、C16、C18烷烃为单一碳源时,发现随着碳原子数的增加、碳链的增长,则更利于槐糖脂的合成,产量分别为17.0、20.0、95.0和175.0 g/L,且C16和C18合成槐糖脂的效率更高。产生上述结果的原因与槐糖脂的自身结构及酶催化特性有关。CYP52M1催化的脂肪酸羟基化的特异性决定了天然槐糖脂的脂肪酸部分一般为C16或C18,因此,当疏水性底物的碳链长度不是16或18时,其产量相对较低。上述结论在后续的研究中得到了进一步的证明。但槐糖脂的产量仍然与微生物种类、培养模式、培养条件、氮源及其添加量等有关,因此需根据具体情况综合考虑。
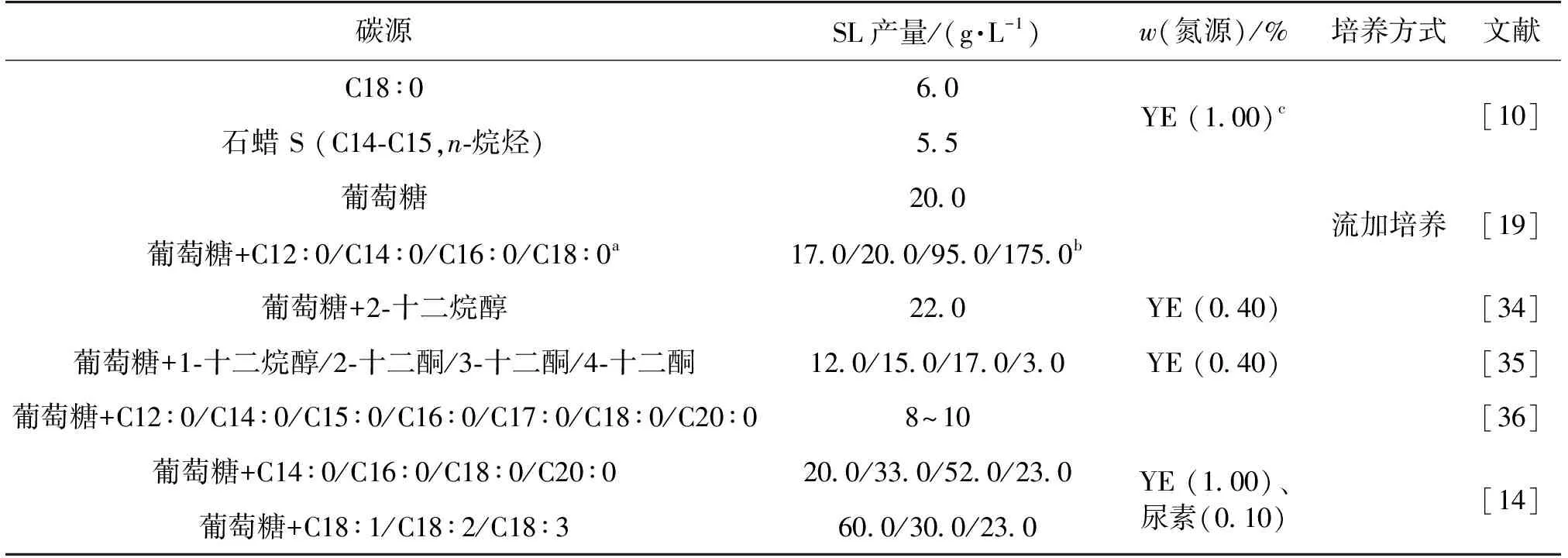
表3 以烃类为替代底物的槐糖脂合成研究概览
注:a—复合碳源;b—不同复合碳源对应的SL产量,且槐糖脂产量是由产率换算而得;c—碳源及其质量分数。
Felse等[14]发现,烃类物质的替代效果不仅受碳原子数量影响,还受其不饱和度的影响。随着烃类物质不饱和程度的降低,槐糖脂产量呈现先增后减的趋势。当底物为葡萄糖+C18∶ 1时,槐糖脂产量最高达到60.0 g/L(底物为葡萄糖+C18∶ 2或C18∶ 3时产量分别为30.0和23.0 g/L)。这结果表明,当使用C18∶ 1代替C18∶ 0为底物时,槐糖脂的产量更高。Brakemeier等[35]评价十二烷醇以及十二烷酮(取代基分别位于第2、3或4位)的替代效果时,发现了一种避开槐糖脂合成受碳链长度依赖性限制的模式,通过研究发现,大部分烷醇均可以不经修饰直接合成槐糖脂,且烷醇和烷酮的替代效果受取代基的位置影响。以十二烷酮为例,由于受脂肪酸末端/近末端的氧化率影响,当取代基位于3位、2位和4位时,槐糖脂产量依次降低,分别为17.0、15.0和3.0 g/L。
2.4 工业副产品类底物
工业废弃物作为槐糖脂发酵生产的替代底物也可以降低槐糖脂的生产成本。目前,生物柴油废料、煎炸废油、大豆黑油、工业脂肪酸废料和餐馆废油等已被用作疏水性底物来替代常规使用的疏水性底物用以槐糖脂的生产,具体研究结果见表4。由表4知,槐糖脂生产所需亲水性碳源也可以使用生物柴油副产物甘油、脱蛋白乳清、甘蔗糖蜜和大豆糖蜜等来替代。
脱蛋白乳清浓缩液中含有大量的乳糖和半乳糖,Daniel等[24]利用脱蛋白乳清浓缩液为底物发酵得到了280 g/L的槐糖脂,而乳糖并未被消耗,且未检测到β-半乳糖苷酶的活性。葡萄糖也可以用更复杂的底物,如主要成分是蔗糖、低聚糖和少量单糖的甘蔗糖蜜和大豆糖蜜等替代。Daverey等[40]研究发现,当以甘蔗糖蜜和豆油/葵花油/橄榄油为复合碳源时,槐糖脂的产量分别为23.3、17.5和19.0 g/L。此外,糖蜜还可以同时替代酵母粉或培养基中的其他氮源,所得槐糖脂产量为53.0 g/L,略低于对照组(酵母粉和尿素)条件下的75.0 g/L[30]。
蜂蜜是葡萄糖和果糖的混合物,也含有一定量的维生素、矿物质和氨基酸。2005年,Pekin等[28]对C.bombicola利用土耳其玉米油和蜂蜜产槐糖脂的能力进行了研究,结果发现:以蜂蜜和玉米油为复合碳源时,添加葡萄糖可以显著提高槐糖脂的产量;在间歇培养模式下所得槐糖脂的产量高于400 g/L。这意味着,以多种还原糖组成的复合体系为亲水性碳源更利于获得高产量槐糖脂,且混合物中每种还原糖的比例也会影响发酵水平。
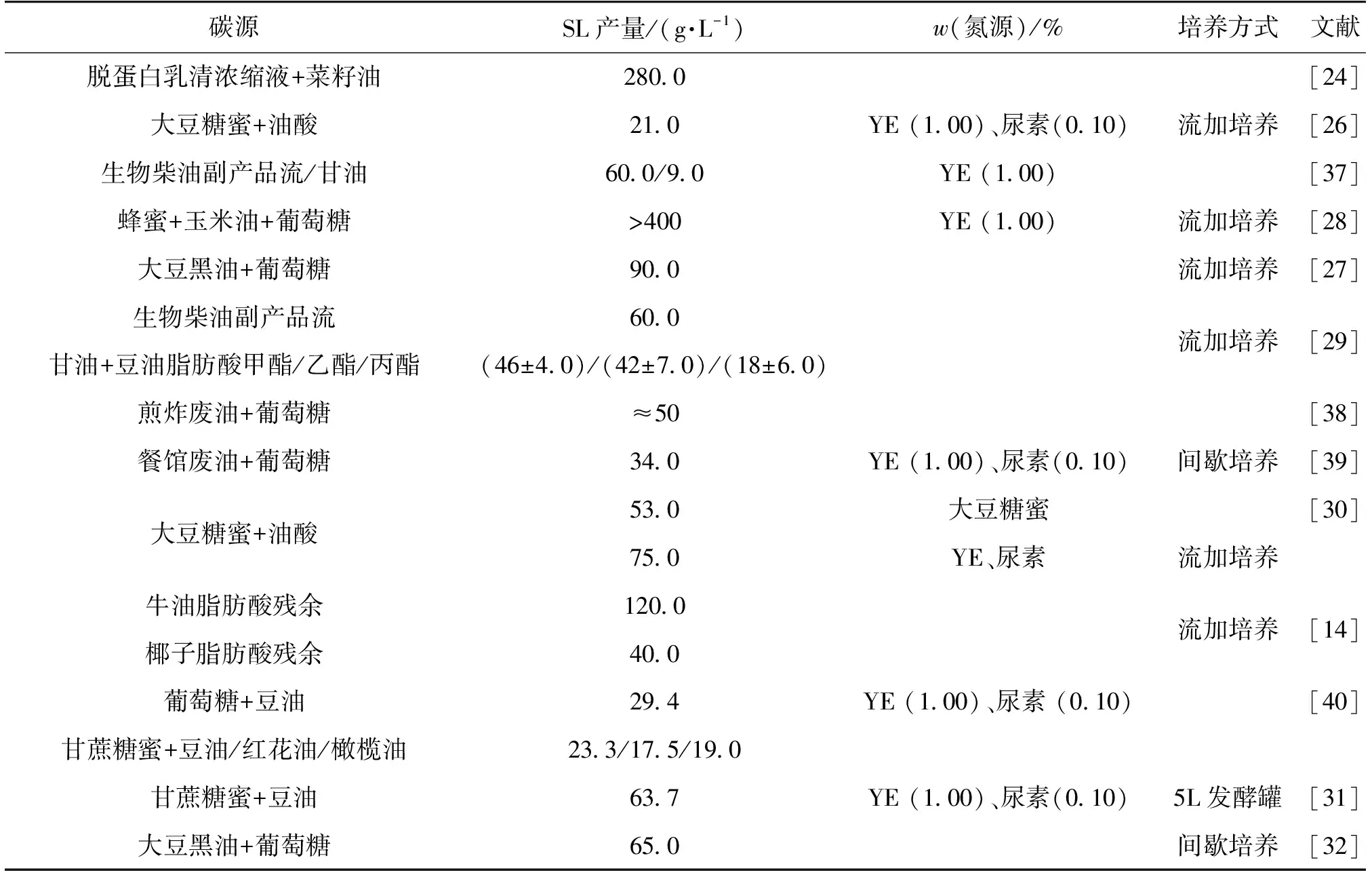
表4 以工业副产品为替代底物的槐糖脂合成研究概览
甘油是生物柴油的主要副产品之一。Ashby等[37]考察了以生物柴油废物流和试剂级甘油为亲水性碳源合成槐糖脂的替代效果。在相同条件下,槐糖脂产量分别为60.0 g/L 和9.0 g/L,即相比于高纯度的甘油,甘油为420 g/L的生物柴油副产物更利于槐糖脂的合成。随后,他们又以不同酯化后的豆油(甲基酯、乙基酯或丙基酯)和甘油为复合碳源,利用流加补料培养C.bombicola,分别得到(46±4.0)、(42±7.0)和(18±6.0) g/L的槐糖脂[29]。近年来,Fleuracker[38]和Shah等[39]也先后以煎炸废油和餐馆废油为底物,得到了50.0 g/L和34.0 g/L的槐糖脂。因此,在槐糖脂生产中引入废物流不仅可以降低槐糖脂合成的原料成本,同时可以使废弃物得到高值化利用,减少环境污染,一定程度上推动人类健康和社会发展。
大豆黑油和工业脂肪酸残余是典型可用作槐糖脂发酵所需疏水性碳源的工业副产品。大豆黑油是豆油生产过程中的副产品,含有65%~75%的脂肪酸和20%~30%的甘油三酸酯,其混合物内的脂肪酸组成同豆油、玉米油等植物油相似。Kim等[27]提出以100 g/L葡萄糖和100 g/L大豆黑油为共底物,对C.bombicola进行流加培养,7 d后得到90.0 g/L的槐糖脂。随后,他们发现,当选取油酸含量为16.1%的大豆黑油为疏水性碳源时,在间歇培养模式下槐糖脂的产量为(65.0±7.07) g/L。槐糖脂产量的降低,一方面可能受培养模式的影响,另一方面就是源于大豆黑油内脂肪酸组成和比例不同,不同类型的脂肪酸合成槐糖脂的生物途径和效率不同,这会导致槐糖脂的积累速率不同,从而影响槐糖脂的产量。
工业脂肪酸残余的组成和比例比较复杂,脂肪酸的碳链长度及其饱和程度均会影响槐糖脂的积累速率。Felse等[14]以工业脂肪酸残余为研究对象,主要对硬脂酸残余、牛油脂肪酸残余和椰子油脂肪酸残余为底物时合成槐糖脂的情况进行了研究。对于硬脂酸残余、牛油脂肪酸残余和椰子油脂肪酸残余,其中C18∶ 0含量分别为55.7%、13.4%和9.6%,C18∶ 1的含量分别为1.5%、41.4%和27.6%。研究表明:在流加培养条件下,C18∶ 1含量最高的牛油脂肪酸残余最适合用于槐糖脂的合成,产量高达120.0 g/L,C18∶ 0和C18∶ 1的总含量最低(37.2%)的椰子油脂肪酸残余为底物时,槐糖脂产量仅为40.0 g/L。因此,可以这样认为,当以富含C18∶ 0和C18∶ 1的脂肪酸体系为底物时,其总含量越高,越利于槐糖脂的合成,尤其是C18∶ 1的比例越高,槐糖脂的积累速率越快。
2.5 木质纤维素类底物
木质纤维素材料是一类尚未被充分利用的、来源广泛、产量丰富的可再生资源。近年来,随着资源、能源问题的日益加剧和环境问题不断恶化,利用农作物秸秆等木质纤维素材料生产高附加值产品的技术开发越来越受各界关注。迄今,已有很多以稻草秸秆、玉米芯、甘蔗渣等农业废弃物用于乙醇、丁醇、生物柴油和单细胞油等化学品合成的报道[41-44],这类技术不仅可以降低相关工艺的生产成本,创造额外利益,而且可以废物利用,实现资源、能源的可持续发展。以木质纤维素材料为底物生产槐糖脂的研究相对较少,结果如表5所示。

表5 以木质纤维素材料为替代底物的槐糖脂合成研究概览
马晓静[41]首次论证了脱木素木糖渣替代葡萄糖生产槐糖脂的可行性,结果表明,脱木素木糖渣水解液可直接被W.domercqiae利用合成一定量的槐糖脂,且水解液的脱毒等操作可以进一步优化槐糖脂产量。在未脱毒和脱毒处理的脱木素木糖渣水解液培养基中,槐糖脂的产量分别达到39.1和42.1 g/L。脱木素木糖渣的引入拓宽了槐糖脂合成的廉价底物替代范围,极大程度上降低了槐糖脂的生产成本,有助于推动其大规模应用。随后,Samad等[42]以甜高粱渣水解液和大豆油为底物,得到了84.6 g/L的槐糖脂;Konishi等[43]改进了玉米芯合成槐糖脂的工艺,降低了酸用量,获得了43.8 g/L的槐糖脂。笔者所在课题组以SO3微热爆处理后的稻草秸秆水解液为底物,未经脱毒处理的摇瓶培养条件下即可得到54 g/L的槐糖脂,降低槐糖脂生产成本的同时简化了木质纤维素材料发酵产槐糖脂的操作步骤[44]。
此外,高粱、玉米芯和稻草秸秆等木质纤维素材料自身的纤维素和木质素含量不同,且其选用的木质素剥离方法也各不相同,致使其水解液中单糖的种类和含量也有所不同,尤其是糠醛、乙酸等发酵抑制物的种类和含量也有一定差异。一方面,水解液中物质的种类和含量的差异会对发酵产槐糖脂的效率造成一定影响;另一方面,不同的木质素剥离方法所带来的成本上的差异,也必将会影响到木质纤维素材料在槐糖脂发酵生产中的应用。
总之,木质纤维素水解液可用作槐糖脂合成所需亲水性碳源。该工艺主要是先利用纤维素酶水解木质纤维素得到富含五碳糖和六碳糖的水解液,进而替代葡萄糖实现槐糖脂的合成。但木质纤维素的替代仍存在如下问题:①针对不同的废弃农作物秸秆,其利用价值不同,故原料成本也大不相同;②木质纤维素材料多富含木质素,使用前需要进行脱木质素处理以提高水解糖化效果,木质纤维素的预处理无形中增加了替代底物的生产成本;③糖化液在使用前需要进行脱毒处理以减少抑制物,以提高木质素材料的利用率,这又在一定程度上提高了其生产成本。马晓静[41]虽然提出以玉米芯生产木糖所获的经济效益来平衡槐糖脂生产中脱木质素环节的加工成本,进而降低生产成本,但其具体生产成本并未进行核算。
3 展望
槐糖脂是一类表面活性、界面活性和生物活性优良的生物表面活性剂,较高的生产成本(原料成本)限制了其开发和应用。尽管还原糖、油脂、烃类、脱蛋白乳清、糖蜜、甘油和秸秆等诸多廉价底物都可用于槐糖脂的合成,但廉价底物的使用给槐糖脂产量带来一定的负面影响。因此,在评价廉价底物或废物流是否能从真正意义上降低槐糖脂生产成本时,应综合考虑原料成本、产率和生产效率等因素,尽量减少降低底物成本带来的负效应。在槐糖脂合成的底物替代研究中,木质纤维素类底物因来源广泛、储存量大、价格低廉等优势,依然是近期和未来研究的热点。
[1] DAVILA A M,MARCHAL R,MONIN N,et al.Identification and determination of individual sophorolipids in fermentation products by gradient elution high-performance liquid chromatography with evaporative light-scattering detection[J].J Chromatogr A,1993,648(1):139-149.
[2] 刘跃文,刘冉,陈静.纳米羟基磷灰石与槐糖脂负载后对宫颈癌细胞的药学活性研究[J].应用与环境生物学报,2017(3):1-5.
[3] RAU U,HAMMEN S,HECKMAN N,et al.Sophorolipids:a source for novel compounds[J].Ind Crops Prod,2001,13(2):85-92.
[4] GUILMANOV V,BALLISTRERI A,IMPALLOMENI G,et al.Oxygen transfer rate and sophorose lipid production byCandidabombicola[J].Biotechnol Bioeng,2002,77(5):489-494.
[5] 伏圣秘,张红蕊,陈静.十四醇为底物合成新型槐糖脂及其抑菌作用[J].齐鲁工业大学学报,2014,28(2):29-33.
[6] VAN BOGAERT I N A,SAERENS K,DE MUYNCK C,et al.Microbial production and application of sophorolipids[J].Appl Microbiol Biotechnol,2007,76(1):23-34.
[7] CIESIELSKA K,ROELANTS S L K W,VAN BOGAERT I N A,et al.Characterization of a novel enzyme:Starmerellabombicolalactone esterase (SBLE)-responsible for sophorolipid lactonization[J].Appl Microbiol Biotechnol,2016,100(22):1-13.
[8] VAN BOGAERT I N A,DEVELTER D,SOETAERT W,et al.Cerulenin inhibits de novo sophorolipid synthesis ofCandidabombicola[J].Biotechnol Lett,2008,30(10):1829-1832.
[9] HOMMEL R K,WEBER L,WEISS A,et al.Production of sophorose lipid byCandida(Torulopsis)apicolagrown on glucose[J].J Biotechnol,1994,33(2):147-155.
[10] GÖBBERT U,LANG S.Sophorose lipid formation by resting cells ofTorulopsisbombicola[J].Biotechnol Lett,1984,6(4):225-230.
[11] KLEKNER V,KOSARIC N,ZHOU Q H.Sophorose lipids produced from sucrose[J].Biotechnol Lett,1991,13(5):345-348.
[12] ZHOU Q H,KOSARIC N.Effect of lactose and olive oil on intra- and extracellular lipids ofTorulopsisbombicola[J].Biotechnol Lett,1993,15(5):477-482.
[13] ZHOU Q H,KOSARIC N.Utilization of canola oil and lactose to produce biosurfactant withCandidabombicola[J].J Am Oil Chem Soc,1995,72(1):67-71.
[14] FELSE P,SHAH V,CHAN J,et al.Sophorolipid biosynthesis byCandidabombicolafrom industrial fatty acid residues[J].Enzyme Microb Technol,2007,42(2):316-323.
[15] COOPER D G,PADDOCK D A.Production of a biosurfactant fromTorulopsisbombicola[J].Appl Environ Microbiol,1984,47(1):173-176.
[16] ASMER H,LANG S,WAGNER F,et al.Microbial production,structure elucidation and bioconversion of sophorose lipids[J].J Am Oil Chem Soc,1988,65(9):1460-1466.
[17] DAVILA A M,MARCHAL R,VANDECASTEELE J P.Kinetics and balance of a fermentation free from product inhibition:sophorose lipid production byCandidabombicola[J].Appl Microbiol Biotechnol,1992,38(1):6-11.
[18] LEE K H,KIM J H.Distribution of substrates carbon in sophorose lipid production byTorulopsisbombicola[J].Biotechnol Lett,1993,15(3):263-266.
[19] DAVILA A M,MARCHAL R,VANDECASTEELE J P.Sophorose lipid production from lipidic precursors:predictive evaluation of industrial substrates[J].J Ind Microbiol,1994,13(4):249-257.
[20] RAU U,MANZKE C,WAGNER F.Influence of substrate supply on the production of sophorose lipids byCandidabombicolaATCC 22214[J].BiotechnolLett,1996,18(2):149-154.
[21] DAVILA A M,MARCHAL R,VANDECASTEELE J P.Sophorose lipid fermentation with differentiated substrate supply for growth and production phases[J].Appl Microbiol Biotechnol,1997,47(5):496-501.
[22] KIM S Y,OH D K,LEE K H,er al.Effect of soybean oil and glucose on sophorose lipid fermentation byTorulopsisbombicolain continuous culture[J].Appl Microbiol Biotechnol,1997,48(1):23-26.
[23] DANIEL H J,REUSS M,SYLDATK C.Production of sophorolipids in high concentration from deproteinized whey and rapeseed oil in a two stage fed batch process usingCandidabombicolaATCC 22214 andCryptococcuscurvatusATCC 20509[J].Biotechnol Lett,1998,20(12):1153-1156.
[24] DANIEL H J,OTTO R T,REUSS M.Sophorolipid production with high yields on whey concentrate and rapeseed oil without consumption of lactose[J].Biotechnol Lett,1998,20(8):805-8078.
[25] CASAS J A,GARCA-OCHOA F.Sophorolipid production byCandidabombicola:medium composition and culture methods[J].J Biosci Bioeng,1999,88(5):488-494.
[26] SOLAIMAN D K Y,ASHBY R D,NUNEZ A,et al.Production of sophorolipids byCandidabombicolagrown on soy molasses as substrate[J].Biotechnol Lett,2004,26(15):1241-1245.
[27] KIM H S,KIM Y B,LEE B S,et al.Sophorolipid production byCandidabombicolaATCC 22214 from a corn-oil processing byproduct[J].J Microbiol Biotechnol,2005,15(1):55-58.
[28] PEKIN G,VARDAR-SUKAN F,KOSARIC N.Production of sophorolipids fromCandidabombicolaATCC 22214 using Turkish corn oil and honey[J].Eng Life Sci,2005,5(4):357-362.
[29] ASHBY R D,SOLAIMAN D K Y,FOGLIA T A.The use of fatty acid esters to enhance free acid sophorolipid synthesis[J].Biotechnol Lett,2006,28(4):253-260.
[30] SOLAIMAN D K Y,ASHBY R D,ZERKOWSKI J A,et al.Simplified soy molasses-based medium for reduced-cost production of sophorolipids byCandidabombicola[J].Biotechnol Lett,2007,29(9):1341-1347.
[31] DAVEREY A,PAKSHIRAJAN K.Production,characterization,and properties of sophorolipids from the yeastCandidabombicolausing a low-cost fermentative medium[J].Appl Biochem Biotechnol,2009,158(3):663-674.
[32] KIM Y B,YUN H S,KIM E K.Enhanced sophorolipid production by feeding-rate-controlled fed-batch culture[J].Bioresour Technol,2009,100(23):6028-6032.
[33] 宋丹丹,梁生康,尚玉俊,等.不同碳源培养条件下假丝酵母菌产槐糖脂的结构及性能[J].环境化学,2015,34(7):1252-1258.
[34] BRAKEMEIER A,WULLBRANDT D,LANG S.Candidabombicola:production of novel alkyl glycosides based on glucose/2-dodecanol[J].Appl Microbiol Biotechnol,1998,50(2):161-166.
[35] BRAKEMEIER A,WULLBRANDT D,LANG S.Microbial alkyl-sophorosides based on 1-dodecanol or 2-,3- or 4-dodecanones[J].Biotechnol Lett,1998,20(3):215-218..
[36] CAVALEROD A,COOPERD G.The effect of medium composition on the structure and physical state of sophorolipids produced byCandidabombicolaATCC 22214[J].J Biotechnol,2003,103(1):31-41.
[37] ASHBY R D,NUEZ A,SOLAIMANDKY,et al.Sophorolipid biosynthesis from a biodiesel co-product stream[J].J Am Oil Chem Soc,2005,82(9):625-630.
[38] FLEURACKER S S J J.On the use of waste frying oil in the synthesis of sophorolipids[J].Eur J Lipid Sci Technol,2006,108(1):5-12.
[39] SHAH V,JURJEVIC M,BADIA D.Utilization of restaurant waste oil as a precursor for sophorolipid production[J].Biotechnol Prog,2007,23(2):512-515.
[40] DAVEREY A,PAKSHIRAJAN K.Production of sophorolipids by the yeastCandidabombicolausing simple and low cost fermentative media[J].Food Res Int,2009,42(4):499-504.
[41] 马晓静.槐糖脂合成的氮源代谢调控及槐糖脂的廉价底物生产和性质研究[D].济南:山东大学,2012.
[42] SAMAD A,ZHANG J,CHENG D.Sophorolipid production from biomass hydrolysates[J].Appl Biochem Biotechnol,2014,175(4):2246-2257.
[43] KONISHI M,YOSHIDA Y,HORIUCHI J I.Efficient production of sophorolipids byStarmerellabombicolausing a corncob hydrolysate medium[J].J Biosci Bioeng,2015,119(3):317-322.
[44] LIU X G,MA X J,YAO R S.Sophorolipids production from rice straw via SO3micro-thermal explosion byWickerhamielladomercqiaevar.sophorolipid CGMCC 1576[J].AMB Express,2016,6(1):1-11.
(责任编辑 荀志金)
Advances in sophorolipids production with low-cost substrates
LIU Xinge,MA Xiaojing,HE Hongbo,YAO Risheng
(School of Biological and Medical Engineering,Hefei University of Technology,Hefei 230009,China)
Sophorolipids (SLs),mainly synthesized by yeasts,are biosurfactants with the highest fermentation level at present.In recent years,SLs have drawn extensive attention for their excellent physiochemical properties and physiologically active functions.Large scale application of SLs is limited by relative high production cost.Application of cheap substrates is an efficient way to reduce the cost.Based on the pathway of SLs biosynthesis,selection and substitution effects of low-cost substrates arereviewed in this paper.Low-cost substrates are mainly divided into reducing sugar,fatty acid,hydrocarbon,industrial effluent flow,and lignocellulosic materials.Finally,industrial production of SLs is addresses and the important potential value of lignocellulosic materials for SLs production is proposed.
sophorolipids; anabolism; carbon source; low-cost substrates
10.3969/j.issn.1672-3678.2017.03.010
2017-02-13
国家自然科学基金青年基金(31400049);国家高技术研究发展计划(863计划)(2014AA021902);中国博士后科学基金(2015T80646);烟草化学安徽省重点实验室开放课题基金(W2015JSKF0493)
刘新歌(1991—),女,黑龙江延寿人,研究方向:生物制药技术与工艺;马晓静(联系人),副教授,E-mail:maxj@hfut.edu.cn;姚日生(联系人),教授,E-mail:yaors@163.com
Q546
A
1672-3678(2017)03-0059-10

