尿microRNAs的检测对膀胱癌诊断价值的Meta分析
王贺龙,宋传旺,郭术俊(蚌埠医学院免疫学教研室,蚌埠 233030;通讯作者,E-mail:50302715@qq.com)
尿microRNAs的检测对膀胱癌诊断价值的Meta分析
王贺龙,宋传旺,郭术俊*
(蚌埠医学院免疫学教研室,蚌埠 233030;*通讯作者,E-mail:50302715@qq.com)
目的 评估尿microRNAs(miRNAs)的检测对膀胱癌的诊断价值。 方法 在PubMed、Medline、Embase和 CNKI(中国知网)等数据库搜索miRNAs检测对膀胱癌诊断有价值的相关文献。用QUADAS-2评分系统评价纳入文献的质量;Stata 13软件分析纳入对象的敏感度、特异度等。 结果 经筛选获得12篇文献符合纳入及排除标准,所有文献中共涉及研究对象2 814例。尿miRNAs检测对膀胱癌诊断价值的合并灵敏度、特异度分别是81%和79%。综合受试者工作特征曲线(summary receiver operating characteristic curve,SROC)下面积(area under curve,AUC)为0.87(95%CI 0.84-0.90),诊断优势比(diagnostic odds ratio,DOR)达到17(95%CI 12-23),具有明显的高诊断比。 结论 尿液miRNAs的检测可用作膀胱癌早期临床筛查及辅助诊断。
膀胱癌; 微小RNA; 诊断; Meta分析
膀胱癌作为泌尿系统常见的恶性肿瘤,在所有癌症发生率中排列第9位,而在男性恶性肿瘤中排列第7位,在女性中排列第17位[1]。流行病学研究发现膀胱癌近年来发病率呈增高趋势,美国2014年膀胱癌估计有74 690例新增病例,其死亡病例达到15 580例,可见膀胱癌对人类健康的危害[2]。分子生物学技术飞速发展为多种疾病诊断提供了可靠的检测指标,也证实了恶性肿瘤的发生、发展是一个多因素相互作用的结果。但目前仍缺乏有效的膀胱癌早期无创诊断和判断预后的有效标记物,目前膀胱癌的主要治疗手段也局限于手术切除和术后辅助化疗或者放疗,以此来提高病人的术后生存率。
近年来对微小RNA (microRNA/miRNA)在不同疾病中异常表达的研究取得了显著的进展,尤其是在肿瘤研究方面,为肿瘤的诊断和治疗提供了新的诊断依据,也为膀胱癌发生发展的分子机制提供了线索,对于阐明膀胱癌的发生机制及指导临床工作带来了新的希望,也为医药行业研发新的治疗药物提供了新的信息。miRNAs是长度约为22个核苷酸的单链非编码的RNA,主要通过降解或抑制靶基因mRNA翻译的方式在转录后水平调控靶基因的表达[3],这个发现通过多种路径影响正常细胞的凋亡和分化及异常细胞的迁移和浸润,研究发现miRNAs的表达水平可以作为特定肿瘤形成的标志物[4,5]。在膀胱癌形成的微环境中,膀胱癌细胞及其分泌物中miRNAs产生了显著的变化,其变化水平和肿瘤的进展形成某种特定的关系,可以通过相关性分析特定miRNA的表达水平作为膀胱肿瘤的临床辅助诊断指标。近年来关于miRNAs在膀胱癌患者诊断及预后的论著和临床试验数量很多,但miRNAs的表达对膀胱癌的诊断价值具体有多大意义,目前还存在争论,本研究就以多种miRNAs在尿液标本中表达水平的检测对膀胱癌的诊断价值做一Meta分析,探索miRNAs的检测对膀胱癌诊断的可靠性。
1 研究方法
1.1 检索策略
利用计算机检索Pubmed、Medline、Embase 和CNKI数据库,检索词限定为:“microRNA”、“miRNA”、“bladder”、“cancer”、“carcinoma”、“malignant”、“diagnosis”、“微小RNA”、“膀胱癌”、“诊断”、“治疗”,及合理的检索词的组合形式:“bladder cancer”、“bladder carcinoma”等。检索式如下:(“microRNA” OR “miRNA”)AND(“bladder cancer”)AND(“diagnosis”);“微小RNA”AND“膀胱癌”AND(“诊断”OR“治疗”)。此外,手工检索纳入文献的相关参考文献,力求收集资料信息的全面性。
1.2 文献的纳入与排除
纳入标准:①病例组患者经临床确诊为膀胱癌,对照组为非肿瘤人群;②文献数据详细完整;③文献为近几年发表的中文或英文原著;④病例-对照研究;⑤经质量评价属于高质量文献。排除标准:①重复发表的文献;②非病例-对照研究;③数据缺失的文献;④质量评价为低质量文献。
1.3 数据提取
由2-3位评价人员对纳入文献进行资料提取,若有分歧,讨论解决。提取内容包括第一作者、发表年份、国家、种族、样本含量、样本类型、miRNA种类、miRNAs检测方法、特异度等。若原始数据不全,可以尝试联系原作者索取必须数据予以补齐。
1.4 文献质量评价
由Cochrane协作网推荐的QUADAS-2评分系统评价纳入文献的质量,共参考11个条目,分别由“是”、“否”、“不清楚”给予评分,回答是的加1分,回答否的减1分,回答不清楚的为0分,最后得出总分作为纳入文献质量的评价标准,0-6分为低质量文献,7-11分为高质量文献。
1.5 统计学方法
相关统计学分析按照诊断性试验的Meta分析标准进行,用Stata 13统计学软件先对纳入文献的数据进行发表偏倚、异质性检验,根据检验结果选择合适的效应模型分析纳入对象的灵敏度(sensitivity,SENS)、特异度(specificity,SPEC)、阳性似然比(positive likelihood ratio,PLR)、阴性似然比(negative likelihood ratio,NLR)、诊断优势比(diagnostic odds ratio,DOR)、验后概率等指标,然后绘制综合受试者工作特征曲线(summary receiver operating characte-ristic curve,SROC),获得SROC线下面积(area under curve,AUC)作为此诊断性实验对膀胱癌的诊断价值的重要性[6]。
2 结果
2.1 纳入文献的基本情况
经过数据库检索获得280篇相关文献(见图 1),排除重复发表文献(n=61),通过阅读标题及摘要排除综述及会议类文献(n=187),最终需要阅读全文的共32篇,阅读文献后再次筛选出非病例-对照的临床研究(n=9)、检测样本不是尿液的文献(n=6),然后排除数据丢失或无法联系作者得到原始数据的文献(n=5),最终共纳入研究的文献12篇(均属于英文原著)[7-18]。纳入其中的文献包含了14个独立的研究,共涉及膀胱癌患者1 745例,健康者1 069例。其中5篇来自欧洲,4篇来自亚洲,2篇来自非洲,1篇来自美国。所有纳入研究的数据均通过直接或间接计算的方法获取(见表 1)。

图1 文献纳入与排除流程Figure 1 Flow diagram of screening studies
表1 纳入文献对象的基本特征
Table 1 Characteristic of included studies
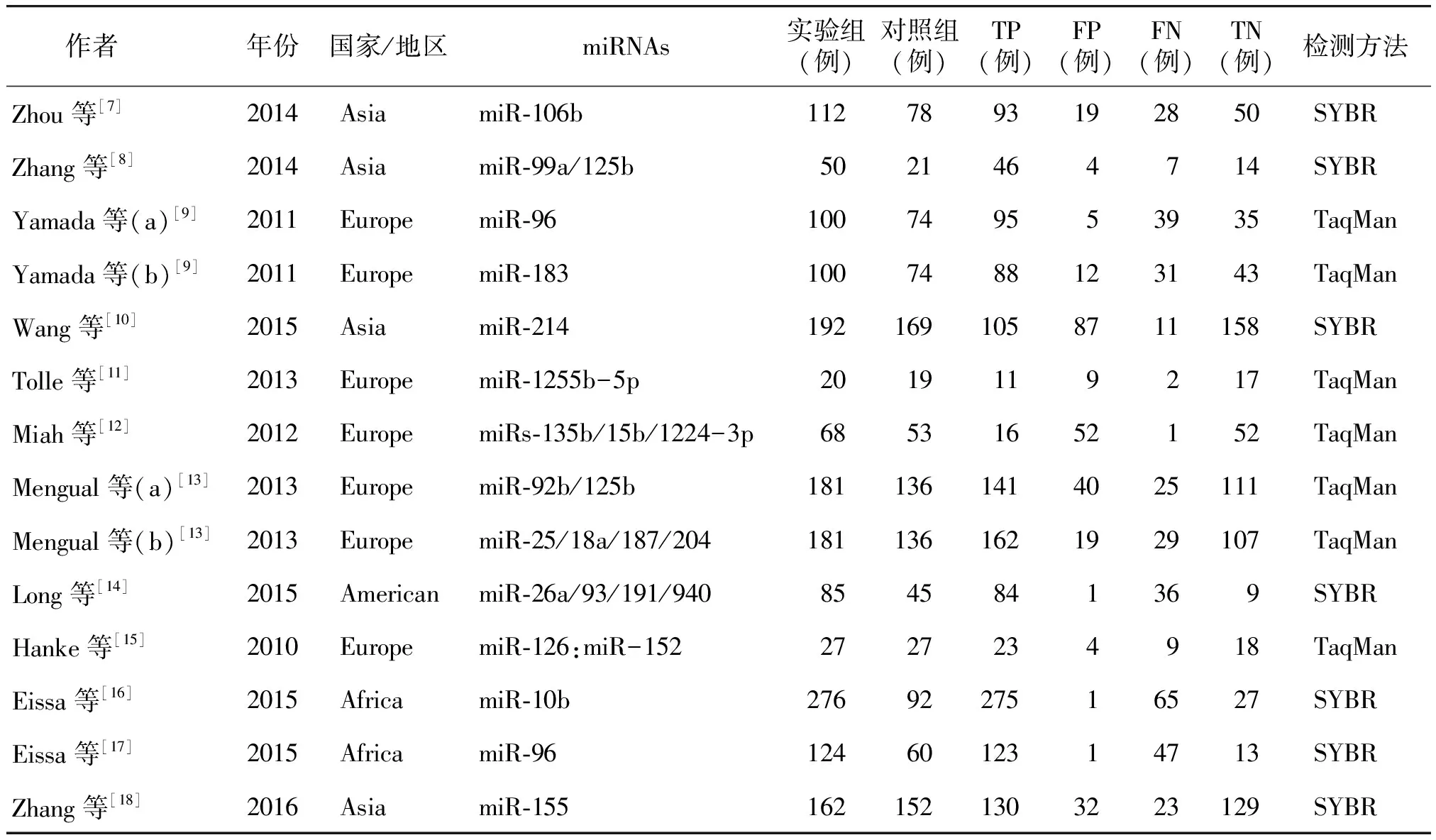
作者年份国家/地区miRNAs实验组(例)对照组(例)TP(例)FP(例)FN(例)TN(例)检测方法Zhou等[7]2014AsiamiR⁃106b1127893192850SYBRZhang等[8]2014AsiamiR⁃99a/125b5021464714SYBRYamada等(a)[9]2011EuropemiR⁃96100749553935TaqManYamada等(b)[9]2011EuropemiR⁃1831007488123143TaqManWang等[10]2015AsiamiR⁃2141921691058711158SYBRTolle等[11]2013EuropemiR⁃1255b-5p2019119217TaqManMiah等[12]2012EuropemiRs⁃135b/15b/1224-3p68531652152TaqManMengual等(a)[13]2013EuropemiR⁃92b/125b1811361414025111TaqManMengual等(b)[13]2013EuropemiR⁃25/18a/187/2041811361621929107TaqManLong等[14]2015AmericanmiR⁃26a/93/191/9408545841369SYBRHanke等[15]2010EuropemiR⁃126:miR-1522727234918TaqManEissa等[16]2015AfricamiR⁃10b2769227516527SYBREissa等[17]2015AfricamiR⁃961246012314713SYBRZhang等[18]2016AsiamiR⁃1551621521303223129SYBR
TP:真阳性;FP:假阳性;FN:假阴性;TN:真阴性
2.2 发表偏倚及异质性检验
Begg 秩相关检验分析(z=0.49,P=0.622)、Egger线性回归分析(t=0.52,P=0.614,见图2A)和诊断实验发表偏倚检验(t=0.00,P=0.998,见图2B)均未显示出发表偏倚。异质性检验(拉贝图)未发现明显研究群体的异质性,Q检验和I2检验结果显示纳入的对象总体上不存在异质性(见图 2C):χ2=14.04,P=0.298,I2=14.5,因此对纳入对象合并进行Meta分析。
2.3 Meta分析结果
根据上述异质性检验结果选择对应的效应模型对灵敏度、特异性、阳性似然比、阴性似然比、诊断优势比合并分析,检测尿液样本中miRNAs对膀胱癌诊断的合并诊断价值,Meta分析结果森林图显示:灵敏度0.82 (95%CI 0.77-0.85)、特异度0.79(95%CI 0.72-0.85)、阳性似然比3.9(95%CI 3.0-5.1)、阴性似然比0.23(95%CI 0.19-0.28)、诊断优势比17(95%CI 12-23),AUC为0.87(95%CI 0.84-0.90),显著性检验z=24.09,P=0.00(见图3),各项指标都提示尿液中miRNAs的检测对膀胱癌诊断的准确度很高。综合受试者工作特征曲线(SROC)能够更好地评估检测方法的准确性,比合并SENS、SPEC、PLR、NLR更能说明检测方法的精准度,AUC的值越接近1越能说明诊断的精度,SROC的检验结果(z=-0.84,P=0.62)表明纳入的研究对象不存在阈值效应,绘制的SROC曲线也说明阈值效应存在的可能性不大(见图2D)。DOR>1即表明miRNAs的检测能够区分膀胱癌的良恶性,DOR<1表明此检测可能将健康人诊断为膀胱癌患者,DOR=1意味着此检测不能区分癌症患者和正常个体。
此外,本研究对纳入对象的地区和miRNAs的检测方法进行亚组分析,结果见表2,均提示miRNAs在对照组和实验组具有显著性差异。
3 讨论
Meta分析及亚组分析可以看出,虽然合并分析纳入文献不存在异质性,纳入文献也不存在发表偏倚,但在灵敏度和特异度的合并分析时仍然显示出明显的异质性。异质性是影响研究对象合并效应和Meta分析的主要问题,即使经严格的纳入和排除标准,异质性仍然不能够完全消除。分层受试者工作特征曲线(HSROC)模型也得出相似的灵敏度(81.5%)、特异度(79.0%)和诊断比值比(16.6),验证了此Meta分析的可靠性。
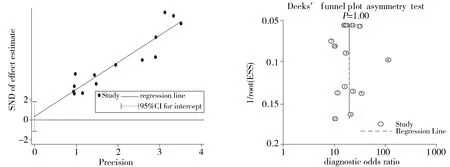
A.Egger线性回归分析 B.发表偏倚检验

C.异质性检验 D.综合受试者工作特征曲线(SROC)图2 发表偏倚及异质性检验Figure 2 Publication bias and heterogeneity test
表2 不同标本来源及miRNAs检测方法的亚组分析结果
Table 2 The results of subgroup analysis of different specimen source and miRNAs detection method
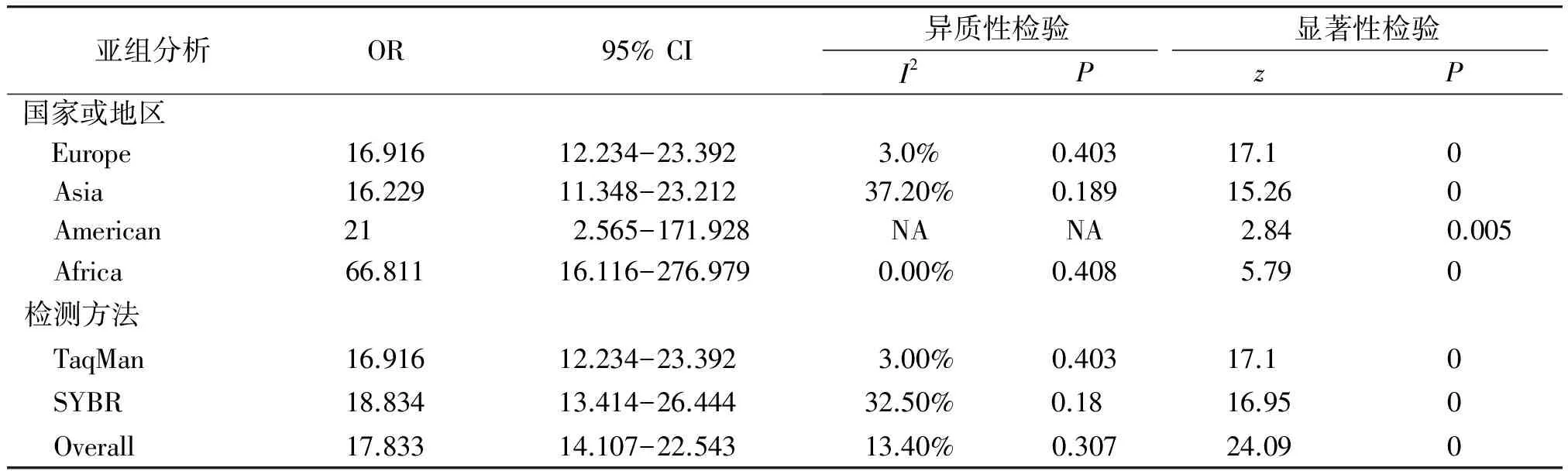
亚组分析OR95%CI异质性检验I2P显著性检验zP国家或地区 Europe16.91612.234-23.3923.0%0.40317.1 0 Asia16.22911.348-23.21237.20%0.18915.260 American21 2.565-171.928NANA2.840.005 Africa66.81116.116-276.9790.00%0.4085.790检测方法 TaqMan16.91612.234-23.3923.00%0.40317.1 0 SYBR18.83413.414-26.44432.50%0.18 16.950 Overall17.83314.107-22.54313.40%0.30724.090
NA:not available
尿液miRNAs检测从人体日常排泄物的途径探索膀胱癌的诊断方法,减少了患者采血的痛苦及传染疾病的风险,有望用于膀胱癌早期的筛查,但由于操作技术要求严格及花费相对较高,目前仍然不能够大力推广。此外,此项研究有其自身的局限性,即纳入的研究并不能完全代表所有的膀胱癌患者和健康人群的区别,其中包括医生在选择诊断标准时,不同的诊断标准(例如miRNAs的种类和相对表达的水平)将会对诊断结果产生偏倚,对文献的质量也有一定的影响。虽然此研究所纳入的研究不存在发表偏倚,但仍有其他的偏倚因素导致文献质量的变化,如选择偏倚、实施偏倚、损耗偏倚、测量偏倚、报告偏倚等。
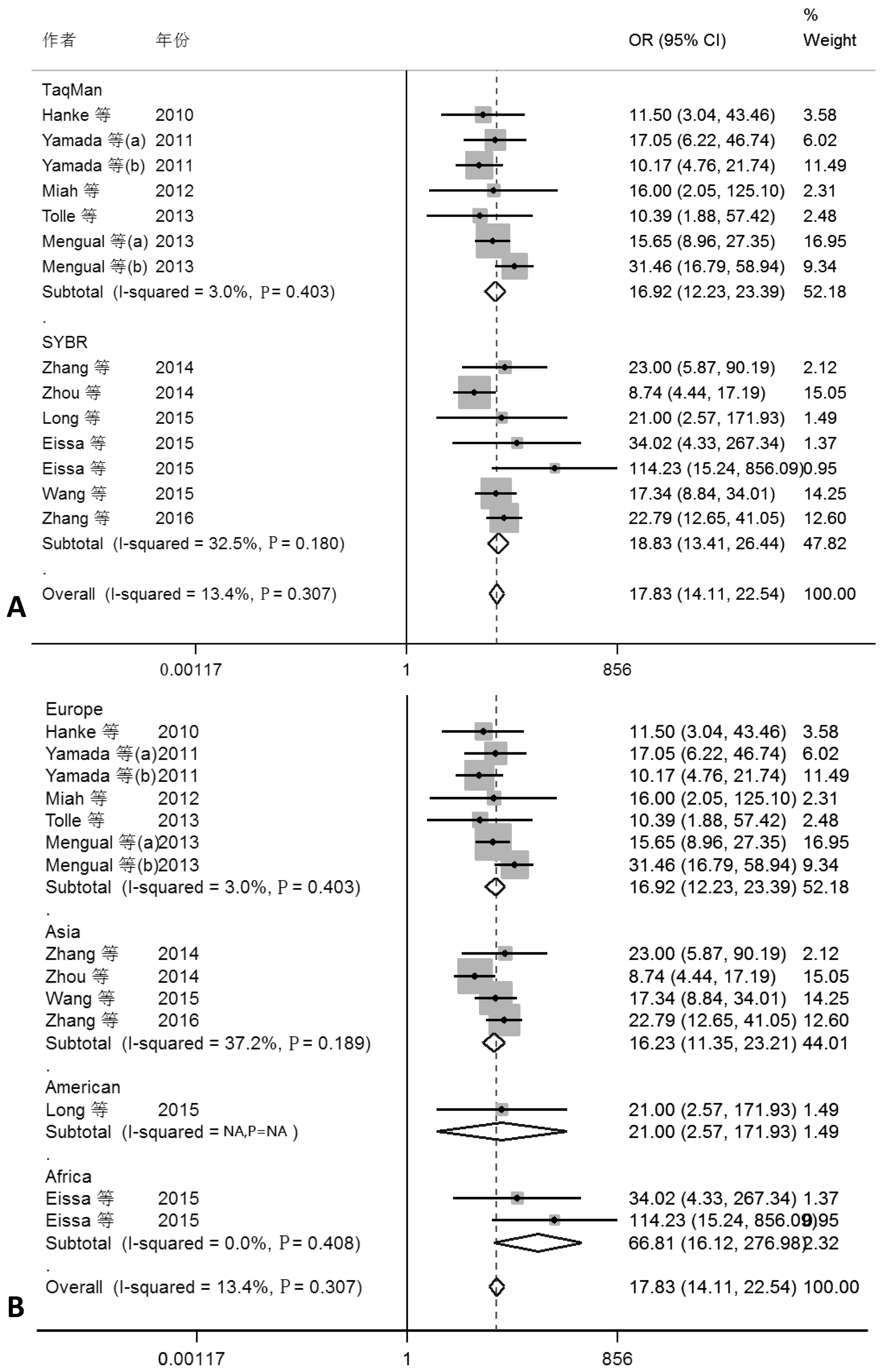
A.以国家或地区为因素的亚组分析; B.以miRNAs检测方法为因素的亚组分析图3 纳入文献合并效应量及亚组分析Figure 3 Pooled effect size and subgroup analysis of included studies
膀胱癌作为人群中常见的恶性肿瘤之一,尤其以男性患者居多,当前提高膀胱癌的诊断率及治疗水平是患者和临床医生共同的愿望。目前,miRNAs的研究成果为膀胱癌的治疗提供了新的线索,miRNAs是一种单链非编码小分子片段RNA,而且miRNAs的物理性质稳定,在强酸或强碱、高温或低温、甚至RNA消化酶等极端环境下,其降解程度都不是很大[19],这在尿液环境下完全可以放心miRNAs的完整性。miRNAs可作为多种疾病的生物标志物,尤其是对肿瘤的诊断价值,如胃癌、肝癌、肺癌、乳腺癌等,而且miRNAs的研究在肿瘤免疫性疾病方面也有着重要的价值,有望成为药物治疗疾病的作用靶点,成为今后治疗各种肿瘤的主要途径之一。
[1] Ploeg M,Aben KK,Kiemeney LA.The present and future burden of urinary bladder cancer in the world[J].World J Urol,2009,27(3):289-293.
[2] Zhao X,He W,Li J,etal.MiRNA-125b inhibits proliferation and migration by targeting SphK1 in bladder cancer[J].Am J Transl Res,2015,7(11):2346-2354.
[3] Lee Y,Kim M,Han J,etal.MicroRNA genes are transcribed by RNA polymerase II[J].EMBO J,2004,23(20):4051-4060.
[4] Zhang C,Ma X,Du J,etal.MicroRNA-30a as a prognostic factor in urothelial carcinoma of bladder inhibits cellular malignancy by antagonizing Notch1[J].BJU Int,2016.118(4):578.
[5] Zhang X,Zhang Y,Liu X,etal.MicroRNA-203 is a prognostic indicator in bladder cancer and enhances chemosensitivity to cisplatin via apoptosis by targeting Bcl-w and survivin[J].PLoS One,2015,10(11):e0143441.
[6] Mitchell MD.Validation of the summary ROC for diagnostic test meta-analysis: a Monte Carlo simulation[J].Acad Radiol,2003,10(1):25-31.
[7] Zhou X,Zhang X,Yang Y,etal.Urinary cell-free microRNA-106b as a novel biomarker for detection of bladder cancer[J].Med Oncol,2014,31(10):1-7.
[8] Zhang DZ,Lau KM,Chan ES,etal.Cell-free urinary microRNA-99a and microRNA-125b are diagnostic markers for the non-invasive screening of bladder cancer[J].PLoS One,2014,9(7):e100793.
[9] Yamada Y,Enokida H,Kojima S,etal.MiR-96 and miR-183 detection in urine serve as potential tumor markers of urothelial carcinoma: correlation with stage and grade,and comparison with urinary cytology[J].Cancer Sci,2011,102(3):522-529.
[10] Wang J,Zhang X,Wang L,etal.Downregulation of urinary cell-free microRNA-214 as a diagnostic and prognostic biomarker in bladder cancer[J].J Surg Oncol,2015,111(8):992-999.
[11] Tolle A,Jung M,Rabenhorst S,etal.Identification of microRNAs in blood and urine as tumour markers for the detection of urinary bladder cancer[J].Oncol Rep,2013,30(4):1949-1956.
[12] Miah S,Dudziec E,Drayton RM,etal.An evaluation of urinary microRNA reveals a high sensitivity for bladder cancer[J].Br J Cancer,2012,107(1):123-128.
[13] Mengual L,Lozano JJ,Ingelmo-Torres M,etal.Using microRNA profiling in urine samples to develop a non-invasive test for bladder cancer[J].Int J Cancer,2013,133(11):2631-2641.
[14] Long JD,Sullivan TB,Humphrey J,etal.A non-invasive miRNA based assay to detect bladder cancer in cell-free urine[J].Am J Transl Res,2015,7(11):2500-2509.
[15] Hanke M,Hoefig K,Merz H,etal.A robust methodology to study urine microRNA as tumor marker: microRNA-126 and microRNA-182 are related to urinary bladder cancer[J].Urol Oncol,2010,28(6):655-661.
[16] Eissa S,Matboli M,Hegazy MG,etal.Evaluation of urinary microRNA panel in bladder cancer diagnosis: relation to bilharziasis[J].Transl Res,2015,165(6):731-739.
[17] Eissa S,Habib H,Ali E,etal.Evaluation of urinary miRNA-96 as a potential biomarker for bladder cancer diagnosis[J].Med Oncol,2015,32(1):413.
[18] Zhang X,Zhang Y,Liu X,etal.Direct quantitative detection for cell-free miR-155 in urine: a potential role in diagnosis and prognosis for non-muscle invasive bladder cancer[J].Oncotarget,2016,7(3):3255-3266.
[19] Chen X,Ba Y,Ma L,etal.Characterization of microRNAs in serum: a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
Urinary miRNAs in the diagnosis of bladder cancer:a Meta analysis
WANG Helong,SONG Chuanwang,GUO Shujun*
(DepartmentofImmunology,BengbuMedicalCollege,Bengbu233030,China;*Correspondingauthor,E-mail:50302715@qq.com)
ObjectiveTo evaluate the value of urinary miRNAs detection in the diagnosis of bladder cancer.MethodsPubMed,Medline,Embase and CNKI database were searched for studies about miRNAs detection in the diagnosis of bladder cancer.The quality of documents was evaluated with QUADAS-2 score system.Stata 13 software was used to analyze the sensitivity and specificity of the included documents.ResultsA total of 11 documents met the inclusion and exclusion criteria involving a total of 2 814 cases.The sensitivity and specificity of urinary miRNAs detection for bladder cancer were 81% and 79%.Summary receiver operating characteristic curve area(AUC) was 0.87 (95% CI 0.84-0.90),and the diagnostic odds ratio(DOR) reached 17 (95%CI 12-23).ConclusionThe detection of urinary miRNAs can be used in the early clinical screening and diagnosis of bladder cancer.
bladder cancer; microRNA; diagnosis; Meta analysis
国家自然科学基金资助项目(81273273);安徽省自然科学基金资助项目(1708085MH218);安徽省高等学校自然科学研究基金资助项目(KJ2015B028by);蚌埠医学院研究生科研创新计划项目(Byycx1602)
王贺龙,男,1989-11生,在读硕士,E-mail: gxingzhe116@hotmail.com
2017-01-20
R737.14
A
1007-6611(2017)05-0493-06
10.13753/j.issn.1007-6611.2017.05.020

