培门冬酶和左旋门冬酰胺酶治疗儿童急性淋巴细胞白血病的临床分析
张静静,张惠琴,陶小娟,卢星辰,党 荣,孙 新(第四军医大学西京医院儿科,西安 710032;通讯作者,E-mail:sunxin6@fmmu.edu.cn)
培门冬酶和左旋门冬酰胺酶治疗儿童急性淋巴细胞白血病的临床分析
张静静,张惠琴,陶小娟,卢星辰,党 荣,孙 新*
(第四军医大学西京医院儿科,西安 710032;*通讯作者,E-mail:sunxin6@fmmu.edu.cn)
目的 探讨培门冬酶(polyethylene glycol conjugated asparaginase,PEG-ASP)和左旋门冬酰胺酶(L-asparaginase,L-ASP)在儿童急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)中疗效。 方法 回顾性分析第四军医大学西京医院2010-01-01~2015-01-01 88例初发的ALL患儿的临床资料,在诱导缓解期随机接受L-ASP治疗42例,PEG-ASP治疗46例,比较两组患儿临床疗效及不良反应。 结果 PEG-ASP组与L-ASP组患儿诱导治疗的完全缓解(complete remission,CR)率比较(88.6%vs87.8%),差异无统计学意义(P>0.05)。PEG-ASP组对骨髓抑制程度重于L-ASP组,且对骨髓抑制持续时间长于L-ASP组 (均P<0.05)。PEG-ASP组后续发生中枢神经系统白血病(central nervous system leukemia,CNSL)比例显著低于L-ASP组(6.82%vs24.39%,P<0.05)。PEG-Asp组患儿凝血功能障碍持续时间[(8.65±3)d]长于L-ASP组[(7.52±2.16)d] (P<0.05)。两组其余不良反应方面比较,差异均无统计学意义(P>0.05)。 结论 PEG-ASP治疗时,骨髓抑制、血常规、血凝恢复正常时间长,余不良反应发生率与L-ASP相似,PEG-ASP可作为儿童ALL一线治疗的选择。
急性淋巴细胞白血病; 培门冬酶; 左旋门冬酰胺酶
L-ASP是一种降解血清中门冬酰胺的细菌酶,是儿童ALL治疗方案中的重要药物。最常用的门冬酰胺酶制剂有大肠埃希菌来源的天然门冬酰胺酶(L-ASP)和聚乙二醇化修饰的培门冬酶(PEG-ASP)[1]。目前尚无不同门冬酰胺酶制剂药效比较的确切临床证据。本研究通过回顾性分析我院88例初诊的ALL患儿的临床资料,比较两种门冬酰胺酶制剂的临床疗效及不良反应,为治疗儿童ALL门冬酰胺酶的选择提供参考。
1 资料与方法
1.1 一般资料
选2010-01-01~2015-01-01在第四军医大学西京医院儿科诊断初发的ALL患儿88例为研究对象,诊断根据2006年中华医学会儿科学分会血液学组《儿童急性淋巴细胞白血病诊疗建议(第三次修订草案)》[2]。所有患儿家属均签署化疗知情同意书。按门冬酰胺酶制剂使用情况分为PEG-ASP组46例和L-ASP组42例。收集两组患儿初诊血常规、 髓外浸润情况、免疫学资料及临床缓解情况、后期CNSL发生率和门冬酰胺酶相关并发症的发生情况及生存情况,并通过门诊或电话进行随访。
1.2 方法
完善使用两种不同的门冬酰胺酶治疗前后患者的血常规、血凝全套、血糖、肝肾功、淀粉酶、心肌酶谱、心电图和腹部B超等检查。在诱导缓解期L-ASP治疗组给予L-ASP 6 000 U/m2,静脉滴注,隔日1次 ,共治疗6次 ;PEG-ASP 治疗组给予PEG-ASP 2 500 U/m2,肌肉注射,每2周用药1次,共2次。其他治疗方案两组一致(长春新碱、柔红霉素、泼尼松)。
1.3 疗效评价
疗效标准参照《血液病诊断及疗效标准》[3]。记录两组患儿诱导缓解情况,对可进行疗效评估的患儿统计总生存(overall survival,OS)期,OS期为自确诊之日起至患儿死亡或末次生存随访之日为止。对达到CR的患儿统计疾病无进展生存(relapse free survival,RFS)期,RFS期为自达到CR之日至疾病进展或末次随访日为止,失访病例以末次随访时间为截点。本研究PEG-ASP组2例于诱导缓解期间并发感染死亡,故PEG-ASP组可用于评价CR率、CNSL发生率的为44例;1例于诱导缓解后并发肺部感染死亡,可评价RFS及总生存时间为43例。L-ASP组1例于诱导缓解期间并发化脓性脑膜炎死亡,故可用于评价CR率、CNSL发生率、RFS及总生存时间的为41例。本研究截止随访时间为2016年9月26日,中位随访时间37月(7个月-80月)。
1.4 统计学分析
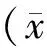
2 结果
2.1 一般资料比较
两组患儿在年龄分布、性别构成、初发血常规及骨髓原始和幼稚淋巴细胞比例、肝脾及淋巴结肿大情况、免疫分型、危险度分级、对泼尼松预治疗反应、凝血功能等方面比较,差异均无统计学意义(均P>0.05,见表1)。
表1 两组患儿一般资料比较
Table 1 Comparison of general data between two groups
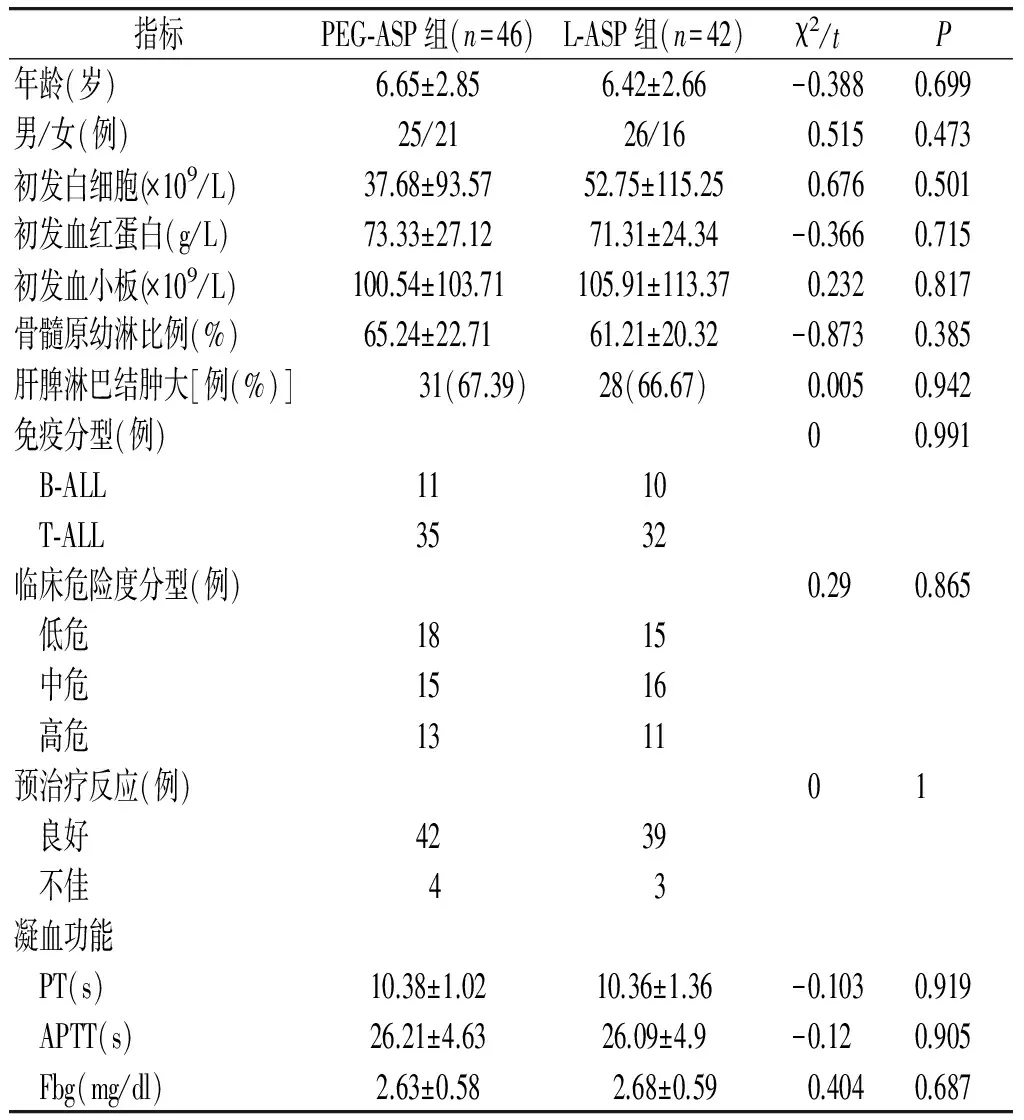
指标PEG⁃ASP组(n=46)L⁃ASP组(n=42)χ2/tP年龄(岁)6.65±2.856.42±2.66-0.3880.699男/女(例)25/2126/160.5150.473初发白细胞(×109/L)37.68±93.5752.75±115.250.6760.501初发血红蛋白(g/L)73.33±27.1271.31±24.34-0.3660.715初发血小板(×109/L)100.54±103.71105.91±113.370.2320.817骨髓原幼淋比例(%)65.24±22.7161.21±20.32-0.8730.385肝脾淋巴结肿大[例(%)] 31(67.39)28(66.67)0.0050.942免疫分型(例)00.991 B⁃ALL1110 T⁃ALL3532临床危险度分型(例)0.290.865 低危1815 中危1516 高危1311预治疗反应(例)01 良好4239 不佳43凝血功能 PT(s)10.38±1.0210.36±1.36-0.1030.919 APTT(s)26.21±4.6326.09±4.9-0.120.905 Fbg(mg/dl)2.63±0.582.68±0.590.4040.687
2.2 两组骨髓增殖抑制程度、恢复时间比较
两种剂型的ASP均对骨髓增殖具有抑制作用,且其抑制程度差异有统计学意义(见表2)。PEG-ASP对骨髓抑制的恢复时间[(20.85±5.76)d]长于L-ASP[(16.02±4.95)d],差异有统计学意义(P<0.05)。
表2 两组患儿骨髓增殖抑制程度的比较 (例)
Table 2 Comparison of bone marrow proliferation inhibition in two groups (cases)
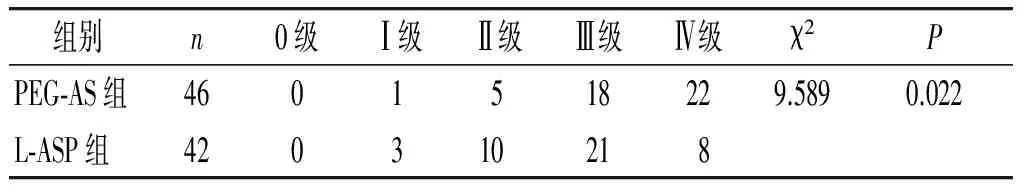
组别n0级Ⅰ级Ⅱ级Ⅲ级Ⅳ级χ2PPEG⁃AS组4601518229.5890.022L⁃ASP组420310218
2.3 两组患儿不良反应的比较
两组凝血功能障碍比较,差异均有统计学意义(P均<0.05)。使用门冬酰胺酶后PEG-ASP组PT[(38.66±15.52)s]、APTT[(66.37±19.31)s]均高于L-ASP组[(32.21±9.5)s及(48.79±8.86)s],而Fbg[(1.39±0.64) mg/dl]低于L-ASP组[(2.09±1.02)mg/dl],差异均有统计学意义(P均<0.05);PEG-ASP组凝血功能障碍的持续时间[(8.65±3)d]长于L-ASP组[(7.52±2.16)d] ,差异有统计学意义(P<0.05)。但两组出血事件发生率比较,差异无统计学意义(P>0.05)。两组在过敏反应、高血糖、心血管损害、血栓形成、肝肾功能损害、感染相关死亡率及胰腺损害方面比较,差异均无统计学意义(P均>0.05,见表3)。
表3 两种门冬酰胺酶发生不良反应比较
Table 3 Comparison of adverse reactions between two groups
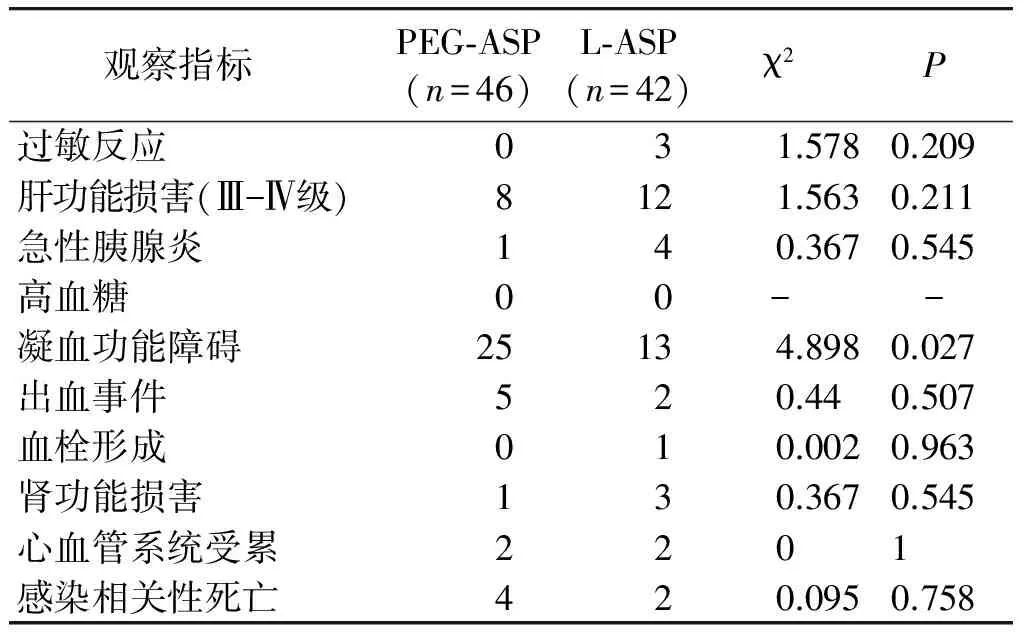
观察指标 PEG⁃ASP(n=46)L⁃ASP(n=42)χ2P过敏反应031.5780.209肝功能损害(Ⅲ-Ⅳ级)8121.5630.211急性胰腺炎140.3670.545高血糖00--凝血功能障碍25134.8980.027出血事件520.440.507血栓形成010.0020.963肾功能损害130.3670.545心血管系统受累2201感染相关性死亡420.0950.758
2.4 两组患儿临床缓解程度及复发、CNSL发生率、生存情况的比较
PEG-ASP组44例中,完全缓解(CR)39例,部分缓解(PR)2例,未缓解(NR)3例,CR率88.6%,总有效率93.18%;L-ASP组41例,CR 36例,PR 2例,NR 3例,完全缓解率87.8%,总有效率92.68%,两组临床缓解度比较,差异无统计学意义(P>0.05)。PEG-ASP、L-ASP治疗相同危险度及相同免疫分型的ALL的临床缓解程度比较,差异均无统计学意义(P均>0.05,见表4,5)。L-ASP治疗后发生CNSL 24.39%(10/41)比例显著高于PEG-ASP组6.82%(3/44),差异有统计学意义(P<0.05)。
表4 两组不同危险度的临床缓解情况比较
Table 4 Comparison of clinical remission of different risk patients between two groups
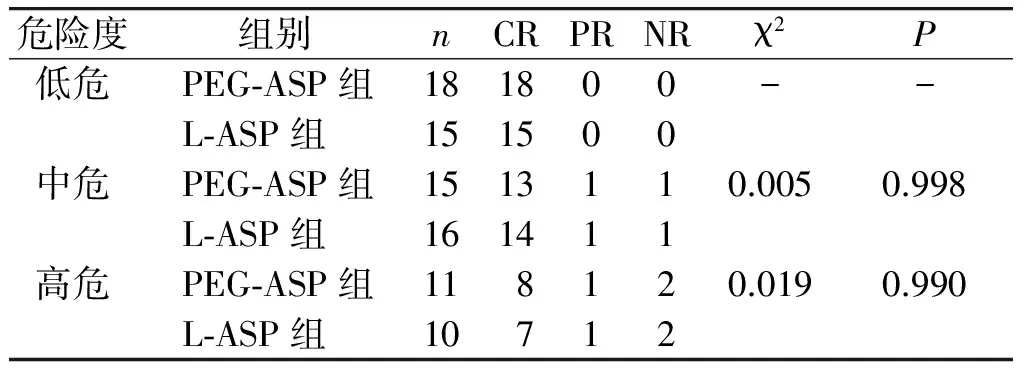
危险度 组别nCRPRNRχ2P低危PEG⁃ASP组181800--L⁃ASP组151500中危PEG⁃ASP组1513110.0050.998L⁃ASP组161411高危PEG⁃ASP组118120.0190.990L⁃ASP组10712
表5 两组不同免疫分型的临床缓解情况比较
Table 5 Comparison of clinical remission of different immune types between two groups
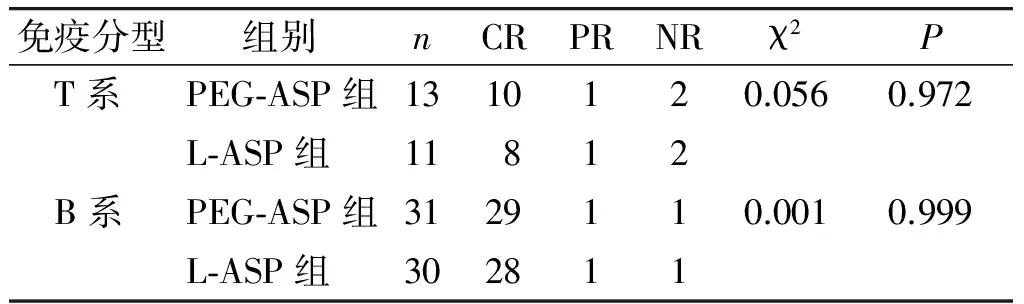
免疫分型 组别nCRPRNRχ2P T系PEG⁃ASP组1310120.0560.972L⁃ASP组11812 B系PEG⁃ASP组3129110.0010.999L⁃ASP组302811
远期疗效:PEG-ASP 46例患者中3例未缓解,2例失访,4例复发(3例骨髓复发,1例中枢神经系统白血病) ,4例死亡(2例于诱导缓解期间并发感染死亡,1例于诱导缓解后并发肺部感染死亡,1例于延迟强化期并发败血症死亡);L-ASP 42例患者中3例未缓解,3例失访,5例复发(2例骨髓复发,2例中枢神经系统白血病,1例睾丸复发),3例死亡(1例于诱导缓解期间并发化脓性脑膜炎死亡,1例于延迟强化治疗中并发感染死亡,1例患者于延迟强化治疗中并发脑出血死亡)。PEG-ASP组RFS[(837.41±543.55)d]和总OS[(1 033.61±558.87)d]均大于L-ASP组RFS[(722.24±461.79)d]和总OS[(944.57±511.07)d],但两组间比较,差异均无统计学意义(P均>0.05)。
3 讨论
目前,使用门冬酰胺酶治疗ALL已有肯定的疗效,含门冬酰胺酶的VDLP方案已成为ALL治疗的指南推荐。L-Asp由于其高免疫原性使患儿体内产生酶抗体,出现过敏反应或寂静失活而影响疗效[4]。有文献报道,儿童初次接受L-ASP治疗时,急性过敏反应的发生率为24%[5]。而PEG-Asp将L-ASP与聚乙二醇及磷脂双分子层连接而成的制剂,该酶既保持了L-ASP的酶活性,又因物理包埋和化学修饰而获得更优异的特性,包括增加了水溶性,降低免疫原性,并提高生物利用率,降低肾脏清除率,延长半衰期等[6]。同时避免了患儿反复注射的疼痛,可大大减少患儿住院时间,PEG-ASP发生过敏反应明显减少[7]。
不同门冬酰胺酶制剂的半衰期不同[2],PEG-Asp的磷脂双分子层增加了水溶性及酶稳定性,保护酶不易被水解,从而使酶在体内长时间保持活性,半衰期大为延长,从L-ASP的20 h延长至5.5 d,约为L-ASP的5倍左右[8]。本研究显示PEG-ASP组在诱导缓解期骨髓抑制程度重。恢复时间长,与其半衰期长,发挥疗效时间长有关。
本研究显示,两种门冬酰胺酶对相同危险度及免疫分型的ALL的临床缓解程度无明显差别。Appel等[9]研究发现不同免疫表型的ALL对门冬酰胺酶的敏感性不同。本研究显示PEG-ASP和L-ASP对T细胞型的ALL临床缓解度均低于B细胞型的ALL,建议在治疗T-ALL时可考虑调整门冬酰胺酶的剂量以达到最佳疗效。
国内外多中心研究表明,PEG-ASP与L-ASP的疗效相同[10],本研究显示两组的CR率无明显差异,关于不良反应方面,本研究显示两组患儿过敏反应、高血糖、心血管损害、血栓形成、肝肾功能及胰腺损害方面比较无明显差异。与Dinndorf等[11]的研究结果一致。有文献报道,门冬酰胺酶可抑制正常细胞的蛋白质合成,会降低多种蛋白质在肝脏的产生和消耗,与影响几乎所有蛋白质性凝血因子的合成有关。使肝脏合成凝血因子能力下降,导致凝血功能障碍[12]。本研究显示PEG-ASP组对凝血功能的抑制程度重,且恢复时间慢。与PEG-ASP发挥疗效时间长,抑制蛋白质合成作用更强有关。
Henriksen等[13]报道ALL患儿中使用L-ASP和PEG-ASP后脑脊液中门冬酰胺水平下降程度无明显差异,但其水平与门冬酰胺酶抗体呈反向关系。本研究发现L-ASP组患儿后续出现CNSL发生率高于PEG-ASP组,与PEG-ASP免疫原性低,酶抗体产生少有关,从而有效降低脑脊液中门冬酰胺的水平,使其抗肿瘤活性强,并可增加激素在体内的作用时间,增强防止发生CNSL的作用[14]。但由于本研究样本量相对较少,关于PEG-ASP在防治CNSL作用上是否更有优势,待样本量进一步扩大或开展前瞻性研究来证实。
关于其远期疗效,许多临床研究表明,PEG-Asp可以更快地清除骨髓中的白血病细胞,诱导缓解率及3年无事件生存率与L-Asp相似[5]。本研究显示PEG-Asp组在总生存时间和疾病无进展时间长于L-Asp组,但二者差异并无统计学意义,与刘芳等[10]研究一致。
综上所述,PEG-Asp抑制白血病细胞能力更强,所以应更加注意加强护理,防范其严重并发症的发生。PEG-ASP的不良反应大,持续时间长,说明其治疗作用强,因其注射次数少,变态反应发生率低,ALL患儿依从性好,其导致的不良反应可采取有效措施预防,且远期疗效与L-Asp相似,故推荐作为儿童初发ALL的一线用药。
[1] 中国临床肿瘤学会(CSCO),中华医学会血液学分会(CHS),中华儿科血液学分会(CCHS).培门冬酶治疗急性淋巴细胞白血病和恶性淋巴瘤的专家共识[J].临床肿瘤学杂志,2013,18(3):256-262.
[2] Asselin BL, Whitin JC, Coppola DJ,etal. Comparative pharma-cokinetic studies of three asparaginase preparations[J]. J Clin Oncol, 1993, 11(9): 1780-1786.
[3] 张之南,沈悌.血液病诊断及疗效标准[M].3版.北京:科学出版社,2007:132.
[4] Vrooman LM, Stevenson KE, Supko JG,etal. Postinduction dexamethasone and individualized dosing of Escherichia Coli L-asparaginase each improve outcome of children and adolescents with newly diagnosed acute lymphoblastic leukemia: results from a randomized study: Dana-Farber Cancer Institute ALL Consortium Protocol 00-01[J]. J Clin Oncol, 2013, 31(9): 1202-1210.
[5] Avramis VI, Sencer S, Periclou AP, et a1.A randomized comparison of native Escheriehia coli asparaginase and polyethylene glycol conjugated asparaginase for treatment of children with newly diagnosed standard-risk acute lymphoblastic leukemia:a Children’s Cancer Group study[J]. Blood, 2002, 99(6): 1986-1994.
[6] Kopecek J. Polymer-drug conjugates: origins, progress to date and future directions[J]. Adv Drug Deliv Rev, 2013, 65(1): 49-59.
[7] Silver man LB, Supko JG, Stevenson KE,etal. Intravenous PEG-asparaginase during remission induction in children and adolescents with newly diagnosed acute lymphoblastic leukemia[J]. Blood, 2010, 115(7): 1351-1353.
[8] Raetz EA, Salzer WL. Tolerability and eficacy of L-asparaginase therapy in pediatric patients with acute lymphoblastic leukemia[J]. J Pediatr Hematol Oncol, 2010, 32(7): 554-563.
[9] Appel IM, Kazemier KM, Boos J,etal. Pharmacokinetic,pharmacodynamic and intracellular effects of PEG-asparaginase in newly diagnosed childhood acute lymphoblastic leukemia:results from a single agent window study[J]. Leukemia, 2008, 22(9): 1665-1679.
[10] 刘芳,邹尧, 张丽, 等. 培门冬酶治疗儿童初发急性淋巴细胞白血病的远期疗效[J].中国小儿血液与肿瘤杂志, 2010, 15(6): 254-257.
[11] Dinndorf PA, Gootenberg J, Cohen MH,etal. FDA drug approval summary: pegaspargase (oncaspar) for the first-line treatment of children with acute lymphoblastic leukemia( ALL)[J]. Oncologist, 2007, 12(8): 991-998.
[12] Hongo T, Okada S, Ohzeki T,etal. Low plasma levels of hemostatic proteins during the induction phase in children with acute lymphoblastic leukemia: a retrospective study by the JACLS. Japan Association of Childhood Leukemia Study[J]. Pediatr Int, 2002, 44(3): 293-299.
[13] Henriksen LT, Nersting J, Raja RA,etal. Cerebrospinal fluid asparagine depletion during pegylated asparaginase therapy in children with acute lymphoblastic leukaemia[J]. Br J Haematol, 2014, 166(2): 213 -220.
[14] Kawedia JD, Liu C, Pei D,etal. Dexamethasone exposure and asparaginase antibodies affect relapse risk in acute lymphoblastic leukemia[J]. Blood, 2012, 119(7): 1658-1664.
Clinical characterizations of pegaspargase and L-asparaginase in treatment of children with acute lymphoblastic leukemia
ZHANG Jingjing,ZHANG Huiqin, TAO Xiaojuan, LU Xingchen, DANG Rong, SUN Xin*
(DepartmentofPediatrics,XijingHospitalofFourthMilitaryMedicalUniversity,Xi’an710032,China;*Correspondingauthor,E-mail:sunxin6@fmmu.edu.cn)
ObjectiveTo explore the efficacy of pegaspargase(PEG-ASP) and L-asparaginase(L-ASP) in children with acute lymphoblastic leukemia(ALL).MethodsClinical data of 88 patients with first-episode ALL were retrospectively analyzed in Xijing Hospital of Fourth Military University from January 2010 to January 2015. Of 88 patients, 42 patients were treated with L-ASP, and 46 patients were treated with PEG-ASP during the induction remission period. The clinical efficacy and adverse reactions were compared between the two groups.ResultsThe complete remission(CR) rate was 88.6% and 87.8% in PEG-ASP group and L-ASP group, respectively(P>0.05). The bone marrow suppression degree in PEG-ASP group was more severe than that in L-ASP group, and the duration of bone marrow suppression was significantly longer(P<0.05). The incidence of central nervous system leukemia in L-ASP group was significantly lower than that in PEG-ASP group(6.82%vs24.39%,P<0.05). The duration of coagulation dysfunction in PEG-ASP group[(8.65±3)d] was longer than that in L-ASP group[(7.52±2.16)d] (P<0.05). There was no significant diffe-rence in the other adverse reactions between the two groups(P>0.05).ConclusionThe recovery time of blood routine,blood clotting routine and bone marrow proliferation inhibition in PEG-ASP group are longer than those in L-ASP group. The incidence of other adverse effects in two groups are similar. PEG-ASP can be used as the first-line treatment for ALL children.
acute lymphoblastic leukemia; pegaspargase; L-asparaginase
张静静,女,1972-06生,学士,主治医师,E-mail:15353355123@163.com
2017-01-04
R733.7
A
1007-6611(2017)05-0485-04
10.13753/j.issn.1007-6611.2017.05.018

