RRM1、CDX2在胃癌组织中的表达及临床意义
王柏桦,孟加榕,唐忠辉,温路生,刘美莲,黄仲庆,禹 乐(漳州卫生职业学院基础医学部病理学教研室,漳州 363000;中国人民解放军第一七五医院病理科,厦门大学附属东南医院病理科;通讯作者,E-mail:tzh6409@6.com)
RRM1、CDX2在胃癌组织中的表达及临床意义
王柏桦1,孟加榕2,唐忠辉1*,温路生2,刘美莲2,黄仲庆1,禹 乐2
(1漳州卫生职业学院基础医学部病理学教研室,漳州 363000;2中国人民解放军第一七五医院病理科,厦门大学附属东南医院病理科;*通讯作者,E-mail:tzh6409@126.com)
目的 探讨RRM1、CDX2在胃癌组织中的表达,并分析其与胃癌侵袭与转移的关系。 方法 选取90例术前未行放化疗的胃癌石蜡标本及与其对应正常胃黏膜蜡标本30例,采用SP免疫组化方法检测RRM1和CDX2在两种组织中表达情况,分析二者表达与分化程度、浸润深度、淋巴结转移、TNM分期之间的关系。 结果 ① RRM1、CDX2在胃癌中的阳性表达率均显著高于正常胃黏膜组(86.7%vs40.0%,P<0.01; 61.1%vs16.7%,P<0.01)。② 90例胃癌中,RRM1与CDX2二者之间呈正相关关系(rs=0.223,P=0.034);RRM1、CDX2表达与分化程度密切相关(P<0.05),CDX2表达与浸润深度、淋巴结转移、TNM分期密切相关(P<0.05),RRM1表达与浸润深度、淋巴结转移、TNM分期无相关(P>0.05)。 结论 RRM1、CDX2可作为较为理想的肿瘤标志物,用于胃癌的诊断和预后的预警。
胃肿瘤; RRM1; CDX2; 免疫组织化学
我国是胃癌的高发区,据统计胃癌基本居于我国恶性肿瘤发病率和死亡率首位[1]。目前认为胃癌的浸润和转移是影响胃癌患者预后的主要因素。核苷酸还原酶亚单位 M1(ribonucleotide reductase M1,RRM1)是近年被广泛关注的抑癌基因,可激发G2期检测点功能,使受损的DNA得以修复或者发生凋亡,并具有抑制细胞侵袭和转移的作用[2,3],可作为多种肿瘤早期诊的指标。尾型同源盒转录因子2(caudal-related homeobox transcription factor 2,CDX2)是人体中终身在肠道特性表达的核转录因子,对肠上皮细胞的分化、增殖、凋亡和肠道特定基因的转录起调控作用,有研究[4,5]发现CDX2蛋白异位表达可能导致胃黏膜肠上皮化生即肠化生,肠化生是胃癌的重要癌前病变。目前关于胃癌中RRM1与CDX2相关性的研究国内外还报道较少,本研究通过检测胃癌组织中RRM1和CDX2 表达的情况,并结合临床病理学特点分析其与胃癌浸润转移的相关性,为进一步研究胃癌的浸润、转移机制提供新的理论依据。
1 材料和方法
1.1 临床资料
选取中国人民解放军第一七五医院病理科2013-08~2014-07期间随访资料完整的原发性胃癌手术切除标本的蜡块90例,其中男64例,女26例,男 ∶女为2.46 ∶1,年龄43-78岁,中位年龄63岁。回顾分析全部病例的临床资料,按消化系统肿瘤WHO(2010年)分类[6]进行组织分型、区域淋巴结转移分站及TNM分期。另选取胃镜活检正常胃黏膜30例,所有患者术前未经过任何抗癌治疗。
1.2 主要试剂
实验用兔抗人RRM1多克隆抗体(即用型)、兔抗人CDX2单克隆抗体(即用型)及SP免疫组化试剂盒及DAB显色试剂盒均购自北京中杉金桥生物技术有限公司。
1.3 免疫组化
采用SP方法对组织切片进行免疫组化染色,DAB显色,苏木精复染,封片,具体操作按照SP试剂盒说明书进行。以PBS缓冲液代替一抗作为阴性对照,用已知阳性组织切片作阳性对照。
1.4 染色结果判断
采用双盲法,由两位病理医师独立观察,若计数相差10%以上重新计数[7]。
RRM1以细胞浆内内出现淡黄色至棕黄色颗粒为阳性细胞,CDX2以细胞核内出现淡黄色至棕黄色颗粒为阳性细胞。采用半定量积分法[8]:根据阳性细胞数和着色深度计分,每例均随机观察计数5个高倍视野(×400),确定其每个视野的阳性率,取平均数,按下列标准计分:阳性细胞≤5%为0分,6%-25%为1分,26%-50%为2分,>51%为3分;阳性细胞表达的着色深度:基本不着色为0分,黄色为1分,棕黄色为2分,棕褐色为3分。将两项积分相乘:0-2分为阴性(-),>2分为阳性(+)。
1.5 统计学方法
用SPSS18.0统计软件对检测结果进行统计分析,以α=0.05作为统计学检验的显著性水准。率的比较采用χ2检验法和Fisher确切概率法,相关分析用Spearman等级相关。
2 结果
2.1 胃癌组织中RRM1表达情况及其与临床病理学特征的关系
通过免疫组化法对120例标本进行检测,RRM1阳性染色主要位于胃黏膜腺上皮或肿瘤细胞的细胞浆,表现为细胞质内出现黄色或棕黄色颗粒物(见图1)。胃癌细胞的RRM1阳性表达率(86.7%)明显高于正常胃黏膜上皮细胞阳性表达率(40.0%),差异具有统计学意义(P<0.01,见表1)。RRM1表达与分化程度密切相关(P<0.05);但在不同性别、不同年龄、不同肿瘤大小、不同肿瘤浸润深度、是否有淋巴结转移、不同TNM分期分组中无统计学差异(P>0.05,见表2)。

A.RRM1蛋白在正常胃黏膜中呈阳性表达,阳性信号定位于胞质B.RRM1蛋白在胃癌中呈阳性表达,阳性信号定位于胞质图1 RRM1蛋白在正常胃黏膜和胃癌(SP,×100)Figure1 ExpressionofRRM1proteininnormalgastricmucosaandgastriccancertissues(SP,×100)
表1 胃癌和正常胃黏膜组织中RRM1、CDX2表达 例(%)
Table 1 The expression of RRM1 and CDX2 in gastric cancer and normal gastric mucosa cases(%)

组别nRRM1阳性CDX2阳性正常组3012(40 0)5(16 7)胃癌组9078(86 7)55(61 1) χ226 13317 778 P0 0000 000
2.2 胃癌组织中CDX2表达情况及其与临床病理学特征的关系
CDX2阳性染色主要位于胃黏膜腺上皮或肿瘤细胞的细胞核,表现为细胞核内出现黄色或棕黄色颗粒物(见图2)。从表1中可见,胃癌细胞的CDX2阳性表达率明显高于正常胃黏膜上皮细胞阳性表达率(61.1%vs16.7%,P<0.01)。CDX2表达与分化程度、肿瘤浸润深度、淋巴结转移、TNM分期密切相关(P<0.05),具有统计学显著差异;但在患者性别、年龄、肿瘤大小分组中无统计学差异(P>0.05,见表2)。2.3 胃癌组织中RRM1与CDX2 蛋白表达的相关性在90例胃癌中RRM1与CDX2二者之间呈正相关关系(rs=0.223,P<0.05,见表3)。
表2 RRM1、CDX2表达与胃癌临床病理特征的关系 例(%)
Table 2 Relationship of expression of RRM1 and CDX2 with clinicopathologic characteristics in gastric cancer cases(%)
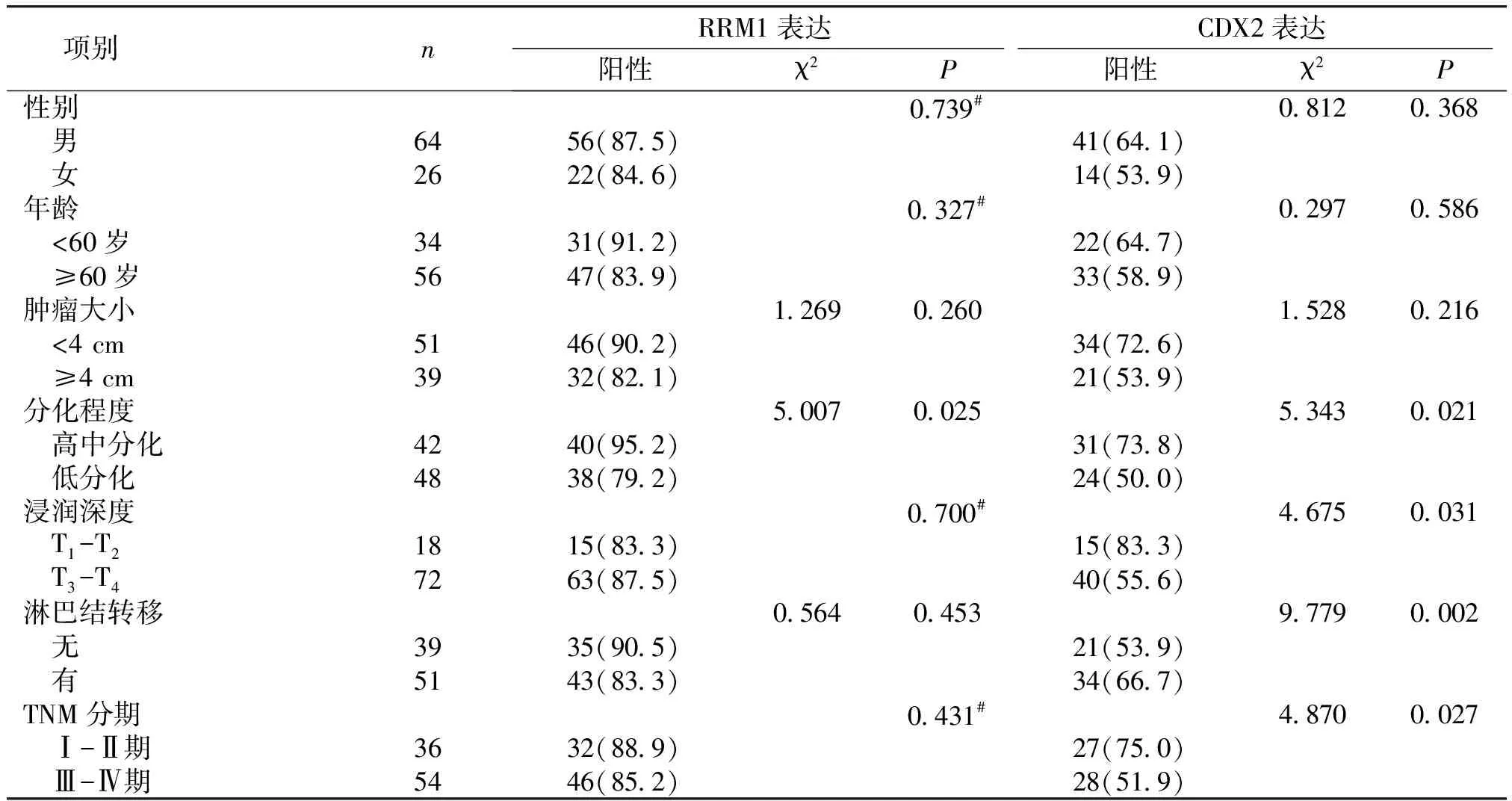
项别 nRRM1表达阳性χ2PCDX2表达阳性χ2P性别0.739#0 8120 368 男6456(87 5)41(64 1) 女2622(84 6)14(53 9)年龄0 327#0 2970 586 <60岁3431(91 2)22(64 7) ≥60岁5647(83 9)33(58 9)肿瘤大小1 2690 2601 5280 216 <4cm5146(90 2)34(72 6) ≥4cm3932(82 1)21(53 9)分化程度5 0070 0255 3430 021 高中分化4240(95 2)31(73 8) 低分化4838(79 2)24(50 0)浸润深度0 700#4 6750 031 T1-T21815(83 3)15(83 3) T3-T47263(87 5)40(55 6)淋巴结转移0 5640 4539 7790 002 无3935(90 5)21(53 9) 有5143(83 3)34(66 7)TNM分期0 431#4 8700 027 Ⅰ-Ⅱ期3632(88 9)27(75 0) Ⅲ-Ⅳ期5446(85 2)28(51 9)
#采用Fisher确切概率法

A.CDX2蛋白在正常胃黏膜中呈阳性表达,阳性信号定位于胞核B.CDX2蛋白在胃癌中呈阳性表达,阳性信号定位于胞核图2 CDX2蛋白在正常胃黏膜和胃癌(SP,×100)Figure2 ExpressionofCDX2proteininnormalgastricmucosaandgastriccancertissues(SP,×100)
表3 RRM1和CDX2表达的的相关性
Table 3 Correlation of RRM1 and CDX2 expression in different gastric mucosa lesions and gastric cancer

RRM1表达nCDX2表达-+rsP-12840.2230.034+782751
3 讨论
RRM1是核糖核苷酸还原酶(ribonucleotide reductase,RR)的具有控制底物特异性和全酶活性的调节M1亚单位,有19个外显子,其编码的蛋白质含有792个氨基酸,分子量为85 kD,定位于染色体11p15.5区域,该区域是一个可出现多种恶性肿瘤的杂合子缺失(loss of heterozygosity,LOH),被称为LOH11A,其与恶性肿瘤的转移和预后有一定的相关性[9]。人们很早就发现在胃癌、食管癌和乳腺癌等存在11p15.5的杂合性丢失,因此认为该区域的丢失与恶性肿瘤的转移有关系[10]。另外,RRMI可以激发G2监测点功能,增加DNA损伤后的修复和凋亡,并可以抑制肿瘤细胞迁移和侵袭[11,12]。本研究采用SP免疫组化方法检测90例胃癌组织中RRM1蛋白的表达,结果发现胃癌细胞的RRM1阳性表达率明显高于正常胃黏膜上皮细胞阳性表达率(86.7%vs40.0%,P<0.01),提示RRM1在胃黏膜癌变过程中发挥作用,其表达异常是胃癌发生的分子事件[13],说明RRM1参与了胃癌的发生、发展。国内有学者研究认为RRM1显著高表达于肿瘤组织,与本研究结果一致,但国内杨倩等[13]研究认为胃癌组织中RRM1表达较低,与本研究结果相反,故有待于进一步探讨。本研究中胃癌组织RRM1表达与患者的性别、年龄、肿瘤大小、肿瘤浸润深度、淋巴结转移、TNM分期无关,但与肿瘤分化程度密切相关(P<0.05),与国内杨倩等[13]研究结果一致,即随着胃癌分化程度的降低,RRM1 表达也降低,这表明 RRM1表达的增多可能在胃恶性肿瘤的进展中起一定作用。
尾型同源盒转录因子2(caudal-related homeobox transcription factor 2,CDX2)属肠特异性转录因子,近年来人体染色体研究表明,CDX2基因全长 22-23 kb,位于染色体13q12-13,由3个外显子和2个内含子构成,与之对应的CDX2蛋白包含311个单氨基酸,通过螺旋-环-螺旋的方式结合于DNA的相应区域,以转录因子的形式调节DNA的表达[14]。CDX2作为一种肠道特异性表达的转录因子,负责调控肠型上皮细胞的分化,对肠道上皮细胞的增殖、分化起着重要作用,并能够特异性结合多种肠道特异性基因的启动子,调控这些基因的肠道特异性表达和表达强度,其调控作用呈现剂量依赖性的特征。Satake等[15]研究发现通过调节claudin1和claudin2的表达在胃肠化和胃癌中都起着很重要的作用。Xie等[16]研究发现CDX2的过表达可以抑制胃癌细胞的生长。本研究发现胃癌细胞的CDX2阳性表达率(61.1%)明显高于正常胃黏膜上皮细胞阳性表达率(16.7%),具有统计学显著差异(P<0.01),其结果与国内外研究报道一致[15-17],提示CDX2蛋白在胃黏膜细胞中的异常表达是引起胃黏膜上皮恶变的早期事件;说明CDX2表达异常与胃癌密切相关。研究发现CDX2表达降低可能是临床中晚期患者肿瘤细胞恶性生长的主要原因,影响胃癌患者预后的关键因素就是肿瘤分化程度、浸润胃壁的深度、淋巴结转移和TNM分期。本研究CDX2发现与胃癌细胞分化、肿瘤浸润深度、淋巴结转移、TNM分期密切相关(P<0.05),即随着胃癌的分化减低,浸润的深度增加,TNM分期增加,CDX2的表达呈现下降趋势,表明高CDX2表达具有较低的侵袭能力,CDX2的高表达有可能能够抑制肿瘤的浸润及促进肿瘤组织的分化,与国内研究一致[18,19]。
胃癌的形成和转移是一个多基因、多阶段、渐进性进行的复杂过程,本研究结果发现,在90例胃癌中RRM1与CDX2二者之间呈正相关关系(rs=0.223,P<0.05),推测RRM1、CDX2之间可能相互影响对方的表达,两者之间存在相互促进作用;并且RRM1、CDX2对胃癌的发生、发展存在某种协同“催化”作用,两者的相互促进作用,加速了胃癌病情的急速发展,加剧了病情恶化。RRM1、CDX2二者之间对胃癌发生发展作用机制目前尚未清楚,有待于进一步研究。
综上所述,RRM1、CDX2表达均与胃癌的发生发展及预后有关,二者可作为较为理想的肿瘤标志物用于胃癌的诊断和转移的预警。
[1] 邹文斌,李兆申.中国胃癌发病率及死亡率研究进展[J].中国实用内科杂志,2014,34(4):408-413.
[2] Zheng Z,Chen T,Li X,etal. DNA synthesis and repair genes RRM1 and ERCC1 in lung cancer[J]. N Engl J Med,2007,356(8):800-808.
[3] 罗扬,冯奉仪.核苷酸还原酶亚单位M1和内切修复交叉补体1在非小细胞肺癌中的研究进展[J].癌症进展杂志,2008,6(2):152-156.
[4] Khor TS,Alfaro EE,Ooi EM,etal. Divergent expression of MUC5AC,MUC6,MUC2,CD10,and CDX-2 in dysplasia and intramucosal adenocarcinomas with intestinal and foveolar morphology: is this evidence of distinct gastric and intestinal pathways to carcinogenesis in Barrett Esophagus[J].Am J Surg Pathol,2012,36(3):331-342.
[5] Muhoh H,Hakamata Y,Sato K,etal. Conversion of gastric mucosa to intestinal in CDX2-expressing transgenic mice[J]. Biochem Biophys Res Commum,2002,294(2):470-479.
[6] 崔全才,孟宇宏,王鲁平.消化系统肿瘤WHO分类[M].北京:诊断病理学杂志社,2012:53-55.
[7] 唐忠辉,池正忠,蔡庆发,等.CD44v6,MMP-9,CD34表达与胃癌生物学行为的关系[J].山西医科大学学报,2006,37(10):1003-1007.
[8] Meng Jia-rong,Tang Hui-zhong,Zhou Kai-zong,etal.TFF3 and survivin expressions associate with a lower survival ratein gastric cancer[J]. Clin Exp Med,2013,13(4):297-303.
[9] Guittet O,Hakansson P,Voevodskaya N,etal. Mammalian p53R2 protein forms an active ribonucleotide reductase in vitro with the R1 protein,which is expressed both in resting cells in response to DNA damage and in proliferating cells[J].J Biol Chem,2001,276 (44):40647-40651.
[10] Kolberg M,Strand KR,Graff P,etal. Structure,function,and mechanism of ribonucleotide reductases[J]. Biochim Biophys Acta,2004,1699(12):1-34.
[11] Rosell R,Danenberg KD,Alberola V,etal. Ribonucleotide reductase messenger RNA expression and survival in gemcitabine/cisplatin-valingenl-trated advanede non-small cell lung cancer patients[J]. Clin Cancer Res,2004,10(4):1318.
[12] GautamA,Li ZR,Bepler G. RRMI-induced metasatsis suppression through PTEN-regulated pathways[J]. Oncogene,2003,22(14):2135.
[13] 杨倩,陈晓宇,彭延申,等.抑癌基因RRM1在胃癌发生、发展中的表达及其临床意义[J].胃肠病学,2012,17(10):587-591.
[14] 陈淑敏,唐忠辉.CDX2和MUC2 在胃癌癌变多阶段组织中的表达及意义的研究近况[J].医学综述,2011,17(14):2111-2113.
[15] Satake S,Semba S,Matsuda Y,etal. CDX2 transcription factor regulates claudin-3 and claudin-4 expression during intestinal differentiation of gastric carcinoma[J]. Pathol Int,2008,58(3):156-163.
[16] Xie Y,Li L,Wang X,etal. Overexpression of CDX2 inhibits progression of gastric cancerinvitro[J].Int J Oncol,2010,36(2):509-516.
[17] 陈淑敏,邹宗楷,唐忠辉,等.利用组织芯片技术研究CDX2和MUC2在萎缩性胃炎及胃癌组织中的表达[J].右江民族医学院学报,2014,36(5):686-691.
[18] 张秋杰.胃癌组织中 CDX2 表达及其与 KI67 的关系分析[J].实用癌症杂志,2016,31(7):1062-1064.
[19] 王秀丽,刘惠敏.CDX-2,PTEN,E-cadherin,NM23在胃癌中的表达及临床意义[J].第二军医大学学报,2010,31(4):404-407.
Expression and clinical significance of RRM1,CDX2 in gastric cancer tissues
WANG Baihua1,MENG Jiarong2,TANG Zhonghui1*,WEN Lusheng2,LIU Meilian2,HUANG Zhongqing1,YU Le2
(1DepartmentofPathology,FacultyofBasicMedicineinZhangzhouHealthVocationalCollege,Zhangzhou363000,China;2DepartmentofPathology,175thHospitalofPLA,DepartmentofPathology,AffiliatedSoutheastHospital,XiamenUniversity;*Correspondingauthor,E-mail:tzh6409@126.com)
ObjectiveTo explore the expression of RRM1 and CDX2 in gastric cancer tissues and its relationship with invasion and metastasis of gastric cancer.MethodsExpression of RRM1 and CDX2 was detected in 90 cases of gastric cancer without preoperative chemoradiotherapy and 30 cases of normal gastric mucosa using immunohistochemistry SP method. The relationships of RRM1 and CDX2 expression with differentiation degree,tumor invasion depth,TNM stage and lymph node metastasis were analyzed.Results① The positive expression rates of RRM1 and CDX2 were both significantly higher in gastric cancer tissues than in those of normal gastric mucosa(86.7%vs40.0%,P<0.01; 61.1%vs16.7%,P<0.01).② The expression of RRM1 in 90 cases of gastric cancer was positively correlated with CDX2(rs=0.223,P=0.034).The expression of RRM1 and CDX2 was related with differentiation degree(P<0.05). The expression of CDX2 was related with tumor invasion depth,TNM stage and lymph node metastasis(P<0.05). The expression of RRM1 was not related with tumor invasion depth,TNM stage,lymph node metastasis(P>0.05).ConclusionRRM1 and CDX2 can be used as ideal tumor markers in diagnosis of gastric cancer and prognosis.
gastric carcinoma; RRM1; CDX2; immunohistochemisty
福建省教育厅B类科技基金资助项目(JB12319)
王柏桦,男,1963-10生,本科,讲师,E-mail:baihw@163.com
2017-02-14
R735.2
A
1007-6611(2017)05-0475-04
10.13753/j.issn.1007-6611.2017.05.016

