胸水细胞块EGFR基因突变检测在非小细胞肺癌中的临床意义
禹 乐,朱启淦,杨立民,温路生,魁国菊,潘羡心,孟加榕(解放军第175医院,厦门大学附属东南医院病理科,漳州 363000;通讯作者,E-mail:mengjiarong@sina.com)
胸水细胞块EGFR基因突变检测在非小细胞肺癌中的临床意义
禹 乐,朱启淦,杨立民,温路生,魁国菊,潘羡心,孟加榕*
(解放军第175医院,厦门大学附属东南医院病理科,漳州 363000;*通讯作者,E-mail:mengjiarong@sina.com)
目的 探讨应用实时荧光定量PCR方法检测非小细胞肺癌阳性胸水细胞块EGFR突变的临床意义。 方法 收集具有组织标本作为对照的非小细胞肺癌阳性胸水60例,制作细胞块,提取DNA,应用实时荧光定量PCR法同时对细胞块和组织标本的EGFR第19外显子(19-Del)和21外显子(L858R)突变进行检测,分析细胞块与组织标本的EGFR突变率的差异。 结果 胸水细胞块中EGFR突变率为35%(21/60),其中19-Del突变11例,L858R突变9例,19-Del和L858R双突变1例;组织标本中EGFR突变率为36.7%(22/60),其中19-Del突变12例,L858R突变9例,19-Del和L858R双突变1例。两种标本的EGFR突变率差异无统计学意义(P>0.05);胸水细胞块EGFR突变类型与其对应的组织标本相一致。 结论 胸水细胞块与组织样本在EGFR基因突变上具有较高的一致性。
肺癌; 胸水; 细胞学; EGFR基因
目前,肺癌不仅在欧美等发达国家居恶性肿瘤发病率及死亡率之首[1,2],也已成为我国城市居民死亡率首位的恶性肿瘤,且有逐年上升的趋势[3]。近年来,随着分子生物学技术的发展,对肿瘤发病机制从细胞、分子水平的进一步认识,小分子基因靶向治疗药物EGFR酪氨酸激酶抑制剂在非小细胞肺癌的治疗中取得了显著效果,有效地延长了患者的生命。但是肺癌缺乏典型的早期症状,70%以上的病人在确诊时已属晚期[4,5],失去了手术机会,从而难以获得用于检测EGFR基因突变的组织学标本,而胸腔积液是晚期肺癌患者常见的并发症之一,标本获取比较容易,本文探索使用非小细胞肺癌阳性胸水作为检测EGFR基因突变的一种标本来源的可行性,进而为晚期伴有胸水的肺癌患者个体化靶向治疗提供分子病理学依据。
1 材料和方法
1.1 标本收集
收集2012-01~2016-10厦门大学附属东南医院具有组织学标本作为对照的非小细胞肺癌患者阳性胸水60例,其中男37例,女23例。
1.2 主要试剂与仪器
石蜡样本DNA提取试剂盒、人类EGFR 基因突变荧光PCR检测试剂盒均来自厦门艾德生物医药科技股份有限公司,免疫组化试剂来自福州迈新公司。Amoydx-Giraffe紫外分光光度计SMA4000;美国ABI 7500 Real Time PCR System 实时荧光定量PCR仪。
1.3 方法
1.3.1 胸水细胞学诊断 新鲜送检的胸水充分震荡后,取10 ml于试管中以2 000 r/min离心4 min,去除上清液,取沉淀均匀涂片,95%乙醇固定后HE染色,镜检选取见到肿瘤细胞或可疑肿瘤细胞的标本制作细胞块。
1.3.2 胸水细胞块制作 取胸水12 ml入15 ml尖底离心管,离心机2 000 r/min,离心5 min,弃上清,如细胞量过少,可重复上述步骤,加入4%中性甲醛6 ml,震荡后静置30 min,离心后弃上清,转移沉淀至显微镜擦镜纸上,包好后经脱水浸蜡制成石蜡细胞块。
1.3.3 细胞块的病理诊断 按常规方法制作HE切片,根据诊断需要选择免疫组化染色标记抗体,采用MaxVisionTM两步法操作,待病理医生诊断后,选取诊断为非小细胞肺癌的细胞块。
1.3.4 石蜡细胞块与组织标本DNA的提取 以6 μm的厚度分别对细胞块与组织标本进行切片,并各取10张至1.5 ml离心管中,加入二甲苯1 ml,振荡混匀10 s,14 000 r/min离心5 min,去上清;加入1 ml无水乙醇,振荡混匀10 s,14 000 r/min离心5 min,去上清,待乙醇充分挥发后,按石蜡样本DNA分离试剂盒(离心柱型)操作步骤进行操作获取样品DNA提取液。
1.3.5 实时荧光定量PCR检测EGFR基因突变 应用紫外分光光度计检测 DNA样品浓度与质量,将DNA浓度稀释至2 ng/μl,取23.5 μl 已稀释为2 ng/μl待检DNA样品,加入1.5 μl Taq酶,将混合好的DNA样品依次取5 μl加入8连管PCR反应体系中,设立阴性、阳性对照,进入ABI7900实时荧光定量PCR仪中反应。循环条件为95 ℃ 5 min 1个循环;95 ℃ 25 s,64 ℃ 20 s,72 ℃ 20 s 15个循环;93 ℃ 25 s,60 ℃ 35 s,72 ℃ 20 s 31个循环。依据操作说明书中提供的两种突变类型的阳性范围Ct值进行结果判读。
1.4 统计学分析
采用SPSS 15.0分析软件进行数据分析,应用χ2检验,比较实时荧光定量PCR方法检测胸水细胞块与组织学标本的EGFR突变率差异,P<0.05为差异有统计学意义。
2 结果
2.1 DNA含量、质量比较
所有样本所获取DNA样本浓度均大于2 ng/μl,OD260/OD280比值范围在1.6-2.2之间,OD260/OD230比值大于1.6,均符合实时荧光定量PCR要求,胸水细胞块与对应的组织标本DNA提取液的质量相近,DNA的浓度普遍低于组织标本(见图1)。
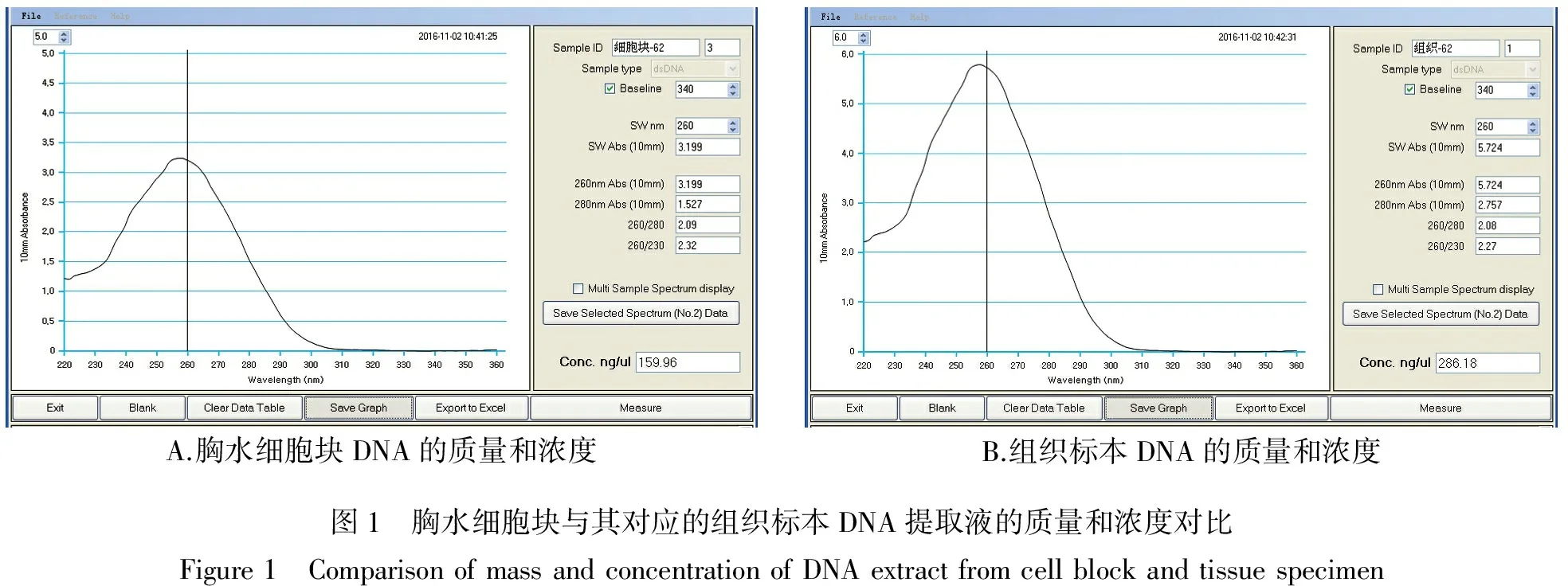
A.胸水细胞块DNA的质量和浓度B.组织标本DNA的质量和浓度图1 胸水细胞块与其对应的组织标本DNA提取液的质量和浓度对比Figure1 ComparisonofmassandconcentrationofDNAextractfromcellblockandtissuespecimen
2.2 EGFR基因突变结果比较
统计结果显示:60例胸水细胞块发生EGFR基因突变的为21例(35%),其中19外显子(19-Del)突变11例,21外显子(L858R)突变9例,19外显子(19-Del)和2l外显子(L858R)双突变1例;60例组织标本中发生EGFR基因突变的为22例(36.7%),其中19外显子(19-Del)突变12例,2l外显子(L858R)突变9例,19外显子(19-Del)和21外显子(L858R)双突变1例。两种标本中EGFR总突变率差异无统计学意义(P>0.05,见表1)。
表1 胸水细胞块与组织标本的EGFR突变结果的比较
Table 1 Comparison of EGFR mutation results between pleural cell block and tissue specimens

标本类型n19Del突变(例)L858R突变(例)19Del和L858R双突变(例)突变率(%) 细胞块60119135 0 组织标本60129136 7
2.3 EGFR基因突变类型结果
除1例组织标本检测结果显示为19Del突变而对应的细胞块检测结果为阴性外,其余的21例细胞块EGFR基因突变类型均与其组织标本完全一致(见图2)。
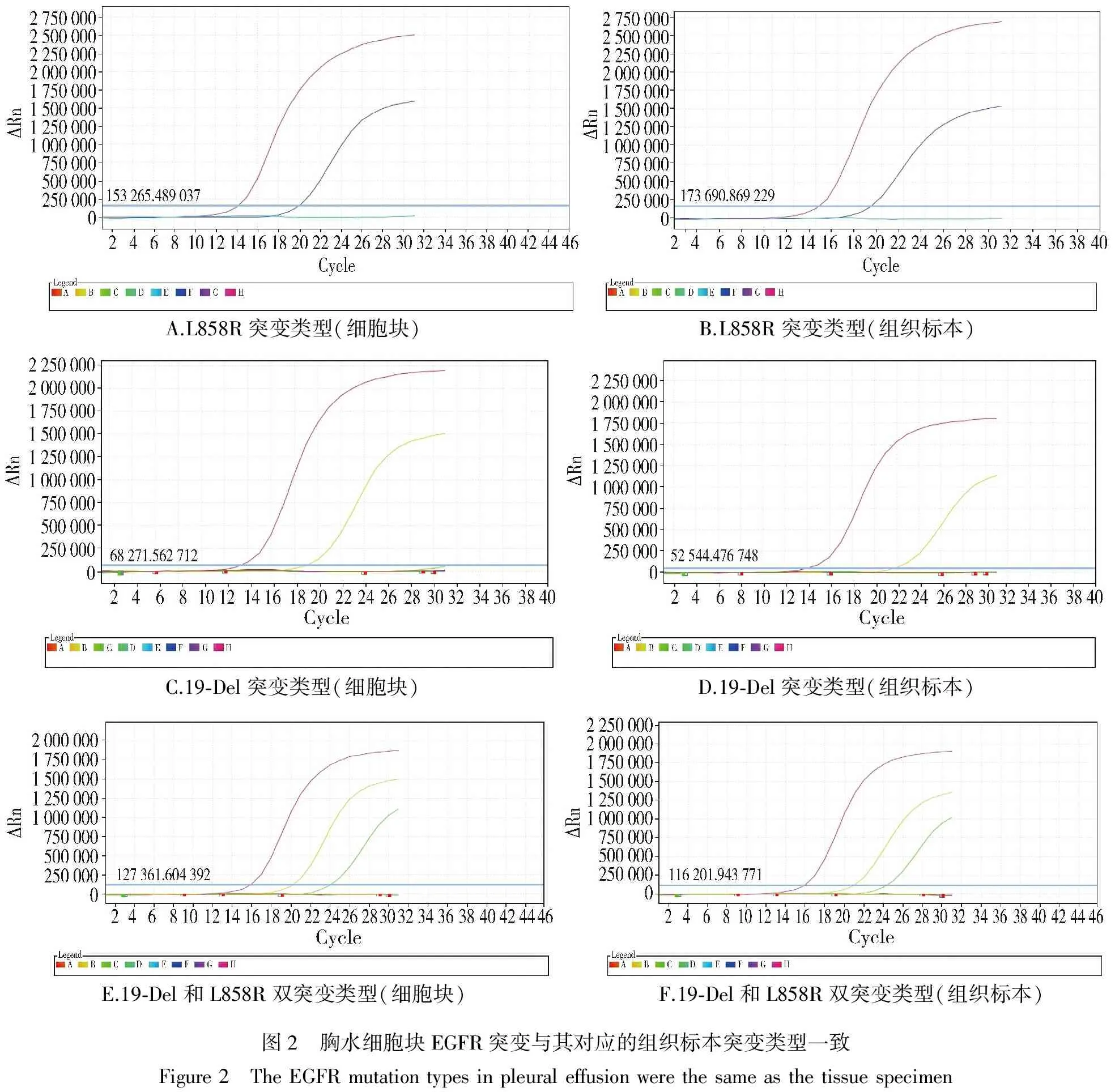
A.L858R突变类型(细胞块) B.L858R突变类型(组织标本) C.19⁃Del突变类型(细胞块) D.19⁃Del突变类型(组织标本) E.19⁃Del和L858R双突变类型(细胞块) F.19⁃Del和L858R双突变类型(组织标本)图2 胸水细胞块EGFR突变与其对应的组织标本突变类型一致Figure2 TheEGFRmutationtypesinpleuraleffusionwerethesameasthetissuespecimen
3 讨论
非小细胞肺癌的表皮生长因子受体(EGFR)基因突变情况是使用酪氨酸激酶抑制剂治疗的关键指标,然而临床中大部分肺癌患者就诊时已经是晚期,失去了手术机会,用于检测EGFR基因突变肿瘤组织获得难度较大。晚期肺癌患者常并发胸腔积液,15%的初诊患者及10%-50%的患者病程中均出现这一症状,尤其是外周型腺癌患者[6]。近年来,国内孟加榕等[7,8]尝试使用胸水的上清液、沉淀等不同成分提取DNA,应用高分辨率熔解曲线(HRM)技术检测EGFR基因突变情况,证实胸水的上清液、沉淀与肿瘤组织的EGFR基因突变情况具有较高一致性。但HRM是一门新兴的技术,国内尚未大范围推广应用。实时荧光定量PCR技术具有敏感度高、特异性高、技术成熟的特点,现已广泛应用于各种基因突变的检测,但目前国内对应用实时荧光定量PCR检测胸水细胞块EGFR基因突变的研究却鲜有报道。
有效地提取肿瘤细胞DNA是进行分子检测的前提,我们对本组研究所获取的DNA样本进行统计发现,同一患者的胸水细胞块提取的DNA液质量与组织标本相近,浓度却普遍略低。这可能是由于胸水中的肿瘤细胞数量相较于组织标本中的偏少,在制作细胞块的过程中又经过福尔马林溶液的固定处理,造成核酸与蛋白质之间发生交联反应,增加了核酸提取的难度,浸蜡和包埋的过程会进一步造成核酸片段化,加剧核酸的甲基化修饰,降低了提取DNA的获得率。检测结果显示血性胸水细胞块的DNA提取液的浓度相较于其组织标本差距最为明显。除上述原因以外,还有可能是因为血性胸水中含有大量的红细胞,在离心后占据了沉淀绝大部分,切取相同数量的蜡片时肿瘤细胞含量就会相对偏少,导致在相同条件下提取的DNA浓度偏低。但所有待检样本的DNA提取原液均需要稀释到浓度为2 ng/μl的工作液,这样可以消除DNA提取原液浓度的差异所带来的影响。总体上所有样本DNA提取液的质量和浓度均符合实时荧光定量PCR检测要求,同时也印证了郭以河等[9,10]所介绍的胸水肿瘤细胞DNA提取的方法是切实可行的,实验的重复性和所获得的DNA提取液的质量是有保证的,从而为下一步应用实时荧光定量PCR检测EGFR基因突变提供了必要的前提条件。
目前已发现不下于30种EGFR基因突变,现有的资料[11-15]表明,EGFR总突变率在20%-45%,其中外显子19、21突变占到EGFR总突变率的85%-90%。从本次应用实时荧光定量PCR检测结果显示,EGFR外显子19、21发生突变率为35%,这与上述相关报道较一致。除1例组织标本检测结果显示为19-Del突变而对应的细胞块检测结果为阴性外,其余的19例胸水细胞块EGFR基因突变的数据和组织学标本完全一致,突变均为21例,其中19外显子(19-Del)突变11例,2l外显子(L858R)突变9例,双突变1例,且其EGFR基因突变类型均与其对应的组织标本一致,经统计学分析,胸水细胞块与组织标本EGFR基因总突变率差异无显著性意义(P>0.05)。经过分析后发现与组织标本检测结果不符的为1例血性胸水,原因可能是血性胸水中含有大量的红细胞、中性粒细胞、单核细胞、淋巴细胞、间皮等细胞,那么肿瘤细胞的含量就会相对较少,这样就会使我们所获得的DNA提取液中的野生DNA含量过高,肿瘤DNA含量低于总量的1%,超出了检测试剂盒的最低检测能力范围,从而出现DNA提取液的浓度和质量均符合检测标准,但检测结果却可能出现阴性的现象。
近年来,随着分子生物学技术的不断发展,应用小分子基因靶向治疗药物酪氨酸激酶抑制剂治疗NSCLC患者,可以有效地改善患者的生活质量,并延长了患者的生命[16],EGFR基因突变的检测是指导应用酪氨酸激酶抑制剂治疗的必要前提[17]。目前,我国NSCLC患者的EGFR基因突变检测率不高,难以获得满意的检测标本是其主要原因之一。临床中推荐使用肿瘤组织标本进行EGFR突变检测,但是对于心肺功能较差或已经失去手术机会的晚期患者组织标本获取往往比较困难,胸腔积液是晚期NSCLC患者常见的并发症,获取胸水标本比较容易,并且创伤较小,容易被患者接受。本研究结果显示,应用实时荧光定量PCR检测胸水EGFR基因突变的结果与组织标本检测结果具有较高的一致性。然而由于本研究的时间跨度比较长,胸水细胞块的EGFR基因突变检测是集中后分批进行的,其间可能存在胸水标本的类型、试剂的批间差异和人为操作等因素的影响,致使此种方法应用于临床还有待于进一步研究。后期将继续完善不同类型胸水细胞块的制作方法,并扩大检测样本量,获得更多数据资料,以拓宽了解非小细胞肺癌患者EGFR基因突变情况的有效途径,以期为临床应用EGFR酪氨酸激酶受体抑制剂治疗NSCLC提供一定的参考价值。
[1] Ahmedin J,Rebecca S,Elizabeth W,etal.Cancer Statistics,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[2] Jemal A,Siegel R,Ward E,etal.Cancer statistics,2007[J].CA Cancer J Clin,2007,57(1):43-66.
[3] 许阳,陈良安,田庆,等.表皮生长因子受体酪氨酸激酶抑制剂在晚期非小细胞肺癌一线治疗中的应用[J].中国肺癌杂志,2010,13(1):48-53.
[4] Carney DN.Lung cancer-time to move on from chemotherapy[J].N Engl J Med,2002,346(2):126-128.
[5] Chute JP,Chen T,Feigal E,etal.Twenty years of phase III trials for patients with extensive-stage small-cell lung cancer: perceptible progress[J].J Clin Oncol,1999,17(6):1794-1801.
[6] Mok TS,Wu YL,Thongprasert S,etal.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009,361(10):947-957.
[7] 孟加榕,郭以河,张闽峰,等.HRM方法检测肺腺癌胸水细胞块中EGFR基因突变的临床意义[J].现代肿瘤医学,2013,21(12):2738-2741.
[8] 孟加榕,潘羡心,郭以河,等.肺腺癌胸腔积液上清液和细胞块EGFR基因突变检测的临床意义[J].解放军医药杂志,2014,26(10):82-83.
[9] 郭以河,潘羡心,孟加榕,等.恶性胸腔积液不同成分DNA提取结果比较分析[J].中国煤炭工业医学杂志,2015,18(2):280-283.
[10] 郭以河,孟加榕,张闽峰,等.一种快速提取恶性胸水中肿瘤细胞DNA的方法[J].现代肿瘤医学,2013,21(12):2833-2834.
[11] 田辉,于凯忠,毛争春,等.非小细胞肺癌314 例EGFR基因突变的研究[J].山西医科大学学报,2014,45(6):465-467.
[12] Dong Q,Huang JS,Huang J,etal.Advance in targeted therapy for lung can-cer and EGFR gene mutations in China[J].Tumor,2005,25(6):625-628.
[13] Zhu JQ,Zhong WZ,Zhang GC,etal.Better survival with EGFR exon 19than exon 21 mutations in getinib-treated non-small cell lung cancer patients is due to differential inhibition of downstream signals[J].Cancer Lett,2008,265(2):307-317.
[14] 刘根贤,慕进勇,张守翠,等.非小细胞肺癌患者胸水与外周血检测EGFR基因突变的比较[J].国际检验医学杂志,2016,37(7):985-987.
[15] Li Mei,Zhang Qiuping,Liu Lina,etal,The different clinical significance of EGFR mutations in exon 19 and 21 in non-small cell lung cancer patients of China[J].Plasma,2011,8(1):74-81.
[16] 吕艳玲,袁冬梅,宋勇,等.肺腺癌患者血清及胸水CEA与EGFR突变的相关性研究[J].临床肿瘤学杂志,2016,27(7):621-625.
[17] 杨新,王秋实,肖华亮,等.肺腺癌胸水细胞块EGFR基因突变检测分[J].临床与实验病理学杂志,2016,32(1):61-63.
Clinical significance of EGFR gene mutation in pleural effusion cell blocks in non-small cell lung cancer
YU Le,ZHU Qigan,YANG Limin,WEN Lusheng,KUI Guoju,PAN Xianxin,MENG Jiarong*
(DepartmentofPathology,175thHospitalofPLA,DongnanAffiliatedHospitalofXiamenUniversity,Zhangzhou363000,China;*Correspondingauthor,E-mail:mengjiarong@sina.com)
ObjectiveTo explore the clinical significance of EGFR mutations in positive pleural effusion cell block of non-small cell lung cancer by RT-PCR.MethodsSixty cases of biopsy tissue specimens and pleural effusion from non-small cell lung cancer patients were collected.Cell blocks of pleural effusion specimens were made.DNA was extracted to detect EGFR mutation in exon 19 (19-Del) and exon 21 (L858R) in biopsy tissue specimens and pleural effusion by RT-PCR.The mutation rate of EGFR was analyzed between pleural effusion and biopsy tissue specimens.ResultsThe mutation rate of EGFR in pleural effusions was 35%(21/60),including 11 cases of 19-Del mutation,9 cases of L858R mutation,and 1 case of 19-Del and L858R double mutations.The mutation rate of EGFR in biopsy tissue specimens was 36.7%(22/60),including 12 cases of 19-Del mutation,9 cases of L858R mutation,and 1 case of 19-Del and L858R double mutations.The rates of EGFR mutation was not significantly different between the two types of specimens(P>0.05).The EGFR mutation types in pleural effusion were the same as that of the tissue specimen.ConclusionPleural effusion cell block and biopsy tissue specimen show high consistency in EGFR mutation.
lung cancer; pleural effusion; cytology; EGFR gene
福建漳州市科技局科研资助项目(z2011066);南京军区医药卫生科研基金资助项目(10MA076);解放军第175医院院内青年苗圃基金资助项目(16Y020)
禹乐,男,1984-07生,学士,主管技师,E-mail:422245066@qq.com
2016-12-24
R734.2
A
1007-6611(2017)05-0462-05
10.13753/j.issn.1007-6611.2017.05.013

